首次自褐家鼠粪便标本中检出香港海鸥菌
2017-04-26刘优招陈炜聪刘志华韩宇宇
刘优招,陈炜聪,刘志华,王 丽,葛 婧,韩宇宇,陈 清,胡 静
首次自褐家鼠粪便标本中检出香港海鸥菌
刘优招1,陈炜聪2,刘志华3,王 丽1,葛 婧1,韩宇宇2,陈 清1,胡 静1
目的 了解褐家鼠粪便标本中是否携带香港海鸥菌,并分析其耐药特征及分子分型。方法 2015年6月-2016年5月,利用笼捕法于广州市南方医院及其周边居民区捕获褐家鼠,其粪便样本经增菌后接种改良头孢哌酮MacConkey琼脂(CMA)平板培养分离可疑菌株,经生化试验及16S rRNA测序确认。采用K-B法进行药物敏感性测定,并运用多位点序列分型进行分子分型分析。结果 共捕获褐家鼠191只,并在2份褐家鼠粪便标本中检出香港海鸥菌,检出率为1.05%。两株菌16S rRNA的测序结果与香港海鸥菌标准株HKU1的一致性达100%。药敏试验显示两株分离株均对头孢菌素类抗生素及利福平耐药。多位点序列分型结果显示两株菌分别为2个新的ST型:ST-163和ST-164。结论 褐家鼠粪便中存在香港海鸥菌污染。褐家鼠与人类生活关系密切,可能为人类感染的的另一潜在来源。
香港海鸥菌;褐家鼠;16S rRNA测序;多位点序列分型
香港海鸥菌(Laribacterhongkongensis,Lh)是一种可能致人类严重腹泻的新发现病原菌。该菌2001年首次在香港肝硬化病人的胸腔脓血中分离到并被鉴定为变形菌门(Proteobaxteria)、β-变形菌纲(β-subclass Proteobacteria)、奈瑟菌科(Neisseriaceae)的一个新属[1]。
香港海鸥菌作为一个新发现的病原菌,其可能的源头、存在哪些宿主、造成人类感染的方式,不同来源菌株间的遗传结构和耐药性等问题都亟待解决。到目前为止,香港海鸥菌除造成人类感染外,主要在淡水鱼和虎纹蛙等淡水生物的肠道标本中检出[2-4],被认为是该菌的主要宿主,进食淡水鱼类和异地旅游被证实是感染该菌的危险因素[5]。但另有研究显示,有些感染香港海鸥菌的病人在感染近期均无进食鱼类史和异地旅游史,其感染来源和途径尚不清楚[6-7],是否存在其他宿主和危险因素仍有待进一步研究。
褐家鼠(Rattusnorvegicus)广泛分布于人类的生活环境中,与人密切接触,是许多病原菌的储存宿主,如钩端螺旋体[8],鼠疫耶尔森菌[9],伤寒立克次体[10],沙门菌[11]和空肠弯曲菌[12]。为了解褐家鼠粪便中是否携带香港海鸥菌,于2015年6月-2016年5月在广州市某综合三甲医院周围及附近居民区捕获褐家鼠,采集褐家鼠粪便标本进行香港海鸥菌的分离培养和鉴定,并对阳性菌进行药物敏感性测定和多位点序列分型(multi-loci sequence typing,MLST)分析。
1 材料与方法
1.1 样本采集 2015年6月-2016年5月,按照《中华人民共和国出入境检验检疫行业标准》(SN/T 2788—2011)相关标准在广东省广州市南方医院周围及附近居民区利用笼捕法捕鼠。鼠笼布置地点主要为仓库、厨房、下水道、垃圾箱、建筑物墙边等,以“晚放晨收”形式每月捕鼠一次,连续捕鼠一年。捕获的老鼠立即运送至实验室,按照《实验动物细菌学检测标本采集》(GB/T—14926.42—2001)要求解剖并收集粪便样本。
1.2 主要试剂 营养肉汤、营养琼脂、麦康凯琼脂(CMA)、MH药敏实验琼脂、三糖铁琼脂、脲酶及精氨酸双水解酶生化管均购自北京路桥技术股份有限公司;头孢哌酮、氧化酶试纸、触酶及K-B法药物敏感纸片购自英国Oxoid公司;细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;引物合成及测序由深圳华大基因公司完成。
1.3 试验方法
1.3.1 香港海鸥菌的分离培养 将粪便样本置于营养肉汤中,37 ℃增菌18~24 h。将增菌肉汤划线接种于改良头孢哌酮MacConkey琼脂(CMA),头孢哌酮浓度为16 μg/mL。CMA平皿置于37 ℃培养箱培养48 h。挑取香港海鸥菌可疑菌落(直径在1.0~1.5 mm之间,浅灰色、半透明圆形、中间略凸起、光滑)接种于营养琼脂平板分纯培养,置37 ℃培养18~24 h后进行生化试验。对氧化酶、触酶、脲酶、及精氨酸双水解酶阳性,三糖铁阴性的菌株再进行16S rRNA测序确认。HKU1和HLHK9 菌株(均由香港大学微生物学系袁国勇教授惠赠)为阳性对照菌株,大肠埃希菌ATCC25922(南方医科大学流行病学实验室保存)为阴性对照菌株。
1.3.2 16S rRNA扩增及测序 细菌基因组DNA提取试剂盒提取初筛菌株的DNA,置于-20 ℃保存备用。PCR扩增16S rRNA的特异性片段,片段大小550 bp。目的片段阳性的进一步扩增16S rRNA全序,扩增产物送华大基因公司测序后利用在线Blast (http://www.ncbi.nlm.nih.gov/BLAST)比对确认。具体引物设计及PCR反应条件参照文献[13]。
1.3.3 药敏实验 采用纸片扩散法(K-B法),按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)标准判读。抗生素纸片包括:头孢噻吩(30 μg)、头孢唑林(30 μg)、头孢呋辛(30 μg)、头孢哌酮(75 μg)、头孢他啶(30 μg)头孢吡肟(30 μg);氨苄西林(10 μg)、哌拉西林(100 μg);亚胺培南(10 μg)氨曲南(30 μg);庆大霉素(10 μg)、阿米卡星(30 μg)、链霉素(10 μg);红霉素(15 μg);利福平(5 μg);环丙沙星(5 μg);四环素(30 μg);氯霉素(30 μg);复方新诺明(甲氧苄啶1.25 μg+磺胺甲恶唑23.75 μg)。大肠杆菌ATCC25922和金黄色葡萄球菌ATCC25923作为质控菌。
1.3.4 MLST分型 根据香港大学MLST分型方法[14],选取rho、acnB、ftsH、trpE、ilvC、thiC、eno等7个管家基因作为MLST分型位点。引物设计及PCR反应体系及条件同参考文献[14]。取5 μL PCR扩增产物于1%琼脂糖凝胶经100 V电泳25 min, 凝胶成像仪观察电泳条带。PCR阳性产物送至华大基因进行双向测序,Chrome软件查看峰图并评估测序结果。用DNAman软件拼接正反序列,得到每个管家基因的完整序列并将菌株的7个管家基因序列送至香港大学与现存的MLST数据库进行比对分析,得到等位基因号及ST号,运用eBURST、START2等分析软件进行谱系分析和聚类分析。
2 结 果
2.1 褐家鼠粪便中香港海鸥菌的检出情况 2015年6月—2016年5月,连续捕鼠12个月,共捕获191只褐家鼠,其中156只成年(118只雄性,38只雌性),35只未成年。在191份粪便标本中检出2份标本香港海鸥菌阳性,检出率为1.05%。两只褐家鼠均为未成年鼠,鼠笼放置地点均在居民区附近的垃圾箱旁边,捕获时间分别为2015年7月和2015年11月。两株香港海鸥菌分别命名为R251和R398。
2.2 16S rRNA基因序列分析 PCR扩增结果显示,不包括引物结合区,菌株R251和R398的16S rRNA 基因序列在1 400 bp左右,两者之间无差异。Blast比对结果显示:R251和R398与香港海鸥菌标准株HKU1(GenBank 登录号:AF389085)相应的序列一致性达100%,与已全基因组测序菌株HLHK9(GenBank登录号:NR_074669)相应的序列存在2个碱基差异,一致性为99%。
2.3 药敏结果 R251和R398对10个种类常用抗生素中的19中抗菌药表现出相似的耐药性,均对头孢呋辛、头孢吡肟、哌拉西林、亚胺培南、氨曲南、庆大霉素、阿米卡星、链霉素、红霉素、环丙沙星、四环素、氯霉素及复方新诺明敏感;对头孢噻吩、头孢唑啉、头孢哌酮及利福平表现为耐药。此外,R251对头孢他啶及氨苄西林敏感,但R398表现为耐药。
2.4 MLST分型 菌株R251的7个管家基因(rho、acnB、ftsH、trpE、ilvC、thiC、eno)的等位基因号分别为:14、18、19、18、13、18、20。菌株R398的则为:42、18、19、49、35、23、20。由7个等位基因号组成等位基因谱,分别得到相应的ST型:ST-163和ST-164。如图1所示,eBURST软件对香港海鸥菌的等位基因号及ST型号进行分析,将ST型分成12组克隆复合体。ST-163和ST-164分散存在,不与其他ST型形成克隆复合体。START2的聚类结果(图2)也显示:菌株R251和R398不与其他ST聚在一起,但两株鼠源分离株与人源分离株的亲缘关系较近。
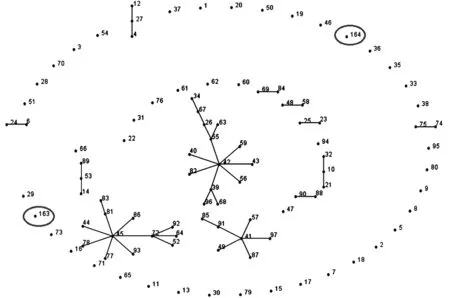
每个数字代表一个ST型,连接2个ST型之间的直线表示两个ST型的7对等位基因中至少有6对是相同的。Each number represents a MLST sequence type (ST) and each line connects STs that are identical in at least six out of the seven housekeeping genes.图1 eBURST 分析香港海鸥菌ST型分布图Fig.1 eBURST analyses of L. hongkongensis strains
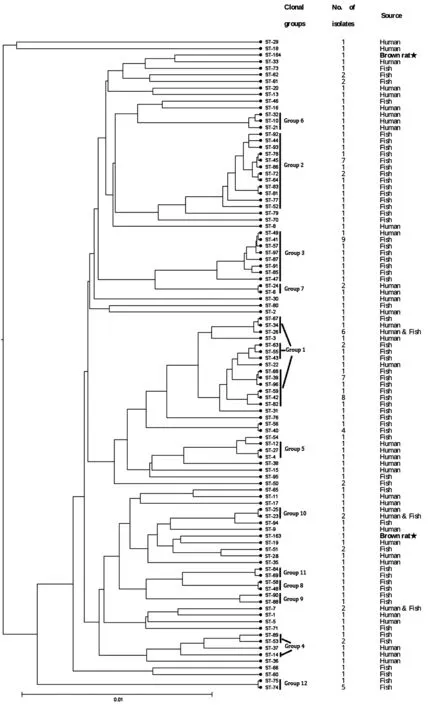
图2 香港海鸥菌的聚类分析Fig.2 Cluster analysis for L.hongkongensis strains
3 讨 论
香港海鸥菌由香港学者Yuen等[1]于2001年从一名肝硬化病人的胸腔脓血分离,后研究表明此菌可致人类腹泻且食用淡水鱼为其危险因素之一[5]。此外,香港海鸥菌还可能是造成侵入性感染的致病菌,如菌血症[15-16]和腹膜炎[17]。自从香港海鸥菌发现至今,除病人以外,仅在淡水鱼[2, 4, 18]、可食用蛙[2-4]、水库水[19]等淡水生物或环境中检测出该菌,但在海产品、猪、牛、鸡、鸭、鹅等粪便或肛拭子标本中均未检测到该菌的存在[18]。本研究首次发现作为哺乳动物的褐家鼠也能携带香港海鸥菌,该结果提示褐家鼠可能是除人和淡水生物以外的另一个香港海鸥菌的潜在宿主。
褐家鼠为杂食性动物,食谱广而杂。在居民区室内,喜吃肉类、蔬菜等;在野外,常以动物性食物为主要食料,捕食小鱼、虾、蛙类等。其栖息场所主要在厨房、仓库、下水道、垃圾堆等杂乱无章处[20]。褐家鼠的生活习性为感染香港海鸥菌提供可能,比如摄食被香港海鸥菌污染的鱼肉类,或捕食携带此菌的小鱼、蛙类等。
我国内地报道,某些感染香港海鸥菌的腹泻患者发病前2周并无进食鱼类史和外出旅游史[6-7],提示除食用淡水鱼和异地旅行等危险因素外,可能还存在感染该菌的其他来源和途径。本次研究从褐家鼠粪便中分离出香港海鸥菌,提示其可能成为人类感染此菌的的另一潜在来源。香港海鸥菌可随褐家鼠粪便排出体外,污染食物、饮水及周围环境,人类可能通过接触污染的食物、饮水而感染此菌。除此之外,褐家鼠还可以通过抓伤、咬伤直接接触人类,传播多种疾病。虽然本研究中,褐家鼠粪便中香港海鸥菌的检出率(1.05%)低于淡水鱼(16.3%)及可食用蛙(59.5%)的检出率[2],但褐家鼠活动范围大,又多活动于居民区,与居民接触机会多,给人类感染带来的潜在危险值得关注。
两株香港海鸥菌的鼠分离株R251和R398的药敏实验结果显示,其对利福平及一、三代头孢菌素类药物均耐药,对二、四代头孢菌类抗生素、其他β-内酰胺类和氨基糖苷类抗生素均敏感,与其他宿主来源的分离株基本一致[2, 18]。但是,与其他宿主来源的香港海鸥菌的耐药谱相比,也存在一定的差异性。鼠来源株(R251和R398)对红霉素类、四环素类、喹诺酮类及磺胺类均表现为敏感,而鱼来源株对红霉素有一定水平的耐药,部分人来源株对红霉素类和四环素类耐药,而蛙来源株对这4类抗生素均表现为一定水平的耐药。
目前,已有学者运用脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)技术[18]及MLST方法[14]进行香港海鸥菌的感染溯源研究,对鱼来源株和人来源株分型,发现大部分人来源株聚在一起,提示一些菌株毒力可能更强,但未进行验证。本研究的MLST聚类分析提示鼠来源株与人来源株有更近的亲缘关系,但两者之间的联系有待进一步研究。到目前为止,香港海鸥菌的致病机理、菌株间的毒力是否存在差异性仍不明确。动物模型是研究腹泻发病机制的重要手段,褐家鼠能携带香港海鸥菌提示从褐家鼠分化而来的SD大鼠可能是一个可以用来尝试建立此菌感染的动物模型。
本研究首次报道了野生型褐家鼠粪便中存在香港海鸥菌。这是除人群病例以外,第一次在哺乳类动物中分离到该菌,扩大了对香港海鸥菌的宿主研究范围,该菌的传播途径、流行范围的认识。此外,褐家鼠在香港海鸥菌的传播过程中扮演着何种角色,其可能造成人类感染的方式等问题也值得进一步研究。
[1] Yuen KY, Woo PC, Teng JL, et al.Laribacterhongkongensisgen. nov. sp. nov., a novel gram-negative bacterium isolated from a cirrhotic patient with bacteremia and empyema[J]. J Clin Microbiol, 2001, 39(12):4227-4232. DOI:10.1128/JCM.39.12.4227-4232.2001
[2] Feng JL, Hu J, Lin JY, et al. The prevalence, antimicrobial resistance and PFGE profiles ofLaribacterhongkongensisin retail freshwater fish and edible frogs of southern China[J]. Food Microbiol, 2012, 32(1):118-123. DOI:10.1016/j.fm.2012.04.018
[3] Lau SK, Lee LC, Fan RY, et al. Isolation ofLaribacterhongkongensis, a novel bacterium associated with gastroenteritis, from Chinese tiger frog[J]. Int J Food Microbiol, 2009, 129(1):78-82. DOI:10.1016/j.ijfoodmicro.2008.10.021
[4] Feng M, Liu YZ, He YQ, et al. Detection and drug resistance characteristic ofLaribacterhongkongensisin freshwater products in a district of Shenzhen City[J]. Chin J Dis Ctrl Prev, 2016, 20(8):764-767. DOI:10.16462 /j.cnki.zhjbkz.2016.08.003 (in Chinese)
冯梅,刘优招,何雅青,等. 深圳市某区淡水产品中香港海鸥菌的检测及耐药特征分析[J]. 中华疾病控制杂志,2016, 20(8):764-767. DOI:10 16462 /j.cnki.zhjbkz.2016. 08.003
[5] Woo PC, Lau SK, Teng JL, et al. Association ofLaribacterhongkongensisin community-acquired gastroenteritis with travel and eating fish:a multicentre case-control study[J]. Lancet, 2004, 363(9425):1941-1947. DOI:10. 1016/S0140-6736(04)16407-6
[6] Zhu JF, Zheng NC, Liao RY, et al.Laribacterhongkongensisisolated from a patient with conmmunity-acquired gastroenteritis in Guangdong province[J]. Chin J Public Health, 2011, 27(4):403-405. (in Chinese)
朱江峰,郑南才,廖如燕,等. 广东省香港海鸥菌感染性腹泻1例分析[J]. 中国公共卫生,2011, 27(4):403-405.
[7] Ni XP, Ren SH, Sun JR, et al.Laribacterhongkongensisisolated from a patient with community-acquired gastroenteritis in Hangzhou City[J]. J Clin Microbiol, 2007, 45(1):255-256. DOI:10.1128/JCM.01400-06
[8] Evangelista KV, Coburn J.Leptospiraasan emerging pathogen:a review of its biology, pathogenesis and host immune responses[J]. Future Microbiol, 2010, 5(9):1413-1425. DOI:10.2217/fmb.10.102
[9] Chanteau S, Ratsifasoamanana L, Rasoamanana B, et al. Plague, a reemerging disease in Madagascar[J]. Emerg Infect Dis, 1998, 4(1):101-104. DOI:10.3201/eid0401.980114
[10] Billeter SA, Gundi VA, Rood MP, et al. Molecular detection and identification ofBartonellaspecies inXenopsyllacheopisfleas (Siphonaptera:Pulicidae) collected fromRattusnorvegicusrats in Los Angeles, California[J]. Appl Environ Microbiol, 2011, 77(21):7850-7852. DOI:10.1128/AEM.06012-11
[11] Yokoyama E, Maruyama S, Kabeya H, et al. Prevalence and genetic properties ofSalmonellaentericaserovar typhimurium definitive phage type 104 isolated fromRattusnorvegicusandRattusrattushouse rats in Yokohama City, Japan[J]. Appl Environ Microbiol, 2007, 73(8):2624-2630. DOI:10.1128/AEM.02465-06
[12] Nkogwe C, Raletobana J, Stewart-Johnson A, et al. Frequency of detection ofEscherichiacoli,Salmonellaspp., andCampylobacterspp. in the faeces of wild rats(Rattusspp.) in Trinidad and Tobago[J]. Vet Med Int, 2011, 2011:686923. DOI:10.4061/2011/686923
[13] Hu J, Zhu JF, Zheng NC, et al. Detection ofLaribacterhongkongensisin freshwater products in Jiangmen, Guangdong[J]. 2013, 28(7):532-535. (in Chinese)
胡静,朱江峰,郑南才,等. 广东省江门市淡水产品中香港海鸥菌的检测[J]. 疾病监测, 2013, 28(7):532-535.
[14] Woo PC, Teng JL, Tsang AK, et al. Development of a multi-locus sequence typing scheme forLaribacterhongkongensis, a novel bacterium associated with freshwater fish-borne gastroenteritis and traveler’s diarrhea[J]. BMC Microbiol, 2009, 9:21. DOI:10.1186/1471-2180-9-21
[15] Tse CW, Curreem SO, Cheung I, et al. A novel MLST sequence type discovered in the first fatal case ofLaribacterhongkongensisbacteremia clusters with the sequence types of other human isolates[J]. Emerg Microbes Infect, 2014, 3(6):e41. DOI:10.1038/emi.2014.39
[16] Kim DS, Wi YM, Choi JY, et al. Bacteremia caused byLaribacterhongkongensismisidentified as Acinetobacter lwoffii:report of the first case in Korea[J]. 2011, 26:679-681. DOI:10.3346/jkms.2011.26.5.679
[17] Woo PC, Poon RW, Foo CH, et al. First report ofLaribacterhongkongensisperitonitis in continuous ambulatory peritoneal dialysis[J]. Perit Dial Int, 2016, 36(1):105-107. DOI:10.3747/pdi.2014.00270
[18] Teng JL, Woo PC, Ma SS, et al. Ecoepidemiology ofLaribacterhongkongensis, a novel bacterium associated with gastroenteritis[J]. J Clin Microbiol, 2005, 43(2):919-922. DOI:10.1128/JCM.43.2.919-922.2005
[19] Lau SK, Woo PC, Fan RY, et al. Isolation ofLaribacterhongkongensis, a novel bacterium associated with gastroenteritis, from drinking water reservoirs in Hong Kong[J]. J Appl Microbiol, 2007, 103(3):507-515. DOI:10.1111/j.1365-2672.2006.03263.x
[20] Gao G, Wang SW. Host animals of plague and its prevention in China[M]. Lanzhou:Technology of Gansu Publishing Press, 2012:109-110. (in Chinese)
高共,王升文. 中国鼠疫宿主动物及其防制[M]. 兰州:甘肃科学技术出版社, 2012:109-110.
Hu Jing, Email:hjalzh@smu.edu.cn
First isolation ofLaribacterhongkongensisfrom stool samples ofRattusnorvegicus
LIU You-zhao1, CHEN Wei-cong2, LIU Zhi-hua3, WANG Li1, GE Jing1, HAN Yu-yu2,CHEN Qing1, HU Jing1
(1.DepartmentofEpidemiology,SchoolofPublicHealth,SouthernMedicalUniversity,GuangdongProvincialKeyLaboratoryofTropicalDiseaseResearch,Guangzhou510515,China; 2.SchoolofTraditionalChineseMedicine,SouthernMedicalUniversity,Guangzhou510515,China; 3.DepartmentofInfectiousDiseases,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
In order to investigate whetherLaribacterhongkongensiscould be detected in stool samples ofRattusnorvegicusin the wild,Rattusnorvegicuswere trapped alive in an urban community of Guangzhou, China over a period of one year from June 2015 to May 2016, and their stool samples were examined for the presence ofL.hongkongensisstrains. Isolates were identified based on phenotypic characteristics and 16S rRNA sequence analysis, and were examined for their susceptibility to 19 antimicrobial agents. Further typing of the isolates was performed using multi-loci sequence typing (MLST) analysis. A total of 191R.norvegicuswere trapped alive.L.hongkongensiswas identified and successfully isolated from two samples, representing a prevalence of 1.05%. Although the two isolates possessed similar phenotypic characteristics and have no base difference of 16S rRNA gene, they constituted two new distinct sequence types (STs), ST-163 and ST-164. This is the first report thatL.hongkongensiscan be detected in the intestinal tract ofR.norvegicus. Results suggest thatR.norvegicuscould serve as carriers ofL.hongkongensisand therefore could be another potential source of infection.
Laribacterhongkongensis;Rattusnorvegicus; 16S rRNA sequence; sequence type
10.3969/j.issn.1002-2694.2017.04.010
国家自然科学基金(No.81373052 & 81373051)资助
胡 静, Email:hjalzh@smu.edu.cn
1.南方医科大学公共卫生学院流行病学系,广州 510515; 2.南方医科大学中医药学院中西医临床,广州 510515; 3.南方医科大学南方医院感染内科,广州 510515
Supported by the National Science Foundation of China (Nos. 81373052 & 81373051)
R378
A
1002-2694(2017)04-0343-06
2016-09-30 编辑:梁小洁
