半胱氨酸天冬氨酸蛋白酶3在亚洲带绦虫实验感染乳猪肝组织的表达
2017-04-26许士刚郎书源包怀恩
许士刚,牟 荣,张 科,杨 林,郎书源,包怀恩
半胱氨酸天冬氨酸蛋白酶3在亚洲带绦虫实验感染乳猪肝组织的表达
许士刚1,2,牟 荣1,2,张 科1,2,杨 林1,2,郎书源1,2,包怀恩1,2
目的 分析亚洲带绦虫实验感染乳猪后囊尾蚴寄生处肝脏组织半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartyl proteinase 3,Caspase-3)的表达变化情况,为探讨Caspase-3在亚洲带绦虫感染致乳猪肝损伤中的作用提供基础资料。方法 将采自贵州省都匀市良亩乡的亚洲带绦虫孕节解剖后,以生理盐水反复清洗并离心收集虫卵。20 d龄约克施格杂交乳猪12 头随机分为实验组和对照组各6 头,实验组以定量虫卵15万个/头灌胃感染,于感染后第15 d 和第75 d 解剖乳猪,取实验组囊尾蚴寄生处肝组织和对照组对应部位肝组织,运用实时荧光定量PCR和免疫印迹方法分别定性定量分析Caspase-3在实验组和对照组中mRNA水平、蛋白水平的表达,并进一步运用免疫组织化学方法对Caspase-3在实验组和对照组中的蛋白表达水平和蛋白表达部位进行分析和定位。结果 感染后第15 d,实时荧光定量PCR结果显示实验组Caspase-3 mRNA水平低于对照组(P=0.011),免疫印迹结果和免疫组化结果均显示实验组Caspase-3蛋白表达量低于对照组(P=0.008,P=0.004);此外,实验组感染后第75 d的Caspase-3 mRNA水平、蛋白表达量均高于实验组感染后第15 d 的样本(P=0.018,P=0.003,P=0.002);免疫组织化学结果显示Caspase-3阳性染色主要定位在肝细胞胞质中,呈黄色或棕黄色。感染后第75 d 实验组和对照组各项结果差异均无统计学意义。结论 Caspase-3在亚洲带绦虫感染早期的乳猪肝组织中低表达,而感染晚期正常表达,提示Caspase-3可能参与了亚洲带绦虫致乳猪早期肝损伤的调节。
亚洲带绦虫;半胱氨酸天冬氨酸蛋白酶3;乳猪;肝脏
近40年来,我国台湾学者范秉真[1]及国外学者Eom[2]、Zarlenga[3]、Bowles[4]及Ito[5]等发现并证实在亚太地区流行一种外形极似牛带绦虫的新虫种,称为亚洲带绦虫(Taeniaasiatica)。近年来,本课题组对采自中国大陆流行区的亚洲带绦虫进行了实验动物感染等方面的研究[6-8],发现其实验感染乳猪后可致乳猪肝损伤和肝细胞凋亡。正常的肝细胞凋亡在肝脏代谢中扮演重要角色,不受调控的持续性的病理性肝细胞凋亡在肝损伤的发生、发展中起了较为重要的作用[9]。半胱氨酸天冬氨酸蛋白酶(Caspase)家族是一类与细胞凋亡相关的蛋白酶家族,Caspase家族是细胞凋亡过程中的关键元件,其激活与超常表达均引起细胞凋亡,因此又称死亡蛋白酶,可通过与众多蛋白因子的相互作用调控细胞凋亡[10],其中Caspase-3是Caspase家族中最重要的凋亡执行者[11],是细胞凋亡过程中的主要效应因子,是多种凋亡刺激信号传递的汇聚点,负责对全部或部分关键性蛋白的酶切,使胞质、胞核及细胞骨架的重要蛋白酶失活,引发细胞凋亡。目前,国内外学者对寄生虫感染宿主引起组织细胞Caspase-3表达变化进行了广泛的研究,主要涉及卫氏并殖吸虫[12]、猪带绦虫[13]、曼氏血吸虫[14]、广州管圆线虫[15]、刚地弓形虫[16]、细粒棘球绦虫[17]和旋毛虫[18]等,但尚无亚洲带绦虫感染对宿主组织细胞Caspase-3表达变化的研究。因此,本研究在已建立的亚洲带绦虫实验感染乳猪动物模型基础上,分别采用实时荧光定量PCR、免疫印迹和免疫组织化学方法检测感染后第15 d和第75 d乳猪肝组织中Caspase-3的表达,为进一步深入研究亚洲带绦虫感染致乳猪肝损伤的分子病理机制提供基础资料。
1 材料与方法
1.1 实验材料
1.1.1 虫体来源 虫体采自贵州省都匀市良亩乡绦虫症患者,经口服槟榔煎剂-生南瓜籽-硫酸镁驱虫,经形态学观察和分子生物学鉴定,确定采集虫体为亚洲带绦虫。
1.1.2 实验动物 12头20 日龄约克施格杂交乳猪购自贵州省龙里县种猪养殖场,体重3.0~4.6 kg,体健,经粪检和间接凝集实验证实无寄生虫感染。
1.1.3 主要试剂和仪器 主要试剂Trizol、荧光定量PCR试剂盒和cDNA合成试剂盒分别购自美国Sigma公司、日本Takara公司和北京康为世纪公司,PCR引物由上海生工生物工程有限公司合成,动物全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜、3,3-二氨基联苯胺(Diaminobenzidine, DAB)显色试剂盒、BCA蛋白浓度定量试剂盒均购自美国Life Sciences公司,Caspase-3(SC-98785,兔抗猪)、β-actin(SC-47778,鼠抗猪)、IgG-HRP(SC-2005,羊抗鼠)和IgG-HRP(SC-2004,羊抗兔)均购自美国Santa-Cruz公司。主要仪器实时荧光定量PCR仪、凝胶成像系统均为美国Bio-Rad公司产品, 型号分别为CFX-96和ChemiDoc TMXRS+,Nikon科研级成像系统为日本Nikon公司产品,型号为Nikon DS-RI2。
1.2 方法
1.2.1 虫卵收集和计数 取每条亚洲带绦虫的末段孕节,在生理盐水中以注射器针头沿纵轴划破孕节使虫卵溢出,并用生理盐水反复淘洗,2 000 r/min,离心20 min,收集虫卵备用。光学显微镜下观察收集的虫卵并分别反复计数5 次,取平均值,将1 mL生理盐水中虫卵数定量为15万个,4 ℃冰箱保存备用。
1.2.2 实验动物感染和标本采集 乳猪随机分为实验组和对照组各6头,实验组乳猪以定量虫卵15万个/头通过胃管灌胃感染。感染之初2组乳猪分开饲养,7 d后混养,整个实验过程中严格实行封闭饲养。于感染后第15 d和第75 d分别随机处死实验组和对照组乳猪各3 头,采集实验组和对照组肝组织。将剥除囊尾蚴的实验组肝组织和对照组肝组织放入有或无1 mL Trizol的EP管内再置于-80 ℃冰箱保存备用,并将未剥除囊尾蚴的实验组和对照组肝组织置于4%多聚甲醛固定后室温保存备用。
1.2.3 实时荧光定量PCR 根据GenBank相关序列,使用Primer Express 5.0软件设计Caspase-3和内参基因(β-actin)实时荧光定量PCR引物,并由上海生工生物公司合成(表1)。采用Trizol一步法提取各组乳猪肝组织总RNA,按试剂盒说明操作获得cDNA。PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,59.4 ℃退火30 s,72 ℃延伸30 s,共40 个循环。记录荧光定量PCR仪得出的各组Caspase-3和内参基因β-actin的CT值,重复3 次取平均值。计算目的基因Caspase-3的△△CT值,△△CT=(CT目的基因-CTβ-actin)-(CT对照组-CTβ-actin),采用2-△△CT法计算出各组目的基因的相对表达量。
表1 实时荧光定量PCR引物
Tab.1 Primers of quantitative real-time PCR
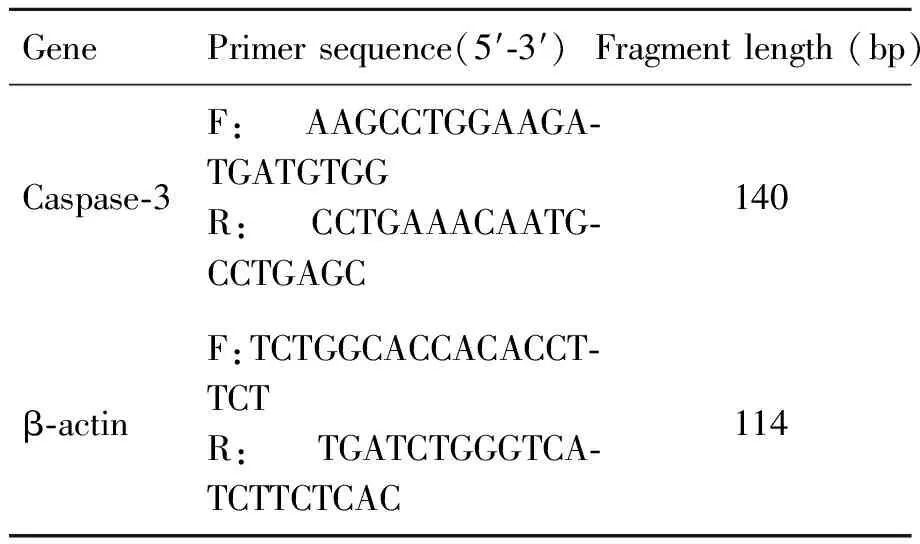
GenePrimersequence(5′⁃3′)Fragmentlength(bp)Caspase⁃3F:AAGCCTGGAAGA⁃TGATGTGGR:CCTGAAACAATG⁃CCTGAGC140β⁃actinF:TCTGGCACCACACCT⁃TCTR:TGATCTGGGTCA⁃TCTTCTCAC114
1.2.4 免疫印迹法 取-80 ℃冰箱保存的肝脏组织约90 mg,用动物蛋白提取试剂盒提取总蛋白,并用BCA蛋白浓度测定试剂盒测定蛋白浓度,各组样品等量上样,经SDS-PAGE电泳分离(积成胶电压40 V, 分离胶电压100 V)后将蛋白转移至PVDF膜并封闭过夜,室温下分别加入一抗Caspase-3(1∶200)和内参β-actin(1∶500),孵育2 h 后加入辣根过氧化物酶标记的二抗(1∶8 000)作用1 h,凝胶成像系统曝光,用IMAGEL3.0软件(Bio-Rad公司)测定各条带的光密度值,经内参β-actin校正后,取Caspase-3/β-Actin比值为蛋白的表达量。
1.2.5 免疫组织化学法 将保存于4%多聚甲醛中的肝组织进行石蜡包埋、切片、脱蜡、脱水、过氧化氢阻断内源性过氧化物酶、蛋白酶K修复,然后加入一抗Caspase-3(1∶100) 4 ℃孵育过夜,辣根过氧化物酶标记的二抗(1∶500)37 ℃孵育30 min、DAB显色60 s、苏木素复染30 s、脱色30 s、中性树胶封片后显微镜下观察,PBS代替一抗作为阴性对照。结果判定:显微镜下观察,Caspase-3阳性染色主要定位在肝细胞胞质中,呈黄色至棕黄色。感染后第15 d和75 d实验组和对照组各取10个样本,每个样本取10个视野,观察免疫组化阳性物的分布,使用Image Pro plus 6.0软件测定每个样品平均光密度值,即每个视野阳性物光密度值和阳性物区域面积的比值,平均光密度值和蛋白表达量呈正相关。
2 结 果
2.1 亚洲带绦虫虫卵感染情况 亚洲带绦虫虫卵能感染约克施格杂交乳猪,感染后第15 d,实验组肝脏可见白色细小点状结构,未见清晰囊尾蚴结构,见图1A;感染后第75 d,实验组大多数囊尾蚴钙化,见图1B。
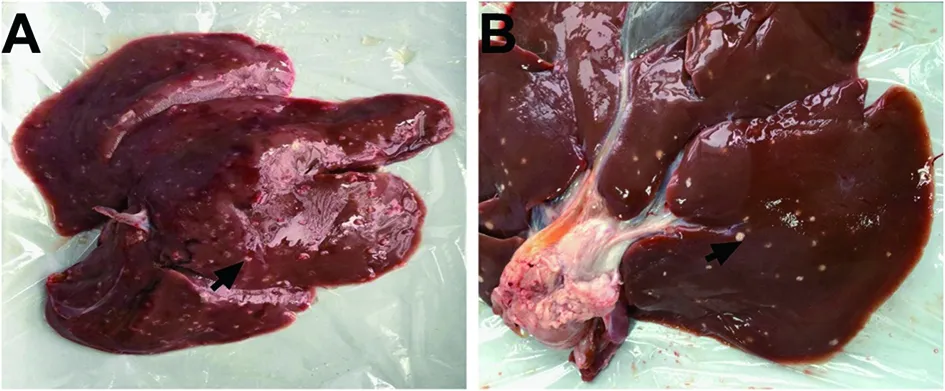
A:亚洲带绦虫囊尾蚴感染后第15 d乳猪肝脏,↑示未成熟的囊尾蚴;B:亚洲带绦虫囊尾蚴感染后第75 d的乳猪肝脏,↑示钙化的囊尾蚴。A:Liver of porket at day 15 post-infection after oral challenge by T. asiatica,↑ indicated immature cysticercus; B:Liver of porket at day 75 post-infection after oral challenge by T. asiatica,↑ indicated calcified cysticercus.图1 亚洲带绦虫囊尾蚴感染不同时间的约克施格杂交乳猪肝脏Fig.1 Liver of Yorkshire and Seghers hybrid porkets at day 15 and day 75 post-infection after oral challenge by T. asiatica
2.2 实时荧光定量PCR结果 感染后第15 d,实验组Caspase-3 mRNA水平低于对照组,而实验组感染后第75 d的Caspase-3 mRNA水平高于感染后第15 d,差异均有统计学意义(P=0.011,P=0.018);感染后第75 d,实验组Caspase-3 mRNA水平相对正常组无明显变化,差异无统计学意义(P=0.221),见图2。
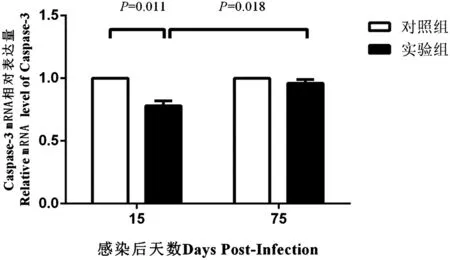
图2 实时荧光定量PCR检测亚洲带绦虫感染后第15 d和第75 d乳猪肝组织Caspase-3的mRNA水平Fig.2 mRNA level of Caspase-3 of liver tissues from porkets of experimental and control groups by quantitative real time PCR at day 15 and day 75 post-infection after oral challenge by T. asiatica
2.3 免疫印迹法检测肝组织Caspase-3蛋白表达结果 免疫印迹实验结果表明对照组和实验组内参β-actin表达量一致(见图3A),即该实验各组蛋白上样量一致,在此基础上,感染后第15 d实验组Caspase-3表达量低于对照组,而感染后第75 d实验组Caspase-3表达量高于感染后第15 d实验组Caspase-3表达量;感染后第75 d,实验组Caspase-3的亮度和对照组基本一致(见图3A)。经IMAGEL3.0及SPSS19.0软件统计处理及内参β-actin校正后,如图3B所示,感染后第15 d,实验组Caspase-3蛋白表达量低于对照组,而感染后75 d,Caspase-3蛋白表达量高于感染后第15 d,差异均有统计学意义(P=0.008,P=0.003),感染后第75 d,实验组与对照组Caspase-3蛋白表达无明显差异 (P=0.599)。
2.4 免疫组织化学法检测肝组织Caspase-3蛋白表达结果 显微镜下观察肝组织切片免疫组化结果显示实验组和对照组均可见肝细胞胞质被染成黄色至棕黄色(图4A—D)。感染后第15 d,实验组肝组织Caspase-3平均光密度值低于对照组,而感染后第75 d,实验组肝组织Caspase-3平均光密度值高于感染后第15 d,差异均有统计学意义(P=0.004,P=0.002),感染后第75 d,实验组肝组织Caspase-3平均光密度值较对照组无明显变化,差异无统计学意义(P=0.531,P=0.231)(见图5)。
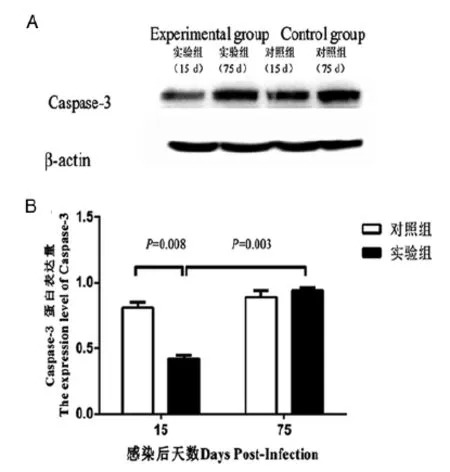
A:免疫印迹法检测感染后第15 d和第75 d乳猪肝组织Caspase-3蛋白表达结果;B:感染后第15 d和第75 d乳猪肝组织Caspase-3蛋白表达量的统计图。A:The result of western blot for Caspase-3 and β-actin of experimental and control groups at indicated time points; B:The histogram for the expression level of Caspase-3 of experimental and control groups at indicated time points.图3 免疫印迹法检测亚洲带绦虫感染后第15 d和第75 d乳猪肝组织Caspase-3蛋白的表达Fig.3 Expression level of Caspase-3 from liver tissue of porkets by western blot assay at day 15 and day 75 post-infection after oral challenge by T. asiatica
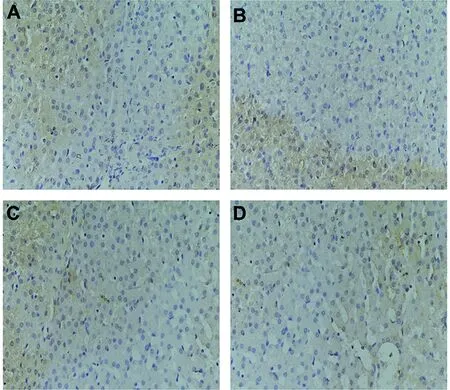
A: 感染后第15 d对照组乳猪肝组织Caspase-3蛋白免疫组化结果;B:感染后第15 d实验组乳猪肝组织Caspase-3免疫组化结果;C: 感染后第75 d对照组乳猪肝组织Caspase-3蛋白免疫组化结果;D:感染后第75 d实验组乳猪肝组织Caspase-3免疫组化结果。(A-D放大倍数=400倍)A:The representative section of liver tissue from control group porkets at day 15 post-inoculated by immunohistochemistry; B:The representative section of liver tissue from experimental group porkets at day 15 post-infection by immunohistochemistry; C:The representative section of liver tissue from control group porkets at day 75 post-inoculated by immunohistochemistry; D:The representative section of liver tissue from experimental group porkets at day 75 post-infection by immunohistochemistry.(A-D:Original magnification 400×)图4 免疫组织化学法检测亚洲带绦虫感染后第15 d和第75 d乳猪肝组织Caspase-3蛋白表达Fig.4 Expression of Caspase-3 of liver tissue from T. asiatica oral challenged porkets by immunohistochemistry assay at day 15 and day 75 post-infection
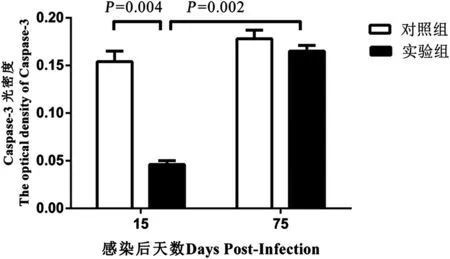
图5 感染后第15 d和第75 d乳猪肝组织Caspase-3平均光密度值Fig.5 Average optical density of Caspase-3 in liver tissues of porkets from experimental and control groups at day 15 and day 75 post-infection
3 讨 论
1972年Kerr[19]首次提出了细胞凋亡概念,细胞凋亡也称程序性细胞死亡(programmed cell death,PCD),是一个生理性的细胞自我毁灭的过程,也是机体清除感染、变异及衰老细胞而维持自身生理状态的主要调节方式之一。有研究表明[20],凋亡主要由以下几个步骤完成:接受凋亡信号后启动细胞凋亡程序;促凋亡蛋白的激活;引发Caspase级联反应裂解靶蛋白;细胞器的降解;细胞凋亡小体的破碎。细胞凋亡主要由凋亡受体途径、线粒体途径、内质网途径、细胞核凋亡途径、高尔基体和溶酶体凋亡途径以及凋亡基因控制,各途径互相联系,共同调节细胞凋亡,其中Caspase在细胞凋亡的各个途径中发挥重要的作用。Caspase家族是哺乳动物细胞中程序性死亡的介导者和执行者,目前,已经发现Caspase包括Caspase1~13,它们可分别在炎症和细胞凋亡中起到不同的作用。目前认为[11]Caspase-3处于细胞凋亡的执行者中的核心地位,Caspase-3是Caspase家族中最重要的凋亡执行者。
肝细胞的凋亡具有两面性,一方面肝细胞凋亡是机体对抗感染、肿瘤及防止自身免疫反应的自卫措施,另一方面大量的肝细胞凋亡常伴有肝细胞坏死,可引起肝脏结构和功能的损伤。本课题组既往研究发现亚洲带绦虫感染乳猪后不同时期可引起家猪肝脏的急性、慢性炎症反应和纤维化等病理性损伤,并且感染中期和晚期均存在肝细胞凋亡[8,21]。吕鹏[22]等研究发现虽然肝细胞凋亡与肝细胞坏死贯穿于肝纤维化的整个病变过程,但二者在肝纤维化的不同时期所处的主导地位不同。本研究结果显示感染后第15 d实验组Caspase-3 mRNA水平和Caspase-3蛋白的表达量均低于对照组,但感染后第75 d实验组较正常对照组无明显变化,但实验组感染后第75 d的Caspase-3 mRNA水平和蛋白表达量均高于实验组感染后第15 d的样本。结合既往研究结果,说明Caspase-3可能参与了亚洲带绦虫感染致乳猪早期肝损伤的调节。研究已发现感染早期乳猪肝细胞有点片状坏死而无明显凋亡,可能因早期入侵的亚洲带绦虫幼虫主要导致乳猪肝细胞坏死,抑制了肝细胞的凋亡,这与本实验发现感染早期Caspase-3在实验组乳猪肝组织中低表达的结果正好吻合,据此推测早期入侵的亚洲带绦虫幼虫可能对肝细胞凋亡相关Caspase-3的表达有抑制作用。此外,本实验结果表明亚洲带绦虫感染晚期乳猪肝细胞凋亡与Caspase-3无关,可能有其它的凋亡蛋白以及凋亡途径发挥作用,有待进一步研究。
目前有学者研究发现Caspase-3的表达量与寄生虫感染致宿主组织细胞凋亡的程度呈正相关。李江辉[15]等发现广州管圆线虫幼虫致小鼠脑组织细胞凋亡程度和Caspase-3的表达量呈正相关。周永华[16]等发现慢性刚地弓形虫感染致大鼠海马神经细胞凋亡的程度和Caspase-3的表达量呈正相关。Chen[14]等发现感染血吸虫的小鼠通过降低Caspase-3的表达抑制肝细胞凋亡,从而起到保护肝脏的作用。此外,有学者发现肝脏疾病中Caspase-3的低表达与细胞凋亡的抑制有关。金雷[23]等发现原发性肝细胞癌患者的肝组织中Caspase-3的低表达可能与肝癌细胞的凋亡障碍有关。黄慧[24]等在内毒素对肝细胞凋亡变化的研究中发现通过下调Caspase-3在肝脏的表达能抑制肝细胞凋亡,从而发挥保护肝脏的作用。结合本研究结果,我们推测:亚洲带绦虫感染致乳猪早期肝损伤的过程中通过Caspase-3的低表达,抑制肝细胞凋亡,可能对肝脏有保护作用。亚洲带绦虫幼虫致中间宿主乳猪肝细胞凋亡的分子机制是一个复杂的过程,Caspase-3是通过哪些信号通路及凋亡途径来调节肝细胞的凋亡尚有待进一步研究。还有学者研究发现寄生虫感染可通过Caspase-3介导宿主炎性细胞凋亡而发挥免疫逃避作用。Ernatus[13]等用免疫组织化学方法研究含有囊尾蚴的猪脑组织中Caspase-3的表达,发现Caspase-3可能通过以介导炎症细胞凋亡方式而在囊尾蚴对宿主的免疫逃避中发挥作用。Min[12]等研究表明在卫氏并殖吸虫感染人体的过程中,通过Caspase-3介导嗜酸性粒细胞凋亡,从而逃避宿主的免疫反应。杨宏强[17]等在棘球蚴感染小鼠过程中,Caspase-3诱导宿主单核细胞发生凋亡,从而逃避宿主的免疫反应。亚洲带绦虫感染乳猪的过程中,是否通过Caspase-3介导乳猪炎性细胞凋亡而使幼虫逃避宿主的免疫反应值得进一步深入研究。
[1] Fan PC. TaiwanTaeniaand taeniasis[J]. Parasitol Today, 1988, 4(3):86-88. DOI:10.1016/0169-4758(88)90204-9
[2] Eom KS, Rim HJ. Morphological descriptions ofTaeniaasiaticasp.n[J]. Korean J Parasitol, 1993, 31(1):1-6. DOI:10.3347/kjp.1993.31.1.1
[3] Zarlenga DS, McManus DP, Cross JH, et al. Characterization and detection of a newly described Asian Taeniid using cloned ribosomal DNA fragments and sequence amplification by polymerase chain reaction[J]. Exper Parasitol, 1991, 72(2):174-183. DOI:10.1016/0014-4894(91)90135-J
[4] Bowles J, McManus DP. Genetic characterization of theAsianTaenia, a newly described taeniid cestode of humans[J]. Am J Trop Med Hyg, 1994, 50(1):33-44.
[5] Ito A, Wandra T, Yamasaki H, et al. Cysticercosis/Taeniasis in Asia and the Pacific[J]. Vectorborne Zoonotic Dis, 2004, 4(2):95-107. DOI:10.1089/1530366041210756
[6] Bao HE, Mou R. Research progress on molecular identification and biologic behavior ofTaeniasaginatain Western China[J]. Chin J Parasitol Parasit Dis, 2009, 27(6):520-526. (in Chinese)
包怀恩,牟荣.中国西部地区牛带绦虫的分子鉴定和生物行为研究进展[J].中国寄生虫学与寄生虫病杂志, 2009, 27(6):520-526.
[7] Linghu Y, Zhu WJ, Bao HE, et al. Observations on pathological and histochemical changes in piglet livers infected withTaeniasaginataasiatica[J]. Front Med China, 2007, 1(3):258-263. DOI:10.1007/s11684-007-0049-8
[8] Mou R, Bao HE, Zhang K, et al. Study on hepatocyte apoptosis of domestic pigs experimentally infected withTaeniaasiaticaandTaeniasaginata[J]. Chin J Parasitol Parasit Dis, 2012, 30(5):367-371. DOI:1000-7423(2012)-05-0367-06 (in Chinese)
牟荣,包怀恩,张科,等.亚洲带绦虫和牛带绦虫实验感染乳猪后肝脏细胞凋亡的研究[J].中国寄生虫学与寄生虫病杂志,2012,30(5):367-371.
[9] Patel T, Gores GJ. Apoptosis and hepatobiliary disease[J]. Hepatology, 1995, 21(6):1725-1741. DOI:10.1016/0270-9139(95)90481-6
[10] Zhang Y, Goodyer C, LeBlanc A. Selective and protracted apoptosis in human primary nenlons microinjection with active caspase-3, -6, -7and-8[J]. J Neurosc, 2000, 20(22):8384-8389.
[11] Sun BH, Zhang J, Wang BJ, et al. Analysis ofinvivopatterns of caspase-3 gene expression in primary hepatocellular carcinoma and its relationship to P21 (WAF1) expression and hepatic apoptosis[J]. World J Gastroenterol, 2000, 6(3):356-360.
[12] Min DY, Lee YA, Ryu JS, et al. Caspase-3-mediated apoptosis of human eosinophils by the tissue-invading helminthParagonimuswestermani[J]. Intl Arch Allergy Immunol, 2004, 133(4):357-364. DOI:10.1159/000077355
[13] Mkupasi EM, Sikasunge CS, Ngowi HA, et al. Detection of cysteine protease inTaeniasolium-induced brain granulomas in naturally infected pigs[J]. Vet Parasitol, 2013, 197(1/2):360-363. DOI:10.1016/j.vetpar.2013.05.004
[14] Chen TT, Wu LS, PW Hsu, et al. Mitochondrial dynamics in the mouse liver infected bySchistosmamansoni[J]. Acta Trop, 2015, 148:13-23. DOI:10.1016/j.actatropica.2015.04.004
[15] Li JH, Tan F, Hu X, et al. Observation on cell apoptosis in mouse brain tissues induced by larvae ofAngiostrongyluscantonensis[J]. Chin J Zoonoses, 2008, 24(10):913-915. DOI:1002-2694(2008)10-0913-03 (in Chinese)
李江辉,谭峰,胡昕,等.广州管圆线虫幼虫致小鼠脑组织细胞凋亡研究[J].中国人兽共患病学报,2008,24(10):913-915.
[16] Zhou YH, Fan HJ, Xu YL, et al. Changes of apoptosis and its related protein expressions of hippocampal neurons in rats withToxoplasmagondiichronic infection[J]. Chin J Schisto Control, 2010, 22(3):264-267. DOI:10.16250/j.32.1374.2010.03.017 (in Chinese)
周永华,范红结,许永良,等.慢性弓形虫感染对大鼠海马神经细胞凋亡周期及Caspase-3与细胞色素C蛋白表达的影响[J].中国血吸虫病防治杂志, 2010, 22(3):264-267.
[17] Yang HQ, Ma SB, Bian ZY, et al. Expression of tumor necrosis factor-α and Caspase-3 protein in monocytes adjacent to the invadedEchinococcusmultilocularisin liver[J]. Chin J Parasitol Parasit Dis, 2012, 30(3):201-205. DOI:1000-7423(2012)-03-0201-05 (in Chinese)
杨宏强,马少波,卞志远,等.肿瘤坏死因子-α和半胱氨酸天冬氨酸蛋白酶3在肝泡型棘球蚴周围单核细胞中的表达[J].中国寄生虫学与寄生虫病杂志, 2012,30(3):201-205.
[18] Li D, Chang HM, Zhao L, et al. Study on Caspase-3 protein expression in small intestine and muscle tissue oftrichinellaspiralismice[J]. J Chengde Med College, 2013, 30(1):7-9. DOI:10.15921/j.cnki.cyxb.2013.01.015 (in Chinese)
李丹,常红敏,赵蕾,等.旋毛虫小鼠小肠和肌肉组织Caspase-3蛋白表达的研究[J]. 承德医学院学报, 2013, 30(1):7-9.
[19] Kerr JF, Willie AH, Currie AR. Apoptosis:A basic biological phenomenon with-ranging implications in tissue kinetics[J]. British J Cancer, 1972, 26(4):239-241. DOI:10.1038/bjc.1972.33
[20] Savitskaya MA, Onishchenko GE. Mechanisms of apoptosis[J]. Biochem (Mosc), 2015, 80(11):1393-1405. DOI:10.1134/S0006297915110012
[21] Wang M, Rong JQ, Mo XZ, et al. Pathological examination on hepatic fibrosisin porkets experimentally infected withTaeniasaginataasiatica[J]. Chin J Zoonoses, 2008, 24(04):331-333. DOI:1002-2694(2008)04-0331-03 (in Chinese)
汪敏, 戎聚全, 莫兴泽, 等. 亚洲带绦虫致乳猪肝纤维化实验观察[J]. 中国人兽共患病学报, 2008, 24(4):331-333.
[22] LYU P, Luo HS, Yu BP. Dynamic analysis of hepatocellular apoptosis and necrosisin liver fibrosis model of rat[J]. Chin J Gastroenterol Hepatol, 2002, 11(3):213-216. (in Chinese)
吕鹏, 罗和生, 余保平. 大鼠肝纤维化模型肝细胞凋亡及肝细胞坏死的动态分析[J]. 胃肠病学和肝病学杂志, 2002, 11(3):213-216.
[23] Jin L, Zhu F, Qin XH, et al. Expression of Caspase-3 mRNA in hepatocellular carcinoma and its clinical signification[J]. J Hepatopancreatobiliary Surg, 2012, 24(4):290-291. (in Chinese)
金雷, 朱峰, 秦锡虎, 等. Caspase-3 mRNA在原发性肝癌中的表达及其临床意义[J]. 肝胆胰外科杂志, 2012, 24(4):290-291.
[24] Huang H, Qu CL, Gao H, et al. Effect of endotoxin on expressions of Caspase-3and protection effect of cation A in liver[J]. Southwest China J Agr Sci, 2013, 26(3):1269-1272. DOI:1001-4829(2013) 03-1269-04 (in Chinese)
黄慧,屈常林,高洪,等.内毒素对肝脏Caspase-3蛋白表达的影响及阳离子A的保护效应[J].西南农业学报,2013,26(3):1269-1272.
Mou Rong, Email:mourong@gmc.edu.cn
Expression of cysteine aspartyl proteinase 3 from liver tissues of the porkets experimentally infected byTaeniaasiatica
XU Shi-gang1,2, MOU Rong1,2, ZHANG Ke1,2, YANG Lin1,2, LANG Shu-yuan1,2, BAO Huai-en1,2
(1.DepartmentofParasitology,GuizhouMedicalUniversity,Guiyang550025,China; 2.LaboratoryofPathogenBiology,GuizhouMedicalUniversity,Guiyang550025,China)
In order to provide substantial scientific information for exploring the mechanism of porcine liver injury caused byTaeniaasiatica(T.asiatica), the expression of Cysteine aspartyl proteinase 3 (Caspase-3) from liver tissues of porkets that were experimentally infected byT.asiaticawas examined. TheT.asiaticaadults were collected from the taeniasis patients in Duyun, Guizhou Province and identified biologically. The eggs were harvested from gravid proglottids and prepared by repeated washing and centrifugation. Twelve 20-days old Yorkshire and Seghers hybrid porkets were randomly divided into experimental and control groups as six pigs per group. The experimental group was orally administrated with 1.5×106eggs per porket at day 0 post-infection. The porkets of both groups were sacrificed on the day 15 and day 75 post-infection (three pigs per time point) respectively, and liver samples were collected for further experiments. Quantitative real-time polymerase chain reaction method was employed to detect the mRNA levels of Caspase-3, and western blotting and immunohistochemistry methods were performed to detect the level of Caspase-3 expression in both groups. At the day 15 post-infection, the mRNA level and expression level of Caspase-3 of the experimental group were significantly decreased, comparison with the control group (P=0.011,P=0.008 andP=0.004 respectively). It was positive with Caspase-3 when yellow or brown signal appeared in the cytoplasm of liver cells by immunohistochemistry. However, at the day 75 post-infection, the mRNA level and expression level of Caspase-3 of the experimental group were dramatically similar to the control group. Furthermore, in the experimental group, the mRNA level and expression level of Caspase-3 were significantly increased at day 75 post-infection than day 15 post-infection (P=0.018,P=0.003 andP=0.002 respectively). These results suggested that Caspase-3 might be involved into the regulation of the damage of porcine liver induced byT.asiaticachallenge at the early infection stage and have on effect to the hepatic injury because of the dramatic recovery of Caspase-3 at the consequent infection stage.
Taeniaasiatica; cysteine aspartyl proteinase 3; porket; liver
10.3969/j.issn.1002-2694.2017.04.007
国家自然科学基金项目(No.81160205)、贵州省优秀科技教育人才省长资金项目(黔省专合字[2008]55号)和贵州省留学人员科技创新项目(黔人项目资助合同[2015]1号)联合资助
牟 荣,Email:mourong@gmc.edu.cn
1.贵州医科大学寄生虫学教研室,贵阳 550025; 2.贵州医科大学病原生物学实验室,贵阳 550025
Supported by the National Natural Science Foundation of China (No. 81160205), the Specific Fund of Provincial Government in Guizhou Province (No.[2008]55), and the Science and Innovation Foundation of Guizhou Province for Returned Chinese Scholars (No. [2015]1)
R383.3
A
1002-2694(2017)04-0326-06
2016-11-14 编辑:刘岱伟
