糯米粉的水分等温解吸及孔特性
2017-04-25赵学伟白艳红段瑞谦
张 华,赵学伟,白艳红,段瑞谦
(1.郑州轻工业学院食品与生物工程学院,河南 郑州 450002;2.河南省食品生产与安全协同创新中心,河南 郑州 450002)
糯米粉的水分等温解吸及孔特性
张 华1,2,赵学伟1,2,白艳红1,2,段瑞谦1
(1.郑州轻工业学院食品与生物工程学院,河南 郑州 450002;2.河南省食品生产与安全协同创新中心,河南 郑州 450002)
糯米粉的等温解吸特性一方面对分析其与周围环境之间的水分传递十分必要,另一方面,还可用于计算糯米粉内孔的特性,借此加深对水分吸附机理的了解。本实验采用静态称质量法在10、20、30 ℃条件下测定糯米粉在10 个水分活度解吸后的平衡水分含量,然后采用4 个等温吸附模型对实验结果进行拟合,并分析糯米粉的孔特性。研究结果表明:糯米粉中水分的解吸属于典型的Ⅱ型吸附;Lewicki模型最能描述同一温度条件下的等温解吸过程,而GDW模型能够同时描述温度和水分活度对平衡水分含量的影响。糯米粉中同时存在微孔和介孔;孔径分布为单态分布,仅在微孔区域出现一单峰,温度变化仅对该峰的峰值产生影响;微孔体积随温度降低而增大;糯米粉的吸附面具有分形特性,随温度降低吸附表面的多孔性增强,单位吸附面积增大,最终导致吸附能力增强。
糯米粉;解吸;孔径;孔径分布;单位表面积;微孔体积;分形维数
食品及其组分的水分吸附特性(包括吸湿和解吸)对涉及水分传递的食品加工、保藏过程十分重要。如对于最为常见的干燥过程,水分吸附特性将决定干燥时间、成品的货架期以及不同水分活度的组分混合后的平衡水分[1]。水分吸附特性对于控制不期望的化学反应、酶反应[2]以及多域(multi-domain)食品内的水分转移[3]十分必要。水分等温吸附数据可用来计算吸附过程中的热力学特性(包括微分焓和微分熵、积分焓和积分熵、焓-熵补偿、铺展压等),从而更为深刻地理解等温吸附现象和吸附机理[4-5]。
等温吸附数据还可用于计算多孔性固体和粉体的孔特性,包括单位吸附面积、孔径及孔径分布、孔体积、吸附表面的分型维数等[6]。很多物理特性(如:吸附、溶解、分散等)的平衡过程和速率与表面结构有很大关系[7]。近年来有研究显示增大微孔部分的体积,可以保证食品虽有较高水分含量但却不发生品质劣变[8-9]。而分形维数则能提供吸附质与吸附剂之间相互作用的物理机理(是范德华作用或是毛细管凝结)[10]。
气体吸附法是测定多孔性材料孔特性的简单而有效的方法,气态N2是最为常见的吸附质[6]。近年来有研究者根据食品对水蒸气的吸附结果,分析计算食品的吸附面积、孔径分布和微孔体积[8-9,11-12]。
糯米几乎不含直链淀粉(0%~2%)[13]。糯米粉是由糯米用水浸泡后碾磨而成。许多以糯米粉为主料的食品加工主要是利用蒸煮后其柔软且黏度高的特性。糯米粉在我国食品工业中的一个重要应用是制作汤圆的皮层。速冻是实现汤圆这一传统食品工业化的重要技术手段。糯米粉的水分解吸特性决定汤圆速冻及保存过程中的失水量,从而影响其最终品质如冻裂率,也将决定汤圆皮与汤圆芯之间水分分配比。因此,增进对糯米粉水分解吸特性的了解是对汤圆速冻进行过程分析和品质控制的基础。
前人研究建立了米淀粉、米粉的水分吸附等温方程并计算出净吸附热[14-16],而关于糯米粉的等温吸附特性鲜见报道。本研究的目为:1)根据糯米粉在不同温度、不同水分活度下的平衡水分测定结果,确定描述糯米粉等温解吸的最适模型;2)计算糯米粉内孔的特性,包括吸附面积、孔径及其分布、微孔体积和分形维数,以增进对糯米粉的孔结构特性和水分吸附机理的了解。
1 材料与方法
1.1 材料与试剂
糯米粉购自郑州市华联超市,经测定其组分含量为:蛋白质8.08%(以干基计,下同)、粗脂肪1.11%、粗纤维0.92%、灰分0.90%、碳水化合物88.99%(差减法)。将糯米粉与适量的水混合,使最终的水分含量为45%(以湿基计),调质3 h后用于解吸实验。
1.2 水分解吸实验设计
采用静态称质量法在10 个水分活度(water activity,aw)条件下测定糯米粉的平衡水分含量(Me)。将约5 g的糯米粉放入盛有不同饱和盐溶液的干燥器中。所用的盐溶液包括:LiBr、LiCl、CH3COOK、MgCl2、K2CO3、Mg(NO3)2、KI、NaCl、KCl和K2SO4,不同温度条件下所对应的水分活度参见文献[17]。在aw>0.75时,干燥器内放一盛有麝香草粉的小试管,以防止实验期间微生物在糯米粉上生长。然后将干燥器放入恒温培养箱中,温度分别控制在10、20、30 ℃(波动范围±1 ℃),平衡水分一直到样品质量不发生明显变化 (±0.001 g)。平衡后的样品采用105 ℃烘箱法测定水分含量(kg/kg(以干基计))。所有实验进行3 次,取其平均值。
2 结果与分析
2.1 糯米粉的水分等温解吸

图1 糯米粉的解吸平衡水分及Lewicki模型的拟合曲线Fig. 1 Equilibrium moisture contents of glutinous rice fl our and curves fi tted with the Lewicki model
糯米粉在10、20、30 ℃不同水分活度条件下的平衡水分见图1,其中的实线是根据最适模型给出的预测值。可以看出,糯米粉的等温解吸曲线呈Sigma形,根据Brunauer等[18]提出的分类方法,属Ⅱ型吸附等温线,这是以有机大分子为主要成分的食品的典型类型。可以根据平衡水分随水分活度变化的特点将平衡曲线分为3 个区域[19]:在aw较低(<0.07)时,水分与固体物质之间的结合十分紧密,这部分水包括结构水和单分子层水分;在aw为中等水平(约0.07~0.80)时,水分子与固形物的结合作用相对较弱,这部分水分通常存在于细小的毛细管内;在高aw区域(>0.8),水分与固体的结合十分微弱,其特性接近自由水,主要存在于固体内的孔洞、缝隙和大的毛细管内。由图1还可明显看出,在相同水分活度条件下,平衡水分含量随温度降低而增大。通常认为是高温引起的物理或化学变化导致了可吸附位点数量降低所致,降低的幅度取决于食品组分的自身特性[20]。
描述水分活度与其对应的平衡水分之间数量关系的方程称为吸附等温式。本研究采用Chung-Pfrost模型(式(1))、Oswin模型(式(2))、Lewicki模型(式(3))和GDW模型(式(4))模拟同一温度条件下的平衡水分含量与水分活度之间的关系。其中Chung-Pfrost模型和Oswin模型为美国农业与生物工程师协会所推荐[21]。Lewicki模型是Lewicki于1998年提出的,该模型的一个特点是aw增大至1时平衡水分含量趋向无穷大[22]。GDW模型是Furmaniak等于2005年提出的,并将其成功用于描述食品的水分吸附特性[23]。
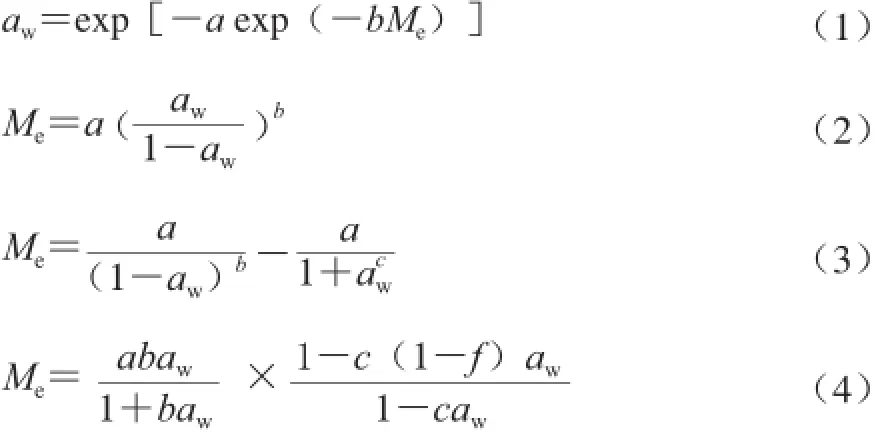
式中:Me为平衡水分含量/(kg/kg);aw为水分活度;a、b、c、f为模型参数。
本研究采用决定系数(R2)、标准估计误差(SEE)、平均相对偏差(mean relative deviation,MRD)为统计分析指标评价上述4 个模型对糯米粉解吸平衡水分的预测性能。各模型的拟合参数及统计分析指标值见表1。可以看出,就糯米粉而言,在本研究所涉及的温度和水分活度范围内,Lewicki模型的预测性能最好,因其R2最大而SEE、MRD值最小;与Chung-Pfrost模型相比,GDW模型的MRD值较大但SEE值较小;Oswin模型的SEE、MRD值比GDW模型的大。
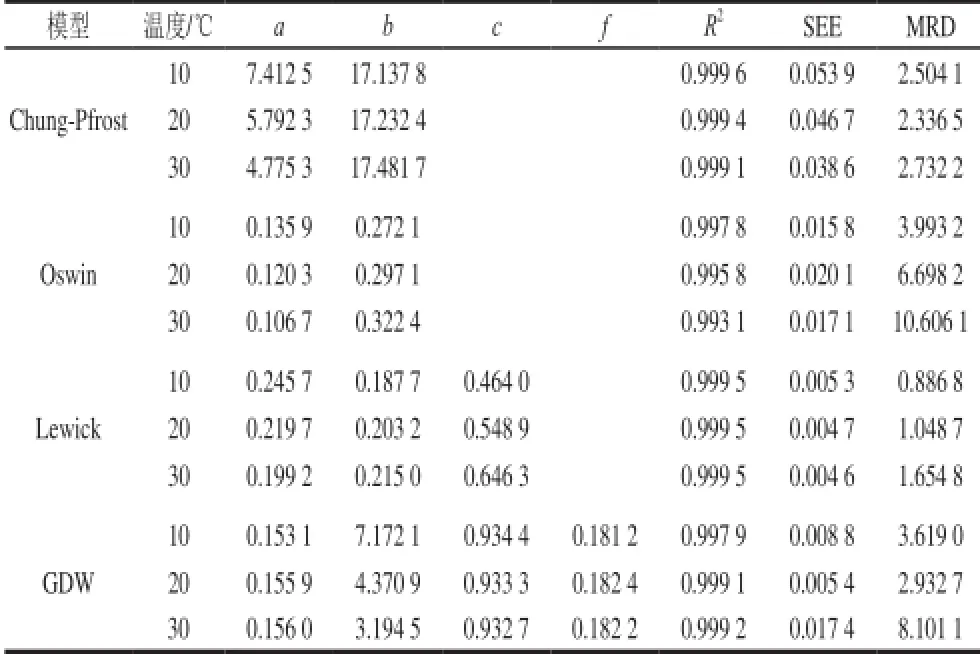
表1 4 种模型拟合所得的模型参数及统计分析指标Table 1 Statistical indicators and best-f i t parameters of four models fi tted to isotherm data of glutinous rice fl our at 10, 20 and 30 ℃
一个好的模型不仅要具有好的统计学指标,其参数还应有合理的物理意义。上述4 个模型中,GDW模型为理论模型,该模型的理论假设为:存在初级吸附位点,其吸附符合朗缪尔吸附;部分吸附在初级位点的水分子可以作为二级吸附位点;二级位点上的吸附遵循Dubinin-Serpinsky假设[23]。GDW模型中,a为吸附在初级吸附位点上的最大吸附量,f为可提供二级吸附位点的数量与初级位点总量的比;b、c为初级、二级吸附的动力学常数,其与温度的关系为:

式中:b0、c0分别为b、c的指前因子;ΔEb、ΔEc为一级、二级吸附焓;R为气体常数(8.314×10-3kJ/(mol·K));T为温度/K。
很多食品加工过程中的水分传递为非稳态过程,要对该过程进行分析计算,需要吸附等温方程必须能体现温度的影响。式(4)与式(5)、(6)联合可实现这一点。式(5)、(6)代入式(4)后拟合实验数据,得b0=3.23×10-5、c0=0.91,ΔEb=28.92 kJ/mol、ΔEc=0.06 kJ/mol。ΔEc接近于零,说明解析二级位点上的水分几乎不需要吸收热量。模型预测结果及测定结果的比较见图2,图中实线为y=x。可以看出式(4)联合式(5)、(6)可以很好预测一定温度、水分活度条件下糯米粉的平衡水分含量。
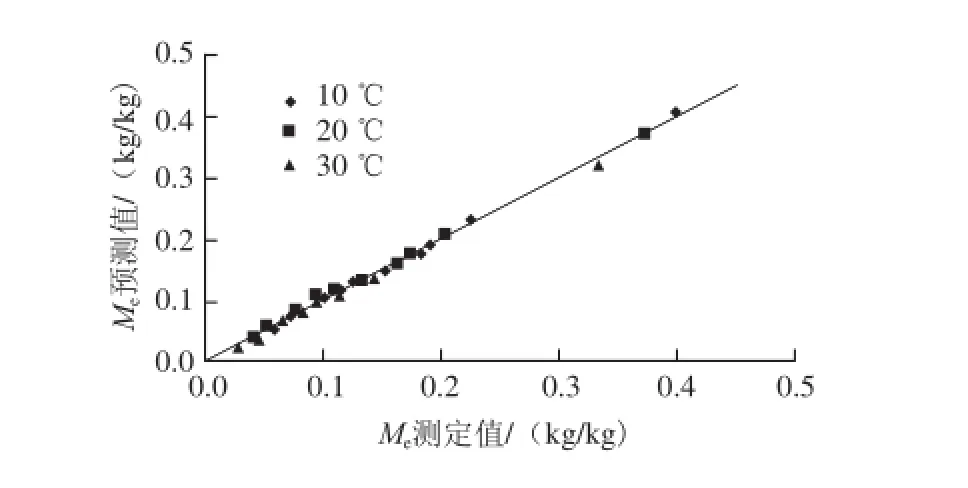
图2 糯米粉平衡水分含量测定值与预测值Fig. 2 Measured equilibrium moisture contents of glutinous rice fl our at three temperatures and their predicted values
2.2 孔径
Kelvin方程(式(7))是由水分活度计算孔径的经典方法[11]。

式中:rc为临界半径/m,为水分在圆柱形孔内发生凝结(对吸湿)或蒸发(对解吸)时孔的半径;γ为吸附质的表面张力(γ水=75.64×10-3N/m);VM为液态吸附质的摩尔体积(对于水VM=1.8×10-5m3/mol)。
Kelvin方程没有考虑在水分凝结之前多孔表面上已吸附的水分子层厚度。食品研究中,多数文献采用式计算该吸附层的厚度t(×10-10m)[25-27],该式实际上是Halsey方程针对氮气作为吸附质的结果。Halsey方程的一般式为[6]:

式中:m为单分子吸附层的厚度(×10-10m),等于单分子层排列时的摩尔体积与面积之比[28]。以水为吸附质时,取截面积=10.6×10-20m2[29],计算出m=2.82;A、r为模型系数。由于该方程是用于描述多层吸附的,采用式(8)拟合3 个温度条件下的5 个较高水分活度的实验结果,得A =-4.87,r =0.299 5。则对于水分作为吸附质时,应采用式(9)计算多分子层厚度(t)。

孔径(rp)为临界半径(rc)与多层厚度(t)之和:

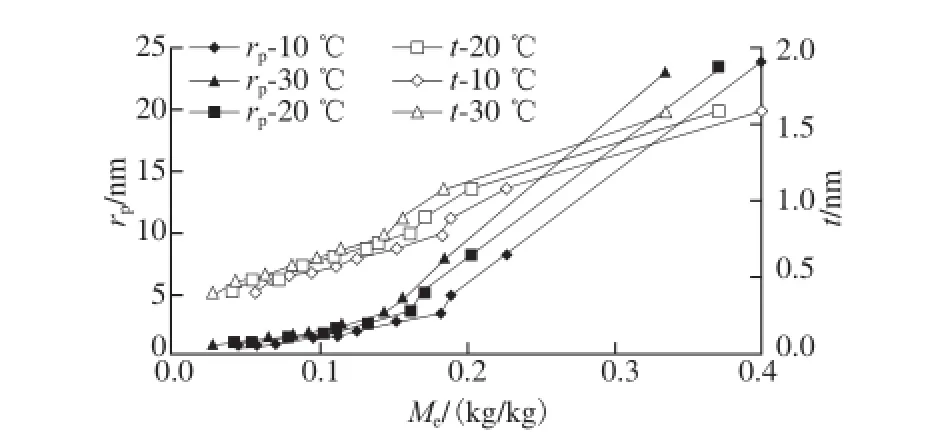
图3 糯米粉内孔径与平衡水分含量的关系Fig. 3 Radius of the pores in glutinous rice fl our as a function of equilibrium water content
aw在0.05~0.95范围内,以0.05为间隔取各aw点,采用式(10)计算各水分活度时糯米粉内的孔半径,采用Lewick模型计算相应水分活度条件下的平衡水分含量。平衡水分含量与孔径之间的关系见图3。在本研究所涉及的温度和水分含量范围内,糯米粉的平均孔径在0.8~23.8 nm之间。国际理论与应用化学联合会将孔分为3 大类:1)直径大于50 nm的称为大孔;2)直径在2~50 nm之间的称为介孔;3)直径小于2 nm的称为微孔[27]。根据该分类标准,糯米粉中的孔为微孔和介孔。
相同温度条件下,随解吸进行,平均孔径越来越小;在水分低于某临界值(与温度有关)时,孔径减小的速率降低(图3);进一步观察发现该临界水分含量对应的aw约为0.65。对于解吸过程,曲线出现折点可能意味着毛细管蒸发作用已经结束[25]。比较图中的rp曲线和t曲线(注意t曲线的纵坐标刻度)可以看出,t对rp的贡献较小,尤其在水分含量很低时。rp曲线的走势主要是由rc决定的。
图3还显示,随温度升高孔径会变大。在发生毛细管蒸发作用的区域内,温度变化对孔径的影响较大,这可能是固体材料受热膨胀的微观结果。Singh等[25-26]关于鸡肉香肠和羊肉的研究也有类似发现。
2.3 孔径分布
孔径分布(PSD)有多种表示方法,最为常见的是孔体积V相对于孔径rp尺寸的分布,由式(11)定义[6]。

由式(10)推导出以rp为自变量的aw的表达式,将其代入式(3),同时根据水的密度,求出以rp为自变量的水分体积V的表达式。求导即得dV/drp与rp的关系。作图得孔径分布曲线,见图4。
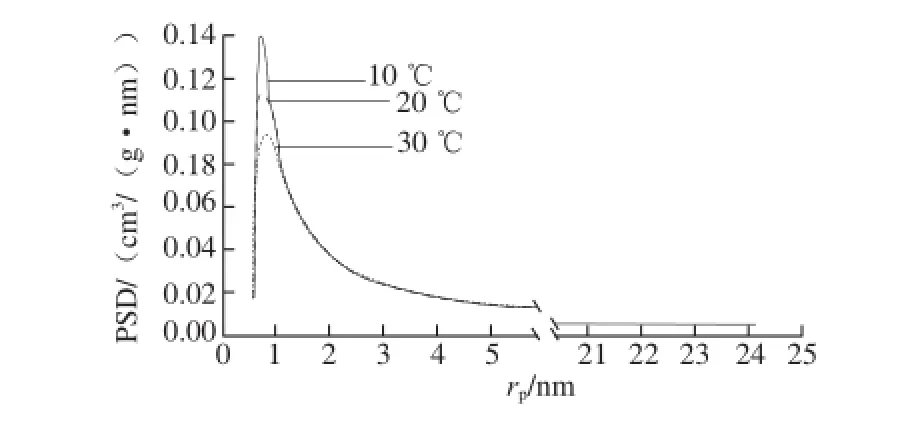
图4 糯米粉在3个温度水平下的体积孔径分布Fig. 4 Pore size distribution of glutinous rice fl our at three different temperatures
图4 显示3 个温度条件下糯米粉的孔径分布均为单态分布,仅在约0.6~2.0 nm范围内有一个峰,而在更高rp水平时PSD值一直维持在较低水平。峰值对应的孔径几乎不随温度而变化。不同温度条件下的峰宽也基本不变,说明温度变化对糯米粉内孔结构的均匀性基本没有影响。温度越低峰值越高(图4),说明吸水能力越强,换言之,糯米粉在较低温度时有更强的水分吸附能力。而这种吸附能力的不同主要是微孔部分不同造成的,因为不同温度条件下孔径分布的不同主要体现在微孔部分。
Yano等[7]以N2为吸附气体测定马铃薯淀粉的孔径分布,发现孔径分布随孔径增大而快速降低,在孔径大于10 nm时变化很小,这种变化趋势与本研究结果有一定的相似性。不同温度条件下小扁豆的孔分布形态、峰宽保持不变,而马铃薯的峰宽随温度升高而增大[11]。Karathanos等[30]采用水银孔隙仪对支链淀粉的测定结果表明,淀粉中存在3 类大小的孔,并指出孔径为6~8 μm的孔可能对应于淀粉粒聚集体之间的孔隙;第2个峰位于l.0~3.5 μm处,可能对应于淀粉粒之间的孔隙,第3个峰位于约3 nm处,大多数存在于淀粉粒内部。本研究没有在更高的孔径范围(rp>2 nm)内发现有峰,说明对糯米粉来说,孔径分布在该范围内是均匀的。
2.4 微孔体积
通常采用Dubinin-Radushkevich方程(D-R方程,式(12))描述微孔吸附过程中被吸附物质的量与水分活度之间的关系[8-9]:

式中:n为被吸附的水分的质量(g /100 g(以干基计,下同));n0为与微孔体积相对应的被吸附水分的质量(g/100 g);B为一个与吸附剂微孔结构有关的常数。根据该方程,在微孔吸附范围内lgn与lg2(1/aw)应当呈线性关系。
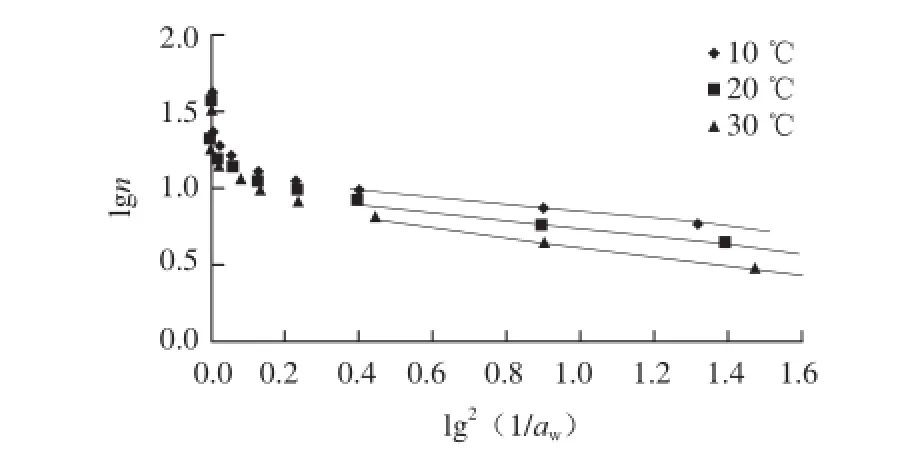
图5 根据Dubinin-Radushkevich方程分析糯米粉的解析过程Fig. 5 Dubinin-Radushkevich graphs for water desorption from glutinous rice fl our
图5 给出了以D-R方程描述糯米粉等温解吸过程的情况。可以看出,对于糯米粉来说,在水分活度较低时,lgn与lg2(1/aw)之间呈线性关系,D-R方程成立;在水分活度较高时,曲线开始向上弯曲,说明可以利用的微孔体积已经被完全填充[31],D-R关系式不再适用。为此采用水分活度较低的3 个点,进行线性回归,由回归直线的截距求出微孔内水的质量,分别是11.70、10.19、9.03 g/100 g。再根据水的密度ρ(10、20、30 ℃时分别为999.77、998.49、995.71 kg/m3[32])计算出微孔体积。
在10、20、30 ℃时糯米粉内的微孔体积分别是11.70、10.21、9.05 mL/100 g。微孔内的水分含量比根据BET方程(式(13))计算出的单分子层水分含量(分别为7.60、6.85、6.28 g/100 g)要高,Azuara[8]和Viganó[33]等也有类似发现。实际上,由于微孔的直径比水分子的直径大得多,水分子在微孔内的吸附除第一层的单层吸附外,还会进行多层吸附。尽管微孔体积对应的水分含量与单分子层水分含量是两个不同的概念,仍然可以推测,温度变化对微孔体积的影响与对单分子层水分含量的影响应归于相同的某个原因。

式中:M0为BET单分子层水分含量/(g/g(以干基计));C为BET常数。
2.5 单位吸附面积
最常用的估算单位吸附面积的方法是BET法。先采用BET方程计算出单分子吸附层水分,然后由式(14)计算[6],这里用SBET表示。
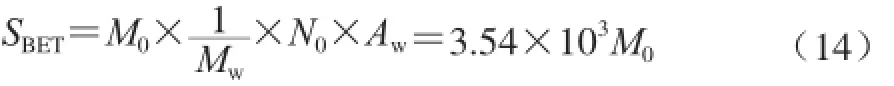
式中:MW为水的摩尔分子质量(18 g/mol);N0为阿伏伽德罗常数(6.02×1023/mol);AW为水分子的截面积(10.6×10-20m2)。
除BET方法外,在食品类文献中还经常采用另外两个方法计算单位吸附面积。其中一个是基于Caurie在1981年提出的等温吸附模型(式(15)),由式(16)计算[34],这里以SC1981表示。
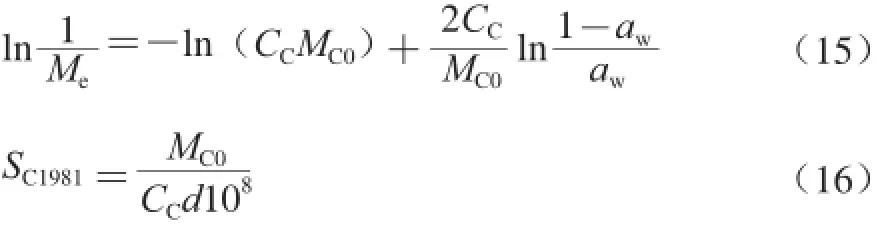
式中:CC为Caurie常数,在数值上等于单分子吸附层内被吸附的水的密度;MC0为根据式(16)求得的单分子层水分;d为水分子的直径,取值3.673×10-10m。以Sl表示ln(1/Me)对ln((1-aw)/aw)所得直线的斜率,则:式(16)转变为简洁的式(17)。该式更为常用[25-26]。

另一个方法是Caurie于2012年[12]根据其2005年[35]提出的等温吸附方程(式(18))推导出来的。这里以SC2012表示。以水为吸附剂时,由式(19)计算。

式(19)中:n为方程(18)中的参数,可由实验测得的Me-aw数据组,通过模型拟合求得;CC’为模型参数。Caurie针对多种材料的研究显示:分别以水、N2为吸附剂时采用BET方法计算出的吸附面积相差很大,不在一个数量级;而采用该作者提出的方法计算时,两个吸附面积在一个数量级上[35]。
本研究也采用式(17)、(19)计算糯米粉的吸附面积,结果见图6。

图6 采用3 种方法的糯米粉内的单位吸附表面积Fig. 6 Specif i c surface area of glutinous fl our at three different temperatures calculated using three different methods
糯米粉的SEBT(222.58~269.29 m2/g)低于马铃薯淀粉的(287~320 m2/g)[36]以及玉米淀粉的(283.60 m2/g)[35]。图6显示,随温度升高,不论采用哪种计算方法,糯米粉内可供水分吸附的面积都减小。式(18)中的n=M0/CC’,而CC’可认为表示单分子吸附层的密度[35],同时结合式(15)、(17)可以看出,单位吸附面积随温度升高而降低主要是由于单分子吸附层水分含量降低。SBET计算的是被吸附分子所占据的实际面积之和,其值大小取决于有效吸附位点的数量。可以认为,温度升高引起的某种理化变化导致一级吸附位点失活。也可从热力学的角度理解,前面的结果显示一级吸附的活化能为正值,这说明解吸是一个吸热过程;因此,低温条件下不利于解吸,使得单分子吸附层水分含量较高。
2.6 吸附面的分形维数
可由多种方法根据等温吸附数据计算吸附面的分形维数,其中FHH模型因适用于多种情况且简单方便而最为常用。FHH理论是由Frenkel、Halsey和Hill提出的,用于描述气体分子在分形表面多层吸附的一个模型。根据该模型,被吸附水的质量与水分活度之间存在如下关系[37]:

式中:AM0为一个与单分子层吸附水分含量有关的常数;1/m为一个与分形维数有关的指数。根据式(20)中1/m的值可区分吸附质与吸附剂之间的作用是范德华引力或是毛细管凝结作用[38]。如果1/m<1/3,是范德华引力,分形维数为:如果1/m>1/3,则是毛细管凝结作用,分形维数为:


需要注意的是,根据上述方法计算出的分形维数为吸附后形成的吸附膜表面的分形维数,而不是固体表面的分形维[6]。
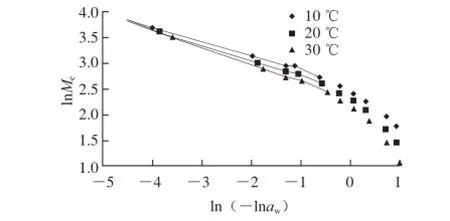
图7 糯米粉的等温吸附过程的分形分析Fig. 7 Fractal analysis of water adsorption isotherm of glutinous rice fl our at three different temperatures
根据糯米粉的等温解吸实验结果,lnMe对ln(-lnaw)作图,结果见图7。可以看出,aw值较高时两者之间呈线性关系。Neimark[37]指出,FHH方程适用于毛细管凝结作用占主导的微孔吸附或解吸,并建议在aw>0.7范围内使用。在此aw范围内进行线性回归(图7),根据回归直线的斜率求出糯米粉在10、20、30 ℃时的分形维数分别为2.19、2.11、2.05。分形维数界于2~3之间, 说明糯米粉的吸附面确有分形特性。
糯米粉吸附面的分形维数与Yano等[7]关于小麦粉、大米粉的分形维数测定结果(2.34、2.29)较为接近。需要说明的是,Yano等是根据颗粒表面积与粒径之间的关系估算分形维数的。Aguerre等[39]采用与BET理论相同的假设前提,推导出一个分形表面的多层吸附等温模型,据此估算分形维数,得出多数淀粉的分形维数接近3,小麦粉的为2.6;Resio等[40]根据该方法估算出苋菜籽淀粉在25、35、45 ℃时的分形维数分别为2.80、2.75、2.78,均高于本研究的结果。随温度升高糯米粉的分形维数略有降低,这一点与Aguerre等[39]关于淀粉的研究结果一致。
对于糯米粉,由于1/m>1/3,说明糯米粉中水分的解吸过程主要是由毛细管凝结作用控制的;而马铃薯淀粉的水分吸附是由范德华力和毛细管凝结共同决定的[36]。
表面分形维数反映表面结构的不均匀性和自相似性,值越大说明其结构越接近三维多孔性结构。因此,分形维数的值越高,吸附表面越粗糙,吸附能力也就越强[41],对比本研究关于不同温度条件下的分形维数和平衡水分含量,也印证了这一点。
3 讨 论
由式(17)、(19)计算的结果均低于采用BET方法计算的结果(图6);式(19)给出的结果更接近BET方法结算的结果。尽管Caurie等[35]关于马铃薯淀粉和玉米淀粉的结果也显示出相同的趋势,至于为何不同计算方法所得结果有很大差异,该作者并未关注。下面对此做深入讨论。
3.1 BET法与Caurie1981法的比较
不同的单分子层水分含量:由前面的计算方程知,Caurie1981法与BET法都是根据单分子层水分含量计算单位吸附面积的,但BET方法中的单分子层水分是采用BET方程得到的,而Caurie1981法中是采用方程(16)得到的。Caurie1981法计算出的糯米粉的单分子层水分含量在10、20、30 ℃时分别为9.56、8.37、7.70 g/100 g,大于BET方程的计算结果(见2.4节)。仅就20 ℃条件下糯米粉的单分子层水分含量而言,则有M0=0.818MC0。
不同的单分子层密度:在由单分子层水分质量计算其对应体积的过程中,Caurie1981方法中采用的是被吸附单分子层的容积密度(式(16)中的CC)。针对本研究,该值在1.382~1.393 kg/m3之间,可取其平均值1.388 kg/m3。而BET方法在计算单位吸附面积时是以单个水分子为计算单位的,可以认为采用的是单个水分子的密度。关于被吸附的单个水分子的体积,可以参考与氨基酸结合的水分子的体积,25.8×10-30m3[42]。由水分子的质量,可计算出水分子的密度为1.159 kg/m3。则相同质量时,VBET=1.198VC1981。
不同的面积计算策略:BET法计算的实际上是单分子吸附层中所有水分子的截面积(实际上为水分子在吸附面上的正投影面积)之和,并不包括投影圆之间的间隙。Caurie1981法则是根据单分子层的总体积除以层高(认为等于水分子的直径,关于这种假设的合理性,后面有详细论述)。根据Caurie1981法,假设水分子球的半径为rw,单位吸附面积为SC1981,则体积为V=2rwSC1981。由于两种方法采用相同的分子直径取值(BET法中面积取值为1.06×10-19m2,该面积的圆所对应的直径为3.673×10-10m,正是Caurie1981法的分子直径),则BET方法中体积为V的吸附层中,半径为rw的球体的数量为单位吸附面积为,将上述V=2rwSC1981代入该式得SBET=1.5SC1981。
针对本研究中20 ℃时的情况,上述3 个因素叠加的结果则是:SBET=0.818×1.198×1.5SC1981=1.470SC1981。而根据BET法和Caurie1981法计算出的单位吸附面积分别为242.74、164.35 m2/g,两者之比为1.477,十分接近1.470。这说明上述关于BET法和Caurie1981法产生差异原因的分析是合理的。
3.2 Cauire1981法与Caurie2012法的比较
由式(16)推导出式(17)的过程中假设水分子的直径为3.673×10-10m,而推导出式(20)的过程中认为水分的直径为2.75×10-10m。如果这两个方法中采用相同的分子直径取值,计算出的单位吸附面积几乎相等(结果略)。
3.3 水分子直径的取值
水分子直径的取值为3.673×10-10m还是2.75×0-10m更合理?Caurie1981法中水分子的直径3.673×10-10m是根据水分子的截面积10.6×10-20m2计算出来的,并以此作为单分子层的厚度[34]。该文献并未给出该截面积数值的出处。而文献[29]中给出的吸附在固体表面的水分子的截面积正是这个值。问题的关键是吸附在固体表面的水分子未必呈球形,仅根据其截面积推算其在另一维上的长度是不合适的,因而,Caurie1981法中采用3.673×10-10m作为单分子吸附层的厚度显得不妥。Caurie等[35]的研究中取水分子的直径为2.75×10-10m,这个值十分接近水分子的范德华半径(2.82×10-10m[43]),但显然不应当将此理解为水分子的直径,因为如此的话,水分子的体积为10.88×10-30m3,比文献[42]报道的值低得多。将2.75×10-10m理解为被吸附的单分子层的厚度更合理。如将水分子简单看作截面为10.6×10-20m2、高为2.75×10-10m的柱体,其体积为29.15×10-30m3。该值比上述的与氨基酸结合的水分子的体积明显要大,而仅略小于大量水体中水分子的体积29.70×10-30m3[42]。实际上,处于被吸附状态的水分子的截面积会因吸附质的不同而有所变化。有报道显示,吸附在纤维素上的水分子的投影面积为14.8×10-20m2[44]。
最后需要说明的是,尽管BET法与Caurie法之间存在前述的3 个差异,但两者之间有着共同点:都认为吸附面积是被吸附的分子所占据的实际面积,并不包括每个分子所占面积之间的“空白”面积。当然,在Caurie法中,认为分子之间不存在“空白”面积。所以,单位吸附面积并不等同于吸附表面的实际面积。实际面积=吸附面积+“空白”面积。
4 结 论
糯米粉中水分解吸属于Ⅱ型吸附。温度越高,其平衡水分含量越低,Lewicki模型能更好低描述其解吸过程中平衡水分含量随水分活度的变化,而GDW模型可以同时预测平衡水分含量随温度和水分活度的变化。
糯米粉中的孔属于微孔和介孔,孔径分布为单态分布,不同温度下孔径分布的不同主要体现在微孔部分。微孔体积、SBET分别在11.70~9.05 mL/100 g、223~269 m2/g之间,随温度升高而减小。吸附面具有分形特性,分形维数在2.05~2.19之间,随温度降低而增大。
导致BET法与Cauire法计算单位吸附面积结果显著不同的根本原因在于:单分子层水分含量、单分子层密度、面积计算策略3 个方面的差异。
[1] CHIRIFE J, IGLESIAS H A. Equations for fitting water sorption isotherms of food: part I-a review[J]. Journal of Food Technology, 1978, 13(3): 159-174. DOI:10.1111/j.1365-2621.1978.tb00792.x.
[2] ROCKLAND L B, BEUCHAT L R. Water activity: theory and applications to food[M]//Practical Applications of Water Activity and Moisture Relations in Foods. New York: Marcel Dekker Inc., 1987: 369-395.
[3] LABUZA T P, HYMAN C R. Moisture migration and control in multi-domain foods[J]. Trend in Food Science and Technology, 1998, 9(2): 47-55. DOI:10.1016/S0924-2244(98)00005-3.
[4] BERISTAIN C I, AZUARA E, VERNON-CARTER E J. Effect of water activity on the stability to oxidation of spray-dried encapsulated orange peel oil using mesquite gum (Prosopis julif l ora) as wall material[J]. Journal of Food Science, 2002, 67(1): 206-211. DOI:10.1111/j.1365-2621.2002.tb11385.x.
[5] 邱光应, 彭桂兰, 吴绍锋, 等. 花椒吸附等温线及热力学性质[J]. 食品科学, 2015, 36(21): 1-5. DOI:10.7506/spkx1002-6630-201521001.
[6] LOWELL S, SHIELDS J E, THOMAS M A. Characterization of porous solids and powders: surface area, pore size and density[M]. New York: Springer Science+Business Media, 2004: 94-100. DOI:10.1007/978-1-4020-2303-3.
[7] YANO T, NAGAI T. Fractal surface of starchy materials transformed with hydrophilic alcohols[J]. Journal of Food Engineering, 1989, 10(2): 123-133. DOI:10.1016/0260-8774(89)90031-9.
[8] AZUARA E, BERISTAIN C I. Enthalpic and entropic mechanisms related to water sorption of yogurt[J]. Drying Technology, 2006, 24(11): 1-7. DOI:10.1080/07373930600961173.
[9] PASCUAL-PINEDA L A, FLORES-ANDRADE E, ALAMILLABELTRAN L, et al. Micropores and their relationship with carotenoids stability: a new tool to study preservation of solid foods[J]. Food Bioprocess Technology, 2014, 7(4): 1160-1170. DOI:10.1007/s11947-013-1162-0.
[10] JARZEBSKI A B, LORENC J, PAJAK L. Surface fractal characteristics of silica aerogels[J]. Langmuir, 1997, 13(5): 1280-1285. DOI:10.1021/la960011z.
[11] AOUAINI F, KNANI S, YAHIA M B, et al. Statistical physics studies of multilayer adsorption isotherm in food materials and pore size distribution[J]. Physica A: Statistical Mechanics and Its Applications, 2015, 432: 373-390. DOI:10.1016/j.physa.2015.03.052.
[12] CAURIE M. A method to correct the wide discrepancy between Brunauer, Emmett and Teller water and N2surface areas of adsorbents[J]. International Journal of Food Science and Technology, 2012, 47(11): 2366-2371. DOI:10.1111/j.1365-2621.2012.03111.x.
[13] LI J R, HSIEH P Y H. Traditional Chinese food technology and cuisine[J]. Asia Pacific Journal of Clinical Nutrition, 2004, 13(2): 147-155.
[14] DURAKOVA A G, MENKOV N D. Moisture sorption characteristics of rice flour[J]. Die Nahrung, 2004, 48(2): 137-140. DOI:10.1002/ food.200300387.
[15] BRETT B, FFGUEROA M, SANDOVAL A J, et al. Moisture sorption characteristics of starchy products: oat flour and rice flour[J]. Food Biophysics, 2009, 4(3): 151-157. DOI:10.1007/s11483-009-9112-0.
[16] 刘成梅, 周国辉, 万婕, 等. 大米淀粉解吸等温线与吸附等温线的拟合模型研究[J]. 食品工业科技, 2014, 35(10): 198-201. DOI:10.13386/j.issn1002-0306.2014.10.036.
[17] GREENSPAN L. Humidity fi xed points of binary saturated aqueous solutions[J]. Journal of Research of the National Bureau of Standards, Section A: Physics and Chemistry, 1977, 81(1): 89-96.
[18] BRUNAURE S, DEMING L S, TELLER E. On a theory of van der Waals adsorption of gases[J]. Journal of the American Chemical Society, 1940, 62(7): 1723-1732. DOI:10.1021/ja01864a025.
[19] DEVAHASTIN S. Mujumdar’s practical guide to industrial drying[M]// Fundamental Principles of Drying. Montreal: Exergex Corp, 2000: 1-22.
[20] RAO M A, RIZVI S S H. Engineering properties of foods[M]// Thermodynamics of Foods in Dehydration. New York: Marcel Dekker, 1995: 133-214.
[21] American Society of Agricultural and Biological Engineers. ASAE D245.6 Moisture relationship of plant-based agricultural products[S]. St. Joseph: American Society of Agricultural and Biological Engineers, 2007: 496-512.
[22] LEWICKI P P. A three parameter equation for food moisture sorption isotherms[J]. Journal of Food Process Engineering, 1998, 21(2): 127-144. DOI:10.1111/j.1745-4530.1998.tb00444.x.
[23] FURMANIAK S, TERZYK A P, GOLEMBIEWSKI R, et al. Searching the most optimal model of water sorption on foodstuffs in the whole range of relative humidity[J]. Food Research International, 2009, 42(8): 1203-1214. DOI:10.1016/j.foodres.2009.06.004.
[24] GARCIA-PEREZ J V, CARCEL J A, CLEMENTE G, et al. Water sorption isotherms for lemon peel at different temperatures and isosteric heats[J]. LWT-Food Science and Technology, 2008, 41(1): 18-25. DOI:10.1016/j.lwt.2007.02.010.
[25] SINGH R R B, RAO K H, ANJANEYULU A S R, et al. Moisture sorption properties of smoked chicken sausages from spent hen meat[J]. Food Research International, 2001, 34(2/3): 143-148. DOI:10.1016/S0963-9969(00)00145-9.
[26] SINGH R R B, RAO K H, ANJANEYULU A S R, et al. Water desorption characteristics of raw goat meat: effect of temperature[J]. Journal of Food Engineering, 2006, 75(2): 228-236. DOI:10.1016/ j.jfoodeng.2005.04.013.
[27] ROSA G S, MORAES M A, PINTO L A A. Moisture sorption properties of chitosan[J]. LWT-Food Science and Technology, 2010, 43(3): 415-420. DOI:10.1016/j.lwt.2009.09.003.
[28] de ALBANI M I D, ARCIPRETE C P. A study of pore size distribution and mean pore size on unsupported gamma-alumina membranes prepared by modifications introduced in the alkoxide hydrolysis step[J]. Journal of Membrane Science, 1992, 69(1/2): 21-28. DOI:10.1016/0376-7388(92)80164-F.
[29] LIVINGSTON H K. Cross-sectional areas of molecules adsorbed on solid surfaces[J]. Journal of the American Chemical Society, 1944, 66(4): 569-573. DOI:10.1021/ja01232a021.
[30] KARATHANOS V T, SARAVACOS G D. Porosity and pore size distribution of starch materials[J]. Journal of Food Engineering, 1993, 18(3): 259-280. DOI:10.1016/0260-8774(93)90090-7.
[31] FLETCHER A J, THOMAS K M. Compensation effect for the kinetics of adsorption/desorption of gases/vapors on microporous carbon materials[J]. Langmuir, 2000, 16(15): 6253-6266. DOI:10.1021/ la9916528.
[32] SPIEWECK F, BETTIN H. Review: solid and liquid density determination[J]. Technisches Messen, 1992, 59(7/8): 285-292. DOI:10.1524/teme.1992.59.78.285.
[33] VIGANÓ J, AZUARA E, TELIS V R N, et al. Role of enthalpy and entropy in moisture sorption behavior of pineapple pulp powder produced by different drying methods[J]. Thermochimica Acta, 2012, 528: 63-71. DOI:10.1016/j.tca.2011.11.011.
[34] CAURIE M. Derivation of full range moisture isotherms[M]// ROCKLAND L B, STEWART G F. Water Activity: Influences on Food Quality, New York: Academic Press, 1981: 63-87.
[35] CAURIE M. The unimolecular character of the classical Brunauer, Emmett and Teller adsorption equation and moisture adsorption[J]. International Journal of Food Science and Technology, 2005, 40(3): 283-293. DOI:10.1111/j.1365-2621.2004.00892.x.
[36] CZEPIRSKI L, KOMOROWSKA-CZEPIRSKA E, SZYMONSKA J. Fitting of different models for water vapor sorption on potato starch granules[J]. Applied Surface Science, 2002, 196(1/2/3/4): 150-153. DOI:10.1016/S0169-4332(02)00050-8.
[37] NEIMARK A V. Determination of the surface fractal dimensionality from the results of an adsorption experiment[J]. Russian Journal of Physical Chemistry, 1990, 64(10): 1397-1403.
[38] SOKOLOWSKA Z, BOROWKO M, RESZKO-ZYGMUNT J, et al. Adsorption of nitrogen and water vapor by alluvial soils[J]. Geoderma, 2002, 107(1/2): 33-54. DOI:10.1016/S0016-7061(01)00137-9.
[39] AGUERRE R J, VIOLLAZ P E, SUAREZ C. A fractal isotherm for multilayer adsorption in foods[J]. Journal of Food Engineering, 1996, 30(1/2): 227-238. DOI:10.1016/S0260-8774(97)89377-6.
[40] RESIO A C, AGUERRE R J, SUAREZ C. Analysis of the sorptional characteristics of amaranth starch[J]. Journal of Food Engineering, 1999, 42(1): 51-57. DOI:10.1016/S0260-8774(99)00103-X.
[41] XIONG J, LIU X, LIANG L X. An investigation of fractal characteristics of marine shales in the southern china from nitrogen adsorption data[J]. Journal of Chemistry, 2015: 1-12.
[42] PERKINS S J. Protein volumes and hydration effects. The calculations of partial specif i c volumes, neutron scattering matchpoints and 280-nm absorption coefficients for proteins and glycoproteins from amino acid sequences[J]. European Journal of Biochemistry, 1986, 157(1): 169-180. DOI:10.1111/j.1432-1033.1986.tb09653.x.
[43] FRANKS F. Water: a matrix of life[M]. 2nd ed. Cambridge: Royal Society of Chemistry, 2000: 9-14. DOI:10.1021/ed078p593.1.
[44] TOPGAARD D, SODEMAN O. Diffusion of water absorbed in cellulose fibers studied with1H-NMR[J]. Langmuir, 2001, 17(9): 2694-2702. DOI:10.1021/la000982l.
Water Desorption Isotherm and Pore Characteristics of Glutinous Rice Flour
ZHANG Hua1,2, ZHAO Xuewei1,2, BAI Yanhong1,2, DUAN Ruiqian1
(1. School of Food and Bioengineering, Zhengzhou University of Light Industry, Zhengzhou 450002, China;2. Henan Province Collaborative Innovation Center for Food Production and Safety, Zhengzhou 450002, China)
Water desorption isotherm of glutinous rice flour is necessary for understanding water transfer from it to environment. On the other hand, the isotherm data can be used to explore pore characteristics a solid matrix, which will allow a deeper understanding of water adsorption mechanism. Equilibrium water contents of glutinous rice flour were determined after conditioning to 10 different water activity levels at 10, 20 and 30 ℃ using a static gravimetric method. The obtained desorption data were fi tted with four selected isotherm models, and were further mined to estimate pore properties of glutinous rice fl our. Glutinous rice fl our exhibited a typical type-Ⅱ adsorption isotherm. The Lewicki model performed best in predicting water desorption of glutinous rice fl our at a constant temperature, while the GDW model could predict the moisture content as a function of water activity and temperature. The pores in glutinous rice fl our included micropore and mesopore. Pore size distribution posed a single peak located in micropore zone whose value increased with the decrease in temperature. Consequently, micropore volume also increased as temperature decreased. The pore surface in glutinous rice fl our was fractal in nature. The more porous surface structure and the larger specif i c surface area at lower temperature contributed to the increased adsorption capacity.
glutinous rice flour; desorption; pore size; pore size distribution; specific surface area; micropore volume; fractal dimension
10.7506/spkx1002-6630-201707015
TS213.2
A
1002-6630(2017)07-0088-08
张华, 赵学伟, 白艳红, 等. 糯米粉的水分等温解吸及孔特性[J]. 食品科学, 2017, 38(7): 88-95. DOI:10.7506/spkx1002-6630-201707015. http://www.spkx.net.cn
ZHANG Hua, ZHAO Xuewei, BAI Yanhong, et al. Water desorption isotherm and pore characteristics of glutinous rice flour[J]. Food Science, 2017, 38(7): 88-95. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707015. http://www.spkx.net.cn
2016-03-12
“十二五”农村领域国家科技计划项目(2012BAD37B06-05);2014年河南省重大科技专项(141100110400);郑州市重大科技专项(152PZDZX026)
张华(1975—),男,副教授,博士,研究方向为米面食品加工。E-mail:zhh7510@126.com
