微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响
2017-04-25万宇俊殷军艺聂少平石惠方谢明勇
万宇俊,殷军艺,聂少平,石惠方,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响
万宇俊,殷军艺,聂少平,石惠方,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
研究微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响。采用沸水浴、微波两种方式提取胡萝卜中的多糖(分别记为WEP和MEP),通过基本理化性质测定、高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)和单糖组成分析等方法比较了两者的基本结构特征,并采用扫描电子显微镜对两者的固体形貌进行表征。结果显示,WEP和MEP的中性糖、糖醛酸和总酚含量存在差异,两者均由半乳糖醛酸、半乳糖、葡萄糖、阿拉伯糖、鼠李糖组成,但MEP总糖含量更高并含有更多果胶类单糖;WEP和MEP的HPSEC图有一定相似性,但WEP中含有重均分子质量高达7.77×105D的组分;WEP表现较为聚集的片状结构,而MEP组分则表现较为分散且主要为小片段状态。上述结果表明,两种不同提取方法所得到的多糖具有显著差异。
胡萝卜;多糖;微波提取;基本结构特征;固体形貌
胡萝卜,又称红萝卜或甘荀,为伞形科草本植物胡萝卜(Daucus carota L.)的肉质根。胡萝卜中富含胡萝卜素、胡萝卜多糖等食品功能成分[1]。研究表明,胡萝卜多糖具有良好的抗氧化及抗菌特性[2];此外,胡萝卜多糖在抗炎[2]、降血糖[3]、抑制脂肪肝[4]等方面的作用也有相关研究进行报道。胡萝卜多糖的良好功能活性被广泛研究报道,但传统的胡萝卜多糖提取方法因耗时长、得率低、流程复杂等使得其工业化生产困难。
微波辅助提取技术具有节能、省时、有效成分得率高等特点[5],在天然产物提取方面具有较好的应用前景,有研究将该技术用于多糖提取[6]。将微波辅助提取应用到胡萝卜多糖提取中能够有效地提高胡萝卜多糖的得率,同时节省提取时间[7],但是通过微波提取的多糖和传统工艺提取得到的多糖在基本结构特征及固体形貌方面的差异却鲜有报道。
本实验以新鲜胡萝卜为原料,分别采用沸水浴加热提取及微波辅助提取,从中提取、制备得到两种胡萝卜多糖,然后通过基本理化指标测定、高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)、单糖组成分析、傅里叶红外光谱及扫描电子显微镜(scanning electron microscope,SEM)方法对两种多糖的基本结构特征及固体形貌方面进行比较,旨在探讨微波辅助提取对胡萝卜多糖基本结构特征及固体形貌的影响,为胡萝卜多糖的提取技术选择提供参考。
1 材料与方法
1.1 材料与试剂
新鲜胡萝卜购于江西省南昌市农贸市场。
单糖标准品(L-岩藻糖、鼠李糖、D-阿拉伯糖、D-半乳糖、D-葡萄糖、D-木糖、D-甘露糖、D-核糖、D-果糖、半乳糖醛酸、葡萄糖醛酸)、醋酸钠 美国Sigma公司;牛血清白蛋白 美国Amersco公司;考马斯亮蓝G-250、溴化钾(光谱纯) 德国Fluka公司;95%食用级酒精、氯仿、正丁醇、浓硫酸、苯酚、咔唑、没食子酸、福林-酚、硝酸钠和叠氮钠等均为国产分析纯。
1.2 仪器与设备
MARS-6微波消解仪 法国CEM公司;多角度激光光散射与凝胶渗透色谱仪(配有DAWN HELEOS Ⅱ型十八角度激光光散射仪、Optlab T-rEX干涉型示差折光检测器、ViscoStar黏度检测器) 美国Wyatt公司;Dionex ICS 5000型离子色谱仪 美国Dionex公司;Nicolet 5700傅里叶红外光谱仪 美国Thermo公司;JSM 6701F场发射扫描电子显微镜(带能谱仪) 日本电子株式会社;Milli-Q超纯水仪 美国Millipore公司;ALPHA 1-2冷冻干燥机 德国Martin Christ公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器公司。
1.3 方法
1.3.1 胡萝卜多糖制备
1.3.1.1 胡萝卜原材料处理
将新鲜的胡萝卜洗净、切丝,放入60 ℃烘箱过夜烘干,烘干后的样品经高速粉碎机粉碎后过100 目筛,收集的胡萝卜粉末置于干燥器中备用。
1.3.1.2 恒温沸水浴法提取胡萝卜多糖及其制备
取适量胡萝卜粉末,按照料液比为1∶60(m/V)、提取温度为100 ℃、提取时间为2 h的条件进行胡萝卜多糖的提取。提取所得上清液经真空浓缩至原体积1/5后,缓慢加入体积分数95%乙醇至乙醇体积分数为80%,4 ℃条件下醇沉过夜,离心去除上清液,得到胡萝卜粗多糖[8]。采用Sevag法[9]对胡萝卜粗多糖进行脱蛋白处理,脱蛋白后的多糖溶液于4 ℃条件下透析72 h。透析后的多糖进行二次醇沉,离心后到的沉淀利用无水乙醚、丙酮分别润洗两次,冻干后得到胡萝卜多糖,记为WEP(water extracted polysaccharide)。
1.3.1.3 微波提取胡萝卜多糖及其制备
取适量胡萝卜粉末,在料液比1∶60(m/V)、提取温度100 ℃、微波功率2 000 W、提取时间15 min的条件下进行胡萝卜多糖的提取。提取所得上清液按照1.3.1.2节中方法制备得到微波提取的胡萝卜多糖,记为MEP(microwave extracted polysaccharide)。
1.3.2 总糖、糖醛酸、蛋白质、总酚含量的测定
以葡萄糖为标准品,采用苯酚-硫酸法[10]测定多糖中的总糖含量;以半乳糖醛酸为标准品,采用咔唑-硫酸法[11]测定多糖中糖醛酸含量;以牛血清白蛋白为标准品,采用考马斯亮蓝法[12]测定多糖中蛋白质含量;以没食子酸为标准品,采用Folin-Ciocalteu法[13]测定多糖中总酚含量。
1.3.3 多糖提取物纯度和分子质量测定
利用0.1 mol/L NaNO3(含0.2 mg/mL NaN3)溶液在室温条件下将多糖样品重复溶解,样品质量浓度为1.0 mg/mL,并用0.2 μm水系滤膜过滤待后续进样分析。
色谱条件:0.1 mol/L NaNO3(含0.2 mg/mL NaN3)溶液为流动相,流速0.6 mL/min,进样量为100 μL,色谱柱为Ohpak SB-G保护柱(6 mm×50 mm,10 µm)、Ohpak SB-806 HQ型色谱柱(8 mm×300 mm,13 µm)与Ohpak SB-804 HQ型色谱柱(8 mm×300 mm,10 µm)串联使用,柱温箱温度为35 ℃。数据采集软件为ASTRA 6.0,样品数据分析前利用葡聚糖(Mw=40 000 D,质量浓度为1.0 mg/mL)标准品采集数据进行系统的归一化处理[14]。
1.3.4 单糖组成分析
称取5 mg样品至20 mL具塞试管中,冰浴条件下缓慢加入0.5 mL 12 mol/L H2SO4,磁力搅拌0.5 h,取出后加入2.5 mL超纯水稀释,转移至100 ℃油浴中充分水解4 h;水解完全后迅速置于冰浴中冷却。将水解液稀释100 倍过0.2 mm水系滤膜后利用Dionex ICS 5000型离子色谱仪进行分析[15]。
色谱条件[16]:CarboPac™ PA20分析柱(3 mm×150 mm),流动相A为250 mmol/L NaOH溶液,B为超纯水,C为1 mol/L乙酸钠溶液,梯度洗脱,洗脱程序如表1所示,流速为0.5 mL/min。

表1 单糖和糖醛酸的洗脱程序Table 1 Gradient elution procedure for the separation of monosaccharide and uronic acid
1.3.5 傅里叶红外光谱分析
取适量经过真空干燥后的多糖样品与KBr粉末混匀后压片,利用Nicolet 5700傅里叶红外光谱仪进行红外光谱扫描[17]。
1.3.6 SEM分析
取微量多糖样品通过导电带吸附到样品台上,经过喷金处理后利用场发射SEM(带能谱仪)进行观察分析[18]。
1.4 数据处理
实验数据利用SPSS 23.0软件,采用单样本t检验进行显著性差异比较(P<0.05)。
2 结果与分析
2.1 多糖提取物基本成分分析
表2 WEP、MEP基本成分分析(n=3,±s)Table 2 Physicochemical properties of WEP and MEP (n= 3,±s)

表2 WEP、MEP基本成分分析(n=3,±s)Table 2 Physicochemical properties of WEP and MEP (n= 3,±s)
注:同列肩标字母不同表示差异显著(P<0.05)。表4同。
组分中性糖含量糖醛酸含量蛋白质含量总酚含量WEP70.50±0.42a30.45±0.35b1.92±0.11a0.09±0.15bMEP66.35±0.30b35.72±0.57a1.02±0.10b0.26±0.13a
从表2中的数据可以看出,两个多糖样品的中性糖与糖醛酸含量之和均大于100%,这是由于在采用苯酚-硫酸法测定中性糖的过程中,糖醛酸同样会有部分显色反应发生[19],导致测得的中性糖含量偏高,从而使两者之和大于100%。此外,从表2还可看出,WEP中的糖醛酸含量及总酚含量比MEP中含量要低,但是WEP中的中性糖含量比MEP要高;基本成分含量的差异初步表明了微波对多糖会有一定影响,导致两者在理化性质上的差异。
2.2 HPSEC检测
HPSEC-激光光散射仪联用不仅可以得到聚合物的重均分子质量(Mw),同时还可以得到数均分子质量(Mn)、多分散度(Mw/Mn)和均旋转半径(Rg)等一系列聚合物构象参数[14]。由HPSEC结果可知,WEP组分较MEP组分更为复杂;同时通过ASTRA软件分析得到的结果可以看出,WEP主要由3 个组分组成,其对应的Mw分别为:7.77×105、1.06×105、1.61×104D;MEP主要由两个组分组成,其对应的Mw分别为:1.59×105、9.95×103D,回收率分别为:54.2%、27.8%。通过比较可知:WEP和MEP的HPSEC图谱有一定相似性,但WEP的分子质量比MEP要高。此结果与Yoo等[20]的结论相吻合。
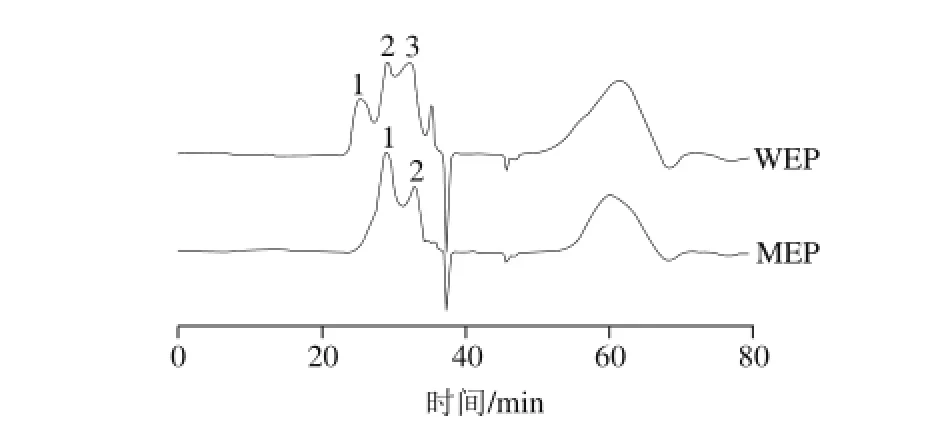
图1 HPSEC光谱图(示差信号)Fig. 1 HPSEC chromatograms of WEP and MEP
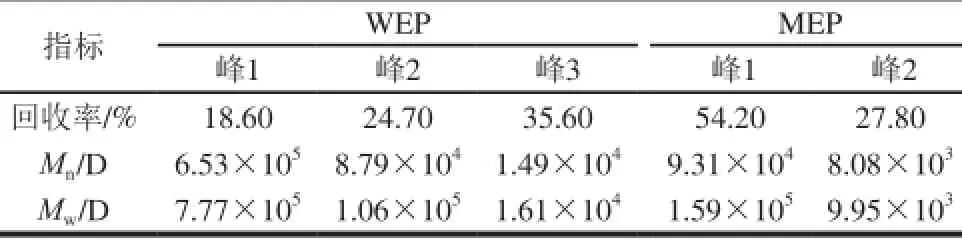
表3 HPSEC分析结果Table 3 Analytical results of WEP by HPSEC
2.3 单糖组成分析
通过离子交换色谱对WEP、MEP进行了单糖组成分析。图2显示了11 种单糖标准和WEP、MEP的单糖组成色谱图,根据不同单糖的标准曲线可以得到WEP由半乳糖醛酸GalA(19.01%)、半乳糖Gal(18.11%)、葡萄糖Glc(11.11%)、阿拉伯糖Ara(8.38%)、鼠李糖Rha(1.62%)组成,MEP由Gal(31.54%)、GalA(19.10%)、Ara(11.47%)、Rha(4.81%)、Glc(4.81%)组成。WEP主要含有GalA、Gal、Glc等单糖,而MEP主要含有Gal、GalA、Ara等果胶类单糖。以上结果表明两种不同方法提取得到的WEP与MEP组分在单糖组成含量上有所差异,Yan Yajuan等[21]研究也表明传统热水浸提与微波提取得到的两组分多糖在单糖组成上有差异。

图2 单糖组成色谱图Fig. 2 HPAEC chromatography
表4 HPAEC分析结果(n=3,xs)Table 4 HPAEC analysis of monosaccharides (n= 3,±s)

表4 HPAEC分析结果(n=3,xs)Table 4 HPAEC analysis of monosaccharides (n= 3,±s)
组分Rha含量Ara含量Gal含量Glc含量GalA含量WEP1.62±0.15b8.38±0.33b18.11±0.68b11.11±0.57a19.01±0.17baMEP4.81±0.95a11.47±0.40a31.54±0.68a4.81±0.01b19.10±1.76a
2.4 傅里叶红外光谱特征
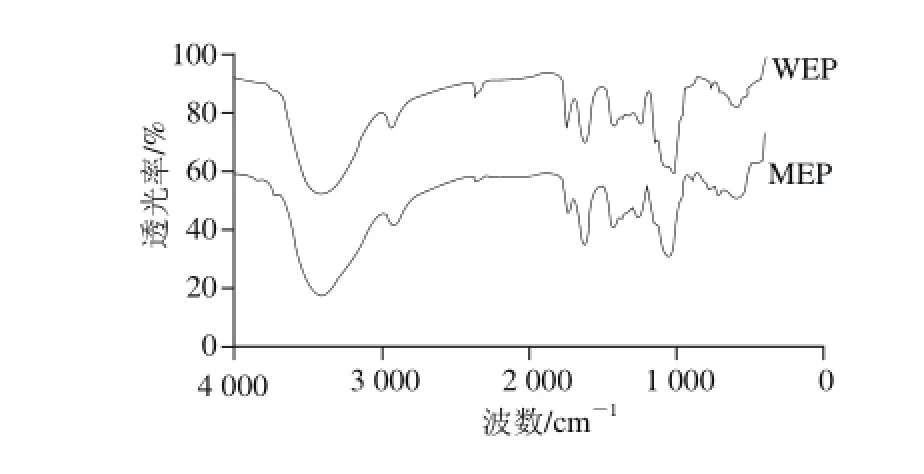
图3 WEP、MEP红外光谱图Fig. 3 Infrared spectra of WEP and MEP
从两种多糖的傅里叶红外光谱图(图3)中可以得到相关结构特征信息:在3 400 cm-1附近的较宽且吸收较强的峰应该是糖类的O—H伸缩振动;在2 800~3 000 cm-1范围内的较弱吸收峰一般是甲基或亚甲基的C—H伸缩振动;2 300 cm-1附近的较弱吸收峰一般由于测试环境中CO2存在所造成的;1 700 cm-1附近的吸收峰为—COOH中的C=O吸收峰;1 620、1 400 cm-1附近的吸收峰分别是伯胺N—H键的弯曲、变角振动;1 200 cm-1附近则是糖类的C—H变角振动; 950~1 160cm-1范围内的吸收峰一般是由于吡喃环的伸缩振动造成。因此WEP、MEP均具有典型的糖类特征吸收峰[15,22-23],且二者均具有吡喃环结构,故WEP、MEP的红外光谱特征较为相似。
2.5 SEM表征

图4 WEP、MEP的SEM图谱Fig. 4 SEM images of of WEP and MEP
采用SEM表征WEP、MEP的形态变化情况,结果如图4所示。WEP表现较为聚集的片状结构,而微波提取所得到的MEP则表现较为分散且主要为小片段状态。通过SEM图像可以看出两者的固体形貌存在较大的差异,造成这种差异的原因可能是由于微波的高能量导致多糖的片状、链状结构解聚成小分子片段[24]。
3 讨 论
胡萝卜分别经过沸水浴提取、微波提取后得到的WEP和MEP存在较明显的差异,具体表现在基本成分分析、单糖组成、分子质量分布及固态形貌等方面。其中MEP的多酚含量为0.26%,是WEP中多酚含量的3 倍,这可能是微波提取的作用时间较短,对于极易被氧化的多酚类物质起到了一个保护作用[25-27],导致MEP中的总酚含量较WEP要高。WEP与MEP中的中性糖含量及糖醛酸含量有所差异,单糖组成分析表明在WEP组分中主要以GalA(19.01%)、Gal(18.11%)及Glc(11.11%)为主,而MEP中主要以Gal(31.54%)、GalA(19.10%)及Ara(11.47%)为主,这些结果初步表明两种提取方法所得到的多糖有一定的差异[28-29]。同时WEP主要有3 个Mw分布,MEP主要有两个Mw分布,结合HPSEC图谱可以看出,MEP中的1.59×105、9.95×103D两个Mw分布与WEP组分中1.06×105、1.61×104D这两个Mw分布有一定的相似性,但是WEP组分中7.77×105D部分在MEP中并没有出现;SEM图像也表明MEP主要以小分子片段为主,而WEP则以片状结构及链状结构为主;但是通过傅里叶红外图谱可以看出两者均具有吡喃环结构且两者所存在的官能团差异不是很大,所以微波提取过程中可能是由于微波的强穿透力导致多糖分子的解聚[30],使得大分子的片段解聚成小分子片段,从而导致MEP分子质量比WEP要小,同时造成两者在单糖组成、中性糖及糖醛酸含量上有所差异。综上所述,微波提取虽然给予了诸多方便,但是对于提取的产物还是会造成一定的影响,而经过微波提取后的产物与传统提取方式所得产物的结构差异性导致其对应的活性变化,也有待于进一步深入、系统研究。
[1] 谢明勇, 殷军艺, 聂少平. 胡萝卜多糖结构与功能及其在食品加工过程中的变化[J]. 中国食品学报, 2016, 16(4): 1-9. DOI:10.16429/ j.1009-7848.2016.04.001.
[2] 刘立新, 张羽男, 沙靖全, 等. 胡萝卜多糖抗炎及体外抗氧化作用研究[J]. 时珍国医国药, 2011, 22(10): 2334-2335. DOI:10.3969/ j.issn.1008-0805.2011.10.008.
[3] 阚国仕, 杨艳侠, 陈红漫, 等. 胡萝卜多糖降低血糖的功能研究[J]. 食品研究与开发, 2015, 36(1): 118-121. DOI:10.3969/ j.issn.1005-6521.2015.01.031.
[4] 阚国仕, 杨奉仪, 陈红漫, 等. 胡萝卜多糖的分离纯化及抑制小鼠酒精肝损伤作用研究[J]. 食品科技, 2011, 36(7): 165-168. DOI:10.13684/j.cnki.spkj.2011.07.026.
[5] 谢明勇, 陈奕. 微波辅助萃取技术研究进展[J]. 食品与生物技术学报, 2006, 25(1): 105-114. DOI:10.3321/j.issn:1673-1689.2006.01.022.
[6] ROSTAMI H, GHARIBZAHEDI S M T. Microwave-assisted extraction of jujube polysaccharide: optimization, purification and functional characterization[J]. Carbohydrate Polymers, 2016, 143: 100-107. DOI:10.1016/j.carbpol.2016.01.075.
[7] 赵强, 张敏, 许雳, 等. 微波辅助提取胡萝卜果胶的工艺优化[J]. 食品研究与开发, 2013, 34(4): 29-32. DOI:10.3969/ j.issn.1005-6521.2013.04.009.
[8] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 1-11. DOI:10.16429/j.1009-7848.2010.02.035.
[9] CHEN Y, XIE M Y, NIE S P, et al. Purif i cation, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241. DOI:10.1016/j.foodchem.2007.08.021.
[10] BAO H H, YOU S G, CAO L K, et al. Chemical and rheological properties of polysaccharides from fruit body of Auricularia auricularjudae[J]. Food Hydrocolloids, 2016, 57: 30-37. DOI:10.1016/ j.foodhyd.2015.12.031.
[11] 闵芳芳, 聂少平, 万宇俊, 等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学, 2013, 34(21): 24-29. DOI:10.7506/spkx1002-6630-201321006.
[12] 殷军艺. 大粒车前子多糖生物活性、结构和构象特征研究及多糖分离纯化新方法初探[D]. 南昌: 南昌大学, 2012: 42-48.
[13] 黄菲, 郭亚娟, 张瑞芬, 等. 不同干制方式的荔枝多糖理化特性和抗氧化活性比较[J]. 中国食品学报, 2016, 16(3): 212-218. DOI:10.16429/j.1009-7848.2016.03.029.
[14] 殷军艺, 刘晓莹, 聂少平, 等. 脱除阿魏酸后车前子多糖的溶液性质、构象特征及固体形貌[J]. 高等学校化学学报, 2016(1): 43-47. DOI:10.7503/cjcu20150513.
[15] 徐萌萌, 殷军艺, 万宇俊, 等. 益生菌发酵胡萝卜汁中不同方法制备的水溶性多糖理化特性[J]. 食品工业科技, 2016, 37(15): 125-128. DOI:10.13386/j.issn1002-0306.2016.15.016.
[16] WANG Z J, XIE J H, SHEN M Y, et al. Carboxymethylation of polysaccharide from Cyclocarya paliurus and their characterization and antioxidant properties evaluation[J]. Carbohydrate Polymers, 2016, 136: 988-994. DOI:10.1016/j.carbpol.2015.10.017.
[17] ANURADHA K, BANGAL P, MADHAVENDRA S S. Macromolecular arabinogalactan polysaccharide mediated synthesis of silver nanoparticles, characterization and evaluation[J]. Macromolecular Research, 2016, 24(2): 152-162. DOI:10.1007/ s13233-016-4018-4.
[18] 田华. 豆天蛾多糖CBP3结构初步研究[J]. 食品工业科技, 2016, 37(9): 97-100. DOI:10.13386/j.issn1002-0306.2016.09.011.
[19] GUO Q, CUI S W, WANG Q, et al. Extraction, fractionation and physicochemical characterization of water-soluble polysaccharides from Artemisia sphaerocephala Krasch seed[J]. Carbohydrate Polymers, 2011, 86(2): 831-836. DOI:10.1016/j.carbpol.2011.05.034.
[20] YOO S, LEE B, LEE H, et al. Structural characteristics of pumpkin pectin extracted by microwave heating[J]. Journal of Food Science, 2012, 77(11): 1169-1173. DOI:10.1111/j.1750-3841.2012.02960.x.
[21] YAN Y J, LI X, WAN M J, et al. Effect of extraction methods on property and bioactivity of water-soluble polysaccharides from Amomum villosum[J]. Carbohydrate Polymers, 2015, 117: 632-635. DOI:10.1016/j.carbpol.2014.09.070.
[22] 包瑛, 马岳, 李雅双, 等. 大白桩菇多糖的结构鉴定及清除自由基活性[J]. 食品科学, 2016, 37(6): 71-76. DOI:10.7506/spkx1002-6630-201606012.
[23] 丁婧思, 聂少平, 冯燕玲, 等. 茶叶酸性多糖的分离、纯化及其理化性质研究[J]. 食品科学, 2014, 35(23): 57-60. DOI:10.7506/spkx1002-6630-201423012.
[24] SHAH U, GANI A, ASHWAR B A, et al. Effect of infrared and microwave radiations on properties of Indian Horse Chestnut starch[J]. International Journal of Biological Macromolecules, 2016, 84: 166-173. DOI:10.1016/j.ijbiomac.2015.12.020.
[25] KAMILOGLU S, TOYDEMIR G, BOYACIOGLU D, et al. A review on the effect of drying on antioxidant potential of fruits and vegetables[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(1): 110-129. DOI:10.1080/10408398.2015.1045969.
[26] LAI M N, NG L T. Antioxidant and antiedema properties of solid-state cultured honey mushroom, Armillaria mellea (higher basidiomycetes), extracts and their polysaccharide and polyphenol contents[J]. International Journal of Medicinal Mushrooms, 2013, 15(1): 1-8. DOI:10.1615/IntJMedMushr.v15.i1.10.
[27] CHAMORRO S, VIVEROS A, ALVAREZ I, et al. Changes in polyphenol and polysaccharide content of grape seed extract and grape pomace after enzymatic treatment[J]. Food Chemistry, 2012, 133(2): 308-314. DOI:10.1016/j.foodchem.2012.01.031.
[28] JI L, XUE Y, ZHANG T, et al. The effects of microwave processing on the structure and various quality parameters of Alaska pollock surimi protein-polysaccharide gels[J]. Food Hydrocolloids, 2017, 63: 77-84. DOI:10.1016/j.foodhyd.2016.08.011.
[29] YIN X, YOU Q H, JIANG Z H, et al. Optimization for ultrasonicmicrowave synergistic extraction of polysaccharides from Cornus officinalis and characterization of polysaccharides[J]. International Journal of Biological Macromolecules, 2016, 83: 226-232. DOI:10.1016/j.ijbiomac.2015.11.059.
[30] PRAJAPAT A L, GOGATE P R. Depolymerization of guar gum solution using different approaches based on ultrasound and microwave irradiations[J]. Chemical Engineering and Processing: Process Intensif i cation, 2015, 88: 1-9. DOI:10.1016/j.cep.2014.11.018.
Impact of Microwave Extraction on Structural Characteristics and Morphology of Carrot (Daucus carota L.) Polysaccharide
WAN Yujun, YIN Junyi, NIE Shaoping, SHI Huifang, XIE Mingyong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In this paper, we investigated the effect of microwave extraction on structural characteristics and morphology of polysaccharides from carrot. Boiling water bath and microwave were used to extract carrot polysaccharide (the resulting products were denoted as WEP and MEP respectively). A comparative evaluation was made of the basic physical and chemical properties of the two polysaccharides. High size exclusion chromatography (HPSEC), monosaccharide composition analysis, and scanning electron microscope (SEM) were also used for the preliminary characterization of their morphology. The results showed that the contents of neutral sugar, uronic acid and total phenol were different in WEP and MEP. They were both composed of galacturonic acid, galactose, glucose, arabinose, and rhamnose, but the total sugar content of MEP was higher and contained more constituent monosaccharides of pectin. The HPSEC chromatogramsss of WEP and MEP had some similarity, but WEP exclusively contained a component with a relative molecular weight of up to 7.77 × 105D. WEP displayed a more aggregated sheet structure, and its components were more dispersed and mainly present as small fragments. According to the results above, the polysaccharides obtained from two different extraction methods had signif i cant differences.
carrot (Daucus carota L.); polysaccharide; microwave extraction; structural characteristics; morphology
10.7506/spkx1002-6630-201707001
TS201.1
A
1002-6630(2017)07-0001-05
万宇俊, 殷军艺, 聂少平, 等. 微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响[J]. 食品科学, 2017, 38(7): 1-5. DOI:10.7506/spkx1002-6630-201707001. http://www.spkx.net.cn
WAN Yujun, YIN Junyi, NIE Shaoping, et al. Impact of microwave extraction on structural characteristics and morphology of carrot (Daucus carota L.) polysaccharide[J]. Food Science, 2017, 38(7): 1-5. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707001. http://www.spkx.net.cn
2016-06-28
国家自然科学基金面上项目(31571826);食品科学与技术国家重点实验室目标导向项目(SKLF-ZZA-201611)
万宇俊(1993—),男,硕士研究生,研究方向为食品科学与工程。E-mail:wanyujun@yeah.net
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:myxie@ncu.edu.cn
