蓝圆鲹传统腌干过程中内源脂肪酶和脂质降解氧化的变化分析
2017-04-25曹松敏吴燕燕李来好林婉玲陈胜军赵永强
曹松敏,吴燕燕*,李来好,林婉玲,陈胜军,赵永强
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
蓝圆鲹传统腌干过程中内源脂肪酶和脂质降解氧化的变化分析
曹松敏1,2,吴燕燕1,*,李来好1,林婉玲1,陈胜军1,赵永强1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
为探明传统腌干鱼类加工过程脂肪降解氧化规律,本研究以蓝圆鲹为原料,采用传统腌干方法,测定传统腌干鱼加工过程(鲜鱼、腌制、浸泡脱盐、烘干、成品)5 个加工阶段的内源性中性脂肪酶(neutral lipase,NL)、酸性脂肪酶(acid lipase,AL)、磷脂酶(phospholipase,PL)、脂肪氧合酶(lipoxygenase,LOX)活力变化,过氧化值(peroxide value,POV)、硫代巴比妥酸值(thiobarbituric acid value,TBARS)、脂肪酸含量变化,分析内源性脂肪酶与脂质降解、氧化的关系。结果表明:蓝圆鲹腌干过程中内源性脂肪水解酶活力均随着加工进程出现不同速率的降低情况,成品中NL、AL、PL活力保存率分别为:17%、57%、33%,LOX在腌干过程中活力显著增强(P<0.05)。POV和TBARS均在加工过程中逐步上升,其中POV在烘干后期急速下降。主成分分析显示内源性脂肪水解酶对脂质的降解有一定的影响作用,对脂肪氧化的影响极小;LOX对脂肪降解的影响较小,与脂质的氧化正相关;多不饱和脂肪酸含量在腌制阶段和烘干阶段呈明显下降趋势(P<0.05);单不饱和脂肪酸脂肪酸和饱和脂肪酸含量均在腌制阶段和烘干阶段显著增加(P<0.05);二十碳五烯酸和二十二碳六烯酸两者的含量变化呈现出互补状态。
蓝圆鲹;传统腌干方法;内源性脂肪酶;脂质分解氧化
蓝圆鲹(brown-striped mackerel scad,Decapterus maruadsi)为鲈形目鲹科圆鲹属的一种,俗称池鱼,巴浪鱼;属暖水性中上层鱼类,主要分布在中国台湾浅滩南部、粤东碣石湾外近海、珠江口、海陵岛、海南省东北部近海及福建沿岸;为南海经济鱼类。蓝圆鲹主要用于加工腌干鱼制品。
传统的腌干鱼制品由于其独特的风味而受到人们的喜爱[1]。腌制鱼类制品的特色挥发性风味物质主要成分为醛类、酮类、醇类、酯类等,这些物质主要来源于脂肪的降解及氧化。鱼类腌制品中内源性脂肪酶系主要分为脂肪水解酶和脂肪氧合酶(lipoxygenase,LOX)两大类,脂肪水解酶主要对脂肪进行降解;LOX主要对脂肪进行氧化。目前国内外对腌制鱼类制品的研究,主要集中于生产过程中产生的胺类、亚硝酸盐、脂肪氧化等方面[2-3],有报道称水产品不同加工方法对脂质氧化分解的影响不同[4]。传统咸鱼加工过程中水分含量不断降低,盐分含量不断升高,对肌肉内源酶活性有较大影响,从而对脂质氧化分解及风味的形成有一定的影响作用。对于相关内源性脂肪酶类在咸鱼加工过程中变化规律及其对鱼类脂肪降解及氧化的影响作用探究几乎为零。相对而言,内源性脂肪酶在其他肉制品加工过程中的规律探索比较多,如Jin Guofeng[5]和Wang Ying[6]等分别研究了干腌培根及风干鸭中的内源性酶类的变化。研究发现LOX活力在火腿等肉制品中的较大,对水解游离脂肪酸生成挥发性风味物质具有重要的影响作用[7]。
本研究以蓝圆鲹为原料,采用传统咸鱼的腌干方法对其进行加工,测定出各个加工阶段即鲜鱼、腌制、浸泡脱盐、烘干、成品5 个加工阶段的内源性脂肪酶、LOX活力变化,脂肪氧化指标过氧化值(peroxide value,POV)、硫代巴比妥酸值(thiobarbituric acid value,TBARS)的变化情况,主要游离脂肪酸的含量和组成变化,分析探究蓝圆鲹传统腌干过程中内源性脂肪酶同脂质分解氧化的关系,脂肪酸的变化与脂肪氧化的关系,揭示蓝圆鲹传统腌干过程中的脂肪氧化规律,为蓝圆鲹腌干鱼制品的实际加工生产及品质控制提供理论依据,也为下一步改进传统的腌干技术提供参考。
1 材料与方法
1.1 材料与试剂
蓝圆鲹(冰鲜,每条鱼质量为80~100 g)、海水晒制粗盐 广东台山李贵记水产有限公司。
4-甲基伞形酮、4-甲基伞形酮油酸酯、牛血清白蛋白(bovine serum albumin,BSA)、亚油酸、二甲基亚砜(dimethyl sulphoxide,DMSO)、硫代巴比妥酸(thiobarbituric acid,TBA)、1,1,3,3-四乙氧基丙烷、正己烷、三氟化硼-甲醇溶液美国Sigma-Aldrich公司;考马斯亮蓝总蛋白含量测试盒 南京建成生物技术有限公司;氯仿、三氯乙酸(trichloroacetic acid,TCA)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、磷酸氢二钠、磷酸二氢钠、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、聚乙二醇辛基苯基醚(polyethylene glycol octylphenol ether,TritonX-100)、三羟甲基氨基甲烷(tris(hydroxymethyl)metyl aminomethane,Tris)、还原铁粉等均为分析纯 广州化学试剂厂。
1.2 仪器与设备
BS224S分析天平 美国Sartorius公司;3k30冷冻离心机 美国Sigma公司;UV-2550紫外分光光度计、QP2010 Plus气相色谱-质谱联用(gas chromatographymass spectrometry,GC-MS)仪 日本岛津公司;UV-3000PC型紫外分光光度计 上海美谱达仪器有限公司;T25均质机 德国IKA公司;RC-5型热泵干燥机 广东省农业机械研究所干燥设备制造厂。
1.3 方法
1.3.1 样品制备
冰鲜蓝圆鲹去内脏后洗净,按照传统加工咸鱼的方法[8-9]进行腌制。腌制后的蓝圆鲹沥水后置于热泵干燥机中烘干2 d,烘干温度(28±2) ℃。
加工过程中不同加工阶段进行分别取样:样品A(鲜蓝圆鲹)、样品B(腌制后)、样品C(脱盐后)、样品D(烘干中期)、样品E(烘干后成品)。每个阶段取样5~8 条鱼,去除可见脂肪及鱼皮,用绞肉机将鱼肉均匀绞碎,装于样品袋中,置于-30 ℃冰箱中保存留用。
1.3.2 脂肪酶活性测定
1.3.2.1 粗酶液提取
粗酶液的提取根据Hernandez等[10]的方法进行,并稍作修改。准确称取样品5.000 g,加入25 mL磷酸盐缓冲液(50 mmol/L、pH 7.5、含5 mmol/L EGTA),用均质机高速匀浆(15 000 r/min,6×10 s),均质后将样品于冰水浴中匀速搅拌30 min,再进行低温离心(4 ℃、10 000×g),离心后的样品用4 层纱布滤去上层脂肪,并用抽提缓冲液定容到25 mL,利用考马斯亮蓝试剂盒测定蛋白质含量,分析酶活力。
1.3.2.2 酸性脂肪酶活力测定
酸性脂肪酶(acid lipase,AL)活力测定方法主要依照Vestergaard等[11]的方法进行,并略作修改。抽取0.1 mL粗酶提取液于10 mL离心管中,向离心管中加入2.8 mL 0.1 mol/L磷酸氢二钠-0.05 mol/L柠檬酸缓冲液(pH 5.0,含0.05% TritonX-100和0.8 mg/mL BSA),之后加入0.1 mL 1.0 mmol/L的4-甲基形酮油酸底物,将混合反应液置于37 ℃水浴锅中保温30 min,立即用0.5 mL浓度为1 mol/L的盐酸终止反应,用荧光分光光度计测定反应后的溶液荧光度,激发波长和发射波长分别为328、470 nm。空白对照用同体积的提取酶缓冲液代替反应所需要的粗酶提取液。
1.3.2.3 中性脂肪酶活力测定
中性脂肪酶(neutral lipase,NL)活力测定方法主要依照Motilva等[12]中的方法进行,并略作修改。抽取0.1 mL粗酶提取液于10 mL离心管中,向离心管中加入2.8 mL 0.22 mol/L Tris-HCl缓冲液(pH 7.5,含0.05% TritonX-100),之后加入0.1 mL 1.0 mmol/L的4-甲基形酮油酸底物,将混合反应液置于37 ℃水浴锅中保温30 min后,立即于冰水浴中冷却终止反应,并于1 min中之内用荧光分光光度计测定反应后的溶液荧光度,激发波长和发射波长分别为328、470 nm。空白对照用同体积的提取酶缓冲液代替反应所需的粗酶提取液。
1.3.2.4 磷脂酶活力测定
磷脂酶(phospholipase,PL)活力测定方法主要依照Vestergaard等[11]的方法进行,并略作修改。抽取0.1 mL粗酶提取液于10 mL离心管中,向离心管中加入2.8 mL 0.1 mol/L磷酸氢二钠-0.05 mol/L柠檬酸缓冲液(pH 5.0,含0.05% TritonX-100、0.8 mg/mL BSA、150 mol/L氟化钠),之后加入0.1 mL 1.0 mmol/L的4-甲基形酮油酸底物,将混合反应液置于37 ℃水浴锅中保温30 min,立即用0.5 mL浓度为1 mol/L的盐酸终止反应,用荧光分光光度计测定反应后的溶液荧光度,激发波长和发射波长分别为328、470 nm。空白对照用同体积的提取酶缓冲液代替反应所需要的粗酶提取液。
分别用测定3 种酶活力所用的缓冲液,配制一系列浓度的4-甲基伞型酮溶液,绘制出标准曲线,利用标准曲线方法计算出3 种酶在加工过程中的酶活力。一个酶活力单位(U)定义为:1 g酶蛋白在1 h内产生1 nmol的4-甲基伞型酮。
1.3.3 LOX活力测定
LOX粗酶液的提取和相关酶活的测定以及亚油酸底物制备均参照Gata等[13]的方法,并略作修改。
1.3.3.1 LOX粗酶液提取
精确称取解冻后样品5.000 g,加入20 mL浓度为50 mmol/L磷酸盐缓冲液(pH 7.0,含1 mmol/L二硫苏糖醇、1 mmol/L EDTA)。用均质机高速匀浆(15 000 r/min、6×10 s),均质后将样品于冰水浴中匀速搅拌30 min,再进行低温离心(4 ℃、10 000×g),离心后的样品用4 层纱布滤去上层脂肪,并用抽提缓冲液定容到25 mL,利用考马斯亮蓝试剂盒测蛋白质含量并分析酶活力。
亚油酸底物准备:准确称取140 g亚油酸,将其溶解于5 mL脱氧重蒸水中(含180 μL吐温20,pH 9.0),亚油酸完全溶解后用脱氧重蒸水定容到50 mL,低温条件下(-18 ℃)贮存备用。
1.3.3.2 LOX活力测定
200 μL亚油酸钠底物与2.9 mL、50 mmol/L的柠檬酸缓冲溶液(pH 5.5)混合,室温条件下快速均匀混合溶液,并快速读取其在234 nm波长处稳定后的吸光度,向混合液中加入0.1 mL酶提取液,迅速混合均匀,读取反应1 min后反应液在234 nm波长处的吸光度,计算反应后吸光度与反应前吸光度之差。每个样品测定3 个平行。1个酶活力单位(U)定义:每分钟每克酶蛋白质吸光度增加1。
1.3.4 游离脂肪酸含量测定及分析
1.3.4.1 脂肪的提取
依照Folch等[14]的方法进行操作,并略作修改。准确称取样品5.000 g,加入15 mL氯仿-甲醇(2∶1,V/V)溶液,用均质机高速匀浆(15 000 r/min、3×10 s、0 ℃)。将匀浆溶液移入50 mL具塞容量瓶中并定容至50 mL,静置1 h后加入10 mL生理盐水,将溶液离心30 min(4 000 r/min),吸取下层溶液至离心管中,氮气吹扫有机试剂,收集浓缩脂质备用。
1.3.4.2 脂肪酸的甲酯化[15-16]
将2 mL 14%三氟化硼-甲醇溶液加入到浓缩脂质中,混合均匀于60 ℃水浴条件下甲酯化反应30 min,反应结束后取出,流水冷却至室温,向溶液中加入1 mL正己烷和1 mL蒸馏水,振荡1 min,静置分层,吸取上层有机层,用氮气吹扫,将溶剂挥干,后用正己烷溶解并定容,过0.22 μm有机滤膜后,用GC-MS进行分析测定。
1.3.4.3 脂肪酸的GC-MS分析
[15-16]。GC条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 mm),进样口温度230 ℃,升温程序:110 ℃保持4 min,以10 ℃/min升温到160 ℃并保持1 min、最后以5 ℃/min升到240 ℃并保持15 min,载气为氦气,流量为1.52 mL/min,采用恒线速度,分流比为1∶30,进样量1 μL。
MS条件:离子源温度200 ℃,电子能量70 eV,质量扫描范围m/z 40~550,溶剂切除时间3 min。
1.3.4 脂肪氧化指标测定
1.3.4.1 POV测定
依据GB/T 5009.37—2003《食用植物油卫生标准的分析方法》[17]中的比色法进行试样中POV的测定,结果表示为meq/kg。
1.3.4.2 TBARS测定
依照Ulu[18]的方法进行测定,并略做修改。取绞碎后的试样1 g于试管中,量取7.5% TCA溶液(含0.1% EDTA-2Na)25 mL加入到试管中,振摇40 min,将混合液用中速滤纸过滤2 次,取滤液5 mL于试管中(空白组用5 mL蒸馏水替代),并加入5 mL TBA(0.02 mol/L)溶液,40 min沸水浴后冷却至室温,最后加入5 mL氯仿并摇匀,静置分层后取上清液,利用分光光度计于538 nm波长处测上清液吸光度。丙二醛(malondialdehyde,MDA)含量通过1,1,3,3-四乙氧基丙烷标准曲线标定计算得出,用以表征TBARS,结果表示为μg/g。
1.4 数据处理
脂肪酸分析:利用计算机NIST 0.5谱库数据库检索,通过对MS图库中的标准谱图进行比较,来确认蓝圆鲹腌制加工过程中的脂肪酸甲酯成分,按面积归一化法分析脂肪酸相对含量[19]。
本实验设计的所有指标均设计3 个平行,并用Excel软件计算各指标平均值及标准差。利用Origin 7.0软件作图,JMP 7.0软件分析方法中的Tukey HSD检验进行数据的显著性分析。利用SPSS软件进行脂肪降解指标及氧化指标的主成分分析。
2 结果与分析
2.1 蓝圆鲹腌干过程中内源性脂肪水解酶活性变化分析
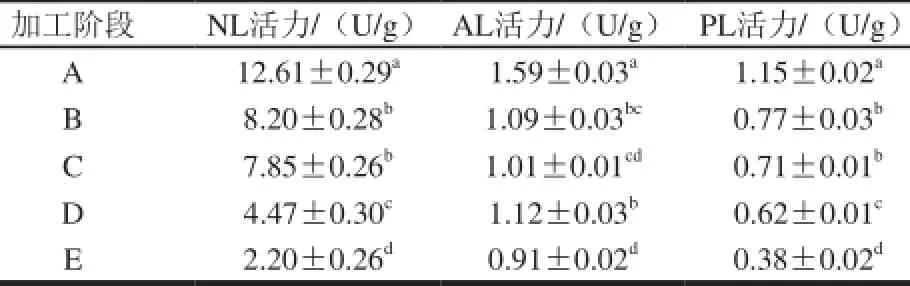
表1 蓝圆鲹腌干工过程中内源性脂肪水解酶活力变化Table 1 Changes in lipase and phospholipase activities of Decapterus maruadsi during dry-salted processing
由表1可见,AL、PL和NL 3 种内源性脂肪水解酶活力在蓝圆鲹传统腌干过程中变化趋势不相同,但整体活性相比于鲜鱼均降低。蓝圆鲹腌干过程中水分含量逐渐降低,盐分含量逐渐增高,从而导致腌干鱼成品中内源性脂肪水解酶活性整体降低,这与Jin Guofeng等[5]在非烟熏腊肉的加工过程中发现脂肪酶活力同水分含量、盐分含量有显著负相关性的结论相同。
蓝圆鲹腌制烘干后成品中3 种脂肪水解酶活性同鲜鱼中的活力相比,活力下降比率不同,研究者们[5,12,20,22-23]在其他肉制品加工过程中均发现了类似规律,由于原材料、酶种类、加工环境等因素的影响,研究发现各种内源脂肪水解酶加工末期酶活力保留率在10%~50%之间不等[5]。本研究中成品NL活力为鲜鱼活力的17%,活力下降83%,活力降低比率最大;成品AL活力为鲜鱼的57%,活力降低最小;成品PL活力为鲜鱼的33%,活力下降67%。由此可见在蓝圆鲹的腌干加工过程中AL活力较为稳定,NL活力受加工因素的影响最大。
由表1可见,整个腌干过程中,NL活力除脱盐阶段较稳定外,其他阶段一直表现出显著降低的趋势(P<0.05),其中腌制阶段活力较鲜鱼时活力下降36%,烘干阶段其活力比腌制阶段下降了45%,烘干后成品中其活性较腌制阶段下降了73%,说明该酶活力在烘干阶段下降趋势最明显。蓝圆鲹腌制阶段NL活力下降明显高于PL和AL,这与Zhou Guanghong[20]和Wang Ying[6]等在金华火腿和盐腌风干鸭的加工过程中发现的规律相同。
AL在整个加工过程中活力变化较小,只在腌制期间活力下降明显(P<0.05),其活力较鲜鱼时下降了31%,而脱盐过程其活力变化不显著(P>0.05);在烘干阶段,酸性脂肪酶活力略有提升,烘干中期其活力达到最高,活力变化显著(P<0.05);至成品阶段,活力再次降低,同烘干中期相比变化差异显著(P<0.05)。这一变化规律同Huang Yechuan等[21]在烟熏腊肉的制备过程中发现的酸性脂肪酶变化规律相同,烟熏腊肉在烟熏10 d后AL活力达到最高点;Jin Guofeng[5]和Vestergaard[11]等分别在腊肉、Parma火腿加工中发现,整个加工过程中AL活力高于NL和PL,并在整个加工过程中起主要作用。但Zhou Guanghong[20]、Jin Guofeng[5]等则在金华火腿和腌制腊肉的加工过程中发现整个加工阶段,AL活力一直处于下降状态,这与本实验结论不相同,猜想可能是加工过程中某些不同加工因素导致的。AL在成品中仍保留较好的活力,所以其在后续产品贮藏过程将继续发挥其功能作用。
蓝圆鲹腌干过程中PL活力随着加工阶段的进行持续降低,在腌制阶段较鲜鱼时下降33%,但烘干阶段其活力比腌制阶段下降了19%,说明磷脂酶从腌制到烘干中期的活力变化不显著,烘干后成品活力较腌制阶段下降了50%。这与Huang Yechuan等[21]在烟熏腊肉中发现PL活力同鲜肉相比下降不明显、Wang Ying等[6]发现盐腌风干鸭在盐腌阶段PL活力呈现出显著增高趋势的结论不一样,这可能是由于原材料和各产品加工过程中环境因素的显著不同造成的。
2.2 蓝圆鲹腌干过程中LOX活力变化分析
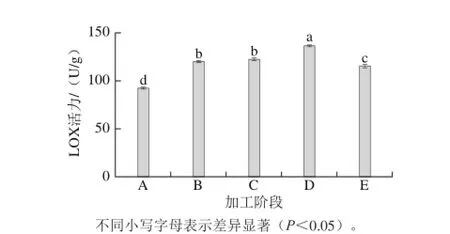
腌干过程中LOX活力变化Fig. 1 Change in LOX activity of Decapterus maruadsi during dry-salted processing图1 蓝圆鲹
由图1可知,LOX活力在整个加工过程是呈先上升后下降趋势,其中蓝圆鲹的腌制、烘干两个阶段均显著增强(P<0.05);LOX活力在烘干中期达到最大值,烘干后产品中该酶活力略有下降,这可能是随着氧化的进行产品中氢过氧化物含量增加,从而引起LOX的钝化[26]。上述LOX活力变化规律同Jin Guofeng等[5]在干腌培根的腌制过程中发现的LOX活力变化规律非常相似。蓝圆鲹腌干过程盐分含量的增加能够激活部分LOX活力,这与Devatkal[24]、Andrés[25]等研究肉制品中LOX活力的变化规律相同。尽管成品期的LOX活力呈现出降低趋势,但相比于鲜鱼中LOX活力还是增加了24%,由此可见传统咸鱼加工过程非常适合LOX发挥作用。
2.3 蓝圆鲹腌干过程中脂肪氧化指标的变化分析
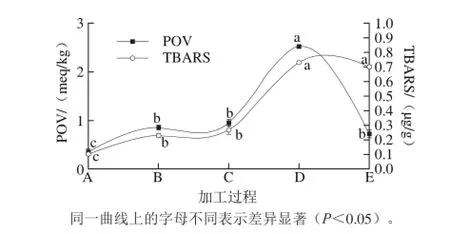
腌干加工过程中POV和TBARS变化Fig. 2 Changes in POV and TBARS of Decapterus maruadsi during dry-salted processing图2 蓝圆鲹
由图2可知,POV和TBARS变化趋势同LOX活力变化趋势非常相似,均是在加工过程逐步上升后下降,在腌制阶段增加较缓慢,但在烘干初期快速增加,至烘干中期达到最高,而后开始降低,其中POV在烘干后期急速下降,这是由于POV反映的是脂肪氧化初级产物氢过氧化物含量,成品期氢过氧化物被急速分解为酮、醛等其他化合物,使得POV出现显著下降趋势;TBARS最高峰出现在烘干中期以后,明显滞后于POV,这是由于TBARS反映的是脂肪氧化的二级产物MDA含量,同时由于MDA在成品期可以与氨基酸等物质结合发生相关反应[27],从而使得TBARS在成品期出现降低趋势,通过方差分析显示降低趋势不明显(P>0.05);腌干蓝圆鲹成品中的POV为0.72 meq/kg明显低于国家标准(0.5 meq/100 g油脂),由此可见腌干蓝圆鲹产品的氧化程度在安全范围内;成品中TBARS为0.7 μg/g,王永丽等[28]在风干鸭中的研究发现当肌肉中MDA含量在0.5~1.0 mg/kg之间时,鸭肉制品不会产生腐败气味,因此腌制蓝圆鲹成品中的MDA含量小于1.0 mg/kg,在接受范围内。
2.4 蓝圆鲹腌干过程中游离脂肪酸含量变化分析
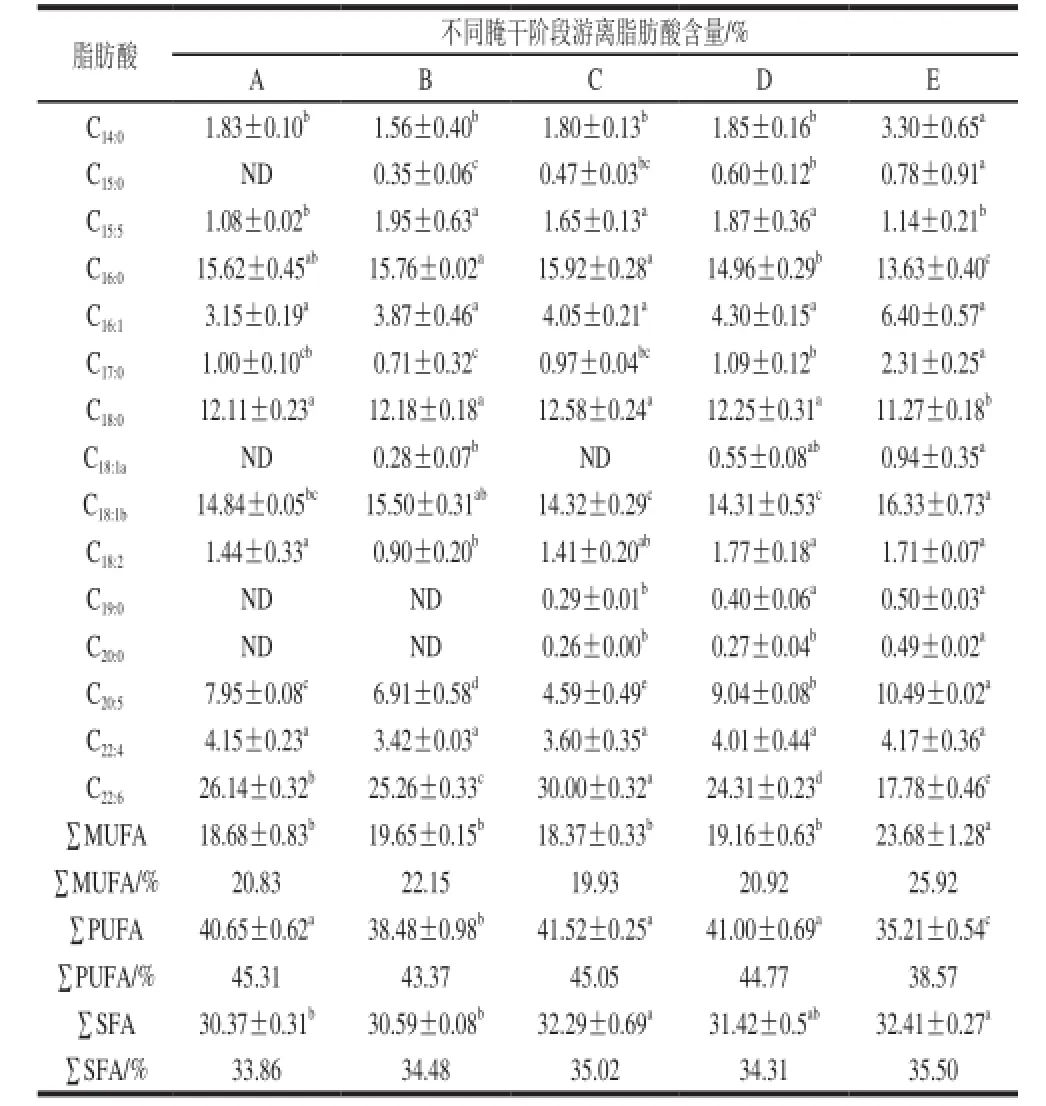
表2 蓝圆鲹腌干过程中几种主要游离脂肪酸相对含量及变化Table 2 Changes in major fatty acid composition of Decapterus maruadsi during dry-salted processing
由表2可知,PUFA含量百分比在整个加工阶段中均大于MUFA、SFA含量,腌制阶段PUFA含量出现明显下降(P<0.05),脱盐阶段含量增大,烘干阶段随着脂肪氧化的快速进行,PUFA含量呈现明显降低趋势(P<0.05),成品中含量降到最低值;蓝圆鲹腌制加工过程中MUFA含量在腌制阶段增加,脱盐阶段降低,烘干阶段含量呈现出缓慢增加趋势,成品中MUFA含量达到最大值,蓝圆鲹腌制加工过程中MUFA含量总体呈现出不断上升的趋势;SFA相对含量变化趋势同MUFA含量变化趋势相似,总体随着加工进程的进行呈现出逐步增大趋势,与MUFA不同的是,在烘干中期SFA含量呈现降低趋势。
C16:0(棕榈酸,palmitic acid,PalA)、C18:0(棕榈酸异丙酯,isopropyl palmitate,PalIE)是蓝圆鲹腌制加工过程中主要的饱和脂肪酸,两者含量均在烘干阶段明显下降(P<0.05),这是因为脂肪氧化将它们分解为其他风味物质导致的;C18:1a(反式脂肪酸)在腌制阶段开始出现,烘干阶段含量不断增加,推测是脂肪氧化在腌制阶段、烘干阶段作用较强的原因,造成反式脂肪酸含量不断增加。C18:1(油酸,oleic acid,OleA)的含量变化趋势与LOX变化趋势相同,腌制阶段、烘干中期、成品期含量均出现显著增高趋势(P<0.05),从而推测它与脂肪氧化相关性较大。
C20:5(二十碳五烯酸,eicosapentaenoic acid,EPA)、C22:6(二十碳六烯酸,docosahexaenoic acid,DHA)两者的含量变化呈现出互补状态,初步推测脱盐阶段之前脂肪降解主要产生DHA,生成量大于消耗量,烘干阶段之后脂肪降解EPA生成量大于脂肪氧化消耗量或者脂肪氧化主要消耗的不饱和脂肪酸为DHA,从而使得EPA含量在烘干阶段显著增高(P<0.05),而DHA含量则显著降低(P<0.05)。蓝圆鲹腌干成品中EPA的含量相比于冰鲜蓝圆鲹明显增高,这大大提升了腌干鱼制品的营养价值。EPA具有帮助降低胆固醇和甘油三酯含量,促进体内饱和脂肪酸代谢的作用,是人体不可缺少的一种营养元素。DHA虽然在烘干阶段由于氧化形成其他风味物质有所损耗,但成品中DHA仍占游离脂肪酸的19.5%。脂质分解导致SFA、MUFA的含量在腌制脱盐阶段逐渐增加,但在烘干阶段,由于脂肪氧化降解作用使得PUFA含量显著减少,但PUFA的含量百分比仍然大于MUFA、SFA含量百分比。由此可见,腌干蓝圆鲹仍由较高的营养价值。
2.5 蓝圆鲹腌干过程中内源性脂肪酶与脂肪降解和氧化之间的关系
蓝圆鲹腌干过程中内源脂肪酶与脂肪降解以及脂肪氧化之间的关系通过SPSS软件中的主成分分析方法进行初步探索。参与分析的因素变量包括腌干蓝圆鲹加工过程AL、NL、PL、LOX活力,MUFA、PUFA、SFA、PalA、PalIE、OleA、EPA、DHA含量。
主成分分析结果显示,所提取的3 个主成分可以解释总因素变量的96.25%。其中主成分1可解释总变量的59.48%,主成分2可解释总变量的26.38%,主成分3可解释总变量的10.39%。图3是以主成分1为X轴,主成分2为Y轴制作所得。可将主成分1定义为与脂肪降解相关的因素,主成分2定义为与脂肪氧化相关的因素。由图3可知,散点主要分布在5 个区域Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ。
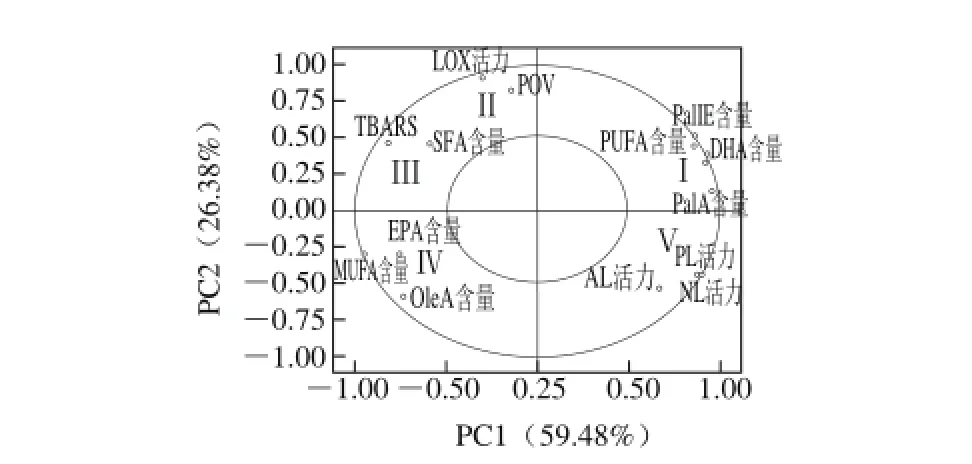
图3 蓝圆鲹腌干过程中脂肪降解因素及脂肪氧化因素的成分图Fig. 3 Loading plots of the factors related to lipolysis and lipid oxidation of Decapterus maruadsi during dry-salted processing
2.5.1 内源酶与脂肪降解之间的关系
Ⅰ、Ⅴ区域内的因素位于X轴右边,说明Ⅰ、Ⅴ区域内的因素对脂肪降解具有正向影响,相关因素的负荷均大于0.5;AL、NL、PL活力的负荷分别为0.667、0.898、0.870,由此可见NL、PL活力对脂肪降解的作用大于酸性脂肪酶,这一结论与Jin Guofeng等[5]在风干腊肉中的研究结论相同;PUFA、DHA、PalA、PalIE含量在X轴的负荷分别为0.852、0.914、0.952、0.854,与脂肪的降解呈现出正相关性,可以将其选作测定脂肪降解程度的指标;LOX活力位于X轴左边,负荷为-0.301,对脂肪降解的影响较小。
2.5.2 内源酶与脂肪氧化之间的关系
由图3可知,Ⅱ区域中的因素位于Y轴上方,且因素负荷均大于0.5,说明Ⅱ区域内的因素与脂肪氧化相关性较大,呈现出正相关作用;LOX活力在主成分2中显示出的负荷为0.909,且LOX活力与POV同属于Ⅱ区域,说明LOX活力在蓝圆鲹腌干过程中与脂肪氧化的相关性比较密切,对脂质的氧化呈现出正向推进作用。Jin Guofeng[5]和Huang Yechuan[20]等在风干腊肉和烟熏腊肉中则发现LOX对脂肪氧化的影响较小,制品中脂肪氧化主要来源于肉制品的自主氧化。脂质氧化指标POV、TBARS与3 种脂肪水解酶(AL、NL、PL)活力均不在一个区域内,说明3 种脂肪水解酶活力对脂肪氧化的影响作用极小。
2.5.3 游离脂肪酸组成与脂肪氧化之间的关系分析
由图3可知,Ⅰ、Ⅲ区域内的游离脂肪酸因素位于Y轴上方,且SFA含量与脂肪氧化指标TBARS属于同一区域,由此可以推断SFA对脂肪氧化的影响较大;Ⅰ区域内的PalIE、PalA均是SFA的主要组成部分,两者在主成分2上的负荷数分别为0.510、0.133,可见PalIE发挥的作用更大;TBARS在主成分2中的负荷数为0.463,PUFA含量影响在主成分2中的负荷数为0.44,而MUFA含量影响的负荷数则为-3.00,说明PUFA是脂质氧化消耗的主要不饱和脂肪酸,从而推断出PUFA对风味的形成有主要的影响作用,这与其他研究者在其他肉制品中的研究发现相吻合,又因DHA含量与PUFA含量处于同一个区域,由此推断出蓝圆鲹在传统腌制加工过程中风味的形成与DHA的含量相关性较大。
3 结 论
蓝圆鲹腌干过程中内源性脂肪水解酶活性均随着加工进程出现不同速率的降低情况,NL活力下降速率最快,PL活力次之,AL活力降低速率最慢且在烘干中期活性出现缓慢增强。腌干蓝圆鲹成品中NL、AL、PL活力相比于冰鲜蓝圆鲹中3 种脂肪水解酶活力保存率分别为:17%、57%、33%,AL在蓝圆鲹腌干过程中的稳定性较好,NL稳定性较差。蓝圆鲹腌干过程中LOX活力变化显著,不同加工阶段LOX活力均显著增强。
通过主成分分析表明内源性脂肪水解酶在整个加工过程虽然活力逐步降低,但对于脂质的降解有一定的影响作用,且NL、PL对脂肪降解的作用大于AL;LOX对脂肪降解的影响较小。LOX在蓝圆鲹腌干过程中与脂肪氧化的相关性比较密切,对脂质的氧化呈现出正向推进作用,3 种脂肪水解酶对脂肪氧化的影响作用极小。
POV和TBARS均在加工过程逐步上升后下降,在腌制阶段增加较缓慢,但在烘干初期快速增加,至烘干中期达到最高,而后呈现出降低趋势,其中POV在烘干后期急速下降。
蓝圆鲹腌制加工过程中,腌制阶段和烘干阶段PUFA含量出现明显下降(P<0.05);MUFA含量和SFA含量变化趋势相似,在腌制阶段和烘干阶段含量明显增加(P<0.05);EPA和DHA两者的含量变化呈现出互补状态。经主成分分析表明SFA含量对脂肪氧化的影响较大,PUFA含量对风味的形成有主要影响,蓝圆鲹传统腌干加工过程中风味的形成与DHA的含量相关性较大。
通过以上的研究表明,可以从控制加工过程中内源性酶活性入手改进传统腌干鱼加工工艺,通过适当方法控制LOX活性,促进制品特色风味的产生,减少或者消除不适宜的产品风味。本研究为从根本上提升腌干鱼的品质与风味的加工技术提供了理论研究基础。
参考文献:
[1] 张婷, 吴燕燕, 李来好, 等. 腌制鱼类品质研究的现状与发展趋势[J].食品科学, 2011, 32(增刊1): 145-155.
[2] 吴燕燕, 刘法佳, 李来好, 等. 改良离子色谱法测定咸鱼中亚硝酸盐的研究[J]. 南方水产科学,2011, 7(6): 1-6. DOI:10.3969/ j.issn.209-0780.2011.06.001.
[3] 吴燕燕, 刘法佳, 李来好, 等. GC-MS检测咸鱼中N亚硝胺的条件优化[J]. 南方水产科学,2012, 8(4): 16-22. DOI:10.3969/ j.issn.2095-0780.2012.04.003.
[4] GLADYSHEV M I, SUSHCHIK N N, GUBANENKO G A, et al. Effect of way of cooking on content of essential polyunsaturated fatty acids in muscle tissue of humpback salmon (Oncorhynchus gorbuscha)[J]. Food Chemistry, 2006, 96(3): 446-451. DOI:10.1016/ j.foodchem.2005.02.034.
[5] JIN G F, ZHANG J H, YU X, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J]. Food Chemistry, 2010, 123(2): 465-471. DOI:10.1016/j.foodchem.2010.05.031.
[6] WANG Y, JIANG Y T, CAO J X, et al. Study on lipolysis-oxidation and volatile fl avor compounds of dry-cured goose with different curing salt content during production[J]. Food Chemistry, 2016, 190(1): 33-40. DOI:10.1016/j.foodchem.2015.05.048.
[7] 刘昌华, 章建浩, 王艳. 鲈鱼风干成熟过程中脂质分解氧化规律[J].食品科学, 2012, 33(5): 13-18.
[8] 陈胜军, 杨贤庆, 樊丽琴, 等. 蓝圆鲹在不同腌制条件下三甲胺和二甲胺含量变化规律[J]. 食品科学, 2012, 33(13): 58-61.
[9] 蔡秋杏, 吴燕燕, 李来好, 等. 厦门白姑鱼腌制加工过程中脂肪酸变化分析[J]. 食品科学, 2015, 36(12): 76-81. DOI:10.7506/spkx1002-6630-201512014.
[10] HERNANDEZ P, NAVARRO J L, TOLDRÁ F. Lipid composition and lipolytic enzyme activities in porcine skeletal muscles with different oxidative pattern[J]. Meat Science, 1998, 49(1): 1-10. DOI:10.1016/S0309-1740(97)00077-6.
[11] VESTERGAARD C S, SCHIVAZAPPA C, VIRGILI R. Lipolysis in dry-cured ham maturation[J]. Meat Science, 2000, 55(1): 1-5. DOI:10.1016/S0309-1740(99)00095-9.
[12] MOTILVA M J, TOLDRÁ F, FLORES J. Assay of lipase and esterase activities in fresh pork meat and dry-cured ham[J]. European Food Research and Technology, 1992, 195(5): 446-450. DOI:10.1007/ BF01191715.
[13] GATA J, PINTO M, MACIAS P. Lipoxygenase activity in pig muscle: purif i cation and partial characterization[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2573-2577. DOI:10.1021/jf960149n.
[14] FOLCH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purif i cation of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[15] 李来好, 叶鸽, 郝淑贤, 等. 2 种养殖模式罗非鱼肉品质的比较[J]. 南方水产科学, 2013, 9(5): 1-6. DOI:10.3969/j.issn.2095-0780.2013.05.001.
[16] 沈慧星, 武华, 阴晓菲, 等. 腌制鳙鱼片在冷藏过程中品质变化规律的研究[J]. 南方水产科学, 2013, 9(4): 70-75. DOI:10.3969/ j.issn.2095-0780.2013.04.012.
[17] 国家标准化管理委员会. 食用植物油卫生标准的分析方法: GB/T 5009.37—2003[S]. 北京: 中国标准出版社, 2003: 306-308.
[18] ULU H. Evaluation of three 2-thiobarbituric acid methods for the measurement of lipid oxidation in various meats and meat products[J]. Meat Science, 2004, 67(4): 683-687. DOI:10.1016/j. meatsci.2003.12.014.
[19] 丁丽丽. 咸鱼加工过程风味形成机理的研究[D]. 上海: 上海海洋大学, 2012: 62.
[20] ZHOU G H, ZHAO G M. Biochemical changes during processing oftraditional Jinhua ham[J]. Meat Science, 2007, 77(1): 114-120. DOI:10.1016/j.meatsci.2007.03.028.
[21] HUANG Y C, LI H J, HUANG T, et al. Lipolysis and lipid oxidation during processing of Chinese traditional smoke-cured bacon[J]. Food Chemistry, 2014, 149(15): 31-39. DOI:10.1016/ j.foodchem.2013.10.081.
[22] HERNÁNDEZ P, NAVARRO J L, TOLDRÁ F. Lipolytic and oxidative changes in two Spanish pork loin products: dry-cured loin and pickled-cured loin[J]. Meat Science, 1999, 51(2): 123-128. DOI:10.1016/S0309-1740(98)00108-9.
[23] RIPOLLÉS S, CAMPAGNOL P C B, AMENTEROS M, et al. Inf l uence of partial replacement of NaCl with KCl, CaCl2and MgCl2on lipolysis and lipid oxidation in dry-cured ham[J]. Meat Science, 2011, 89(1): 58-64. DOI:10.1016/j.meatsci.2011.03.021.
[24] DEVATKAL K, NAVEENA B. Effect of salt, kinnow and pomegranate fruit by-product powders on color and oxidative stability of raw ground goat meat during refrigerated storage[J]. Meat Science, 2010, 85(2): 306-311. DOI:10.1016/j.meatsci.2010.0.019.
[25] ANDRÉS A, CAVA R, VENTANAS J, et al. Lipid oxidative changes throughout the ripening of dry-cured Iberian hams with different salt contents and processing conditions[J]. Food Chemistry, 2004, 84(3): 375-381. DOI:10.1016/SO308-8146(03)00243-7.
[26] FU X J, XU S Y, WANG Z. Kinetics of lipid oxidation and offodor formation in silver carp mince: the effect of lipoxygenase and hemoglobin[J]. Food Research International, 2009, 42(1): 85-90. DOI:10.1016/j.foodres.2008.09.004.
[27] DIAZ P, LINARES M B, EGEA M, et al. TBARs distillation method: revision to minimize the interference from yellow pigments in meatproducts[J]. Meat Science, 2014, 98(4): 569-573. DOI:10.1016/ j.meatsci.2014.06.012.
[28] 王永丽, 章建浩, 靳国锋, 等. 风干成熟工艺对风鸭脂质分解氧化影响的研究[J]. 食品科学, 2009, 30(14): 81-86.
Evoluation of Endogenous Lipase Activity, Lipolysis and Lipid Oxidation during the Processing of Traditional Dry-Salted Decapterus maruadsi
CAO Songmin1,2, WU Yanyan1,*, LI Laihao1, LIN Wanling1, CHEN Shengjun1, ZHAO Yongqiang1
(1. Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
In order to fi gure out the evolution of lipolysis and lipid oxidation during the processing of traditional dry-salted Decapterus maruadsi, the changes in neutral lipase (NL), acidic lipase (AL), phospholipase (PL), lipoxygenase (LOX), thiobarbituric acid reactive substance value (TBARS), peroxide value (POV), and lipid composition were measured and the correlation of endogenous lipase activity with lipid degradation and oxidation was analyzed at fi ve processing stages, i.e., fresh fish, salting, soaking desalting, drying and final product. The results showed that neutral lipase, acid lipase, phospholipase activities markedly decreased (P < 0.05) during the whole process, and only 17%, 57%, 33% of the initial activity was retained in the final product, respectively. LOX activity increased significantly during the whole process (P < 0.05), and both POV and TBARS increase except for a signif i cant decrease in POV during the late stage of drying. As evaluated by principal component analysis, the activities of endogenous fat hydrolases (NL, AL and PL) had a signif i cant effect on lipid degradation, but a rather limited effect on lipid oxidation. LOX activity was positively related to lipid oxidation but it was little related to lipolysis. During both salting and drying polyunsaturated fatty acids (PUFA) revealed a significant decrease (P < 0.05), but monounsaturated fatty acids (MUFA) and saturated fatty acid (SFA) revealed a signif i cant increase (P < 0.05). The contents of both eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) exhibit a complementary relationship.
Decapterus maruadsi; traditional dry-salted fi sh; endogenous lipase; lipolysis and lipid oxidation
2016-04-19
国家自然科学基金面上项目(31371800;31571869)
曹松敏(1990—),女,硕士研究生,研究方向为水产品加工与质量安全控制。E-mail:song90000@126.com
*通信作者:吴燕燕(1969—),女,研究员,博士,研究方向为水产品加工与质量安全控制。E-mail:wuyygd@163.com
10.7506/spkx1002-6630-201707007
TS254.4
A
曹松敏, 吴燕燕, 李来好, 等. 蓝圆鲹传统腌干过程中内源脂肪酶和脂质降解氧化的变化分析[J]. 食品科学, 2017, 38(7): 36-42.
10.7506/spkx1002-6630-201707007. http://www.spkx.net.cn
CAO Songmin, WU Yanyan, LI Laihao, et al. Evoluation of endogenous lipase activity, lipolysis and lipid oxidation during the processing of traditional dry-salted Decapterus maruadsi[J]. Food Science, 2017, 38(7): 36-42. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707007. http://www.spkx.net.cn
