磁性壳聚糖的制备及在脂肪酶固定的应用
2017-04-25王楠楠张大准董发才
王楠楠,张大准,董发才
(河南大学 生命科学学院,植物逆境生物学重点实验室,河南 开封 475004)
磁性壳聚糖的制备及在脂肪酶固定的应用
王楠楠,张大准,董发才*
(河南大学 生命科学学院,植物逆境生物学重点实验室,河南 开封 475004)
采用共沉淀法制备磁性壳聚糖微球,戊二醛做交联剂把脂肪酶固定在磁性壳聚糖载体上,分别使用扫描电子显微镜、傅立叶红外光谱仪、X射线衍射仪、振动样品磁强计、热重分析仪等对磁性壳聚糖微球进行表征分析,并检测了固定化酶的特性. 结果表明,制备的磁性壳聚糖性能良好,与游离酶相比,固定化酶的最适pH,最适温度均有提高,固定化酶的热稳定性,对变性剂的耐受力,重复使用性都有较大幅度提高.
磁性壳聚糖;脂肪酶;固定化酶
脂肪酶(Lipase,E.C.3.1.1.3)又称三脂酰甘油水解酶,能够将甘油三酯水解为脂肪酸和甘油[1-2]. 随着研究的深入,人们发现脂肪酶还能够催化甘油三酯的醇解、脂肪酸的酯化、酰胺键的水解等反应. 基于脂肪酶的这些催化特性,目前已被广泛地用于食品[3-4]、生物柴油[5-6]和药物的拆分[7]等领域. 游离的脂肪酶在工业应用时存在分离纯化等困难,一般为一次性使用,很难回收利用,增加工业成本[8]. 固定化技术可以解决以上问题,固定化酶不仅保持了游离酶的高效性和专一性,同时增加了酶对温度、酸碱、变性剂的耐受性,易于分离和重复使用,有效的降低了成本,已引起国内外学者的关注[9]. 壳聚糖(CS)具有生物相容性、生物亲和性和无毒等特性,分子链上大量存在的羟基和氨基又使其易于进行化学改性,常被作为磁性高分子材料的“外壳”而应用于污水处理、医药和酶固定化等领域. 磁性壳聚糖微球作为一种新型功能高分子材料,已作为载体被广泛应用于酶的固定化领域. WANG等[10]采用乳化交联法成功制备磁性壳聚糖微球固定化碱性蛋白酶. LIU等[11]应用壳聚糖包覆的Fe3O4磁性纳米粒子固定化木聚糖酶,固定化酶量达162.2 mg/g,显示了较高结合酶的能力. CHEN等[12]使用磁性壳聚糖微球对β-半乳糖苷酶进行固定化研究,分解乳糖生产低聚半乳糖,产率可达到50.5%. 目前,磁性壳聚糖微球作为载体已经应用于淀粉酶,米糠内源酶,酵母乙醇脱氢酶、蛋白酶、脂肪酶[13-17]等的固定化的应用. 通常采用乳化交联法制备磁性壳聚糖微球,但该方法使用了大量有机试剂,成本高、对人体有害、污染环境、操作复杂. 本实验通过共沉淀法制备磁性壳聚糖微球得到性能良好的脂肪酶固定化载体,克服了以上缺点,并对固定化酶特性做了相关研究.
1 实验材料与方法
1.1 实验仪器和试剂
AVATAR360型傅立叶变换红外光谱仪,美国 Nicolet公司;X Pert Pro型X射线衍射仪,荷兰Philips;JSM5600LV型扫描电子显微镜,日本电子株式会社;HWS28型电热恒温水浴锅,上海恒科学仪器有限公司;LNG-T83型干燥箱;JJ-1型电动搅拌器,金坛市科析仪器有限公司.
三羟甲基氨基甲烷(TRIS)购于索莱宝公司;四水氯化亚铁,戊二醛(体积分数50%)均购自阿拉丁公司;Candida rugosa lipase Type VII购自Sigma公司;十二水磷酸氢二钠、磷酸二氢钾、异丙醇购于天津基准化学试剂有限公司;壳聚糖、4-硝基酚、三氯乙酸、乙二胺购自国药集团化学试剂有限公司;4-硝基苯基棕榈酸酯购自萨恩化学技术有限公司;盐酸购自中平能化集团开封市东大化工有限公司;冰乙酸购自天津市德恩化学试剂有限公司;六水三氯化铁购自天津市科密欧化学试剂有限公司.
1.2 方法
1.2.1 磁性壳聚糖微球的制备
称取0.3 g壳聚糖加入250 mL三口烧瓶中,取15 mL的2%的冰醋酸溶液加入三口烧瓶中,搅拌使壳聚糖完全溶于冰醋酸溶液,分别称取1.22 g六水三氯化铁和0.5 g四水氯化亚铁溶于30 mL 0.05 mol/L的稀盐酸中,充分搅拌至氯化铁和氯化亚铁完全溶解后倒入三口烧瓶中,500 r/min搅拌使铁盐与壳聚糖冰醋酸溶液充分混合,加入3 mL体积分数50%的戊二醛200 r/min交联1 h,加入1.3 mol/L氢氧化钠至完全沉淀,将沉淀转移至烧杯中用灭过菌的双蒸水洗涤3次,然后磁分离和真空干燥,即可得到磁性壳聚糖微球(Fe3O4/CS).
1.2.2 磁性壳聚糖微球的活化和醛基含量测定
磁性壳聚糖微球的活化:称取0.5 g磁性壳聚糖微球,分别加入10 mL浓度为0.55%的戊二醛溶液,对制备的磁性壳聚糖微球进行活化.
醛基含量测定[18]:分别称取0.1 g恒重干燥的磁性壳聚糖微球和活化后的磁性壳聚糖微球,加入到25 mL 0.25 mol/L的盐酸羟胺-甲基橙溶液中,用玻璃棒搅拌使其充分接触,室温下反应2 h后,用0.1 mol/L的NaOH溶液滴定,当溶液颜色由红色变成黄色后停止滴定,记录此时消耗的NaOH溶液体积. 将不加样品,其他条件不变作为空白对照,记录空白对照消耗的NaOH溶液体积. 使用空白对照校正样品的滴定结果. 醛基的含量计算公式如下:
N: NaOH的浓度, mol/L;V0: 样品消耗的NaOH溶液体积, mL;V1: 空白对照消耗的NaOH溶液体积, mL;W: 样品的质量, g.
1.2.3 脂肪酶的固定
称取0.5 g磁性壳聚糖微球置于100 mL的三口烧瓶中,加入10 mL 0.35%的戊二醛溶液与磁性壳聚糖微球于30 ℃,120 r/min交联60 min,磁分离,弃上清保留沉淀,取灭过菌的双蒸水洗涤沉淀物3次后加入10 mL一定浓度的脂肪酶pH 7.5的PBS缓冲液100 r/min反应60 min,磁分离,分别检测上清和固定化酶的活力.
1.2.4 脂肪酶活力测定[19]
酶活力单位定义: 在pH 7.5时,35 ℃条件下,每小时内催化产生1 mmol对硝基酚需要的酶量为1个脂肪酶活力单位 (U).
具体实验步骤参照文献[19],其中终止反应的三氯乙酸和中和反应NaOH加入量均为5.2 mL.
固定化率=(固定化酶活力/加入游离酶的活力) ×100%
2 结果与讨论
2.1 磁性壳聚糖微球的表征分析
2.1.1 热重图
磁性壳聚糖微球热重分析如图1所示. 100 ℃以下的失重可能是由于不同方法制备的磁性壳聚糖微球有少量的水份. 第二个失重阶段在200~650 ℃温度范围内,这部分的失重来源于壳聚糖的分解. 继续升高温度,曲线趋于平稳,表明壳聚糖已经完全分解. 此结果表明,制备的磁性壳聚糖微球中壳聚糖的含量在60%以上.
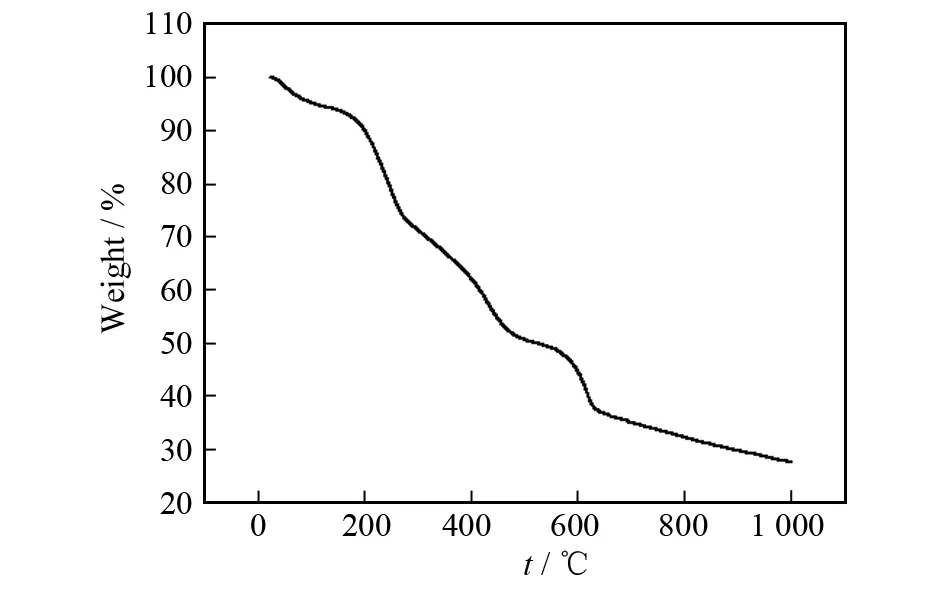
图1 Fe3O4/CS微球的热重分析图Fig.1 TG curve of Fe3O4/CS microspheres
2.1.2 扫描电子显微镜 (SEM) 观察
图2 (A) 是Fe3O4的扫描电镜图,由图可知Fe3O4粒子的微观形貌呈不规则的类球形,有轻微团聚现象. 图2 (B) 和图2 (C) 中磁性壳聚糖微球表面凸凹不平,有孔状片层,与Fe3O4粒子的微观形貌有显著差异,结合热重分析的结果,说明Fe3O4粒子表面包裹了壳聚糖形成了磁性壳聚糖复合微球.

(A) Fe3O4;(B) Fe3O4/CS; (C) 放大的Fe3O4/CS.图2 扫描电镜图Fig.2 SEM photograph
2.1.3 傅立叶红外谱图
图3为CS (a),Fe3O4(b) 与Fe3O4/CS微球 (c) 的FT-IR谱图. 从图3中可以看出,谱线 (b) 于588 cm-1有强吸收峰,此处对应于Fe3O4中Fe-O特征伸缩振动吸收峰. 谱线 (c) 在588 cm-1附近也有吸收峰,并且与谱线 (b) 中Fe3O4的特征吸收峰非常相似,说明Fe3O4/CS微球中有Fe3O4,壳聚糖确实包埋了Fe3O4. 谱线 (a) 在3 431 cm-1附近有红外吸收,这是-OH和-NH2的伸缩振动峰,2 892 cm-1附近为壳聚糖中C-H的伸缩振动吸收峰,1 084 cm-1附近为C-O峰. 谱线 (c) 中既出现了壳聚糖的特征吸收峰,又在1 649 cm-1处出现Shiff碱键C=N的特征吸收峰,说明磁性微球的外层成功包埋了壳聚糖,并且交联剂戊二醛和壳聚糖发生了交联反应.
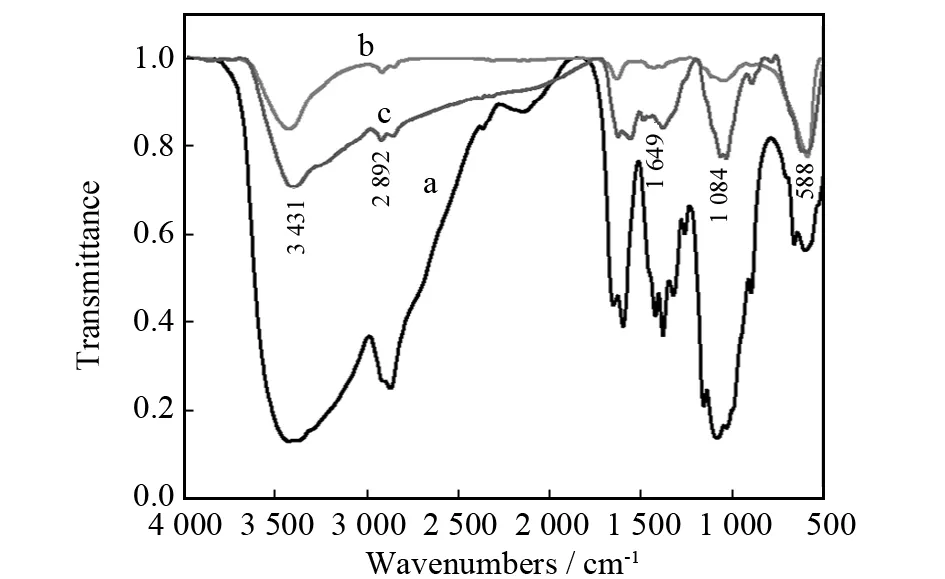
图3 CS (a), Fe3O4 (b) 与Fe3O4/CS微球 (c) 的FTIR谱图Fig.3 FTIR spectra of CS (a) Fe3O4 (b), and Fe3O4/CS microspheres (c)
2.1.4 X射线衍射分析(XRD)
图4所示 (a) 为磁性Fe3O4粒子的XRD谱图,(b) 为Fe3O4/CS微球的XRD谱图. 从图4中可以看出,(a)磁性Fe3O4粒子的XRD图谱没有出现杂质峰,是典型的单相四氧化三铁的尖晶石结构. (b)Fe3O4/CS微球的在2θ角为30.1°、35.5°、43.1°、53.4°、57°、62.6°这6个典型的峰位置出现主要衍射峰,与(a)基本相同,表明磁性Fe3O4粒子被壳聚糖包埋修饰过后,其晶格结构未变化.
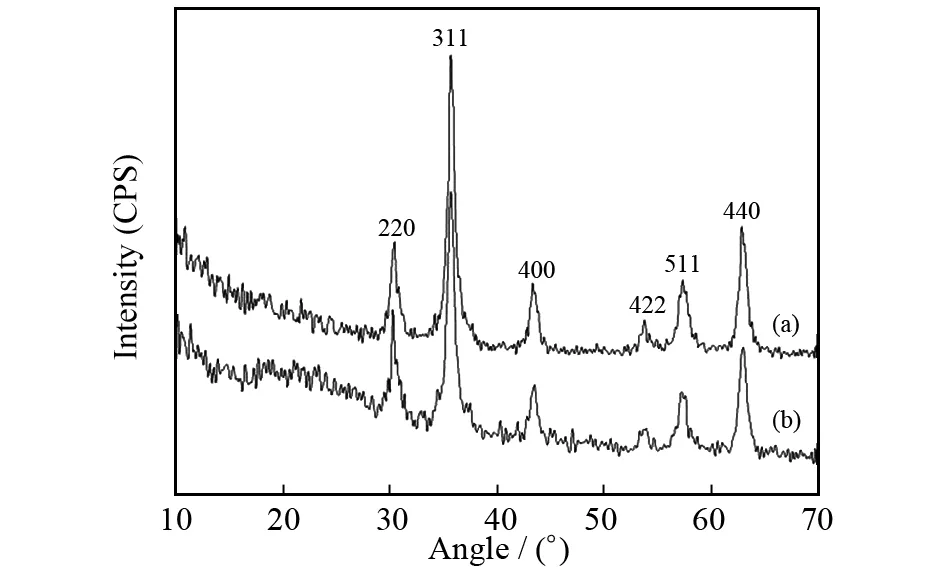
图4 Fe3O4 (a) 与Fe3O4/CS微球 (b) 的XRD谱图Fig.4 XRD patterns of Fe3O4 (a) and Fe3O4/CS microspheres (b)
2.1.5 磁学特性
图5中 (a) 是四氧化三铁的磁滞回线,(b) 是磁性壳聚糖微球的磁滞回线. 从图5中可以看出,磁性壳聚糖微球的比饱和磁化强度与四氧化三铁相比,下降幅度较大,可能是因为大量的壳聚糖包埋在四氧化三铁表面,降低了磁性壳聚糖载体的比饱和磁化强度,间接证明了壳聚糖成功包埋了四氧化三铁.
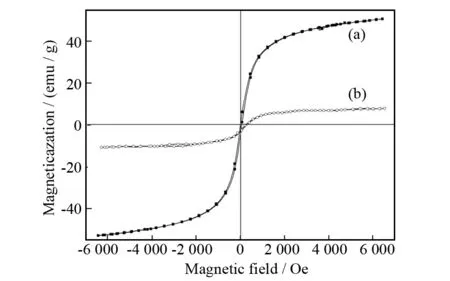
图5 纳米Fe3O4 (a)与Fe3O4/CS载体(b)的磁滞回线图Fig.5 Hysteresis loop of Fe3O4 nanoparticles (a) and Fe3O4/CS carriers (b)
2.1.6 磁性壳聚糖微球醛基含量的测定
磁性壳聚糖微球醛基含量的测定结果如表1所示,每克磁性壳聚糖材料中有0.89 mmol醛基;经戊二醛活化后的磁性壳聚糖材料中,每克有1.46 mmol醛基,原因是戊二醛可以增加壳聚糖表面醛基,进而使磁性壳聚糖中的醛基数目增加.

表1 磁性壳聚糖微球醛基含量的测定
2.2 固定化酶性质测定
2.2.1 磁性壳聚糖微球固定化脂肪酶最适温度测定
在温度较低时,适当增加温度可以提高酶的活性,因为此时酶分子的催化速度随温度的增加而增大. 但是脂肪酶的本质是蛋白质,温度过高会导致酶因构像变化变性而失活. 因此必须在酶催化反应活化速度和蛋白质变性之间寻求一种平衡,探索酶活反应温度的最佳值. 由图6可以看出,游离酶活力在35 ℃ 时最高,固定化酶的最适温度为43 ℃,相比游离酶提高了8 ℃,原因可能是脂肪酶被固定到载体上后,载体束缚酶分子,对外界影响有一定屏蔽保护效果. 当反应温度高于35 ℃,游离酶的活力开始下降,固定酶的活力继续上升,43 ℃后无论是游离酶还是固定酶活力均下降,因为温度过高导致酶分子失活比例增大.
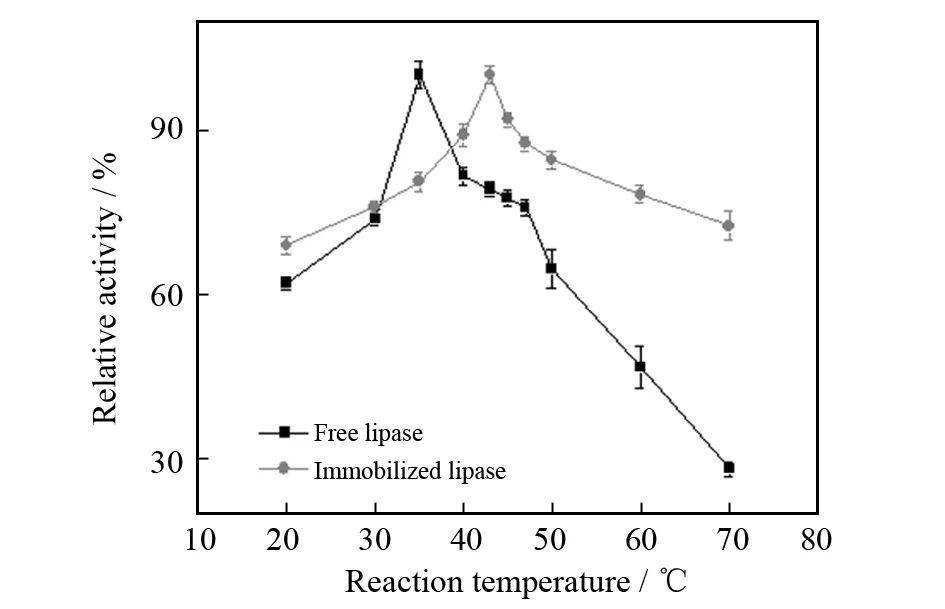
图6 温度对脂肪酶活力的影响Fig.6 Effect of temperature on the activity of free and immobilized lipase
2.2.2 固定化酶最适pH
测定底物溶液pH为4.0,5.0,6.0,7.0,7.5,8.0,9.0,10.0时酶活,并在相同条件下测定对应的游离酶酶活,以同组最高酶活为100%,其余酶活为与其比值,得到结果如图7所示. 游离酶活力在pH为6.0时最高,固定化酶的活力在pH为7.5时最高,相比游离酶提高了1.5. 当底物溶液pH低于6.0,游离酶和固定酶的活力均随着pH的增大而增大,当底物溶液pH在6.0到7.5之间时,游离酶的活力开始下降,固定酶的活力继续上升,在底物溶液pH大于7.5后,无论是游离酶还是固定酶活力均下降,但固定化酶的活力明显高于游离酶,原因可能是磁性壳聚糖表面含有大量羟基,脂肪酶在被固定到载体的过程中,酶分子的构象和酶分子活性中心一些官能团的离子状态发生改变,载体上过量的负电荷影响了酶活性中心和水质子化的相互作用,增加了脂肪酶对碱性溶液的耐受性.
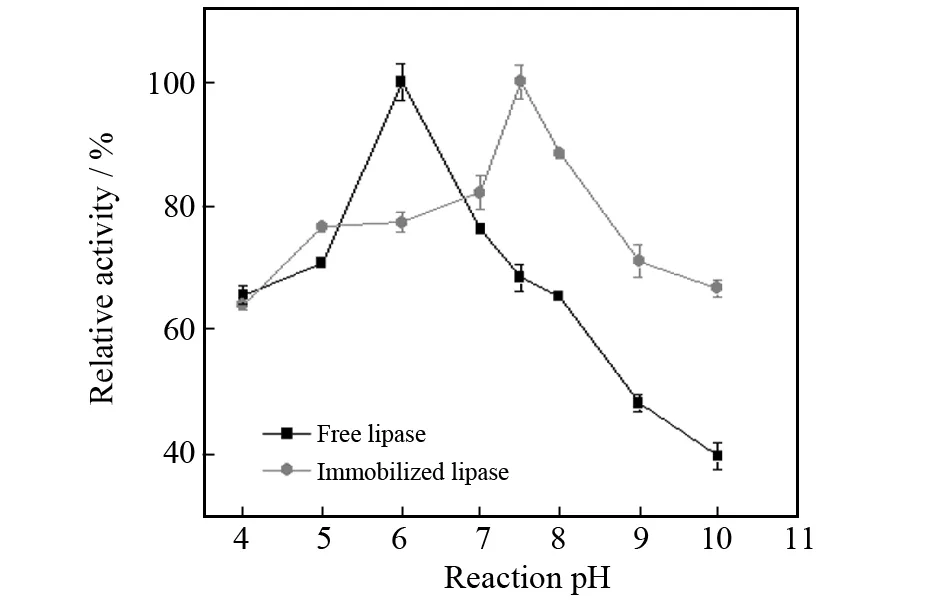
图7 pH对脂肪酶活力的影响Fig.7 Effect of pH on the activity of free and immobilized lipase
2.2.3 固定化酶热稳定性
分别制备磁性壳聚糖载体固定化酶将其和对应的游离酶置于60 ℃恒温水浴锅中保温不同时间,定时取样测量酶活,以同组最高酶活为100%,其余酶活为与其比值,绘制酶的热稳定曲线. 从图8可以看出游离酶和固定酶活力均呈现下降趋势,游离酶的相对活力比固定化酶下降速度更快,趋势更明显. 图8中游离酶在60 ℃保温120 min时游离酶活力剩余14.8%,而固定化酶活力是42%. 在相同温度保温相同时间后,固定化酶活力明显高于游离酶,表现出更强的温度耐受性. 原因可能是脂肪酶被固定到载体的过程中,酶分子之间,酶与载体之间通过共价键、分子间作用力等相互作用,增强固定化酶分子的结构刚性,提高其耐高温的能力,而游离酶缺乏这些相互作用力,容易在高温条件下酶分子结构改变而变性[20].

图8 脂肪酶的热稳定性Fig.8 Thermal stability of the free and the immobilized lipase
2.2.4 固定化酶抗变性
尿素是一种常用的蛋白质变性剂,蛋白质分子中的肽链以一定的方式盘绕曲折,形成特定的构象. 而这种构象的维持,主要依赖于蛋白质分子中的氢键. 高浓度尿素能破坏氢键,导致蛋白质分子结构松弛,从而使蛋白质发生不同程度的变性. 图9的实验说明:游离酶和固定酶活力均随着尿素浓度的增加而降低,游离酶的相对活力比固定化酶下降速度更快,在相同尿素浓度时,固定化酶的活力始终明显高于游离酶. 图中游离酶在尿素浓度为5 mol/L时,酶活力剩余24.8%,而固定化酶活力性是62%;固定化酶活力高于游离酶,表现出更强的对尿素这种变性剂的耐受性,原因可能是脂肪酶被固定到载体后,酶分子与载体相互作用,形成了保护酶分子的微环境,减弱了尿素溶液对酶蛋白的氢键和疏水残基的破坏,进而减轻了酶分子的构象变化.
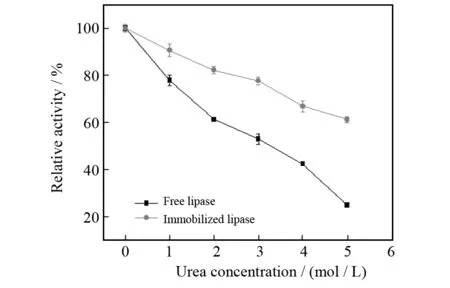
图9 尿素浓度对脂肪酶活力的影响Fig.9 Effect of urea concentration on the activity of free and immobilized lipase
2.2.5 固定化酶重复使用性
分别称取1 g磁性壳聚糖载体固定化酶在相同情况下连续反应10次,测定其活力,得到图10所示结果. 随着使用次数增加,固定化酶的活力缓慢下降,在连续使用10次后,磁性壳聚糖载体固定化酶的活力剩余66%,说明固定化酶有良好的重复使用性.
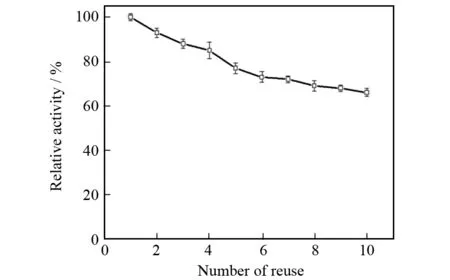
图10 固定化脂肪酶的重复使用性Fig.10 Reuse of the immobilized lipase
2.2.6 固定化酶动力学分析
图11显示了固定化酶和对应的游离酶的Lineweaver-Burk曲线. 通过计算可以得知(a)中磁性壳聚糖载体固定化酶的Km为2.41 μmol/L,对应游离酶的Km为0.31 μmol/L固定化酶对底物的亲和力降低. 出现这种结果的原因可能是载体材料对底物的扩散有一定得限制作用,同时脂肪酶被固定化后,载体材料与酶分子的活性位点间有空间位阻,降低了酶与底物的结合能力.
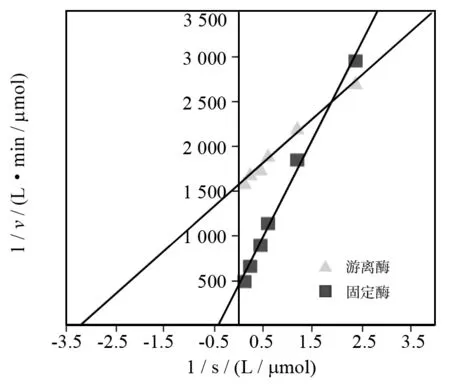
图11 固定化脂肪酶的动力学分析Fig.11 The kinetics analysis of immobilized enzyme
3 结论
摸索出一种新的制备磁性壳聚糖微球的方法,该方法工艺相对简单;采用的原料壳聚糖来源广、价格低廉、没有毒副作用,降低了工业成本,对环境无污染. 这些优点使该制备方法可用于磁性壳聚糖微球工业化大规模生产. 制备的磁性壳聚糖微球中壳聚糖包裹在磁性粒子表面,有良好的磁响应性. 经固定化后,脂肪酶的热稳定性、抗变性剂尿素的能力和重复使用性均得到显著提高,对底物的亲合力出现一定程度的降低. 使用磁性壳聚糖材料固定化脂肪酶,克服了游离酶分离回收难的缺点,提高了酶的使用效率,为固定化酶进一步工业应用打下良好的基础.
[1] WEI T, FENG S X, MAO D B, et al. Characterization of a new thermophilic and acid tolerant esterase from Thermotoga maritima capable of hydrolytic resolution of racemic ketoprofen ethyl ester [J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 85: 23-30.
[2] PAPILLON J P N, PAN M, BROUSSEAU M E, et al. Synthetic phospholipids as specific substrates for plasma endothelial lipase [J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26(15): 3514-3517.
[3] ESTEBAN-TORRES M, MANCHENO J M, DE LAS RIVAS B, et al. Characterization of a halotolerant lipase from the lactic acid bacteria Lactobacillus plantarum useful in food fermentations [J]. LWT- Food Science and Technology, 2015, 60(1): 246-252.
[4] PARWANI L, BOHRA Y, GUPTA S, et al. Effect of temperature onα-glucosidase, lipase inhibition activity and other nutritional properties of moringa oleifera leaves: Intended to be used as daily antidiabetic therapeutic food [J]. Journal of Food and Nutrition Research, 2016, 55(1): 69-77.
[5] LOPEZ E N, MEDINA A R, MORENO P A G, et al. Extraction of microalgal lipids and the influence of polar lipids on biodiesel production by lipase-catalyzed transesterification [J]. Bioresource Technology, 2016, 216: 904-913.
[6] KUO T C, SHAW J F, LEE G C. Conversion of crude Jatropha curcas seed oil into biodiesel using liquid recombinant Candida rugosa lipase isozymes [J]. Bioresource Technology, 2015, 192: 54-59.
[7] VERRIA F, DIAZ U, MACARIOA A, et al. Optimized hybrid nanospheres immobilizing Rhizomucor miehei lipase for chiral biotransformation [J]. Process Biochemistry, 2016, 51(2): 240-248.
[8] GILANI S L, NAJAFPOUR G D, MOGHADAMNIA A, et al. Stability of immobilized porcine pancreas lipase on mesoporous chitosan beads: A comparative study [J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: 144-153.
[9] 王新, 刘丽, 陆佳靓, 等. 固定化漆酶载体研究进展[J]. 生态学杂志, 2013, 32(10): 2823-2829.
WANG X, LIU L, LU J L. Carriers for immobilized laccase: Research progress [J]. Chinese Journal of Ecology, 2013, 32 (10): 2823-2829.
[10] WANG S N, ZHANG C R, QI B K, et al. Immobilized alcalase alkaline protease on the magnetic chitosan nanoparticles used for soy protein isolate hydrolysis [J]. European Food Research and Technology, 2014, 239(6): 1051-1059.
[11] LIU M Q, DAI X J, GUAN R F, et al. Immobilization of aspergillus niger xylanase A on Fe3O4-coated chitosan magnetic nanoparticles for xylooligosaccharide preparation [J]. Catalysis Communications, 2014, 55: 6-10.
[12] CHEN S C, DUAN K J. Production of galactooligosaccharides usingβ-galactosidase immobilized on chitosan-coated magnetic nanoparticles with tris(hydroxymethyl)phosphine as an optional coupling agent [J]. International Journal of Molecular Sciences, 2015, 16(6): 12499-12512.
[13] LONG J, LI X F, WU Z Z, et al. Immobilization of pullulanase onto activated magnetic chitosan/Fe3O4nanoparticles prepared by in situ mineralization and effect of surface functional groups on the stability [J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2015, 472: 69-77.
[14] 张媛媛, 张晖, 王立, 等. 磁性壳聚糖微球固定化米糠内源酶的研究[J]. 食品与机械, 2013, 29(3): 51-54.
ZHANG Y Y, ZHANG H, WANG L, et al. Study on immobilization of bran rice endogenous enzyme on magnetic chitosan microspheres [J]. Food & Machinery, 2013, 29(3): 51-54.
[15] LI G, LI Y, HUANG K, et al. Surface functionalization of chitosan-coated magnetic nanoparticles for covalent immobilization of yeast alcohol dehydrogenase from saccharomyces cerevisiae [J]. Journal of Magnetism and Magnetic Materials, 2010, 322 (24): 3862-3868.
[16] 梁玉杰, 芦鑫, 黄纪念, 等. 纳米磁性壳聚糖微球固定化Alcalase 碱性蛋白酶的制备及酶学性质研究[J]. 食品与发酵工业, 2014, 40(8): 66-71.
LIANG Y J, LU X, HUANG J N, et al. Study on preparation and enzymatic properties of immobilized alcalase alkaline protease magnetic chitosan microspheres [J]. Food and Fermentation Industries, 2014, 40(8): 66-71.
[17] LIU Y, JIA S Y, WU Q, et al. Studies of Fe3O4-chitosan nanoparticles prepared by co-precipitation under the magnetic field for lipase immobilization [J]. Catalysis Communications, 2011, 12 (8): 717-720.
[18] ZHAO H, HEINDEL N D. Determination of degree of substitution of formyl groups in polyaldehyde dextran by the hydroxylamine hydrochloride method [J]. Pharmaceutical Research, 1991(8): 400-402.
[19] 江慧芳, 王雅琴, 刘春国. 三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程, 2007, 24(8): 72-75.
JIANG H F, WANG Y Q, LIU C G, et al. Comparison and improvement of three determination methods for lipase activity [J]. Chemistry and Bioengineering, 2007, 24(8): 72-75.
[20] 邱广亮, 李咏兰. 磁性琼脂糖复合微球固定化纤维素酶的研究[J]. 精细化工, 2000, 17(2): 115-117.
QIU G L, LI Y L. Immobilization of cellulase on magnetic agarose composite microsphere [J]. Fine Chemicals, 2000, 17(2): 115-117.
[责任编辑:刘红玲]
Research on preparation of magnetic chitosan and immobilization of lipase
WANG Nannan, ZHANG Dazhun, DONG Facai*
(LaboratoryofPlantStressBiology,SchoolofLifeSciences,HenanUniversity,Kaifeng475004,Henan,China)
The magnetic chitosan microspheres were prepared using the cross-linking co-precipitation technique. The lipase was immobilized on magnetic chitosan microspheres using glutaraldehyde as a crosslinking agent. The characteristics of the magnetic chitosan microspheres were evaluated by scanning electron microscope (SEM), fourier transform infrared spectrometer (FT-IR), phase X-ray diffraction (XRD), vibration sample magnetometer (VSM) and the thermogravimetric analysis. The results indicated that the microspheres had good properties. The thermal, degeneration agent of urea tolerance, reusablities and storage stabilities of the enzyme were greater increased after the immobilization the free enzyme.
magnetic chitosan; lipase; immobilization
2016-11-11.
国家棉花生物学重点实验室基金资助项目(CB2015C26).
王楠楠(1988-),女,博士生,研究方向为酶工程.*
,E-mail:06wangnan@163.com.
O629.8
A
1008-1011(2017)02-0247-07
