LC-MS/MS法测定牛乳及其制品中β-乳球蛋白的含量
2017-04-25袁明美王守云张巍伟冯雪松
袁明美,封 聪,王守云,张巍伟,陈 默,姜 泓*,冯雪松
(1.中国医科大学 药学院,辽宁 沈阳 110122; 2.中国医科大学 公共卫生学院,辽宁 沈阳 110122)
LC-MS/MS法测定牛乳及其制品中β-乳球蛋白的含量
袁明美1,封 聪2,王守云1,张巍伟2,陈 默2,姜 泓2*,冯雪松1
(1.中国医科大学 药学院,辽宁 沈阳 110122; 2.中国医科大学 公共卫生学院,辽宁 沈阳 110122)
建立LC-MS/MS测定牛乳及其制品中β-乳球蛋白含量的方法. 从β-乳球蛋白酶解产物中筛选出标签肽,通过多反应检测模式,对牛乳及其制品中的β-乳球蛋白进行定量. 结果表明,所建立方法具有灵敏度、准确度高,重现性好,前处理简单的优点,可用于牛乳制品中β-乳球蛋白的定量检测.
液相色谱质谱联用;β-乳球蛋白;标签肽;牛乳制品;含量测定
乳及乳制品是人体重要的蛋白质来源,乳蛋白是牛乳中最有营养价值的部分. 正常的牛乳中含有约2.2%~4.4%的蛋白质,主要包括乳清蛋白、酪蛋白及少量的脂肪球膜蛋白等[1]. 乳清蛋白具有较高的蛋白质含量、营养价值及生物学效价,是公认的人体优质蛋白质补充剂之一,被广泛应用于乳制品和配方食品中[2].β-乳球蛋白是由乳腺上皮细胞合成的乳特有蛋白质,在奶牛常乳中的含量约为4.0 g/L,占乳清蛋白总量的43.6%~50%[3-5].β-乳球蛋白具备最佳的氨基酸比例,支链氨基酸含量极高,有降低胆固醇、抗氧化、易被吸收、促进脂溶性营养素如维生素A和维生素E的吸收等特点[6-7],被认为是多功能蛋白.
目前,β-乳球蛋白常用的检测方法有高效液相色谱法(HPLC)[8]、凝胶电泳法(SDS-PAGE)[9]、毛细管电泳法(CE)[10]、酶联免疫吸附法(ELISA)[11]等. 这些检测方法由于操作繁琐、检测周期长、分离度差等缺点,无法对乳及乳制品中β-乳球蛋白的含量进行更准确的评价. 因此,有必要建立乳与乳制品中β-乳球蛋白定量检测的方法. 本文应用超高效液相色谱-三重四级杆质谱联用仪(LC-MS/MS),基于蛋白组学中自下而上的鸟枪法-特征肽段(标签肽)定量靶蛋白,采用多反应检测(MRM)模式,检测牛乳及其制品中β-乳球蛋白的含量,为准确评价牛乳制品中有效营养价值提供参考依据和准确的检测方法.
1 实验部分
1.1 仪器与试剂
1290液相色谱-6420三重串联四级杆质谱联用系统(美国,Agilent);CP124C全自动电子天平(十万分之一)(日本A&D公司);3K-18型超速低温冷冻离心机(Sigma公司).
MTV-100多管漩涡混合仪(杭州奥盛仪器有限公司);TMS-200超级恒温混匀仪(杭州奥盛仪器有限公司);MVS-1漩涡混合器(北京金北德工贸有限公司);Easypure纯水系统(美国,Barnstead公司);碳酸氢铵(NH4HCO3)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、甲醇(HPLC级)、乙腈(HPLC级)、甲酸、胰蛋白酶和β-乳球蛋白(Bovine,纯度 ≥ 90%)标准品均购于美国Sigma公司;骆驼奶粉来自迪拜Al Ain Dairy. 标签肽VLVLDTDYK和内标肽ETTVFENLPEK*(K*, Lys-OH-13C6,15N2) 由上海杰肽生物科技有限公司合成. 纯奶、酸奶、全脂奶粉、脱脂奶粉等均购自当地大型超市.
1.2 色谱条件和质谱条件
ZORBAX SB-C18色谱柱(Agilent 2.1 mm×50 mm,1.8 μm),柱温40 ℃,流动相A:含0.1%甲酸的水溶液,流动相B:含0.1%甲酸的乙睛溶液,流速为0.4 mL/min,进样量5 μL. 梯度洗脱:初始B相为10%,保持0.2 min;在2.8 min内线性升高至50%;然后0.2 min内B相线性升高至95%,并保持此梯度0.2 min;之后在0.2 min内,B相降低回到10%的初始梯度条件,平衡1.1 min后开始下一个进样程序,总洗脱时间5 min.
电喷雾(ESI)离子源,正离子模式,扫描方式为多反应检测(MRM),标签肽VLVLDTDYK的m/z为533.2→853.4,内标肽ETTVFENLPEK*的m/z为657.8→884.4. 优化后的质谱离子源条件参数如下:毛细管电压为4.0 kV;离子源温度100 ℃,脱溶剂气(N2)温度:350 ℃;标签肽和内标肽的毛细管出口电压分别为150 V和100 V,碰撞电压(CE)分别均为20 V;保护气流量10 L/min.
1.3 实验方法
1.3.1 标准曲线溶液和质控样品溶液的配制
精密称取牛β-乳球蛋白标准品和骆驼奶粉空白基质适量,分别用50 mmol/L NH4HCO3溶液溶解,制得浓度为1 mmol/L的β-乳球蛋白储备液和10 g/L的骆驼奶粉空白基质溶液. 检测分析前,精密量取β-乳球蛋白储备液适量,用骆驼奶粉空白基质溶液梯度稀释配成浓度为2、5、10、20、50 和 100 μmol/L的系列标准对照溶液以及 3.5、15 和 75 μmol/L的质控标准品溶液. 精密称取内标肽ETTVFENLPEK*适量,用水溶液配制成2 mmol/L的储备溶液冻存于-80 ℃. 临用前精密量取储备液适量,用水稀释成浓度为0.1 mmol/L溶液,作为内标溶液,4 ℃保存备用.
1.3.2 样品溶液的制备
精密称取乳制品0.1 g,用50 mmol/L NH4HCO3溶解稀释至浓度为10 g/L. 取200 μL样品(稀释后的乳制品、系列标准品溶液和质控标准品溶液),加入0.1 mmol/L内标肽段溶液20 μL混匀. 随后加入100 μL 100 mmol/L 二硫酥糖醇(DTT)溶液在恒温混匀仪中60 ℃反应60 min,待反应温度降至室温加入200 μL 100 mmol/L 碘乙酰胺(IAA)溶液30 ℃避光反应30 min. 然后加入200 μL 1 g/L 胰蛋白酶溶液,溶剂为25 mmol/L NH4HCO3溶液37 ℃过夜反应. 最后加入200 μL 10%甲酸水溶液室温静止30 min终止反应. 4 ℃下5 000 g离心10 min,过0.22 μm滤膜,转移至新的离心管中待测备用.
1.3.3 方法学验证和应用
为了保证所建立方法的准确性,我们进行了特异性、线性、检测限、精密度、回收率、稳定性和重复性等方面的方法学考察. 同时,为了验证方法的适用性,采集了液态奶制品纯奶和酸奶以及固态奶制品全脂奶粉和脱脂奶粉,对β-乳球蛋白进行了分析检测.
2 结果与讨论
2.1 特征肽段的选择
牛乳中的β-乳球蛋白的相对分子质量约为19 000,由178个氨基酸残基组成. 通过蛋白质数据库Uniprot (www.uniprot.org)可获得其氨基酸残基序列,将得到的β-乳球蛋白的氨基酸序列(UniProt ID: P02754)导入计算机模拟水解软件Skyline[12]中,选择合适的预测筛选条件,如特征肽段氨基酸残基个数为5~25,不含半胱氨酸、蛋氨酸等不稳定氨基酸,可得到符合条件的模拟水解肽段8个. 然后将经酶解处理后的的样品进入LC-MS分析,通过全扫描和MRM分析,8个模拟水解肽段中,有7条肽段被检测到,分别是GLDIQK [24, 29]、VYVEELKPTPEGDLEILLQK[56, 75]、IPAVFK [93, 98]、IDALNENK [99, 106]、VLVLDTDYK [107, 115]、TPEVDDEALEK [140, 150]、ALPMHIR [157, 163]. 肽段IIAEK [86, 90]可能由于基质的影响或质谱响应等方面的问题,没有被检测到. 通过在线的Uniprot数据库BLAST分析工具对β-乳球蛋白酶解出的肽段与数据库中其他全部已知蛋白进行对比分析,结果表明GLDIQK [24, 29]、IPAVFK. [93, 98]、ALPMHIR [157, 163]这3条肽段蛋白专属性较差,不具有足够的特异性,不再进入下一步分析. 另外,肽段VYVEELKPTPEGDLEILLQK[56, 75]由于含有20个氨基酸,序列较长,标准肽段合成繁琐也不再进行下一步分析. 化学合成剩余三条肽段的标准品,进行质谱MRM参数优化,结果如表1所示. 进一步比较其质谱响应,最终选择色谱分离过程无干扰,质谱响应值最高的肽段VLVLDTDYK [107, 115]作为牛β-乳球蛋白的特征肽段—标签肽(见图1d),另外两条肽段可用做佐证肽段. 用于定量的标签肽VLVLDTDYK的m/z为533.2→853.4.

表1 三个候选标签肽的MRM参数
*定量子离子.
2.2 内标物、空白基质的选择及方法的专属性
在应用LC-MS/MS法对样品的酶解产物进行检测时,由于样品前处理影响和液质离子化效率不一致等因素会对肽段信号响应产生影响,液质分析过程中经常加入内标物质作为参照物,以达到更好的重现性. 本文选择的内标肽段ETTVFENLPEK*(K*, Lys-OH-13C6,15N2)为前期实验中合成的同位素内标物,m/z为657.8→884.4,在样品酶解前后通过MRM提取均检测不到,并且和β-乳球蛋白的标签肽具有相似的色谱行为(见图1b和c),可用于校正样品处理和检测过程中的不稳定因素.
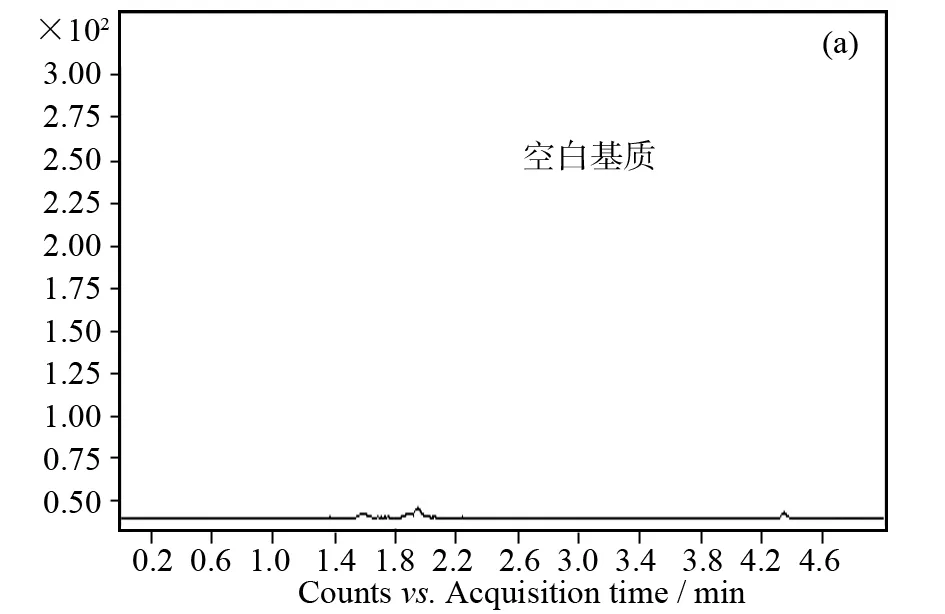
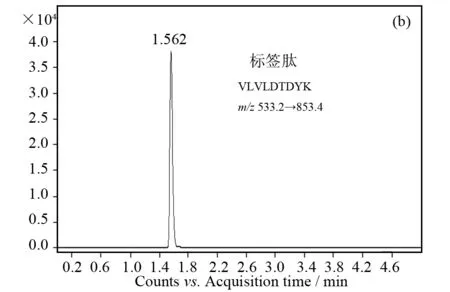

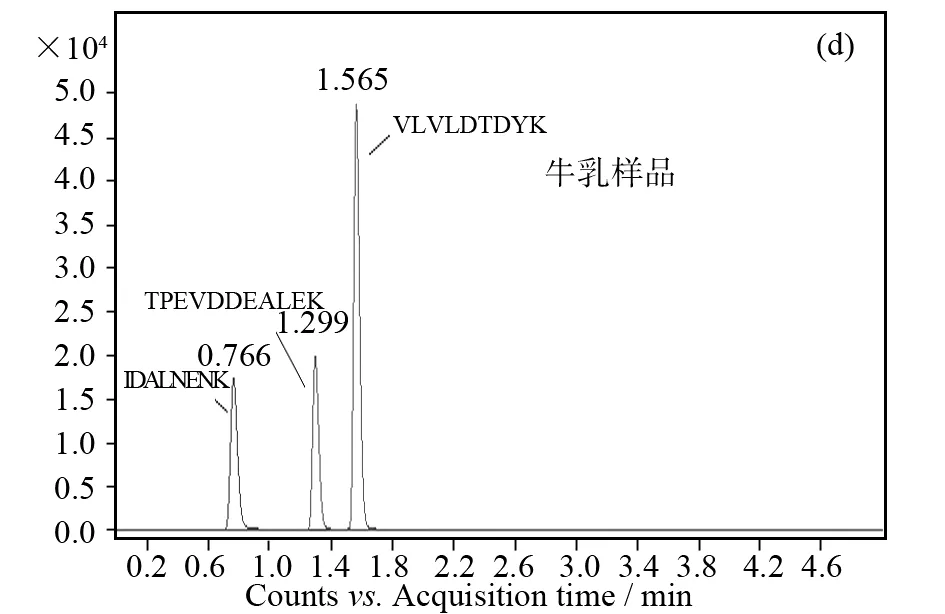
图1 酶解产物色谱图
LC-MS/MS对复杂生物样品进行分析时,基质效应对测量结果的影响不容忽视. 本实验中检测的特异性多肽需从β-乳球蛋白中经胰蛋白酶水解出来,酶解效率也会受到基质的影响. 为了尽可能还原β-乳球蛋白在乳制品中实际的水解情况,我们将一定量β-乳球蛋白加入空白基质中和样品经过同样的处理过程,这样大大增加了定量的准确性. 经过比较筛选,我们最终选择骆驼奶粉作为空白基质,一方面骆驼奶粉也是乳制品在组成和性质上接近牛乳制品,另一方面我们在骆驼奶粉酶解前后的对牛β-乳球蛋白特征肽段和内标肽段进行MRM提取,均未检测到色谱峰(见图1a). 结果表明,该方法具有良好的专属性.
2.3 标准曲线、检测限、精密度和重复性考察
本文中的标准曲线通过将β-乳球蛋白标准品加入骆驼奶粉空白基质中溶解稀释,经和样品相同的处理过程后,检测水解出的特异性多肽VLVLDTDYK,建立校准曲线. 结果表明,标签肽回归方程为y= 7 281.4x+ 21 772 (r=0.996 3),在2~100 μmol/L(0.4~20 g/100 g)范围内线性良好,可以满足实验检测要求.
用检测限与定量限评价方法的灵敏度,信噪比(S/N)为3∶1和10∶1时的溶液浓度分别为检测限(LOD)和定量限(LOQ),计算所得检测限为1 nmol/L(0.2 mg/100 g), 定量限为3 nmol/L(0.6 mg/100 g). 日内和日间精密度相对标准偏差(RSD)分别为1.2%~2.5% 和 5.0%~5.4%. 重复性(n=6)RSD为2.8%~6.2%.
2.4 回收率和样品稳定性考察
本实验采用标准加入法测定回收率,取15份预混合的样品分别加入低、中、高3个浓度水平的β-乳球蛋白标准品,另取5份预混合样品作为对照,每一浓度水平平行5份,加入内标后混匀,按照样品前处理步骤进行处理,进行检测分析. 3个添加水平的平均回收率在91.5%~100.2%之间,且RSD < 4.5%,结果表明该方法具有良好的回收率.
此外,对样品的稳定性进行了考察,结果在室温条件下稳定24 h,-20 ℃冰冻条件下稳定30 d,反复冻融3 d均不影响处理后样品中标签肽的检测及β-乳球蛋白的定量.
2.5 应用
取3个厂家市售奶制品,用建立的方法进行检测,结果如表2所示,不同生产厂家的奶制品中β-乳球蛋白的含量虽有差别,但相差不多. 从品种上来看,纯奶中的β-乳球蛋白的含量相对酸奶高些,脱脂奶粉的β-乳球蛋白含量比全脂奶粉高,具体原因可能与生产工艺有关.
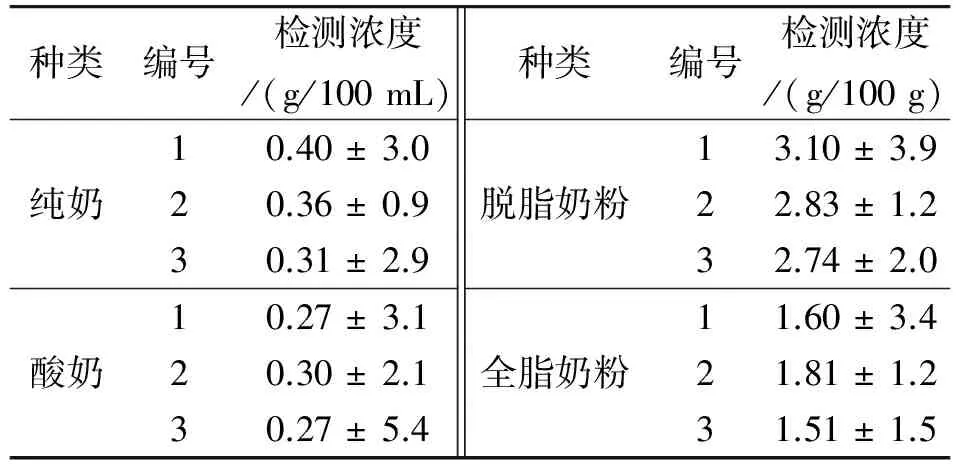
表2 检测不同奶制品中β-乳球蛋白的含量
3 结论
本方法采用靶向蛋白质组学技术,筛选出对牛β-乳球蛋白具有高度专一性的特征肽段和空白基质,并对定量肽段进行了方法学考察,所建方法具有灵敏度高、检测速度快、选择性好、定量结果准确等优点.
[1] 秦宜德, 邹思湘. 乳蛋白的主要组分及其研究现状[J]. 生物学杂志, 2003, 20(2): 5-7.
QIN Y D, ZOU S X. Main components of milk protein and its research status [J]. Journal of Biology, 2003, 20(2): 5-7.
[2] 李莹, 林晓明. 乳清蛋白营养特点与功能作用[J]. 中国食物与营养, 2008(6): 62-64.
LI Y, LIN X M. Nutritional characteristics and function of whey protein [J]. Food and Nutrition in China, 2008(6): 62-64.
[3] 刘光磊, 王加启, 程金波, 等. 牛奶中免疫活性蛋白提高技术研究进展[J]. 中国奶牛, 2007(9): 37-40.
LIU G L, WANG J Q, CHENG J B, et al. Advances in technology to improve milk protein immunoreactivity [J]. China Dairy Cattle, 2007(9): 37-40.
[4] 孟祥河, 潘秋月, 邵平, 等. 酶解膜分离两步分离乳清中β-乳球蛋白的研究[J]. 农业工程学报, 2008, 24(5): 280-283.
MENG X H, PAN Q Y, SHAO P, et al. Isolation ofβ-lactoglobulin from whey by proteolysis coupled with membrane separation technology [J]. Transactions of the CSAE, 2008, 24(5): 280-283.
[5] 关璐, 李跃敏. 乳清蛋白与运动营养[J]. 四川体育科学, 2003(4): 17-19.
GUAN L, LI Y M. Whey protein and sports [J]. Nutrition Sichuan Sports Science, 2003(4): 17-19.
[6] KONTOPIDIS G, HOLT C, SAWYER L. Invited review: beta-lactoglobulin: binding properties, structure, and function [J]. Journal of Dairy Science, 2004, 87(4): 785-796.
[7] 李飞, 刘红娟, 王龙, 等. 乳清蛋白功能活性的研究[J]. 中国酿造, 2015, 34(7): 20-23.
LI F, LIU H J, WANG L, et al. Research of the functional activity of whey protein [J]. China Brewing, 2015, 34(7): 20-23.
[8] 李慧, 陈敏, 李赫, 等. 反相高效液相色谱法测定乳清蛋白中的α-乳白蛋白和β-乳球蛋白[J]. 色谱, 2007, 25(1): 116-117.
LI H, CHEN M, LI H, et al. Determination ofα-lactalbumin andβ-lactoglobulin in whey protein by RP-HPLC [J]. Chinese Journal of Chromatography, 2007, 25(1): 116-117.
[9] 韩奕奕, 黄菲菲, 王建军, 等. 凝胶电泳法(SDS-PAGE)测定乳与乳制品中β-乳球蛋白的含量[J]. 乳业科学与技术, 2009, 32(2): 74-77.
HAN Y Y, HUANG F F, WANG J J, et al. The determination ofβ-lactoglobulin content in milk and dairy products by SDS-PAGE electrophoresis [J]. Journal of Dairy Science and Technology, 2009, 32(2): 74-77.
[10] 赖心田, 詹家芬, 邓武剑, 等. CE法检测α-乳白蛋白和β-乳球蛋白[J]. 食品研究与开发, 2011, 32(10): 115-118.
LAI X T, ZHAN J F, DENG W J, et al.α-Lactalbumin andβ-lactglobulin separated and detected by CE [J]. Food Research and Development, 2011, 32(10): 115-118.
[11] COSTA N, RAVASCO F, MIRANDA R, et al. Evaluation of a commercial ELISA method for the quantitative detection of goat and cow milk in ewe milk and cheese [J]. Small Ruminant Research, 2008, 79(1): 73-79.
[12] IRENE V, WILFRIED M, WILLIAM D. Bioanalytical LC-MS/MS of protein-based biopharmaceuticals [J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2013, 929(7): 161-179.
[责任编辑:吴文鹏]
Determination of bovineβ-lactoglobulin in dairy products by LC-MS/MS
YUAN Mingmei1, FENG Cong2, WANG Shouyun1, ZHANG Weiwei2, CHEN Mo2, JIANG Hong2*, FENG Xuesong1
(1.CollegeofPharmacy,ChinaMedicalUniversity,Shenyang110122,Liaoning,China; 2.CollegeofPublicHealth,ChinaMedicalUniversity,Shenyang110122,Liaoning,China)
A method for determining bovineβ-lactoglobulin in cow dairy products was developed by LC-MS/MS. The content ofβ-lactoglobulin was detected by multiple reaction monitoring using the signature peptides which were chosen and identified from the tryptic hydrolysates. The results show that the established method has the advantages of good sensitivity, accuracy and reproducibility as well as with simple pretreatment. It can be used for the quantitative detection ofβ-lactoglobulin in dairy products.
LC-MS/MS;β-lactoglobulin; signature peptide; dairy products; determination
2017-01-16.
中华医学会医学教育分会和中国高等教育学会医学教育专业委员会2016年医学教育研究立项课题(2016A-YF002), 辽宁省高等教育学会“十三五”规划高教研究立项课题(GHZD160007).
袁明美(1991-),女,硕士生,主要从事化学生物分析及作用机制研究.*
, E-mail:hjiang@cmu.edu.cn.
O657
A
1008-1011(2017)02-0219-05
