苜蓿皂苷对胆固醇逆向转运基因三磷酸腺苷结合盒转运体A1、清道夫受体BⅠ mRNA表达的影响
2017-04-24陈言言刘伯帅陈跃鹏朱晓艳袁德地齐胜利王成章史莹华
陈言言 刘伯帅 陈跃鹏 朱晓艳 袁德地 齐胜利 王成章 史莹华
(河南农业大学牧医工程学院,郑州450002)
苜蓿皂苷对胆固醇逆向转运基因三磷酸腺苷结合盒转运体A1、清道夫受体BⅠ mRNA表达的影响
陈言言 刘伯帅 陈跃鹏 朱晓艳 袁德地 齐胜利 王成章 史莹华*
(河南农业大学牧医工程学院,郑州450002)
本试验以大鼠肝脏和肝脏细胞(BRL细胞)及小鼠巨噬细胞(ANA-1细胞)为研究对象,从动物和细胞水平上研究苜蓿皂苷对胆固醇逆向转运基因三磷酸腺苷结合盒转运体A1(ABCA1)、清道夫受体BⅠ(SR-BⅠ)mRNA表达的影响。取雄性健康SD大鼠32只,随机分成4组,分别为正常对照组、苜蓿皂苷组、高脂模型组和高脂苜蓿皂苷组,每组8只。正常对照组和苜蓿皂苷组饲喂基础饲粮,其余2组均饲喂高脂饲粮,饲喂4周后,苜蓿皂苷组和高脂皂苷组从第5周开始每天灌胃240 mg/kg苜蓿皂苷,灌胃4周。采用胎牛血清作用于BRL细胞48 h,构建脂变模型,将BRL细胞分为正常对照组(正常细胞)、苜蓿皂苷组(正常细胞)、脂变模型组(脂变细胞)和脂变皂苷组(脂变细胞),苜蓿皂苷组、脂变皂苷组培养液中添加苜蓿皂苷(终浓度300 μg/mL),培养24 h。采用氧化低密度脂蛋白(ox-LDL)作用于ANA-1细胞48 h,构建荷脂模型,将ANA-1细胞分为正常对照组(正常细胞)、苜蓿皂苷组(正常细胞)、荷脂模型组(荷脂细胞)和荷脂皂苷组(荷脂细胞),苜蓿皂苷组、荷脂皂苷组培养液中添加苜蓿皂苷(终浓度300 μg/mL),培养24 h。采用荧光定量PCR法测定大鼠肝脏、BRL细胞和ANA-1细胞中ABCA1、SR-BⅠ mRNA表达量。结果表明:1)苜蓿皂苷显著提高了正常大鼠肝脏ABCA1和SR-BⅠ mRNA表达量(P<0.05),显著提高了高脂大鼠肝脏ABCA1 mRNA的表达量(P<0.05),对高脂大鼠肝脏SR-BⅠ mRNA表达量影响不显著(P>0.05);2)苜蓿皂苷显著提高了正常BRL细胞ABCA1和SR-BⅠ mRNA的表达量(P<0.05),而对脂变BRL细胞ABCA1和SR-BⅠ mRNA表达量影响不大(P>0.05);3)苜蓿皂苷显著降低正常ANA-1细胞ABCA1 mRNA表达量(P<0.05)。由此可见,苜蓿皂苷可通过上调大鼠肝脏和正常肝脏细胞ABCA1和SR-BⅠ mRNA的表达促进胆固醇的逆向转运,增强肝脏胆固醇排泄,从而发挥其对高脂血症的预防和治疗作用。
苜蓿皂苷;BRL细胞;ANA-1细胞;大鼠;胆固醇逆向转运;mRNA表达量
随着社会现代化的发展,人们的生活质量得到不断的提高,但是也带来了不利的影响。血脂异常,尤其是血液中胆固醇含量的升高是导致动脉粥样硬化和冠状动脉心脏疾病发生的主要因素。在正常情况下,大部分胆固醇是细胞膜的结构成分,其余是通过血流运至肝脏、肾上腺、卵巢、睾丸、皮肤等组织和器官,之后被合成为胆汁酸、激素和维生素D。胆固醇和其他脂质以及各种载脂蛋白共同组成数种脂蛋白[1]。人类80%胆固醇在肝外组织合成,极少一部分来源于血浆中的低密度脂蛋白胆固醇(LDL-C)。为防止肝外组织胆固醇的积聚,肝外组织合成的胆固醇由高密度脂蛋白(HDL)携带经血流转运至肝脏,合成胆汁酸[2]。在胆固醇从肝外组织向肝脏转运的过程中,HDL具有重要的作用。大规模临床试验证实,HDL含量与心血管疾病呈负相关。而HDL的代谢是相当复杂的,它涉及许多代谢通路,HDL作为胆固醇受体不断地移走细胞膜上的胆固醇,导致细胞内多余胆固醇的外流,这一过程是由识别载脂蛋白A1(apoA-1)和清道夫受体BⅠ(SR-BⅠ)介导的。最近,路倩等[3]报道了非受体介导的方式,即通过三磷酸腺苷结合盒转运体A1(ABCA1)清除外周组织胆固醇的方式。ABCA1属于三磷酸腺苷结合盒转运体(ABC)基因家族一员,ABCA1编码的蛋白参与生物膜间物质的转运,ABCA1编码的蛋白质称作胆固醇外流调节蛋白(CERP),参与胆固醇外流,促使胆固醇转移到apoA-1和HDL。
目前,在植物中发现具有降低胆固醇作用的主要活性成分有皂苷类、酮类、萜类等。其中皂苷具有多种生物学功能,是植物中降低机体胆固醇含量的重要有效成分。因此,苜蓿皂苷成为植物提取物中降血脂药物研究和开发的一个重点。
苜蓿皂苷是从苜蓿中提取的具有独特生物学活性的物质,是由糖中羟基或非糖类化合物的羟基以缩醛链脱水缩合而成的环状缩醛链物,其结构为五环三萜烯类化合物[4]。早在20世纪50年代,国外就开始研究苜蓿皂苷,主要在提取、分离、结构鉴定方面做了大量的工作,有关这方面的研究报道很多。近年来,我国学者对苜蓿皂苷的研究也取得一定的成绩。王先科等[5]研究了苜蓿皂苷通过促进肝脏胆固醇7-羟化酶(CYP7A1)和低密度脂蛋白受体(LDL-R)的表达,增强肝脏胆固醇的排泄,发挥其对高脂血症的预防和治疗作用。Liang等[6]以大鼠肝脏细胞(BRL细胞)为对象,研究苜蓿皂苷对胆固醇代谢相关基因表达的影响,从而探究苜蓿皂苷在细胞水平上对胆固醇代谢的调节作用。本试验通过苜蓿皂苷在大鼠肝脏和BRL细胞及小鼠巨噬细胞(ANA-1细胞)中对胆固醇逆向转运(reverse cholesterol transport,RCT)相关基因ABCA1和SR-BⅠ mRNA的表达,初步探讨苜蓿皂苷对RCT的影响及其机制,为其在动物生产中的应用提供可靠的科学依据。
1 材料与方法
1.1 试验材料
苜蓿皂苷(河北宝恩公司,由苜蓿草粉经醇提法与大孔树脂柱分离纯化得到,经薄层层析法检测其主要成分为苜蓿皂苷,经紫外分光光度法检测其中总皂苷含量为51%)、32只雄性健康SD无特定病原体(SPF)级大鼠(河南省实验动物中心)、全自动生化分析仪(HITACHI7170A,HITACHI公司)、台式高速冷冻离心机(Eppendorf公司)、总胆固醇(TC)测定试剂盒(北京北化康泰临床试剂有限公司)、总胆汁酸测定试剂盒(南京建成生物工程研究所)、酶标仪(Multiskan GO 1.00.40,Thermo公司)、HDL和低密度脂蛋白(LDL)测定试剂盒(广州达尔斯科生物科技有限公司)、甘油三酯(TG)检测试剂盒(宁波美康生物科技股份有限公司)、大鼠BRL细胞和ANA-1细胞(中国科学院上海生科院细胞资源中心)、噻唑蓝(MTT)(Solarbio公司)、氧化低密度脂蛋白(ox-LDL)(北京协生生物科技有限责任公司)、高糖DMEM培养液(Solarbio公司)、胎牛血清(杭州四季青生物工程材料有限公司)、RPMI-1640培养液(Solarbio公司)、胰酶(Solarbio公司)、二甲基亚砜(DMSO)(Sigma公司)、25 cm2培养瓶(Coming公司)、6孔板和96孔板(Coming公司)、血细胞计数板(上海求精生化试剂仪器有限公司)、总RNA提取试剂(Invitrogen公司)、荧光定量PCR试剂盒[东洋纺(上海)生物科技有限公司]、反转录试剂盒和DNA凝胶回收试剂盒[宝生物工程(大连)有限公司]、2×Taq PCR Master Mix(北京康为世纪生物科技有限公司)、琼脂糖(Invitrogen公司)。
1.2 动物试验
预试期(1周)结束后,将32只雄性健康SD大鼠[体重(191.41±16.01) g]随机分为2组,分别为正常组、高脂组,各组之间血清TC含量和体重无统计学差异(P>0.05)。采用饲喂高脂饲粮的方法建立大鼠高脂模型。正常组饲喂基础饲粮(表1),高脂组饲喂高脂饲粮。高脂饲粮组成:1.0%胆固醇、0.1%猪胆盐、10.0%猪油、5.0%蛋黄粉、5.0%全脂奶粉、78.9%基础饲粮。建模时间为4周。

表1 基础饲粮组成及营养水平(风干基础)
建模结束后,根据血清TC含量和体重分别将正常组和高脂组各随机分为2组,分组情况及具体试验设计如下。正常对照组:饲喂基础饲粮,每天09:00灌胃2 mL蒸馏水;苜蓿皂苷组:饲喂基础饲粮,每天09:00灌胃240 mg/kg苜蓿皂苷2 mL;高脂模型组:饲喂高脂饲粮,每天09:00灌胃2 mL蒸馏水;高脂皂苷组:饲喂高脂饲粮,1~4周每天09:00灌胃2 mL蒸馏水,从第5周开始,每天09:00灌胃240 mg/kg苜蓿皂苷,连续灌胃4周。各组大鼠均自由饮水、采食。
样本的采集与制备:试验结束后,所有大鼠禁食过夜,麻醉后沿大鼠腹部中部剖开,取肝脏相同部位,吸干血迹用锡箔纸包装好后,迅速置于液氮中冷冻,并保存于-80 ℃冰箱待测。
1.3 BRL细胞试验
1.3.1 脂变BRL细胞模型的建立[7]
BRL细胞接种于50 mL的细胞培养瓶中,用10%胎牛血清的高糖DMEM培养液于37 ℃ 5% CO2培养箱中培养,待细胞贴壁长满瓶底,胰酶消化,计数后接种于6孔板中,每孔接种约1.5×105个细胞,待细胞长满80%后,更换新鲜培养液,在培养液中加入50%胎牛血清,继续培养24~48 h至出现细胞内脂滴或泡沫样物沉积,即制成脂变细胞模型。将所得细胞改置于含0.1%胎牛血清的高糖DMEM培养液中,使其静止24 h,再做相应的处理。
1.3.2 试验分组
细胞用六孔板培养,试验分为4个组,每组6个重复,具体分组情况如下。
正常对照组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换液,继续培养48 h后,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,再加入100 μL的培养液培养24 h。
苜蓿皂苷组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换液,继续培养48 h后,置于含0.1%胎牛血清高糖DMEM培养液中静止24 h,再加入100 μL的300 μg/mL(终浓度为100 μg/mL)苜蓿皂苷溶解液,培养24 h。
脂变模型组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换成含50%胎牛血清的高糖DMEM培养液,继续培养48 h后,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,再加入100 μL的培养液培养24 h。
脂变皂苷组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换成含50%胎牛血清的高糖DMEM培养液,继续培养48 h后,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,再加入100 μL的300 μg/mL(终浓度为100 μg/mL)苜蓿皂苷溶解液,培养24 h。
1.4 ANA-1细胞试验
将ANA-1细胞接种于25 cm2培养瓶中,加入含10%胎牛血清的RPMI-1640培养液,铺满瓶底即可,置于37 ℃ 5% CO2培养箱中培养。注意更换新鲜培养液。细胞密度达到2×106个/mL更换培养液,定期将培养瓶置于显微镜下观察,观察细胞形态。
1.4.1 荷脂ANA-1细胞模型的建立
试验前以无血清的RPMI-1640培养液培养细胞12 h,使细胞处于静止状态。用50 mg/L的ox-LDL作用于细胞48 h,制成荷脂ANA-1细胞模型。
1.4.2 试验分组
细胞用六孔板培养,试验分为为4个组,每组6个重复,具体分组情况如下。
正常对照组:六孔板每孔添加2.9 mL含10%胎牛血清的RPMI-1640培养液,培养48 h后置于含0.1%胎牛血清的RPMI-1640培养液中静止24 h,再加入100 μL的培养液培养24 h。
苜蓿皂苷组:六孔板每孔添加2.9 mL含10%胎牛血清的RPMI-1640培养液,培养48 h后置于含0.1%胎牛血清的RPMI-1640培养液中静止24 h,再加入100 μL 300 μg/mL(终浓度为100 μg/mL)苜蓿皂苷溶解液培养24 h。
荷脂模型组:六孔板每孔添加2.8 mL含10%胎牛血清的RPMI-1640培养液,100 μL 1.45 μg/μL的ox-LDL(终浓度50 mg/L)培养48 h后,置于含0.1%胎牛血清的RPMI-1640培养液中静止24 h,再加入100 μL的培养液培养24 h。
荷脂皂苷组:六孔板每孔添加2.8 mL含10%胎牛血清的RPMI-1640培养液,100 μL 1.45 μg/μL的ox-LDL(终浓度50 mg/L)培养48 h后,置于含0.1%胎牛血清的RPMI-1640培养液中静止24 h,再加入100 μL 300 μg/mL(终浓度为100 μg/mL)苜蓿皂苷溶解液的培养液培养24 h。
1.5 指标测定与方法
1.5.1 MTT法测定苜蓿皂苷对BRL和ANA-1细胞活性的影响
用浓度为2×104个/mL的细胞悬液接种于96孔板,每孔100 μL,培养24 h后加入不同剂量的苜蓿皂苷,终浓度分别为0(对照)、50、100、200、250 μg/mL。每组6个重复孔,37 ℃ 5% CO2培养24 h,显微镜观察其效果,去上清液,加入90 μL新鲜培养液,再加入10 μL MTT孵育,继续培养4 h后,每孔加二甲基亚砜(DMSO)150 μL振荡10 min,以无细胞空白孔为零点,用酶标仪在波长490 nm处检测各孔吸光度值(OD)。
1.5.2 大鼠肝脏、BRL细胞和ANA-1细胞基因mRNA相对表达量测定
1.5.2.1 肝脏和细胞总RNA提取
Trizol法提取总RNA,保存于-80 ℃,以备后续试验使用。
1.5.2.2 总RNA浓度的测定
采用Thermo微量紫外分光光度计260 nm处测定总RNA浓度,并记录OD260 nm/OD280 nm,结果在1.8~2.0的样本满足要求。
1.5.2.3 总RNA的质量检测
用1%琼脂糖凝胶胶电泳鉴定总RNA的完整性。
1.5.2.4 总RNA反转录
采用大连宝生物工程公司提供的Reverse Transcriptase M-MLV(Rnase H-)试剂盒,按照说明书进行操作,得到cDNA产物。
1.5.2.5 引物设计与合成
根据GenBank大鼠甘油醛-3-磷酸脱氢酶(GAPDH)、ABCA1、SR-BⅠ DNA序列,小鼠β肌动蛋白(β-actin)、ABCA1、SR-BⅠ DNA序列运用Primer 5.0设计引物,引物序列及参数见表2。
1.5.2.6 荧光定量PCR
本试验采用SYBR qPCR Mix为荧光染料,经过摸索确定最佳反应体系如下:SYBR-qPCR Mix 5 μL,焦碳酸二乙酯(DEPC)处理水3.8 μL,模板cDNA 1 μL,上、下游引物各0.1 μL,总体系为10 μL。按照以下条件进行荧光定量PCR:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,此步骤40个循环;溶解曲线,产物20 ℃保存10 min。根据本试验条件,采用2-△△Ct法对数据进行分析处理。
1.6 统计分析
试验数据采用SPSS 13.0统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行组间多重比较,以P<0.05表示差异显著,结果用“平均值±标准差”表示。
2 结果与分析
2.1 苜蓿皂苷对BRL细胞、ANA-1细胞活性的影响
由表3可知,苜蓿皂苷添加终浓度为50、100 μg/mL时,BRL细胞活性与对照组相比差异不大,而200、250 μg/mL时BRL细胞活性升高,且与对照组相比差异显著(P<0.05)。苜蓿皂苷添加终浓度为50、100、200、250 μg/mL时ANA-1细胞活性与对照组差异不显著(P>0.05)。苜蓿皂苷浓度在100 μg/mL以下时对BRL细胞和ANA-1细胞都未见毒性。
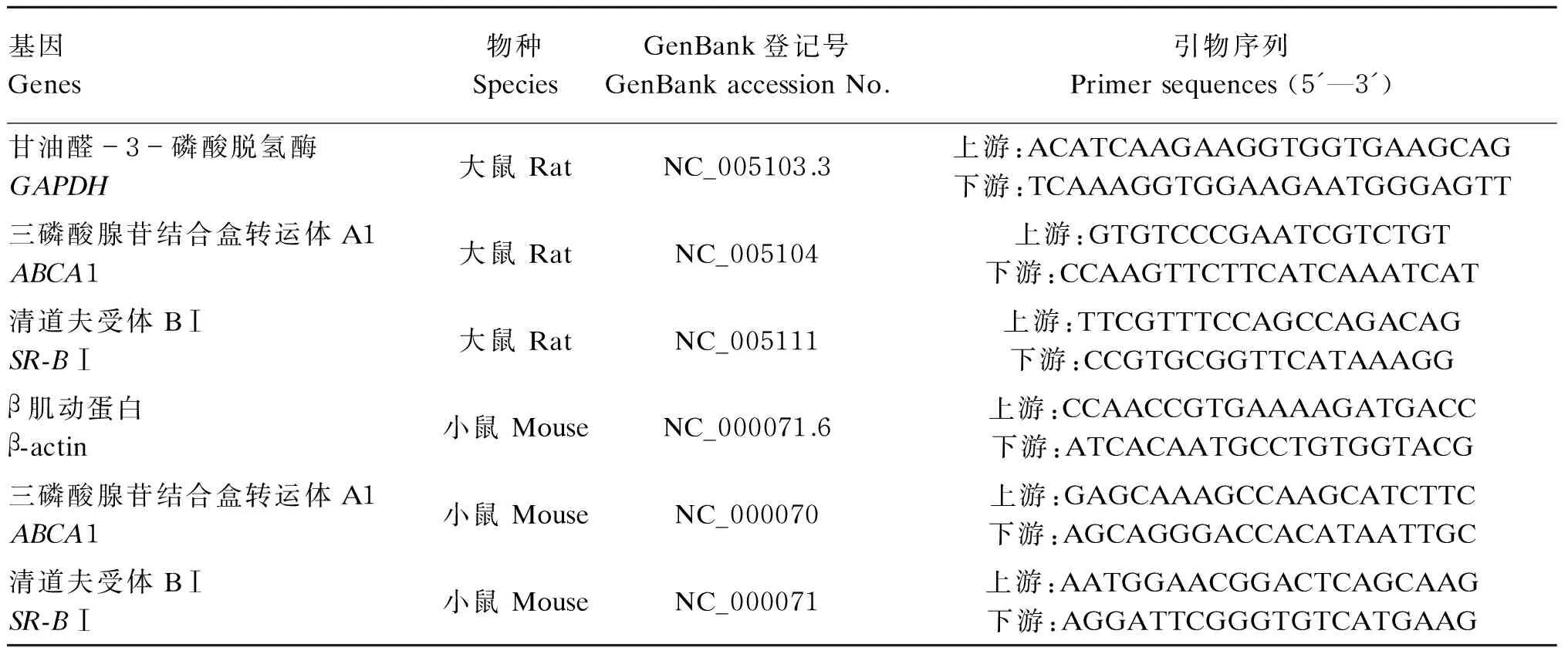
表2 引物序列及参数

表3 苜蓿皂苷对BRL细胞、ANA-1细胞活性的影响
同列数据肩标相同或无小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same column, values with the same or no small letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 苜蓿皂苷对大鼠肝脏ABCA1、SR-BⅠ mRNA表达量的影响
由表4可知,与正常对照组相比,苜蓿皂苷组、高脂模型组、高脂皂苷组ABCA1 mRNA表达量显著升高(P<0.05),分别是正常对照组的8.34、3.86、9.57倍;与正常对照组相比,苜蓿皂苷组SR-BⅠ mRNA表达量显著升高(P<0.05),分别是正常对照组的12.07、2.77、2.94倍;与高脂模型组相比较,高脂皂苷组ABCA1 mRNA表达量显著上升(P<0.05),SR-BⅠ mRNA表达量则变化不大,差异不显著(P>0.05)。
2.3 苜蓿皂苷对BRL细胞ABCA1、SR-BⅠ mRNA表达量的影响
由表5可知,与正常对照组相比,苜蓿皂苷组、脂变模型组、脂变皂苷组ABCA1 mRNA表达量显著升高(P<0.05),分别是正常对照组的5.97、1.46、1.47倍;与脂变模型组相比,脂变皂苷组ABCA1 mRNA表达量没有显著变化(P>0.05)。与正常对照组相比,苜蓿皂苷组SR-BⅠ mRNA表达量显著升高(P<0.05),是正常对照组的1.69倍,脂变模型组和脂变皂苷组显著降低(P<0.05),分别是正常对照组的0.17、0.35倍;与脂变模型组相比较,脂变皂苷组SR-BⅠ mRNA的表达量略有升高,但差异不显著(P>0.05)。

表4 苜蓿皂苷对大鼠肝脏ABCA1、SR-BⅠ mRNA表达量的影响

表5 苜蓿皂苷对BRL细胞ABCA1、SR-BⅠ mRNA表达量的影响
2.4 苜蓿皂苷对ANA-1细胞ABCA1、SR-BⅠ mRNA表达量的影响
由表6可知,与正常对照组相比较,苜蓿皂苷组、荷脂模型组、荷脂皂苷组ABCA1 mRNA表达量显著降低(P<0.05),是正常对照组的0.59、0.24、0.26倍。与正常对照组相比,苜蓿皂苷组SR-BⅠ mRNA表达量略有下降(P>0.05),是正常对照组的0.60倍,荷脂模型组和荷脂皂苷组则显著提高(P<0.05),分别是正常对照组的4.56、4.07倍;与荷脂模型组相比较,荷脂皂苷组ABCA1、SR-BⅠ mRNA表达量均没有显著变化(P>0.05)。

表6 苜蓿皂苷对ANA-1细胞ABCA1、SR-BⅠ mRNA表达量的影响
3 讨 论
血脂是血液中所含各类脂质的总称,包括胆固醇、TG、磷脂(PL)和游离脂肪酸(FFA)等。本课题组前期研究表明,苜蓿皂苷可以能降低高脂血症大鼠血清中TC、TG和LDL-C含量,表明苜蓿皂苷具有良好的降血脂效应[8]。
HDL的抗动脉粥硬化性疾病作用主要基于HDL参与的RCT过程。而苜蓿皂苷具有溶血作用,将其水溶液注射入血液,低浓度时即可使红细胞破裂。一般认为溶血作用与皂苷和红细胞膜中胆固醇的相互作用有关。本试验用MTT法检测苜蓿皂苷对BRL细胞、ANA-1细胞生长的影响,以确定苜蓿皂苷对这2种细胞是否具有毒性,并确定细胞培养过程中苜蓿皂苷的添加量,为后续试验打下基础。本试验结果表明,苜蓿皂苷浓度小于100 μg/mL时对BRL细胞的活性并无影响,苜蓿皂苷各个剂量对ANA-1细胞的影响差异均不显著,但浓度高于100 μg/mL时,ANA-1细胞活性有下降趋势,故选取100 μg/mL作为细胞培养过程中苜蓿皂苷的添加量。
组成生物膜系统的重要成分——胆固醇的摄取、合成以及排出之间存在着动态平衡,这个平衡是维持细胞膜系统与细胞基本生命活动的关键。RCT是指新生的圆盘状HDL从外周细胞(包括动脉壁细胞)中摄取过剩的胆固醇,在血浆中经卵磷脂胆固醇酰基转移酶(lecithin cholesterolacyl transferase,LCAT)酯化后,游离胆固醇转变为胆固醇脂并向HDL的内核转移,最终形成球状的成熟HDL,将胆固醇转运至肝脏,主要通过生成胆汁酸的形式排出体外的过程[9-10]。机体通过这一过程阻断泡沫细胞的形成,是HDL抗动脉粥样硬化的最主要机制之一。目前已知有3条胆固醇流出通路,分别为apoA-1/ABCA1通路、SR-BⅠ途径和液相扩散途径。本试验选取了RCT过程中的2种关键基因ABCA1、SR-BⅠ,从个体和细胞水平研究苜蓿皂苷对其mRNA表达的影响,初步探讨苜蓿皂苷对RCT的调控机制。
ABCA1是ABC超家族的成员之一,能促进细胞内胆固醇流出而参与RCT过程,从而清除组织过量的胆固醇[11]。它是近年来新发现的启动细胞内胆固醇外流、形成HDL、增加RCT的关键因子,ABCA1介导RCT的第1步,也是限速步骤,对脂质代谢和动脉粥样硬化的发生及发展具有重要影响。大量研究表明,高表达ABCA1的转基因小鼠可以通过升高血清中HDL含量,降低LDL含量,加速体内胆固醇的流出[12-14];同时,ABCA1在巨噬细胞清除过多的胆固醇,阻止动脉粥样硬化进展方面发挥重要作用[15]。本试验结果表明,添加苜蓿皂苷后正常和高脂大鼠肝脏中ABCA1 mRNA表达量均显著升高,正常BRL细胞中ABCA1 mRNA表达量也显著升高,说明苜蓿皂苷可通过上调ABCA1 mRNA的表达来增加RCT。而添加苜蓿皂苷后脂变BRL细胞中ABCA1 mRNA的表达量变化不大,推测苜蓿皂苷对大鼠肝脏ABCA1的影响是代偿性的而非直接作用,具体机制有待进一步研究。添加苜蓿皂苷后正常ANA-1细胞中ABCA1 mRNA表达量下降,荷脂ANA-1细胞中ABCA1 mRNA的表达量变化并不大。这说明苜蓿皂苷并不能促进巨噬细胞中RCT。对比大鼠肝脏、BRL细胞和ANA-1细胞的试验结果可发现,苜蓿皂苷主要是促进肝脏细胞中RCT,而对巨噬细胞中RCT影响不大。
SR-BⅠ属于CD36超家族成员,主要分布及发挥重要作用的组织器官是肝脏,还有如肾上腺、卵巢、睾丸等产生甾体类激素的组织中,而且在选择性摄取HDL-C的组织中SR-BⅠ含量较多,此外在一些组织细胞中有低水平表达。SR-BⅠ是HDL受体,而且同时具有多个配体的结合位点。SR-BⅠ与HDL结合后,介导胆固醇脂选择性摄取,在该过程中SR-BⅠ作为HDL受体,可直接将HDL-C选择性摄取。HDL流出速率与细胞SR-BⅠ mRNA表达呈正相关。研究发现,SR-BⅠ在肝脏中过表达同时伴随着血浆中HDL-C含量的降低和胆汁中胆固醇含量的升高;相反,对SR-BⅠ基因敲除小鼠的研究发现,血液循环中TC含量增加,尤其HDL-C含量。故而认为,SR-BⅠ基因可参与RCT途径,将血液及组织细胞中过多的胆固醇转运至肝及其他可利用的器官形成胆汁酸和类固醇类激素从而达到清除过多血脂,防止动脉粥样硬化发生的作用[16]。本试验结果表明,苜蓿皂苷主要影响正常大鼠肝脏和正常BRL细胞中SR-BⅠ mRNA表达,而对高脂大鼠和脂变BRL细胞中SR-BⅠ mRNA表达影响不大,推测苜蓿皂苷参与调节正常肝脏细胞SR-BⅠ mRNA表达,对脂变肝脏细胞中SR-BⅠ mRNA表达调节较少。这说明血脂水平的高低影响体内胆固醇的代谢,因此研究苜蓿皂苷对胆固醇代谢的影响时应考虑血脂水平的差异。苜蓿皂苷对正常和荷脂ANA-1细胞中SR-BⅠ mRNA表达量的影响均不大,推测苜蓿皂苷对巨噬细胞中SR-BⅠ参与调节RCT无影响,具体的作用机制还需进一步研究[17]。
4 结 论
苜蓿皂苷可通过上调大鼠肝脏和正常肝脏细胞ABCA1和SR-BⅠ mRNA的表达促进胆固醇的逆向转运,增强肝脏胆固醇排泄,从而发挥其对高脂血症的预防和治疗作用。
[1] 李则一,陈吉棣.胆固醇的逆向转运与高密度脂蛋白受体[J].中国运动医学杂志,2000,19(1):71-73.
[2] BROOKS-WILSON A,MARCIL M,CLEE S M,et al.Mutations in ABC1 in tangier disease and familial high-density lipoprotein deficiency[J].Nature Genetics,1999,22(4):336-345.
[3] 路倩,陈五军,尹凯,等.动脉粥样硬化中胆固醇外流的研究进展[J].生物化学与生物物理进展,2012,39(4):319-326.
[4] 何春年,高微微,佟建明.苜蓿属植物的皂苷类化学成分[J].中国农学通报,2005,21(3):107-111.
[5] 王先科,史莹华,王成章,等.苜蓿皂苷对高脂血症大鼠胆固醇代谢及其相关基因表达的影响[J].动物营养学报,2012,24(5):983-990.
[6] LIANG X P,ZHANG D Q,CHEN Y Y,et al.Effects of alfalfa saponin extract on mRNA expression ofLdlr,LXRα,andFXRin BRL cells[J].Journal of Zhejiang University:Science B,2015,16(6):479-486.
[7] 靳培英.皮肤病药物治疗学[M].北京:人民卫生出版社,2009.
[8] 刘伯帅,王文静,陈言言,等.苜蓿皂苷对大鼠肝脏及肝脏细胞低密度脂蛋白受体、三磷酸腺苷结合盒转运体mRNA表达的影响[J].动物营养学报,2017,29(4):1437-1445.
[9] CHEN B,REN X F,NEVILLE T,et al.Apolipoprotein AⅠ tertiary structures determine stability and phospholipid-binding activity of discoidal high-density lipoprotein particles of different sizes[J].Protein Science,2009,18(5):921-935.
[10] NAKAMURA Y,KOTITE L,GAN Y H,et al.Molecular mechanism of reverse cholesterol transport:reaction of pre-β-migrating high-density lipoprotein with plasma lecithin/cholesterol acyltransferase[J].Biochemistry,2004,43(46):14811-14820.
[11] ORAM J F.HDL apolipoproteins and ABCA1:partners in the removal of excess cellular cholesterol[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2003,23(5):720-727.
[12] KISS R S,MCMANUS D C,FRANKLIN V,et al.The lipidation by hepatocytes of human apolipoprotein A-Ⅰ occurs by both ABCA1-dependent and-independent pathways[J].Journal of Biological Chemistry,2003,278(12):10119-10127.
[13] 倪占玲.普罗布考促进小鼠巨噬细胞胆固醇逆转运的体内外实验研究[D].博士学位论文.长沙:中南大学,2007.
[14] 唐朝克,杨永宗.三磷酸腺苷结合盒转运体A1在转基因小鼠中的作用[J].中国老年学杂志,2005,25(2):225-227.
[15] SCHMITZ G,KAMINSKI W E.ATP-binding cassette (ABC) transporters in atherosclerosis[J].Current Atherosclerosis Reports,2002,4(3):243-251.
[16] 柴婵娟,杨志明.高密度脂蛋白受体SR-BI对细胞内胆固醇外流的影响[J].临床医药实践,2012,21(4):300-302.
[17] 袁德地,史莹华,王成章,等.苜蓿皂苷对SD大鼠胆固醇代谢的影响及其分子机理的初步探讨[J].草业学报,2013,22(5):294-301.
*Corresponding author, professor, E-mail: annysyh@126.com
(责任编辑 王智航)
Effects of Alfalfa Saponins mRNA Expressions of Reverse Cholesterol Transport Genes: ATP-Binding Cassette Transporter A1 and Scavenger Receptor Class B Type Ⅰ
CHEN Yanyan LIU Boshuai CHEN Yuepeng ZHU Xiaoyan YUAN Dedi QI Shengli WANG Chengzhang SHI Yinghua*
(CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
Rat liver, rat liver cells (BRL cells) and mouse macrophages (ANA-1 cells) were used to investigate the effects of alfalfa saponins (AS) on mRNA expressions of reverse cholesterol transport genes, which were ATP-binding cassette transporter A1 (ABCA1) and scavenger receptor class B type Ⅰ(SR-BⅠ), and discuss the effects of AS from animal and cellular levels. Thirty two healthy male SD rats were randomly divided into four groups: normal control group, AS group, hyperlipidemic model group and hyperlipidemic saponins group, and each group had 8 rats. Rats in normal control group and AS group were fed a basal diet, and those in the other two groups were fed a high-fat diet. After 4 weeks feeding, AS [240 mg/(kg·d)] was intragastric administered to rats in AS group and hyperlipidemic saponins group from weeks 5 to 8. BRL cells were incubated with fetal bovine serum for 48 h to constitute hyperlipidemic model. BRL cells were divided into four groups, which were normal control group (normal cells), AS group (normal cells), hyperlipidemic model group (hyperlipidemic cells) and hyperlipidemic saponins group (hyperlipidemic cells), and AS (final concentration 300 μg/mL) was added to culture medium in AS group and hyperlipidemic saponins group to culture for 24 h. ANA-1 cells were incubated with oxidized low density lipoprotein for 48 h to constitute lipid-loaded model. ANA-1 cells were divided into four groups, which were normal control group (normal cells), AS group (normal cells), lipid-loaded model group (lipid-loaded cells) and lipid-loaded saponins group (lipid-loaded cells), and AS (final concentration 300 μg/mL) was added to culture medium in AS group and lipid-loaded saponins group to culture for 24 h. The mRNA expressions ofABCA1 andSR-BⅠ in rat liver, BRL cells and ANA-1 cells were determined by fluorescent quantitative PCR. The results showed as follows: 1) AS significantly increased the mRNA expressions ofABCA1 andSR-BⅠ in liver of normal rats and ofABCA1 in liver of hyperlipidemic rats (P<0.05), but had no significant effects on that ofSR-BⅠ in liver of hyperlipidemic rats (P>0.05); 2)AS significantly increased the mRNA expressions ofABCA1 andSR-BⅠ in normal BRL cells(P<0.05), but had no significant effects on those in hyperlipidemic BRL cells (P>0.05); 3) AS significantly reduced the mRNA expression ofABCA1 in normal ANA-1 cells (P<0.05). In conclusion, AS might promote reverse cholesterol transport by up-regulating the mRNA expressions ofABCA1 andSR-BⅠin rat liver and normal BRL cells, promote the excretion of liver cholesterol, and play prevention and curing effects on hyperlipidemia.[ChineseJournalofAnimalNutrition, 2017, 29(4):1446-1454]
alfalfa saponins; BRL cells; ANA-1 cells; rat; cholesterol reverse transport; mRNA expression
10.3969/j.issn.1006-267x.2017.04.044
2016-10-14
国家自然科学基金(31301983);现代农业产业技术体系(CARS-35);河南农业大学科技创新基金(30600968)
陈言言(1989—),女,河南商丘人,硕士研究生,从事牧草营养与利用研究。E-mail: 1220675190@qq.com
*通信作者:史莹华,教授,硕士生导师,E-mail: annysyh@126.com
S816.7
A
1006-267X(2017)04-1446-09
