苜蓿皂苷对大鼠肝脏及肝脏细胞低密度脂蛋白受体、三磷酸腺苷结合盒转运体mRNA表达的影响
2017-04-24刘伯帅王文静陈言言朱晓艳袁德地齐胜利王成章史莹华
刘伯帅 王文静 陈言言 朱晓艳 袁德地 齐胜利 王成章 史莹华
(河南农业大学牧医工程学院,郑州450002)
苜蓿皂苷对大鼠肝脏及肝脏细胞低密度脂蛋白受体、三磷酸腺苷结合盒转运体mRNA表达的影响
刘伯帅 王文静 陈言言 朱晓艳 袁德地 齐胜利 王成章 史莹华*
(河南农业大学牧医工程学院,郑州450002)
本试验旨在研究苜蓿皂苷对大鼠肝脏及大鼠肝脏细胞(BRL细胞)胆固醇清除和转运途径中关键基因低密度脂蛋白受体(LDLR)、三磷酸腺苷结合盒转运体G5(ABCG5)、三磷酸腺苷结合盒转运体G8(ABCG8)mRNA表达量的影响,从个体和细胞水平初步探讨苜蓿皂苷调控胆固醇清除和转运的分子机制。采用高脂饲粮建立大鼠高脂模型,测定苜蓿皂苷对正常、高脂大鼠血清指标[总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量]和肝脏LDLR、ABCG5、ABCG8 mRNA表达量的影响;采用高糖DMEM培养液建立BRL细胞脂变模型,测定苜蓿皂苷浓度对BRL细胞活性的影响,测定苜蓿皂苷对正常、脂变细胞LDLR、ABCG5、ABCG8 mRNA表达量的影响。结果表明:1)苜蓿皂苷显著降低高脂大鼠血清中TG、TC和LDL-C的含量(P<0.05);2)苜蓿皂苷显著上调正常大鼠肝脏LDLR、ABCG5、ABCG8及高脂大鼠ABCG5、ABCG8 mRNA表达量(P<0.05);3)添加200、250 μg/mL苜蓿皂苷显著提高了BRL细胞的活性(P<0.05);4)苜蓿皂苷显著上调正常BRL细胞LDLR、ABCG5、ABCG8 mRNA表达量(P<0.05),而对脂变BRL细胞各基因mRNA表达量无显著影响(P>0.05)。结果提示,苜蓿皂苷可通过调控LDLR、ABCG5、ABCG8 mRNA的表达来增加肝细胞内胆固醇的清除和转运,从而降低机体胆固醇的含量。
苜蓿皂苷;大鼠;BRL细胞;低密度脂蛋白受体;三磷酸腺苷结合盒转运体G5;三磷酸腺苷结合盒转运体G8;mRNA表达量
随着社会现代化的发展,人们的生活质量不断的提高,但是也带来了不利的影响。血脂异常,尤其是饮食中胆固醇含量的升高是导致动脉粥样硬化和冠状动脉心脏疾病发生的主要因素。据统计,全世界大约每年有1 000多万人由于患有高脂血症而死亡。我国大约有9 000万人患有高脂血症,而且随着人们生活水平的不断提高,高脂血症人群也在不断的增多,并有年轻化的趋势[1]。先前许多大规模临床试验证实,胆固醇含量的降低能够显著改善心血管疾病患者的心肌缺血症状、缓解心绞痛、改善心脏功能,从而减少心血管疾病的发生[2-4]。中草药和植物提取物在降血脂方面的应用历史悠久、资源丰富、效果明显,且副作用较小,长期服用耐受性好,具有得天独厚的优势。植物提取物具有来源广泛、毒副作用小、降脂作用明显等优点,因此成为近年来降脂药物研究开发的重点和热点。大量研究表明,植物中的活性物质,如皂苷类、甾醇类、酮类、生物碱类、萜类等,都具有降低机体胆固醇的作用[5-6]。其中皂苷类物质的降脂效果最明显,也最受关注。苜蓿皂苷是从紫花苜蓿中提取的具有独特生物学活性的物质,是由糖中羟基或非糖类化合物的羟基以缩醛链脱水缩合而成的环状缩醛链物,其结构为五环三萜烯类化合物[7]。大量的试验研究证明,苜蓿皂苷能够降低动物体内胆固醇的含量,良好的抗动脉粥样硬化的作用使其成为降低胆固醇药物和绿色饲料添加剂的理想原料[8-9]。机体主要通过胆固醇的合成、小肠的吸收、胆汁和粪便的排泄维持胆固醇的动态平衡。三磷酸腺苷结合盒转运体(ABC)家族介导的胆固醇单向跨膜转运机制排出胞外[10],另外,低密度脂蛋白受体途径在降低血清胆固醇的含量,调节低密度脂蛋白代谢和保持血液中胆固醇正常含量方面起着非常重要的作用[11]。本试验旨在通过研究苜蓿皂苷对正常血脂、高脂水平大鼠及正常、脂变大鼠肝脏细胞(BRL细胞)低密度脂蛋白受体(LDLR)、三磷酸腺苷结合盒转运体G5(ABCG5)、三磷酸腺苷结合盒转运体G8(ABCG8)mRNA表达的影响,探讨其对胆固醇转运和清除途径中关键基因mRNA表达量的影响,从分子水平揭示苜蓿皂苷调控胆固醇清除和转运,进而降低胆固醇的机理,为其在安全、绿色、健康畜产品生产中的广泛应用提供理论依据。
1 材料与方法
1.1 动物试验
1.1.1 试验设计
雄性健康SD无特定病原体(SPF)级大鼠32只,体重为(191.41±16.01) g,购自河南省实验动物中心。大鼠适应性饲喂1周,之后所有大鼠禁食过夜,称量体重,尾动脉采血,检测血清总胆固醇(TC)含量。并根据血清TC含量和体重情况将雄性健康SD大鼠32只随机分为2组,分别为正常组、高脂组,每组16只,2组之间血清TC含量和体重无统计学差异(P>0.05)。采用饲喂高脂饲粮的方法建立大鼠高脂模型。正常组饲喂基础饲粮,高脂组饲喂高脂饲料。高脂饲粮组成:1.0%胆固醇、0.1%猪胆盐、10.0%猪油,5.0%蛋黄粉、5.0%全脂奶粉、78.9%基础饲粮。建模时间为4周。每周称量1次体重,第4周末尾动脉采血。建模成功后,根据血清TC含量和体重分别将正常组和高脂组各随机分为2组,每组8只,分组情况及具体试验设计如下:正常对照组,饲喂基础饲粮,每天09:00灌胃2 mL蒸馏水;正常皂苷组,饲喂基础饲粮,每天09:00灌胃240 mg/kg苜蓿皂苷2 mL;高脂模型组,饲喂高脂饲粮,每天09:00灌胃2 mL蒸馏水;高脂皂苷组,饲喂高脂饲粮,每天09:00灌胃240 mg/kg苜蓿皂苷2 mL。试验期4周。
大鼠均自由饮水、采食,所有饲料和饮用水均经过消毒处理。苜蓿皂苷由河北省沧州市宝恩生物科技有限公司提供,总皂苷含量为51%。
1.1.2 样本的采集与制备
试验结束后,所有大鼠禁食过夜。乙醚麻醉,断尾采血,4 ℃冰箱倾斜静置过夜,3 000 r/min离心10 min,分离出血清分装于EP管中,-20 ℃冰箱保存待测。沿大鼠腹部中部剖开,取肝脏,吸干血迹后称重,将肝脏一分为二,用锡箔纸包装好后1/2置于-20 ℃度冰箱待测,另1/2迅速置于液氮中冷冻,并保存于-80 ℃冰箱待测。
1.1.3 血清相关指标的测定
采用全自动生化分析仪测定血清中TC、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量,TC含量测定试剂盒购自北京北化康泰临床试剂有限公司,TG含量测定试剂盒购自宁波美康生物科技有限公司,LDL-C和HDL-C含量测定试剂盒购自广州达尔斯科生物科技公司,具体操作详见试剂盒说明书。
1.2 细胞试验
选取BRL细胞为试验材料,购于中国科学院上海生科院细胞资源中心。
1.2.1 细胞计数
细胞计数步骤如下:1)制备浓度适中的细胞悬液;2)将计数板及盖片擦拭干净,并在计数板上盖好盖片;3)吸出15 μL细胞悬液,沿着盖片边缘缓慢滴加,直至悬液充满盖片和计数板之间,静置3 min左右,注意盖片下不要有气泡,也不能让悬液流入旁边槽中;4)数计数板4大格中的所有细胞,压线细胞只计左侧和上方的,避免重复计数。镜下细胞团按单个细胞计数,若细胞团10%以上,说明分散不好,需重新制备细胞悬液;5)细胞数(个/mL)=4大格细胞总数/4×104。
1.2.2 BRL细胞的培养
将BRL细胞接种于25 cm培养瓶中,加入含10%胎牛血清的高糖DMEM培养液,铺满瓶底即可,置于37 ℃ 5% CO2培养箱中培养。每2 d更换1次新鲜培养液,定期将培养瓶置于显微镜下观察,当细胞生长至瓶底70%左右时即可传代或冻存。
1.2.2.1 脂变BRL细胞模型的建立[12]
BRL细胞接种于50 mL的细胞培养瓶中,采用10%胎牛血清的高糖DMEM培养液,于37 ℃ 5% CO2培养箱中培养,待细胞贴壁长满瓶底,胰酶消化,计数后传代。接种于6孔板中,每孔接种约1.5×105个细胞,待细胞长满80%后,更换新鲜培养液,在培养液中加入50%胎牛血清,继续培养24~48 h至出现细胞内脂滴或泡沫样物沉积,即制成脂变肝细胞模型。将所得细胞改置于含0.1%胎牛血清的高糖DMEM培养液中,使其静止24 h后,再做相应的处理。
1.2.2.2 试验分组
细胞用六孔板培养,试验分为4个组,每组6个重复,具体分组情况如下。
正常对照组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换液,继续培养48 h后,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,加入100 μL的培养液培养24 h。
苜蓿皂苷组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h后换液,继续培养48 h后,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,加入100 μL的300 μg/mL苜蓿皂苷溶解液(终浓度为100 μg/mL)培养24 h。
脂变模型组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h,之后用含50%胎牛血清的高糖DMEM培养液继续培养48 h,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,加入100 μL的培养基培养24 h。
脂变皂苷组:六孔板每孔添加2.9 mL含10%胎牛血清的高糖DMEM培养液,培养24 h,之后用50%胎牛血清的高糖DMEM培养液继续培养48 h,置于含0.1%胎牛血清的高糖DMEM培养液中静止24 h,加入100 μL的300 μg/mL苜蓿皂苷溶解液(终浓度为100 μg/mL)培养24 h。
1.2.3 噻唑蓝(MTT)法测定苜蓿皂苷对BRL细胞活性的影响
测定步骤如下:1)胰酶消化对数期细胞,终止消化后离心收集,制成细胞悬液,细胞计数调整其浓度至2×104个/mL;2)将细胞悬液制备好后,轻轻混匀,96孔板每孔加入100 μL,这样待测细胞的密度为2 000个/孔(边缘孔用无菌磷酸盐缓冲液填充),每加6个孔混匀1次,以确保接种的细胞密度在各孔之间完全相同;3)将接种好的细胞培养板放入培养箱中培养,培养24 h后添加苜蓿皂苷50 μL,5个梯度,终浓度分别为0(对照)、50、100、200、250 μg/μL,每个浓度设6个复孔;4)5% CO237 ℃孵育24 h,倒置显微镜下观察药物的作用效果;5)每孔加入10 μL MTT溶液(5 mg/mL,即0.5% MTT),继续培养4 h;6)3 000 r/min离心5 min后,用移液器将上清移走,注意不能把结晶移走,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解;用酶标仪在490 nm波长处测量各孔的吸光度值。
1.3 基因mRNA表达量的测定
1.3.1 大鼠肝脏、细胞总RNA提取
总RNA提取步骤如下。1)匀浆的制备。肝脏:将样品置于用液氮预冷过的研钵中,用研磨棒敲碎大块组织。取30~50 mg肝脏组织,用力研磨至组织呈均匀的白色细粉末为止。将研磨好的组织粉末转移到加有Trizol的1 mL EP管。大鼠BRL细胞:吸去细胞培养皿中的上清液,每10 cm2培养皿面积加1 mL Trizol,枪头上下吹打几次,转移到EP管中。2)室温下静置孵育5 min,使组织或细胞完全溶解。3)加入200 μL三氯甲烷,盖好盖子。4)用手剧烈摇晃15 s。5)4 ℃ 12 000×g离心15 min,可见液体分为3层。6)45°倾斜离心管,移液枪吸取上层水相400 μL左右,移入新的离心管中,操作过程中应避免碰到中间相与有机相。7)每1 mL Trizol加入0.5 mL异丙醇,轻轻翻转摇匀。8)室温下孵育10 min。9)4 ℃ 12 000×g离心10 min。10)弃去上清液,只留下RNA沉淀。11)每1 mL Trizol加入1 mL 75%的乙醇,洗涤RNA沉淀。12)涡旋振荡数秒,4 ℃ 7 500×g离心5 min,弃去洗涤液。13)空气或真空干燥5~10 min,干燥不要太彻底,以免RNA难以溶解。14)将其重新溶于50 μL不含RNA酶的水中,用枪头轻轻吹打,55~60 ℃放置10~15 min使RNA完全溶解。15)总RNA保存于-80 ℃,以备后续试验使用。
1.3.2 总RNA浓度的测定
采用Thermo微量紫外分光光度计260 nm处测定总RNA浓度,并记录OD260 nm/OD280 nm,结果在1.8~2.0的样本满足要求。
1.3.3 总RNA的质量检测
用英国Syngene公司电泳凝胶成像系统检测电泳结果。
1.3.4 总RNA反转录
总RNA反转录采用大连宝生物工程公司提
供的Reverse Transcriptase M-MLV(RNase H-)试剂盒进行,得到cDNA。
1.3.5 引物设计与合成
根据GenBank大鼠甘油醛-3-磷酸脱氢酶(GAPDH)、ABCG5、ABCG8、LDLRDNA序列,运用Primer 5.0设计引物,引物序列及参数见表1。

表1 引物序列及参数
1.3.6 荧光定量PCR
本试验采用SYBR qPCR Mix为荧光染料,经过摸索确定最佳反应体系如下:SYBR qPCR Mix 5 μL, 焦碳酸二乙酯(DEPC)处理水3.8 μL,模版cDNA 1 μL,上、下游引物各0.1 μL,反应体系为10 μL。按照以下条件设定荧光定量PCR仪器,进行PCR:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,此步骤40个循环;溶解曲线,产物20 ℃保存10 min。采用2-△△Ct法进行相对定量分析。
1.4 数据统计分析
试验数据采用SPSS 13.0统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行组间多重比较,以P<0.05差异显著判断标准,结果用“平均值±标准差”表示。
2 结果与分析
2.1 苜蓿皂苷对大鼠血清指标的影响
由表2可知,与正常对照组比较,高脂模型组大鼠血清TG、TC以及LDL-C含量显著升高(P<0.05);苜蓿皂苷组大鼠血清TG、TC、HDL含量略有升高,但差异并没有统计学意义(P>0.05)。与高脂模型组相比,高脂皂苷组大鼠血清TG含量显著下降(P<0.05),下降幅度17.29%,血清TC含量显著下降(P<0.05),下降幅度为12.20%,血清HDL含量变化不显著(P>0.05),血清LDL-C含量显著下降(P<0.05),下降幅度为21.95%。
2.2 苜蓿皂苷对大鼠肝脏LDLR、ABCG5、ABCG8 mRNA表达量的影响
由表3可知,与正常对照组相比较,苜蓿皂苷组LDLR、ABCG5和ABCG8 mRNA表达量分别提高了31.11、6.77和7.26倍,且差异显著(P<0.05),高脂模型组和高脂皂苷组LDLRmRNA表达量分别提高了6.57、4.47倍,差异达到显著水平(P<0.05),ABCG5 mRNA表达量分别提高了2.32、4.37倍,差异达到显著水平(P<0.05),ABCG8 mRNA表达量分别提高了2.57、3.40倍,差异显著(P<0.05)。与高脂模型组相比较,高脂皂苷组LDLRmRNA表达量有所下降,但差异并不显著(P>0.05);ABCG5、ABCG8 mRNA表达量均有不同程度的提高,且差异显著(P<0.05)。

表2 苜蓿皂苷对大鼠血清指标的影响
同列数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same column with different small letter superscripts mean significant difference (P<0.05). The same as below.
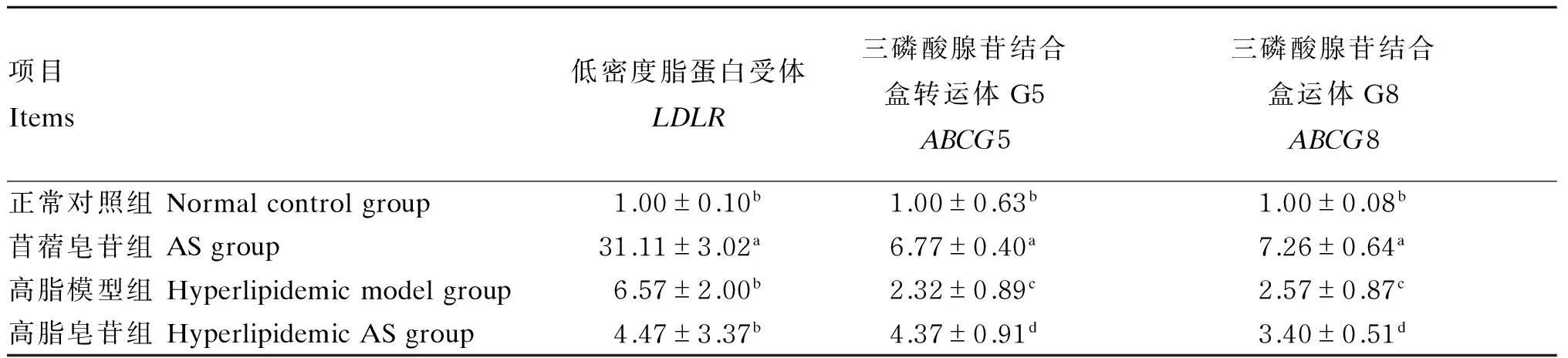
表3 苜蓿皂苷对大鼠肝脏LDLR、ABCG5、ABCG8 mRNA表达量的影响
2.3 苜蓿皂苷对BRL细胞活性的影响
由表4可知,苜蓿皂苷添加终浓度为50、100 μg/mL时,BRL细胞活性与对照组相比差异不显著(P>0.05),而200、250 μg/mL时BRL细胞活性升高,且与对照组相比差异显著(P<0.05)。

表4 苜蓿皂苷对BRL细胞活性的影响
2.4 苜蓿皂苷对BRL细胞LDLR、ABCG5、ABCG8 mRNA表达量的影响
由表5可知,与正常对照组相比较,苜蓿皂苷组LDLRmRNA表达量提高了3.35倍,且差异显著(P<0.05),ABCG5和ABCG8 mRNA表达量升高,分别为对照组的1.75、3.27倍,且差异达到显著水平(P<0.05);脂变细胞组LDLRmRNA表达量下降,但差异不显著(P>0.05),脂变皂苷组LDLRmRNA表达量略有上升,但差异不显著(P>0.05)。脂变细胞组和脂变皂苷组ABCG5、ABCG8 mRNA表达量差异不显著(P>0.05);与脂变细胞组相比较,脂变皂苷组LDLRmRNA表达量有所上升,但差异不显著(P>0.05);脂变皂苷组ABCG5、ABCG8 mRNA表达量均有不同程度的下降,且差异显著(P>0.05)。
3 讨 论
3.1 苜蓿皂苷对大鼠血清指标的影响
血脂是血液中所含各类脂质的总称,包括胆固醇、TG、磷脂(PL)和游离脂肪酸等。高脂血症是指由于脂肪代谢或运转异常使血浆中一种或多种脂质高于正常的现象。临床上把高脂血症分为以下3类:一是高胆固醇血症即TC含量增高;二是高甘油三酯血症即TG含量增高;三是混和型高脂血症即TC和TG含量均增高。故TC和TG含量是评定是否得高脂血症的重要指标[13]。高脂血症目前已经被广泛认为是导致动脉粥样硬化等心脑血管疾病形成的一个主要危险因子[14-15]。大量研究表明,苜蓿皂苷能够降低血脂水平,具有良好的抗动脉粥样硬化效应[16]。Yu等[17]的研究表明,苜蓿皂苷能够显著降低高脂小鼠血液中TC、TG和LDL-C含量。Malinow等[18]的研究表明,苜蓿皂苷能够降低血清TC的含量而不改变高密度脂蛋白的含量,增加胆汁酸和中性胆固醇的排泄。本试验结果表明,添加苜蓿皂苷后高脂皂苷组大鼠血清中TG、TC、LDL-C含量显著降低,与前人的研究结果一致。
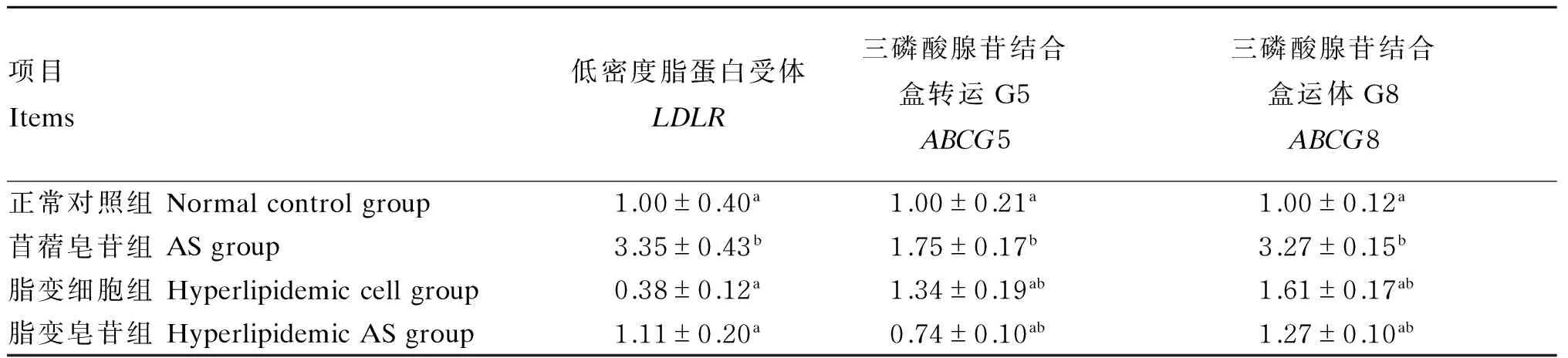
表5 苜蓿皂苷对BRL细胞LDLR、ABCG5、ABCG8 mRNA表达量的影响
3.2 苜蓿皂苷对BRL细胞活性的影响
苜蓿皂苷具有溶血作用,将皂苷水溶液注射入血液,低浓度时即可使红细胞破裂。一般认为溶血作用与皂苷和红细胞膜中胆固醇的相互作用有关。本试验用MTT法检测苜蓿皂苷对BRL细胞生长的影响,以确定苜蓿皂苷对这种细胞是否具有毒性,并确定细胞培养过程中苜蓿皂苷的添加量,为后续试验打下基础。本试验结果表明,苜蓿皂苷浓度在100 μg/mL以下时对BRL细胞的活性并无影响,故选取100 μg/mL作为细胞培养过程中苜蓿皂苷的添加量。
3.3 苜蓿皂苷对胆固醇清除和转运的影响
前人对植物皂苷降低胆固醇机理方面的研究主要集中在物理化学方面,即皂苷在肠道中和胆固醇结合形成不溶性的复合物,分子方面的研究很少且不系统。王先科等[19]的研究表明,苜蓿皂苷降低高脂血症大鼠胆固醇的作用可能与抑制大鼠乙酰辅酶A乙酰基转移酶2(ACAT-2)的转录和表达,降低胆固醇的吸收,促进胆固醇7-羟化酶(CYP7A1)的转录和表达,加速胆固醇向胆汁酸的转变有关。Yu等[17]研究了苜蓿皂苷对高脂血症大鼠胆固醇代谢的影响,发现脂蛋白脂酶(LPL)、肝脂酶(HTGL)的活性和mRNA的表达量均显著升高,从而推测苜蓿皂苷降低胆固醇的效应是由肝脏脂蛋白酯酶的活性升高引起的。本试验从动物个体和细胞2种水平上,研究了苜蓿皂苷对胆固醇清除和分泌途径中关键基因LDLR、ABCG5、ABCG8 mRNA表达量的影响,从分子水平探讨苜蓿皂苷调控胆固醇清除和转运,进而降低胆固醇的机理。
LDLR是位于细胞表面的跨膜受体,主要功能是参与低密度脂蛋白(LDL)的代谢过程,血浆中LDL携带的胆固醇主要是通过肝细胞LDLR清除,LDLR对LDL的吞噬与清除是LDL代谢过程中最关键的环节。LDLR途径在降低血清胆固醇的含量、调节低密度脂蛋白代谢和保持血液中胆固醇正常含量方面起着非常重要的作用[11]。血清中近2/3的LDL-C是通过这一内吞途径清除的,LDL-C被摄入量的多少取决于LDLR的数量和活性,因此LDLR对维持血浆中的LDL-C和胆固醇含量发挥着重要作用[20]。大量研究表明,植物活性成分能够通过调节LDLRmRNA的表达来调控机体内胆固醇的含量。罗艳等[21]研究表明,姜黄素能够显著降低血液中胆固醇的含量,其机理可能为姜黄素显著增加LDLR的数量和活性,从而起到降胆固醇的作用。窦晓兵[22]进一步研究了其机理,结果表明姜黄素可以通过激活胆固醇调节元件(SRE)促进LDLR的表达,或者是通过逆转受胰岛素诱导2(Insig2)抑制的胆固醇调节元件结合蛋白(SREBP)通路上调LDLR的表达。刘凯等[23]研究了大槐合剂对试验大鼠脏器摄取LDL和胆固醇排泄的影响,结果表明大槐合剂可以显著增强脏器对LDL的摄取,有效促进胆固醇自体内的排出。本试验结果表明,添加苜蓿皂苷后,正常和高脂水平大鼠肝脏LDLRmRNA的表达量均成倍增加;正常BRL细胞LDLRmRNA表达量上升,其结果与正常大鼠动物试验结果相近,而苜蓿皂苷对脂变BRL细胞LDLRmRNA表达量的影响不大。这说明苜蓿皂苷可通过调控LDLR mRNA表达量来加速正常肝细胞内胆固醇的吞噬与清除。
ABCG5和ABCG8是ABC超家族G亚家族的新成员[24],是胆固醇进入胆汁的关键蛋白质,它们的表达量增加后肝脏胆固醇转运增加,中性胆固醇排泄选择性增多以及胆固醇合成代偿性增加;阻断这对基因后血浆和肝脏胆固醇含量对于饮食胆固醇含量的应答明显增加。在肝脏内表达的ABCG5、ABCG8分子对胆汁胆固醇的转运具有决定作用。Yu等[25-26]研究发现,ABCG5、ABCG8基因敲除的小鼠中,胆汁胆固醇分泌急剧减少,而在ABCG5、ABCG8转基因鼠中胆汁酸胆固醇含量显著增多,粪便中性胆固醇含量也显著增多。本试验结果显示,添加苜蓿皂苷后,正常和高脂水平大鼠肝脏ABCG5、ABCG8 mRNA的表达量均成倍增加;正常BRL细胞ABCG5、ABCG8 mRNA表达量上升,其结果与正常大鼠动物试验结果相一致,而苜蓿皂苷对脂变BRL细胞ABCG5、ABCG8 mRNA表达量影响不大。这说明苜蓿皂苷可通过调控ABCG5、ABCG8 mRNA的表达来增加正常肝细胞内源性胆固醇的转运,从而减少胆固醇的含量。本试验中,苜蓿皂苷可显著影响高脂大鼠肝脏LDLR、ABCG5、ABCG8 mRNA的表达,但对脂变BRL细胞中各基因的表达无显著影响,推测苜蓿皂苷对高脂大鼠肝脏胆固醇清除和转运的调控可能是代偿性的而非直接作用,具体的作用机制还需进一步研究。
4 结 论
① 苜蓿皂苷显著降低了高脂血症大鼠血清中TG、TC以及LDL-C的含量。
② 添加苜蓿皂苷后,正常和高脂水平大鼠肝脏LDLR、ABCG5、ABCG8 mRNA的表达量均成倍增加;正常BRL细胞LDLR、ABCG5、ABCG8 mRNA表达量上升,而苜蓿皂苷对脂变BRL细胞各基因mRNA表达量的影响不大。这说明血脂水平影响大鼠体内胆固醇的代谢,因此研究苜蓿皂苷对胆固醇代谢的影响时应考虑血脂水平的差异。
[1] 盛漪,谷文英.植物甾醇调节血脂功能的研究[J].食品科技,2006,31(9):296-298.
[2] 吕亚青.丹参的化学成分及临床应用进展[J].中国药房,2007,18(12):947-948.
[3] 赵水平.大幅度降低胆固醇能更有效地防治冠心病[J].中华心血管病杂志,2006,33(12):1161-1163.
[4] 陈良华.降低胆固醇在冠心病防治中的作用[J].国外医学内科学分册,1997,24(7):291-294.
[5] JI W,GONG B Q.Hypolipidemic activity and mechanism of purified herbal extract ofSalviamiltiorrhizain hyperlipidemic rats[J].Journal of Ethnopharmacology,2008,119(2):291-298.
[6] DI DONNA L,DE LUCA G,MAZZOTTI F,et al.Statin-like principles of bergamot fruit (Citrusbergamia):isolation of 3-hydroxymethylglutaryl flavonoid glycosides[J].Journal of Natural Products,2009,72(7):1352-1354.
[7] 何春年,高微微,佟建明.苜蓿属植物的皂苷类化学成分[J].中国农学通报,2005,21(3):107-111.
[8] 王成章,王彦华,史莹华,等.苜蓿皂苷对断奶仔猪脂质代谢,抗氧化和免疫的影响[J].草业学报,2011,20(4):210-218.
[9] 王先科,史莹华,王成章,等.苜蓿皂苷对高脂血症大鼠胆固醇代谢及其相关基因表达的影响[J].动物营养学报,2012,24(5):983-990.
[10] BERGE K E,TIAN H,GRAF G A,et al.Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters[J].Science,2000,290(5497):1771-1775.
[11] 吴清和,邢燕红,荣向路,等.褐藻糖胶(FPS)对高脂血症大鼠肝脏LDL-RmRNA表达的影响[J].中药材,2007,30(8):968-970.
[12] 靳培英.皮肤病药物治疗学[M].2版.北京:人民卫生出版社,2009.
[13] 张若曦,苑望,伍晓雄,等.共轭亚油酸对高脂血症大鼠脂质代谢及visfatin基因表达水平的影响[J].中国实验动物学报,2009,17(6):452-456.
[14] MASSBERG S,BRAND K,GRÜNER S,et al.A critical role of platelet adhesion in the initiation of atherosclerotic lesion formation[J].The Journal of Experimental Medicine,2002,196(7):887-896.
[15] MORENO J J,TERESA MITJAVILA M.The degree of unsaturation of dietary fatty acids and the development of atherosclerosis (review)[J].The Journal of Nutritional Biochemistry,2003,14(4):182-195.
[16] KHALEEL A E,GAD M Z,EL-MARAGHY S A,et al.Study of hypocholesterolemic and antiatherosclerotic properties ofMedicagosativaL.cultivated in Egypt[J].Journal of Food and Drug Analysis,2005,13(3):212-218.
[17] YU C H,XIE G,HE R R,et al.Effects of a purified saponin mixture from alfalfa on plasma lipid metabolism in hyperlipidemic mice[J].Journal of Health Science,2011,57(5):401-405.
[18] MALINOW M R,MCNULTY W P,HOUGHTON D C,et al.Lack of toxicity of alfalfa saponins in cynomolgus macaques[J].Journal of Medical Primatology,1982,11(2):106-118.
[19] 王先科,史莹华,王成章,等.苜蓿皂甙对高脂血症大鼠胆固醇代谢及肝脏ACAT-2和HMG-CoAr基因表达的影响[J].草业学报,2012,21(3):287-293.
[20] HANNAH J S,YAMANE K,BERLIN E,et al.Invitroregulation of low-density lipoprotein receptor interaction by fatty acids[J].Metabolism,1995,44(11):1428-1434.
[21] 罗艳,范春雷,沃兴德,等.姜黄素对小鼠巨噬细胞LDL受体的影响[J].杭州师范学院学报:自然科学版,2005,4(6):420-422.
[22] 窦晓兵.姜黄素对肝细胞LDLR表达作用的分子机理研究[D].博士学位论文.北京:北京中医药大学,2007.
[23] 刘凯,李传富,李子行,等.大槐合剂对实验大鼠脏器摄取LDL和胆固醇排泄的影响[J].中国病理生理杂志,1994,10(3):288-292.
[24] HAZARD S E,PATEL S B.Sterolins ABCG5 and ABCG8:regulators of whole body dietary sterols[J].Pflügers Archiv:European Journal of Physiology,2007,453(5):745-752.
[25] YU L Q,LI-HAWKINS J,HAMMER R E,et al.Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol[J].The Journal of Clinical Investigation,2002,110(5):671-680.
[26] YU L Q,HAMMER R E,LI-HAWKINS J,et al.Disruption of Abcg5 and Abcg8 in mice reveals their crucial role in biliary cholesterol secretion[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(25):16237-16242.
*Corresponding author, professor, E-mail: annysyh@126.com
(责任编辑 王智航)
Effects of Alfalfa Saponins on mRNA Expressions of Low-Density Lipoprotein Receptor and Adenosine Triphosphate Binding Cassette Transporters in Liver and Liver Cells of Rats
LIU Boshuai WANG Wenjing CHEN Yanyan ZHU Xiaoyan YUAN Dedi QI Shengli WANG Chengzhang SHI Yinghua*
(CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
This experiment was conducted to investigate the effects of alfalfa saponins (AS) on mRNA expressions of low-density lipoprotein receptor (LDLR), adenosine triphosphate binding cassette transporter G5 (ABCG5) and adenosine triphosphate binding cassette transporter G8 (ABCG8) in liver and liver cells of rats, and discuss the mechanism of AS regulating cholesterol elimination and transportation at both individual and cellular levels. Hyperlipidemic rat model was set up using high fat diet, and the effects of AS on serum indexes [total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C) and high-density lipoprotein cholesterol (HDL-C) contents] and liverLDLR,ABCG5 andABCG8 mRNA expressions of normal and hyperlipidemic rats were determined; hyperlipidemic cell model was set up using high DMEM culture medium, the effects of AS concentration on BRL cell activity, and AS onLDLR,ABCG5 andABCG8 mRNA expressions of normal and hyperlipidemic cells were determined. The results showed as follows: 1) AS significantly decreased the contents of triglyceride, total chelesterol and low-density lipoprotein cholesterol in serum of hyperlipidemic rats (P<0.05); 2) AS significantly up-regulated mRNA expressions ofLDLR,ABCG5 andABCG8 in liver of normal rats and those of ABCG5 and ABCG8 in liver of hyperlipidemic rats (P<0.05); 3) the supplementation of 200 and 250 μg/mL AS increased BRL cell activity (P<0.05); 4) AS significantly up-regulated mRNA expressions ofLDLR,ABCG5 andABCG8 of normal BRL cells (P<0.05), however, AS had no significant effects on those of hyperlipidemic BRL cells. The results indicate that AS may accelerate the elimination and transportation of cholesterol by up-regulating mRNA expressions ofLDLR,ABCG5 andABCG8, and then reduce the content of cholesterol in body.[ChineseJournalofAnimalNutrition, 2017, 29(4):1437-1445]
alfalfa saponins; rat; BRL cell; low-density lipoprotein receptor; adenosine triphosphate binding cassette transporter G5; adenosine triphosphate binding cassette transporter G8; mRNA expression
10.3969/j.issn.1006-267x.2017.04.043
2016-09-08
国家自然科学基金(31301983);现代农业产业技术体系(CARS-35);河南农业大学科技创新基金(30600968)
刘伯帅(1993—),男,河南新乡人,硕士研究生,从事牧草营养与利用研究。E-mail: 1339712268@qq.com
*通信作者:史莹华,教授,硕士生导师,E-mail: annysyh@126.com
S816.7
A
1006-267X(2017)04-1437-09
