饲料脂肪水平对黄姑鱼幼鱼生长性能、肌肉组成和血浆生化指标的影响
2017-04-24王秋荣谢仰杰王志勇陈庆凯
叶 坤 王秋荣 谢仰杰 王志勇* 陈庆凯
(1.集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门361021;2.福建省宁德市水产技术推广站,宁德352000)
饲料脂肪水平对黄姑鱼幼鱼生长性能、肌肉组成和血浆生化指标的影响
叶 坤1王秋荣1谢仰杰1王志勇1*陈庆凯2
(1.集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门361021;2.福建省宁德市水产技术推广站,宁德352000)
本研究以鱼油为主要脂肪源,配制脂肪水平分别为4.07%(L4组)、7.04%(L7组)、10.05%(L10组)和12.97%(L13组)的4种等氮配合饲料,并将1 200尾初始平均体重为(41.7±3.1) g的黄姑鱼幼鱼分成4组,进行为期8周的饲养试验,探讨饲料脂肪水平对黄姑鱼幼鱼生长性能、肌肉组成和血浆生化指标的影响。每组设3个重复,每个重复放养100尾鱼。结果表明:L4和L7组黄姑鱼幼鱼的终末均重、终末均体长、增重率、成活率、饲料效率、蛋白质效率、肥满度和脏体比均显著高于L10和L13组(P<0.05);L7组黄姑鱼幼鱼的特定生长率和肝体比显著高于L10和L13组(P<0.05),但L7和L4组之间差异不显著(P>0.05);L4、L7和L10组黄姑鱼幼鱼的肌肉粗蛋白质含量显著高于L13组(P<0.05),L4、L7和L10组之间差异不显著(P>0.05);L4组黄姑鱼幼鱼的肌肉粗脂肪含量显著低于L7、L10和L13组(P<0.05),L7、L10和L13组之间差异不显著(P>0.05);L7组黄姑鱼幼鱼的肌肉粗灰分含量显著低于L4、L10和L13组(P<0.05),L4、L10和L13组之间差异不显著(P>0.05);L4和L7组黄姑鱼幼鱼的血浆中总蛋白、白蛋白、球蛋白、甘油三酯、高密度脂蛋白和低密度脂蛋白含量显著高于L10和L13组(P<0.05),而葡萄糖和胆固醇含量以及乳酸脱氢酶、谷丙转氨酶、谷草转氨酶和碱性磷酸酶活性则显著低于L10和L13组(P<0.05)。综合以上试验结果,在本试验条件下,黄姑鱼幼鱼饲料中适宜的脂肪水平为7.04%。
黄姑鱼幼鱼;饲料脂肪水平;生长性能;肌肉组成;血浆生化指标
黄姑鱼(NibeaalbifloraRichardson)在分类上隶属于硬骨鱼纲(Osteichthyes),鲈形目(Perciformes),石首鱼科(Sciaenidae),黄姑鱼属(Nibea),主要分布于朝鲜半岛、日本南部海域以及中国沿海,为暖温性近海中下层鱼类,是我国重要经济鱼类[1-3]。黄姑鱼肉味鲜美、营养丰富,其鳔是中药补品,长期以来都是人们餐桌上的上品菜肴。黄姑鱼不易患刺激隐核虫引发的白点病,养殖后期存活率高,受到广大养殖业者的青睐,成为福建、浙江近年发展较快的新兴养殖种类之一。国内已有许多科研工作者对黄姑鱼的繁殖生物学[4-10]、人工养殖技术[11-14]、病害[15-18]等方面进行了较为深入的研究,为黄姑鱼产业的发展奠定了重要的基础。但有关黄姑鱼营养需求方面的研究[19-21]还很少,目前市场上尚未有黄姑鱼的专用配合饲料,大多养殖户仍采用冰鲜杂鱼以及其他海水鱼配合饲料喂养黄姑鱼,冰鲜杂鱼的质量参差不齐及其带来的养殖水域污染致使黄姑鱼病害频发,而市售海水鱼配合饲料也因存在营养配比不能满足黄姑鱼营养需求造成其生长缓慢、饲料成本偏高等问题而不被养殖业者所接受。因此,研制和开发高效环保的黄姑鱼配合饲料,是黄姑鱼养殖产业化发展的迫切需要。
脂肪是鱼类组织细胞的重要组成成分,并提供机体所需能量及必需脂肪酸,也是脂溶性维生素和某些激素的溶解介质等[22-24],在水产动物的生长和繁殖过程中起着至关重要的作用,是水产动物配合饲料研制中需要考虑的重要指标之一,配合饲料中脂肪水平过高或者过低都会影响鱼体生长及健康。因此,在配合饲料中提供适宜水平的脂肪至关重要。
本研究采用单因素试验设计,研究饲料中不同脂肪水平对黄姑鱼幼鱼生长性能、肌肉组成及血浆生化指标的影响,为黄姑鱼的健康养殖及其配合饲料中脂肪的合理添加提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验鱼
试验鱼由宁德市横屿岛水产有限公司提供,初步挑选均重约为40 g的黄姑鱼幼鱼1 500余尾,在室内10 m3的水泥池中暂养1周后开始试验。
1.1.2 试验饲料
以酪蛋白、白鱼粉为主要蛋白质源,鱼油为脂肪源,根据预试验结果设置试验饲料的蛋白质水平为40%,配制脂肪水平分别为4%(L4)、7%(L7)、10%(L10)和13%(L13)的等氮配合饲料,实测脂肪水平分别为4.07%、7.04%、10.05%和12.97%。试验饲料组成及营养水平如表1所示。饲料原料经粉碎后过60目筛,按照饲料配方的比例称重后放置于搅拌机中搅拌均匀,搅拌过程中加入适量的水混合成团状,用绞肉机把团状饲料绞成条状(长度为5~8 mm,粒径为3 mm),饲料规格大小根据黄姑鱼幼鱼的不同生长阶段进行调节。制备好的饲料放在4 ℃冰箱保存,每次投喂前0.5 h将饲料取出放在室温下待恢复常温后再投喂。
1.2 试验方法
1.2.1 试验设计
经室内暂养1周后,选取规格相近、健康无病的初始平均体重为(41.7±3.1) g的黄姑鱼幼鱼1 200尾,随机分为4组,每组3个重复,每个重复放养100尾鱼,饲养于规格为2 m×1 m×1 m的水泥池中。各组试验鱼分别投喂脂肪水平为4.07%(L4组)、7.04%(L7组)、10.05%(L10组)和12.97%(L13组)的4种等氮配合饲料。养殖池水位为0.8 m,增氧方式为散气石打气增氧,饲养时间为8周。
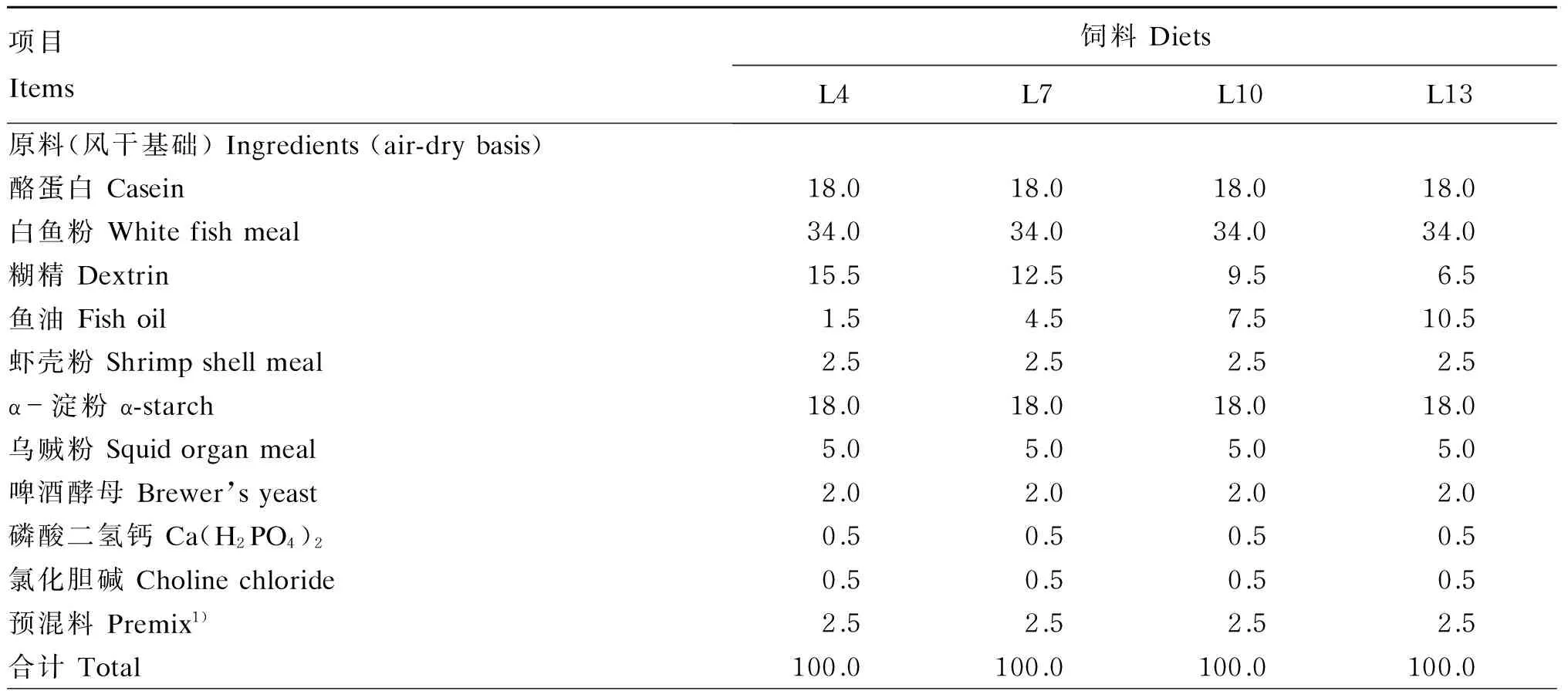
表1 试验饲料组成及营养水平

续表1项目Items饲料DietsL4L7L10L13营养水平(干物质基础)Nutrientlevels(DMbasis)2)粗蛋白质Crudeprotein40.0140.0539.9639.92粗脂肪Crudelipid4.077.0410.0512.97粗灰分Ash3.953.843.763.81总能Grossenergy/(MJ/kg)14.2114.8415.4716.10
1)每千克预混料中含有One kilogram of premix contained the following:VA 60 000 IU,VD320 000 IU,VE 5 000 IU,VB1120 mg,VB2200 mg,VB6200 mg,VB122 mg,VK330 mg,VC 7 000 mg,烟酸 niacin acid 500 mg,泛酸 pantothenic acid 800 mg,叶酸 folic acid 100 mg,胆碱 choline 10 000 mg,生物素 biotin 7.5 mg,Fe 2 000 mg,Cu 500 mg,Mn 400 mg,Zn 1 500 mg,I 15 mg,Se 5 mg,Co 7.5 mg。
2)总能根据粗蛋白质、粗脂肪和碳水化合物的能值(分别为17.0、39.0和17.0 MJ/kg)计算得出,其余营养水平为实测值。Gross energy was calculated based on the fuel values of 17.0, 39.0 and 17.0 MJ/kg for crude protein, crude lipid and carbohydrate, respectively, while the other nutrient levels were measured values.
1.2.2 养殖管理
试验鱼日投喂3次(08:00、13:00和18:00),日投喂量为鱼体重的3%~6%,日投喂量根据天气情况及试验鱼摄食情况、健康状况进行适当的调整。每次投喂0.5 h后迅速吸取残饵并冷冻干燥、称重,以用于摄食率的计算;上午和傍晚投喂后进行吸污换水,日换水量为100%。每天检查记录黄姑鱼幼鱼的摄食情况、健康状况和死亡情况并及时清理死亡个体,防止水质变坏。试验期间养殖用水为经过沙滤的自然海水,水温为(27±2) ℃、pH为8.0±0.5、盐度为27‰~29‰、溶解氧浓度>5 mg/L、氨氮浓度<0.05 mg/L、亚硝酸盐浓度<0.05 mg/L。
1.3 样品的采集
1.3.1 饲料样品
采取“四分法”从各试验组饲料中采集50 g作为样品,放入自封袋中,置于-20 ℃冰箱保存待测。
1.3.2 试验鱼样品
试验结束前停食24 h,对每个养殖池试验鱼进行计数和称重,然后测量每尾鱼体重和体长。随后,每池随机取5尾鱼用丁香酚麻醉后进行尾静脉采血,抽取的血液注入预备好的含1%肝素钠的2 mL离心管中,制备成抗凝血,用台式离心机4 000 r/min离心10 min,取上清液放入-4 ℃冰箱冷藏备用;取血后的试验鱼解剖取出内脏包括肝脏并称重,以计算肝体比和脏体比;之后取肌肉放入自封袋中,置于-80 ℃冰箱中保存用于营养成分测定。
1.4 生长指标及其计算公式
增重率(weight gain rate,WGR,%)=
100×(Wt-W0)/W0;
特定生长率(specific growth rate,SGR,%/d)=
100×(lnWt-lnW0)/t;
饲料效率(feed efficiency,FE,%)=100×
(Wt-W0)/Wd;
蛋白质效率(protein efficiency ratio,PER,%)=
100×(Wt-W0)/Wp;
成活率(survival rate,SR,%)=
100×Nf/Ni;
肥满度(condition factor,CF,%)=
100×Wb/L3;
肝体比(hepatosomatic index,HSI,%)=
100×Wh/Wb;
脏体比(viserosomatic index,VSI,%)=
100×We/Wb。
式中:Wt为终末体重(g);W0为初始体重(g);t为饲喂天数(d);Wb为每尾鱼体重(g);Wd为摄食饲料总量(g);Wp为摄入蛋白质总量(g);L为每尾鱼体长(cm);Wh为肝脏重量(g);Ni为初始鱼尾数;Nf为终末鱼尾数;We为内脏团重(g)。
1.5 样品检测
1.5.1 营养成分测定
粗蛋白质含量采用全自动凯氏定氮仪(FOSS KT260,瑞士)测定;粗脂肪含量采用索氏抽提仪(FOSS Soxtec-2055,瑞典)测定;水分含量采用105 ℃烘箱干燥法测定;粗灰分含量采用马福炉550 ℃灼烧法测定。
1.5.2 血浆生化指标测定
将血浆解冻后3 000 r/min离心10 min除去凝胶状物,用全自动生化分析仪(Selectra XL,荷兰)进行血浆生化指标测定,主要检测指标有总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、葡萄糖(GLU)、钠离子(Na+)、钾离子(K+)、氯离子(Cl-)、钙离子(Ca2+)、甘油三酯(TG)、胆固醇(CHOL)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和乳酸脱氢酶(LDH)。
1.6 数据分析
试验数据用平均值±标准差(mean±SD)表示,采用SPSS 13.0统计软件的ANOVA程序进行方差分析,如差异显著(P<0.05),则用Tukey’s检验法进行多重比较。
2 结 果
2.1 饲料脂肪水平对黄姑鱼幼鱼生长性能的影响
由表2可知,L4和L7组黄姑鱼幼鱼的终末均重、终末均体长、成活率、饲料效率、肥满度均显著高于L10和L13组(P<0.05),L4和L7组之间差异不显著(P>0.05),但L7组略高于L4组;L7组黄姑鱼幼鱼的特定生长率和肝体比显著高于L10和L13组(P<0.05),L7和L4组之间差异不显著(P>0.05),但L7组略高于L4组;L7组黄姑鱼幼鱼的蛋白质效率和脏体比显著高于其他试验组(P<0.05),同时L4组黄姑鱼幼鱼的蛋白质效率和脏体比显著高于L10和L13组(P<0.05)。

表2 饲料脂肪水平对黄姑鱼幼鱼生长性能的影响
同行数据肩标不同小写字母表示显著差异(P<0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 饲料脂肪水平对黄姑鱼幼鱼肌肉组成的影响
由表3可知,L4、L7和L10组黄姑鱼幼鱼的肌肉粗蛋白质含量显著高于L13组(P<0.05),L4、L7和L10组之间差异不显著(P>0.05),但L7组略高于L4和L7组;L4组黄姑鱼幼鱼的肌肉粗脂肪含量显著低于L7、L10和L13组(P<0.05),L7、L10和L13组之间差异不显著(P>0.05);L7组黄姑鱼幼鱼的肌肉粗灰分含量显著低于其他试验组(P<0.05),其他3个试验组之间差异不显著(P>0.05)。各试验组黄姑鱼幼鱼肌肉水分含量差异不显著(P>0.05)。
2.3 饲料脂肪水平对黄姑鱼幼鱼血浆生化指标的影响
由表4可知,随着饲料脂肪水平的升高,各试验组黄姑鱼幼鱼血浆中TP、ALB、GLB、TG、CHOL、HDL和LDL的含量均呈现逐渐降低的趋势,而GLU的含量以及LDH、ALT、AST和ALP的活性均呈现逐渐上升的趋势。L4和L7组黄姑鱼幼鱼血浆中TP、ALB、GLB和TG含量显著高于L10和L13组(P<0.05),而GLU和CHOL的含量以及LDH、ALT、AST和ALP的活性则显著低于L10和L13组(P<0.05)。L4组黄姑鱼幼鱼血浆中HDL和LDL含量显著高于L10和L13组(P<0.05)。各试验组黄姑鱼幼鱼血浆中Na+、K+、Cl-和Ca2+含量差异不显著(P>0.05)。
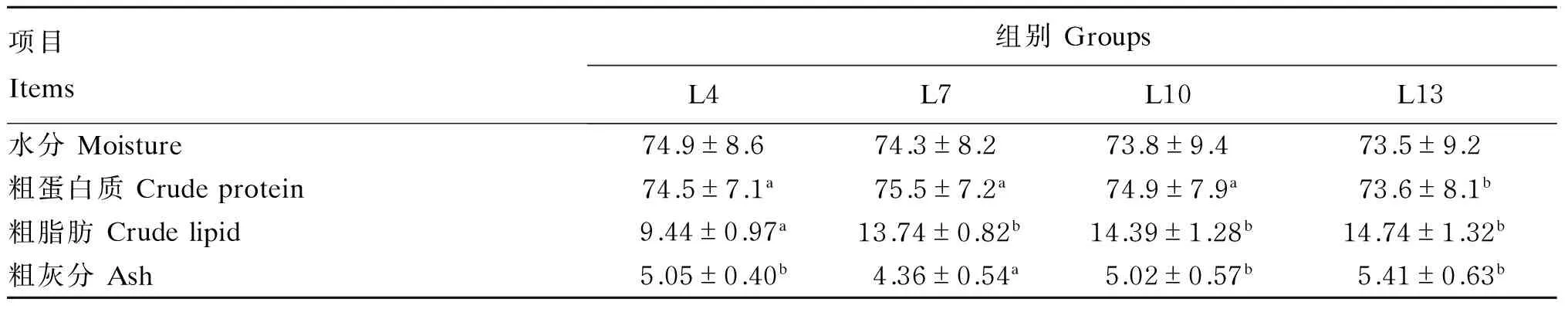
表3 饲料脂肪水平对黄姑鱼幼鱼肌肉组成的影响(干物质基础)

表4 饲料脂肪水平对黄姑鱼幼鱼血浆生化指标的影响
3 讨 论
3.1 饲料脂肪水平对黄姑鱼幼鱼生长性能的影响
脂肪作为鱼类生命活动的重要能源物质,在其生长、发育过程中不可或缺,饲料中适宜的脂肪水平能够加快鱼类的生长速度、提高饲料利用率、节约蛋白质等,过高或者过低的脂肪水平都会影响鱼类的生长[25]。本研究的结果表明,在一定程度上提高饲料中脂肪的水平(在本研究中饲料脂肪水平从4.07%升高到7.04%),可以显著地促进黄姑鱼幼鱼的生长,提高饲料效率,降低氮排泄率,表现出“蛋白质节约作用”[26];但脂肪水平过高则黄姑鱼幼鱼的生长速度和饲料效率显著下降,本研究中L10和L13组的主要生长指标和饲料效率均显著低于L7和/或L4组,试验过程中L10和L13组的黄姑鱼幼鱼表现为摄食少、游动少、体色偏黑、消瘦等特征,与患脂肪肝病的虹鳟(Oneothynchusmykiss)[27]、美国红鱼(Sciaenopsocellatus)[28]、奥尼罗非鱼(Oreochromisniloticus×O.aureus)[29]等出现的症状非常相似,而且成活率显著下降,显示该2组黄姑鱼幼鱼可能罹患了脂肪肝,健康状况和生活力严重受损,而L7和L4组的成活率则较高。Yi等[30]在研究同为石首鱼科的大黄鱼(Larimichthyscroceus)时发现高脂饲料可以促进大黄鱼幼鱼(体重10 g)的生长,大黄鱼幼鱼饲料中适宜的脂肪水平为11.7%;Huang等[31]研究表明,浅色黄姑鱼饲料中适宜的脂肪水平为12.9%。这些结果的不同可能与试验鱼的种类、规格、饲料原料组成、养殖环境等不同有较大的关系。本试验采用蛋白质水平为40%的饲料,是因为笔者预试验得出黄姑鱼幼鱼对蛋白质的适宜需要量在40%左右,这与邱金海等[32]的研究结果相似,而与鲁琼等[21]的研究结果有较大的差异,这可能与不同试验所用的黄姑鱼规格、养殖密度、环境条件等不同有关。本研究在所给定的饲料蛋白质水平下,初步确定黄姑鱼幼鱼饲料中适宜的脂肪水平为7.04%。
3.2 饲料脂肪水平对黄姑鱼幼鱼肌肉组成的影响
评价鱼类肌肉营养价值和质量的常用指标是蛋白质和脂肪含量[33]。一般认为,饲料中的脂肪在肠道经脂肪酶等作用被分解为脂肪酸,一部分直接经血液进入不同组织,另一部分经肝门静脉进入肝脏重新合成脂类物质后被运送到肌肉等组织中积累。当饲料中脂肪水平过高时,肝脏中脂类物质的合成量增加,被转运到各组织中的脂肪量也随之增加。而肝脏的运送能力有限,当饲料中脂肪水平过高时,过多的脂肪无法被及时运出,就会使鱼体脂肪含量升高并造成能量过剩,致使饲料中营养利用率下降,影响了肌肉等其他组织中蛋白质的吸收和沉积[25]。
根据本研究的结果,L4、L7、L10组黄姑鱼幼鱼肌肉粗蛋白质含量差异不显著,但在脂肪水平升高到12.97%时饲养8周后,黄姑鱼肌肉粗蛋白质含量则较上述3组显著降低,结合其蛋白质效率也显著低于L4、L7和L10组,说明饲料脂肪水平过高不利于饲料蛋白质的转化和鱼体中蛋白质的沉积;随着饲料脂肪水平的升高,黄姑鱼幼鱼的肌肉粗脂肪含量也随着增加,即饲料中过量的脂肪被沉积在鱼体内,但饲料中脂肪达到一定水平后(10.04%以上),黄姑鱼幼鱼肌肉粗脂肪含量趋于稳定,这与Peres等[34]对欧洲鲈(Dicentrarchuslabrax)的研究结果相一致。
3.3 饲料脂肪水平对黄姑鱼幼鱼血浆生化指标的影响
血液生化指标反映了鱼类的生理代谢状况,并与其营养状况密切相关。血液中TP和ALP含量是机体蛋白质吸收和代谢的重要指标,GLU含量的变化反映鱼体对糖类的吸收、运转和代谢情况,甘油三酯(TG)在鱼体产生和储存能量,CHO参与形成细胞膜、合成胆汁酸、维生素D以及甾体激素的原料[25]。本研究发现,黄姑鱼幼鱼血浆中TP、ALB、GLB、TG和CHOL的含量随着饲料脂肪水平的升高而逐渐降低,当脂肪水平达到10.05%时显著下降,原因可能是消化脂肪的胆汁分泌异常或肝功能障碍所致,导致TG转运出肝脏受到阻碍,血液中TG含量迅速减少。这说明高脂肪水平的饲料可能造成肝功能受损或肝细胞破坏,致使黄姑鱼幼鱼机体生理代谢产生不利状况,与王菊华等[35]、施兆鸿等[36]的研究结果是相似的。但是王爱民等[37]、Kjaer等[38]以及董晓慧等[39]的研究显示,血清中CHOL含量与饲料脂肪水平呈现正相关,与本文研究结果不一致。也有研究表明,即使饲料脂肪水平适于鱼类生长,甚至更低,鱼类仍有患脂肪肝的可能性,这可能与饲料能量、蛋白质水平及磷脂含量有关[40-41],相关机制有待进一步的研究和分析。
本研究中,黄姑鱼幼鱼血浆中ALT和AST活性随着饲料脂肪水平的升高而不断升高,各组之间的差异均达到显著水平。ALT和AST参与机体内转氨基作用,主要分布在骨骼肌、肝脏、肾脏等组织中,其活性的高低与肝细胞的炎症、变性和坏死等密切相关,是反映肝细胞受损的主要敏感指标[42],其在正常情况下只有少量进入血液中,当上述组织细胞受损引起细胞膜通透性增加时,致使渗透压调节能力和物质主动转运机制削弱以致消失,甚至细胞解体,这些组织细胞中的ALT和AST进入血液中,使血液中这2种酶的活性升高[43-44]。HDL和LDL负责脂肪的代谢,当机体肝功能异常或发生病变时,血液中HDL和LDL的含量会显著下降。本研究中,随着饲料脂肪水平的升高,黄姑鱼幼鱼血浆中HDL和LDL的含量逐渐降低,这可能是由于饲料脂肪水平超过一定范围后造成鱼体病变所致[29]。ALP与机体营养免疫相关,机体在正常状况下ALP的活性很低,当肝脏等组织发生病变时,ALP的活性会显著升高;LDH是机体无氧代谢的标志酶,当机体组织受到损伤时,细胞内的LDH就会大量逸出,导致血液中该酶的活性迅速上升[45]。本研究中,黄姑鱼幼鱼血浆中HDL、LDL的含量以及ALT、AST、ALP、LDH的活性在饲料脂肪水平达到12.97%时均显著升高,说明过高的脂肪水平可能造成黄姑鱼幼鱼肝脏等组织细胞受损,致使肝脏等组织中的一些物质大量逸出至血液中,从而导致血液中ALT、AST、LDH、ALP的活性显著升高。饲料脂肪水平的变化对黄姑鱼幼鱼血浆中Na+、K+、Cl-和Ca2+含量的影响不大。
4 结 论
在本研究条件下,当脂肪水平超过7.04%时,黄姑鱼幼鱼的生长性能、蛋白质效率及饲料效率下降,血浆中肝功能敏感指标ALT和AST的活性上升,综合以上指标得出黄姑鱼幼鱼饲料中适宜的脂肪水平为7.04%。
[1] 朱元鼎,罗云林,伍汉霖.中国石首鱼类分类系统的研究和新属新种的叙述[M].上海:上海科学技术出版社,1963:47-57.
[2] 朱元鼎,张春霖,成庆泰.东海鱼类志[M].北京:科学出版社,2005:277-278.
[3] 倪勇,伍汉霖.江苏鱼类志[M].北京:中国农业出版社,2006:543.
[4] 雷霁霖,樊宁臣,郑澄伟.黄姑鱼(NibeaalbifloraRichardson)胚胎及仔、稚鱼形态特征的初步观察[J].海洋水产研究,1981(2):77-84.
[5] 陈超,徐延康,雷霁霖.黄姑鱼人工育苗初步试验[J].水产科学,1989,8(1):7-11.
[6] 雷霁霖,陈超,徐延康,等.黄姑鱼工厂化育苗技术研究[J].海洋科学,1992(6):5-10.
[7] 孙忠,余方平,程国宝.舟山近海黄姑鱼室内全人工育苗技术研究[J].浙江海洋学院学报:自然科学版,2005,24(1):27-30,47.
[8] 楼宝,史会来,毛国民,等.黄姑鱼全人工繁育及大规格苗种培育技术研究[J].现代渔业信息,2011,26(3):20-23.
[9] 林楠,姜亚洲,袁兴伟,等.象山港黄姑鱼的繁殖生物学[J].海洋渔业,2013,35(4):389-395.
[10] 杨育凯,谢仰杰,蔡明夷,等.黄姑鱼雌核发育诱导及鉴定[J].水产学报,2013,37(9):1297-1303.
[11] 蔡厚才,林岿璇,陈传再.南麂海区黄姑鱼网箱养殖技术研究[J].浙江海洋学院学报:自然科学版,2001,20(1):66-69.
[12] 吴常文,赵淑江,胡春春.东海黄姑鱼年龄与生长的初步研究[J].海洋渔业,2005,27(3):193-199.
[13] 刘巧灵.黄姑鱼Nibeaalbiflora(Richardson)苗种网箱暂养技术研究[J].现代渔业信息,2009,24(1):20-22.
[14] 徐冬冬,詹炜,楼宝,等.网箱养殖黄姑鱼生长特性初步研究[J].渔业现代化,2010,37(5):34-37.
[15] 马爱敏,闫茂仓,常维山,等.黄姑鱼创伤弧菌的分离和鉴定[J].中国人兽共患病学报,2008,24(10):960-964.
[16] 闫茂仓,单乐州,陈少波,等.黄姑鱼淀粉卵涡鞭虫病的防治[J].水产科技情报,2009,36(2):63-64.
[17] 吕纪增.黄姑鱼五种常见病害的防治[J].齐鲁渔业,2006,23(6):46-47.
[18] 张赛乐,闫茂仓,陈少波,等.枯草芽孢杆菌对黄姑鱼免疫机能的影响[J].科技通报,2012,28(11):61-65,129.
[19] 金煜华,谢中国,楼宝,等.黄姑鱼仔稚鱼发育过程中氨基酸和脂肪酸的变化[J].浙江海洋学院学报:自然科学版,2014,33(1):53-58.
[20] 谢中国,王芙蓉,罗玉双,等.不同壁材微胶囊饲料对黄姑鱼稚鱼生长和消化酶活力的影响[J].水生生物学报,2015,39(1):52-57.
[21] 鲁琼,王立改,楼宝,等.饲料蛋白质水平对黄姑鱼幼鱼生长性能、体组成和消化酶活性的影响[J].动物营养学报,2015,27(12):3763-3771.
[22] WATANABE T.Lipid nutrition in fish[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1982,73(1):3-15.
[23] BROMLEY P J.Effect of dietary protein,lipid and energy content on the growth of turbot (ScophthalmusmaximusL.)[J].Aquaculture,1980,19(4):359-369.
[24] VERGARA J M,LPEZ-CALERO G,ROBAINA L,et al.Growth,feed utilization and body lipid content of gilthead seabream (Sparusaurata) fed increasing lipid levels and fish meals of different quality[J].Aquaculture,1999,179(1/2/3/4):35-44.
[25] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996.
[26] SARGENT J R,TOCHER D R,BELL J B.The lipids[M]//HALVER J E,HARDY R W.Fish nutrition.3rd ed.San Diego:Academic Press,2002:181-246.
[27] 娄忠玉.虹鳟脂肪肝病的病因、病理及防治[J].鱼类病害研究,2000,22(4):24-25.
[28] 蒋步国.饲料中不同蛋白质和脂肪水平对美国红鱼脂肪肝病的研究[J].科学养鱼,2015,31(12):68-69.
[29] 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海海洋大学学报,2009,18(1):35-41.
[30] YI X W,ZHANG F,XU W,et al.Effects of dietary lipid content on growth,body composition and pigmentation of large yellow croakerLarimichthyscroceus[J].Aquaculture,2014,434:355-361.
[31] HUANG Y S,WEN X B,LI S K,et al.Effects of dietary lipid levels on growth,feed utilization,body composition,fatty acid profiles and antioxidant parameters of juvenile chu’s croakerNibeacoibor[J].Aquaculture International,2016,24(5):1229-1245.
[32] 邱金海,杨清山,林星.饲料中不同的蛋白质水平对黄姑鱼生长性能的影响[J].现代农业科技,2016(8):235-237,246.
[33] 黄钧,杨凇,覃志彪,等.云斑鮰、泥鳅和瓦氏黄颡鱼的含肉率及营养价值比较研究[J].水生生物学报,2010,34(5):990-997.
[34] PERES H,OLIVA-TELES A.Effect of dietary lipid level on growth performance and feed utilization by European sea bass juveniles (Dicentrarchuslabrax)[J].Aquaculture,1999,179(1/2/3/4):325-334.
[35] 王菊华,薛敏,丁建中,等.鱼类营养性脂肪肝的研究进展[J].饲料工业,2008,29(4):34-37.
[36] 施兆鸿,岳彦峰,彭士明,等.饲料脂肪水平对褐菖鲉血清生化指标、免疫及抗氧化酶活力的影响[J].中国水产科学,2013,20(1):101-107.
[37] 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J].水生生物学报,2011,35(1):80-87.
[38] KJAER M A,VEGUSDAL A,BERGE G M,et al.Characterisation of lipid transport in Atlantic cod (Gadusmorhua) when fasted and fed high or low fat diets[J].Aquaculture,2009,288(3/4):325-336.
[39] 董晓慧,杨俊江,谭北平,等.幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量[J].动物营养学报,2015,27(1):133-146.
[40] 冯健,贾刚.饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究[J].水生生物学报,2005,29(1):61-64.
[41] DU Z Y,LIU Y J,TIAN L X,et al.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp (Ctenopharyngodonidella)[J].Aquaculture Nutrition,2005,11(2):139-146.
[42] 康格菲.临床生物化学[M].北京:人民卫生出版,1989:73-96.
[43] 向枭,周兴华,陈建,等.饲料中豆粕蛋白替代鱼粉蛋白对齐口裂腹鱼幼鱼生长性能、体成分及血液生化指标的影响[J].水产学报,2012,36(5):723-731.
[44] 惠天朝,施明华,朱荫湄.硒对罗非鱼慢性镉中毒肝抗氧化酶及转氨酶的影响[J].中国兽医学报,2000,20(3):264-266.
[45] 周玉香,吕玉玲,王洁,等.血液生化指标在动物生产与营养调控研究中的应用概况[J].畜牧与饲料科学,2012,33(5/6):72-74.
*Corresponding author, professor, E-mail: zywang@jmu.edu.cn
(责任编辑 菅景颖)
Effects of Dietary Lipid Level on Growth Performance, Muscle Composition and Plasma Biochemical Indices of JuvenileNibeaalbiflora
YE Kun1WANG Qiurong1XIE Yangjie1WANG Zhiyong1*CHEN Qingkai2
(1.KeyLaboratoryofHealthyMaricultrueforEastChinaSea,MinistryofAgricultureofChina,FisheriesCollege,JimeiUniversity,Xiamen361021,China; 2.FisheriesTechnologyExtensionStationofNingdeMunicipality,Ningde352000,China)
This study was conducted to evaluate the effects of dietary lipid level on growth performance, muscle composition and plasma biochemical indices of juvenileNibeaalbiflora. A total of 1 200 juvenileNibeaalbiflorawith the average initial body weight of (41.7±3.1) g were randomly divided into 4 groups and fed iso-nitrogenous formulate diets containing different lipid levels [4.07% (L4 group), 7.04% (L7 group), 10.05% (L10 group) and 12.97% (L13 group), respectively] using fish oil as the lipid source for 8 weeks. Each group had 3 replicates and each replicate fed with 100 fish. The results showed that the final average weight (FW), final average length (FL), weight gain rate (WGR), survival rate (SR), feed efficiency (FCR), protein efficiency ratio (PER), condition factor (CF) and viserosomatic index (VSI) of juvenileNibeaalbiflorain L4 and L7 groups were significantly higher than those in L10 and L13 groups (P<0.05). The specific growth rate (SGR) and hepatosomatic index (HSI) of juvenileNibeaalbiflorain L7 group were significantly higher than those in L10 and L13 groups (P<0.05), while no significant difference was found between L4 and L7 groups (P>0.05). The muscle crude protein content of juvenileNibeaalbiflorain L4, L7 and L10 groups was significantly higher than that in L13 group (P<0.05), which showed no significant difference among L4, L7 and L10 groups (P>0.05). The muscle crude lipid content of juvenileNibeaalbiflorain L4 group was significantly lower than that in L7, L10 and L13 groups (P<0.05), while no significant differences were found among L7, L10 and L13 groups (P>0.05). The muscle ash content of juvenileNibeaalbiflorain L7 group was significantly lower than that in L4, L10 and L13 groups (P<0.05), while no significant differences were found among L4, L10 and L13 groups (P>0.05). The total protein (TP), albumin (ALB), globulin (GLB), triacylglycerol (TG), high density lipoprotein (HDL) and low density lipoprotein (LDL) contents in plasma of juvenileNibeaalbiflorain L4 and L7 groups were significantly higher than those in L10 and L13 groups (P<0.05), while the contents of glucose (GLU) and cholesterol (CHOL) and the activities of lactic dehydrogenase (LDH), alanine transaminase (ALT), aspartate transaminase (AST) and alkaline phosphatase (ALP) were significantly lower than those in L10 and L13 groups (P<0.05). The results indicate that the optimal dietary lipid level of juvenileNibeaalbiflorais 7.04% under the present experimental conditions.[ChineseJournalofAnimalNutrition, 2017, 29(4):1418-1426]
juvenileNibeaalbiflora; dietary lipid level; growth performance; muscle composition; plasma biochemical indices
10.3969/j.issn.1006-267x.2017.04.041
2016-10-09
厦门南方海洋研究中心重大项目(14GZY70NF34);福建省农业高校产学合作重大项目(2014N5011)
叶 坤(1984—),男,湖北孝感人,助理实验师,硕士,从事鱼类遗传育种、养殖技术研究。E-mail: kye1015@jmu.edu.cn
*通信作者:王志勇,教授,博士生导师,E-mail: zywang@jmu.edu.cn
S963.1
A
1006-267X(2017)04-1418-09
