大豆磷脂油有效能值评定及其在仔猪饲粮中的应用效果
2017-04-24蒲俊宁陈代文毛湘冰
蒲俊宁 韩 鸽 陈代文 毛湘冰 虞 洁 郑 萍 何 军 余 冰
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安625014)
大豆磷脂油有效能值评定及其在仔猪饲粮中的应用效果
蒲俊宁 韩 鸽 陈代文 毛湘冰 虞 洁 郑 萍 何 军 余 冰*
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安625014)
本研究包括2个试验,试验1旨在评定大豆磷脂油的有效能值;试验2旨在研究大豆磷脂油对断奶仔猪生长性能、血清脂质代谢及直肠微生物数量的影响。试验1(代谢试验):选用16头平均体重(27.54±1.20) kg的“杜×长×大”去势公猪,随机分为2个组,每个组8个重复,每个重复1头猪,分别饲喂基础饲粮和4%大豆磷脂油替换基础饲粮的试验饲粮,预试期5 d,正试期4 d。试验2(饲养试验):选用54头23日龄断奶、初始体重(6.50±0.48) kg“杜×长×大”仔猪,按体重相近原则随机分为3个组,每个组6个重复,每个重复3头猪,分别饲喂基础饲粮(含2%大豆油,对照组)、1.0%磷脂油饲粮(大豆磷脂油等量替代基础饲粮中50%大豆油,即含1.0%大豆油+1.0%磷脂油)和1.5%磷脂油饲粮(大豆磷脂油等能替代基础饲粮中50%大豆油,即含1.0%大豆油+1.5%磷脂油),试验期35 d。代谢试验结果表明:大豆磷脂油的表观消化能为31.32 MJ/kg,表观代谢能为30.07 MJ/kg。饲养试验结果表明,与对照组相比:1)第15~35天,1.0%、1.5%磷脂油饲粮组仔猪平均日采食量(ADFI)分别提高了6.23%和3.13%(P>0.05),平均日增重(ADG)分别提高了6.66%和5.28%(P>0.05);第1~35天,1.0%磷脂油饲粮组仔猪ADFI和ADG分别提高了5.34%和5.64%(P>0.05)。2)1.0%磷脂油饲粮组仔猪腹泻率和腹泻指数分别降低了5.81%和13.41%(P>0.05)。3)1.0%磷脂油饲粮组仔猪血清甘油三酯和游离脂肪酸的含量分别降低了10.91%和12.80%(P>0.05);1.5%磷脂油饲粮组血清甘油三酯、总胆固醇和高密度脂蛋白胆固醇含量分别降低了7.27%、5.33%和10.53%(P>0.05)。4)第15天,1.0%和1.5%磷脂油饲粮组仔猪直肠粪便大肠杆菌数量分别降低了4.88%和4.12%(P>0.05);第36天,1.0%磷脂油饲粮组仔猪直肠粪便大肠杆菌数量降低了4.88%(P>0.05)。综上可见,大豆磷脂油的表观消化能为31.32 MJ/kg,表观代谢能为30.07 MJ/kg;饲粮添加1.0%大豆磷脂油等量替代基础饲粮中的大豆油,可一定程度提高仔猪ADFI和ADG,降低腹泻率和直肠粪便大肠杆菌数量。
大豆磷脂油;有效能值;断奶仔猪;应用效果
随着饲料工业和现代畜牧业的快速发展,我国不仅面临着优质蛋白质饲料原料紧缺的问题,能量饲料原料紧缺状况也日益突出,大豆油脂等优质能量原料供应不足,价格不断上涨[1]。因此,开发饲用能量新原料,寻求优质、供应稳定的大豆油替代品具有极其重要的生产价值和经济意义。大豆磷脂油,也称之为液体磷脂或粗磷脂,为黄色黏稠状物质,是生产大豆油脱胶时的副产品,经真空干燥、脱色所制得的产物,其主要成分包括卵磷脂、脑磷脂、肌醇磷脂、不饱和脂肪酸和大豆油等多种与动物生长、发育、免疫等相关的生物活性物质[2],且含有较高的有效能。因其含有大量的生物活性物质,并且具有促生长[3]、抗氧化、促进脂类代谢[4]、增强机体免疫[5]、构成机体生物膜等生物学功能[6],在医药及食品工业中的应用非常广阔[7-8]。近年来的一些研究表明,大豆磷脂可以部分替代饲料中的植物油,促进动物生长,提高动物抗病能力,降低设备磨损,因此,正被逐步应用于虾、鱼、畜禽等饲料,并取得了较好的经济效益[9-10]。
尽管国内外已有不少关于大豆磷脂油在畜禽养殖方面的研究报道,但迄今为止,主要停留在对畜禽生长性能及营养物质利用率上[11-12]。然而,关于大豆磷脂油的营养价值及其对畜禽脂肪代谢、肠道微生物的影响报道甚少。与此同时,不同来源大豆磷脂油因其组成的差异,其营养价值和饲用价值也不尽相同。因此,本研究旨在评估一种饲用大豆磷脂油猪消化能和代谢能含量的基础上,考察其对仔猪生长性能、血清脂质代谢及直肠微生物数量的影响,为大豆磷脂油在养猪生产中的应用提供试验依据。
1 材料与方法
1.1 试验材料
大豆磷脂油:由广州倚德生物科技有限公司提供,呈黏稠液状,黄棕色;其有效成分及含量:磷脂酰胆碱18%,磷脂酰乙醇胺12%,磷脂酰肌醇9%,磷脂酸5%,磷脂酰丝氨酸6%,大豆油40%,其他磷脂、固醇及其他化合物10%。
1.2 大豆磷脂油有效能值评定试验
1.2.1 试验设计
试验选用16头平均体重为(27.54±1.20) kg的杜×长×大(杜洛克×长白×大白,Duroc×Landrace×Yorkshire,DLY)三元杂交去势公猪,按体重随机分为2个组,每个组8个重复,每个重复1头猪,分别饲喂基础饲粮和大豆磷脂油试验饲粮,预试期5 d,正试期4 d。
1.2.2 试验饲粮
基础饲粮参考NRC(2012)20~50 kg猪营养需要配制,为玉米-豆粕型饲粮,基础饲粮组成及营养水平见表1,大豆磷脂油试验饲粮为4%的大豆磷脂油等量替换基础饲粮构成。
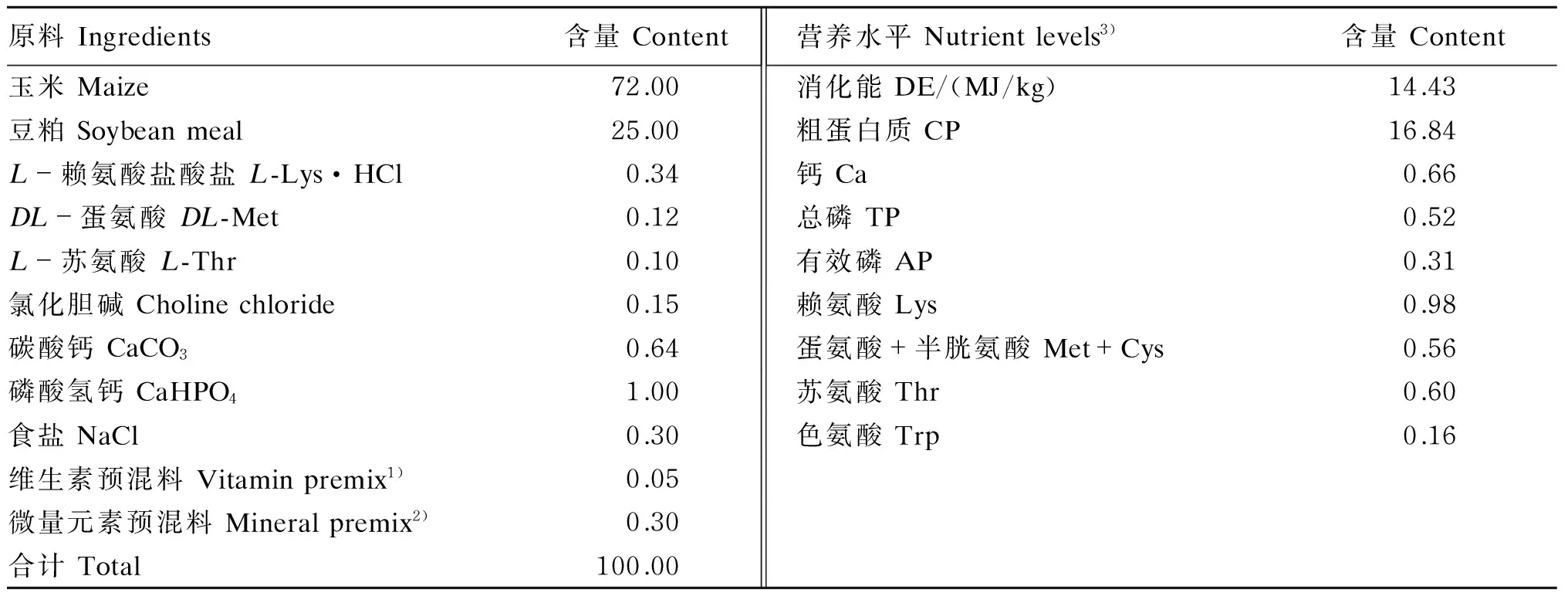
表1 基础饲粮组成及营养水平(风干基础)
1)维生素预混料可为每千克饲粮提供 Vitamin premix provided the following per kg of the diet:VA 8 000 IU,VD32 000 IU,VE 20 IU,VK31 mg,VB11.5 mg,VB25 mg,VB62 mg,VB1230 μg,叶酸 folic acid 0.5 mg,烟酸 nicotinic acid 20 mg,D-泛酸D-pantothenic acid 15 mg。
2)微量元素预混料可为每千克饲粮提供 Mineral premix provided the following per kg of the diet:Fe 60 mg,Cu 4 mg,Mn 2 mg,Zn 60 mg,I 0.14 mg,Se 0.20 mg。
3)消化能为实测值,其余营养水平为计算值。DE was a measured value, while the other nutrient levels were calculated values.
1.2.3 饲养管理
试验在四川农业大学动物营养研究所科研基地代谢实验室进行。所有试验猪单笼饲养于代谢笼中,常规饲养管理。日喂料3次(08:00、14:00和20:00),自由饮水。试验猪上代谢笼观察3 d后即称重分组。试验期共9 d,前5 d为预试期,试验猪自由采食,观察其采食量;后4 d为全收粪尿期,饲喂量按自由采食量的90%供给。
1.2.4 样品采集与处理
饲料样品:按照国标GB/T 14699.1—2005《饲料采样法》的要求通过四分法分别采集不同组饲料样品1 kg,研磨过40目筛,混匀,装入洁净的密闭塑料袋,标记,-20 ℃保存待测。
粪样和尿样品:正式试验期4 d内收集试验猪的全部粪样和尿样。每日每头猪的粪样单独收集到样品袋中,每100 g粪样加入10%硫酸10 mL,另加甲苯数滴防腐。每日早上将前1 d收集的粪样混匀称重按15%比例取样,-20 ℃保存。尿样收集到盛尿瓶中,每100 mL尿样中加入10%硫酸5 mL。每日早上将前1 d收集的尿样混匀称量后按3%比例取样,保存于密封容器中,-20 ℃保存。试验结束后,将同一头猪4 d所有的粪样混合均匀,于60~65 ℃烘48 h后回潮24 h称重,再烘24 h后回潮24 h称重,如此反复,达到恒重。样品干燥后粉碎,过40目筛,于-20 ℃保存待测。来自同一头猪的所有尿样混合均匀后取样,-20 ℃保存待测。
1.2.5 测定指标与方法
1.2.5.1 饲粮能量表观消化率和表观利用率
采用全自动氧弹式热量计(PARR-1281,美国)测定饲料、粪样和尿样的总能,计算饲粮表观消化能、表观代谢能和能量的表观利用率,并根据套算法原理计算大豆磷脂油的表观消化能和表观代谢能。猪饲粮表观消化能测定参考国家标准GB/T 26438—2010进行,饲粮能量表观消化率和表观利用率参照张丽英全收粪法进行计算[13],计算公式如下:
饲粮能量表观消化率(%)=[(食入
饲粮总能量-粪中总能量)/
食入饲粮总能量]×100;
饲粮能量表观利用率(%)=[(食入饲粮
总能量-粪中总能量-尿液总能量)/
食入饲粮总能量]×100。
1.2.5.2 大豆磷脂油有效能含量
以玉米-豆粕型饲粮为基础饲粮时,大豆磷脂油表观能量消化率可通过套算法计算得到,计算公式如下:
D(%)=[(A-B)/F]×100+B。
式中:D为待测大豆磷脂油表观消化率(%);A为顶替后混合饲粮能量表观消化率(%);B为基础饲粮能量表观消化率(%);F为被测大豆磷脂油提供能量占顶替后混合饲粮能量的比例(%)。
大豆磷脂油表观消化能=大豆磷脂油总能×
大豆磷脂油表观消化率。
1.3 大豆磷脂油在断奶仔猪上应用效果的研究
1.3.1 试验设计
试验选用54头23日龄断奶、初始体重(6.50±0.48) kg的DLY仔猪进行饲养试验,按体重随机分为3个组:1)对照组,基础饲粮(含2%大豆油);2)1.0%大豆磷脂油饲粮组,大豆磷脂油等量替代基础饲粮中50%大豆油(含1.0%大豆油+1.0%磷脂油);3)1.5%大豆磷脂油饲粮组,大豆磷脂油等能替代基础饲粮中50%大豆油(含1.0%大豆油+1.5%磷脂油)。每个组6头重复,每个重复3头猪。试验期35 d。
1.3.2 试验饲粮
基础饲粮参照NRC(2012)断奶仔猪营养需要进行配制,为玉米-豆粕型饲粮,基础饲粮组成及营养水平见表2。
1.3.3 饲养管理
试验在四川农业大学动物营养研究所科研基地仔猪舍进行。室温保持在25 ℃左右。日喂料4次(08:00、12:00、16:00、20:00),每次以猪吃饱后料槽内略有余料为度,自由饮水。圈舍每日打扫,注意通风换气。每天记录采食量、温度、相对湿度和腹泻情况,定期用百毒杀消毒。
1.3.4 样品采集与处理
血清样品:试验结束时,每个重复选择1头接近平均体重的仔猪,空腹,前腔静脉采血15 mL,静置30 min后3 000 r/min离心15 min制备血清,用EP管分装后放入-20 ℃冰箱保存待测。
直肠粪便样品:分别于试验第15天早上和第36天早上,每个重复选1头接近平均体重的试验猪,用消毒棉签由肛门插入直肠4~5 cm处,轻轻转动,取出粪便并迅速将其置于灭菌的冻存管里,液氮速冻,保存待测粪便微生物。

表2 基础饲粮组成及营养水平(风干基础)
1)维生素预混料可为每千克饲粮提供 Vitamin premix provided the following per kg of the diet:VA 8 000 IU,VD32 000 IU,VE 20 IU,VK31 mg,VB11.5 mg,VB25 mg,VB62 mg,VB1230 μg,叶酸 folic acid 0.5 mg,烟酸 nicotinic acid 20 mg,D-泛酸D-pantothenic acid 15 mg。
2)微量元素预混料可为每千克饲粮提供 Mineral premix provided the following per kg of the diet:Fe 100 mg,Cu 150 mg,Mn 20 mg,Zn 100 mg,I 0.3 mg,Se 0.3 mg。
3)营养水平为计算值。Nutrient levels were calculated values.
1.3.5 测定指标与方法
1.3.5.1 生长性能
试验期间准确记录每个重复每日采食量,分别于试验起始、第15天和第36天08:00试验猪空腹称重,计算试验猪的平均日增重(average daily gain, ADG)、平均日采食量(average daily feed intake, ADFI)和料重比(feed/gain, F/G)。
1.3.5.2 腹泻率
试验期内,每日由同一人观察记录每个重复仔猪腹泻头数和腹泻程度,并进行腹泻评分。腹泻评分标准如表3所示。腹泻率的计算参照Yuan等[14];平均腹泻指数的计算,参照廖波[15]。计算公式如下:
腹泻率(%)=试验期仔猪腹泻头数/
(每个重复试验猪头数×试验天数)×100;
平均腹泻指数=腹泻评分/(每个重复试验猪
头数×试验天数)。
1.3.5.3 血清脂质代谢
血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和甘油三酯(TG)含量采用全自动生化分析仪(HITACHI-7020,日立有限公司,日本)测定;游离脂肪酸(FFA)含量采用上海美谱达UV-1100紫外可见分光光度计测定。所有试剂盒均购自南京建成生物工程研究所。
1.3.5.4 直肠粪便微生物
参考刁慧[16]的方法,采用实时荧光定量PCR法检测粪便中总菌、大肠杆菌、乳酸杆菌、双歧杆菌和芽孢杆菌数量。采用Omega公司的DNA提取试剂盒提取食糜中总DNA,-20 ℃保存备用。采用实时荧光定量PCR仪(ABI7900HT Real-Time PCR System,ABI,美国),根据细菌16S rRNA基因序列设计特异性引物,应用Taqman探针进行实时荧光定量PCR,使用天根公司的RealMater Mix进行检测,以每克内容物为检测单位,通过Ct值与标准曲线计算得出每份样品所含拷贝数,结果用每克内容物中细菌数量的常用对数表示[lg(CFU/g)]。乳酸杆菌和大肠杆菌反应体系为20 μL:20×Probe Ehance Solution 1 μL,Real Mater Mix 8 μL,上下游引物各1 μL,DNA 1 μL,探针0.3 μL,ddH2O 7.7 μL;双歧杆菌反应体系为20 μL:20×Probe Ehance Solution 1 μL,Real Mater Mix 8 μL,上下游引物各1 μL,DNA 1 μL,探针0.8 μL,ddH2O 7.2 μL。采用三步法PCR扩增标准程序:95 ℃预变性10 s,95 ℃ 5 s,50~60 ℃ 25 s,95 ℃ 10 s,共50个循环,引物和探针序列参考Qi等[17]。总菌反应体系为25 μL:SYBR Premix Ex TaqTMⅡ 12.5 μL,上下游引物各1 μL,DNA 1 μL,ddH2O 9.5 μL。采用三步法PCR扩增标准程序:95 ℃预变性10 s,95 ℃ 5 s,50~60 ℃ 25 s,95 ℃ 10 s,溶解曲线条件为95 ℃ 39 s、55 ℃ 1 min、95 ℃ 1 min,共40个循环,引物设计参考Fierer等[18],PCR引物及探针序列见表4。

表3 腹泻情况发生评判标准

表4 实时荧光定量PCR特异性引物序列及探针
1.4 数据处理与统计分析
所有试验数据采用Excel 2010进行初步整理。试验1数据用SPSS 19.0软件中独立样本t检验程序(independentttest)进行分析;试验2数据用SPSS 19.0软件对数据进行单因素方差分析并结合Duncan氏法进行多重比较;数据以平均值±标准误表示,以P<0.05为差异显著。
2 结 果
2.1 大豆磷脂油对饲粮能量消化率及有效能含量的影响
由表5可知,2种饲粮总能表观消化率无显著差异(P>0.05),但大豆磷脂油饲粮组的消化能和代谢能值均显著高于基础饲粮组(P<0.05)。
按照套算法计算公式,根据上述结果计算出大豆磷脂油的表观消化能为31.32 MJ/kg,表观代谢能为30.07 MJ/kg。
2.2 大豆磷脂油对断奶仔猪生长性能的影响
由表6可知,在各试验阶段,1.0%、1.5%磷脂油饲粮组与对照组相比,仔猪ADFI、ADG和F/G均差异不显著(P>0.05);但相对于对照组,第15~35天,1.0%、1.5%磷脂油饲粮组仔猪ADFI分别提高了6.23%和3.13%,ADG分别提高了6.66%和5.28%;第1~35天,1.0%磷脂油饲粮组ADFI和ADG分别提高了5.34%和5.64%。
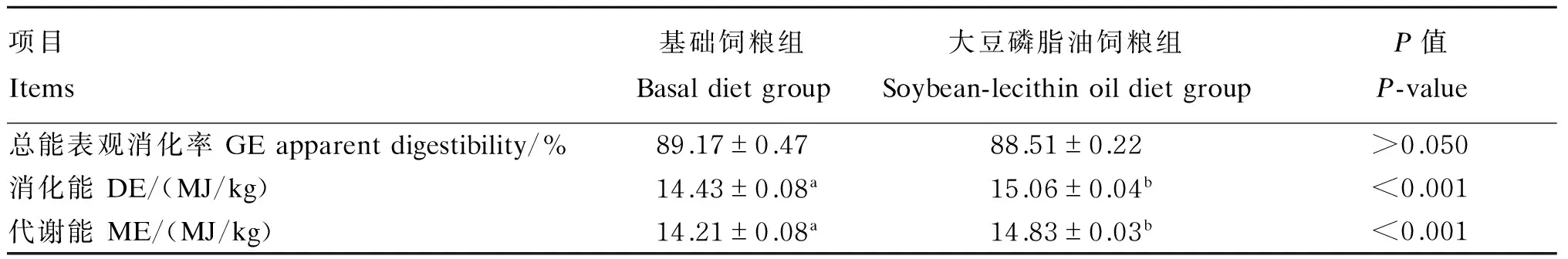
表5 大豆磷脂油对生长猪能量表观消化率的影响
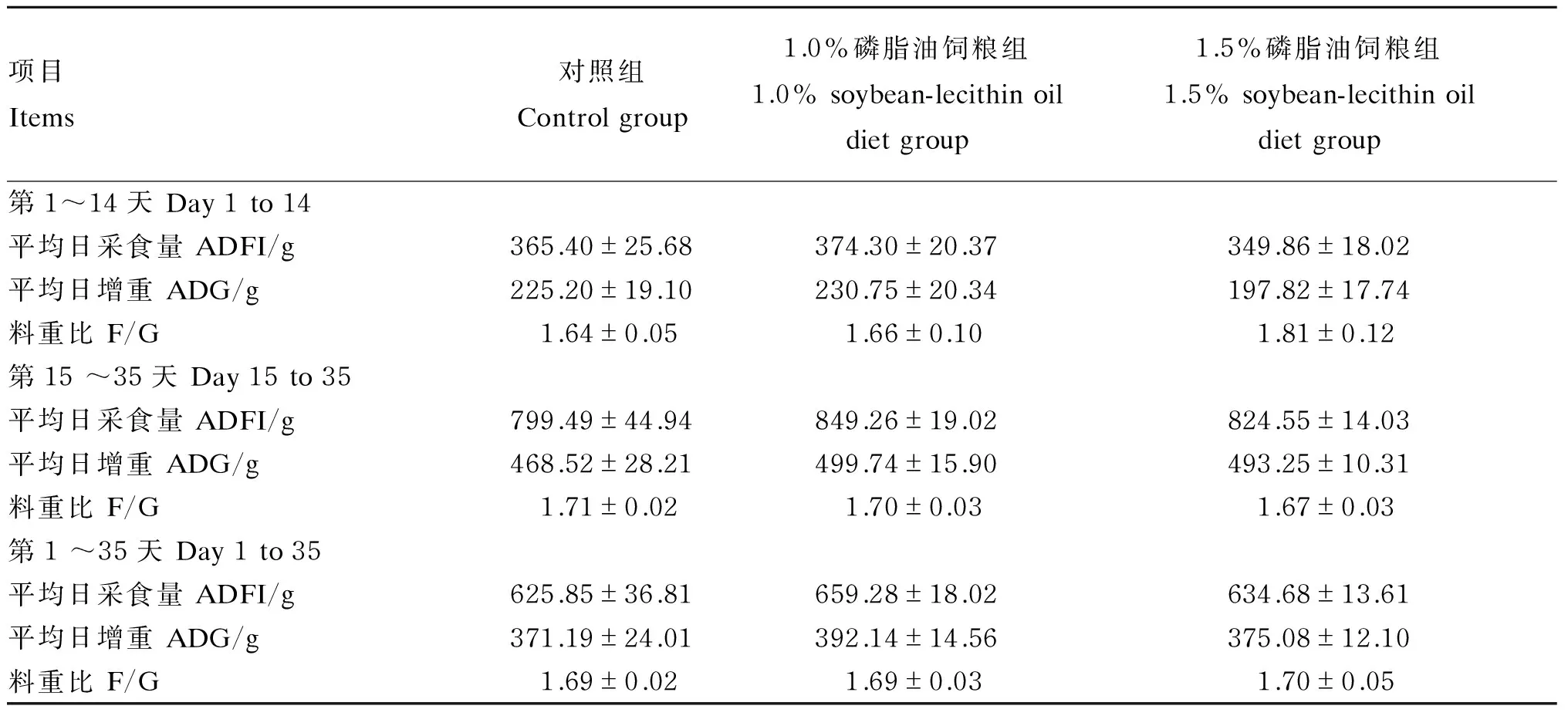
表6 大豆磷脂油对断奶仔猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different letter superscripts mean significant difference (P<0.05),while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.3 大豆磷脂油对断奶仔猪腹泻的影响
由表7可知,各组断奶仔猪腹泻率和腹泻指数差异均不显著(P>0.05),但相对于对照组,1.0%磷脂油饲粮组仔猪腹泻率和腹泻指数分别降低了5.81%和13.41%;而1.5%磷脂油饲粮组仔猪腹泻率和腹泻指数分别提高了27.56%和10.98%。
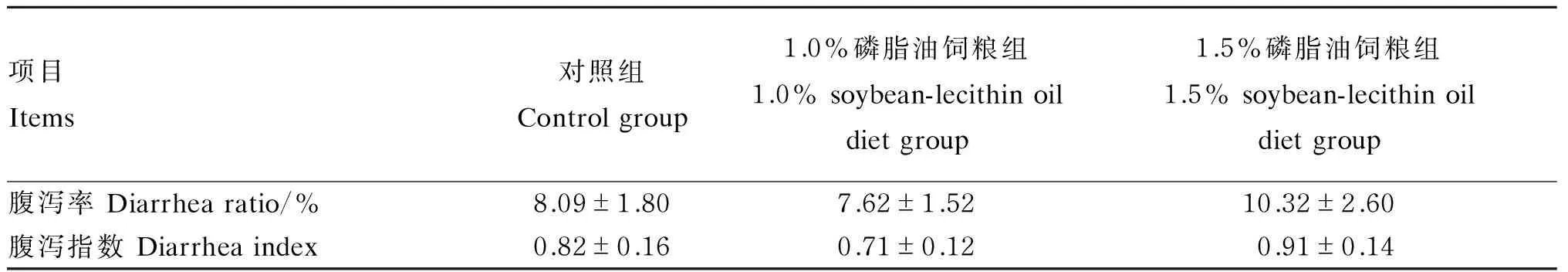
表7 大豆磷脂油对断奶仔猪腹泻的影响
2.4 大豆磷脂油对断奶仔猪血清脂质代谢的影响
由表8可知,各组仔猪血清中甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和游离脂肪酸含量差异不显著(P>0.05)。但相对于对照组,1.0%磷脂油饲粮组仔猪血清中甘油三酯和游离脂肪酸含量分别降低了10.91%和12.80%,而血清低密度脂蛋白胆固醇含量提高了7.03%;1.5%磷脂油饲粮组仔猪血清中甘油三酯、总胆固醇、高密度脂蛋白胆固醇和游离脂肪酸含量分别降低了7.27%、5.33%、10.53%和7.69%。
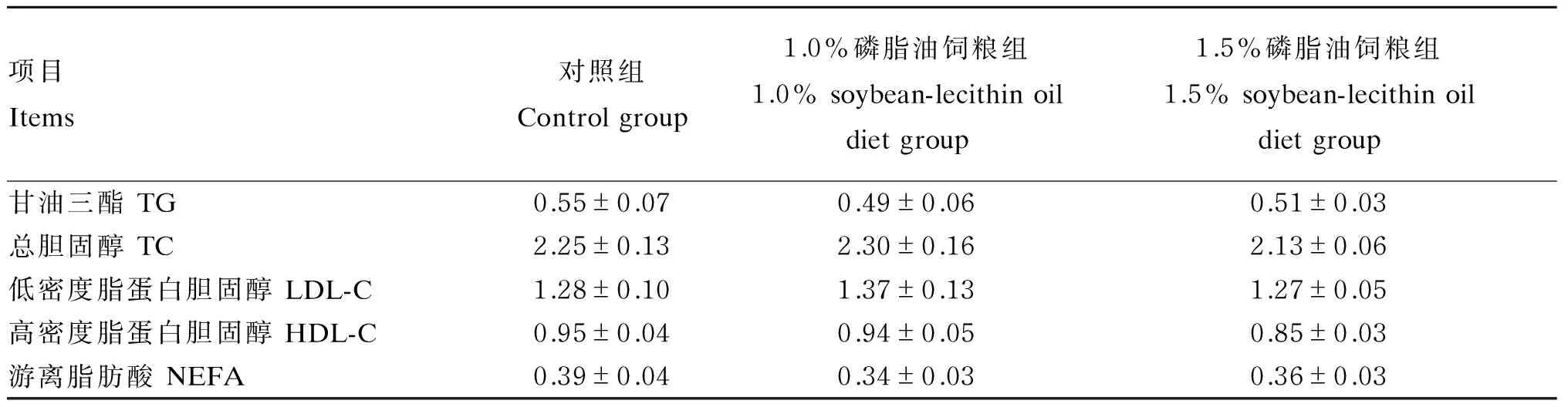
表8 大豆磷脂油对断奶仔猪血清脂质代谢的影响
2.5 大豆磷脂油对断奶仔猪直肠粪便微生物数量的影响
由表9可知,第15、36天,各组仔猪直肠粪便微生物中总菌、芽孢杆菌、大肠杆菌、乳酸杆菌和双歧杆菌数量差异均不显著(P>0.05)。相对于对照组,第15天,1.0%、1.5%磷脂油饲粮组仔猪直肠粪便微生物中乳酸杆菌数量分别提高了5.40%和4.52%,大肠杆菌数量分别降低了4.88%和4.12%;在第36天,1.0%磷脂油饲粮组仔猪直肠粪便微生物中大肠杆菌数量降低了4.88%,1.5%磷脂油饲粮组仔猪直肠粪便微生物中乳酸杆菌数量提高了3.92%。
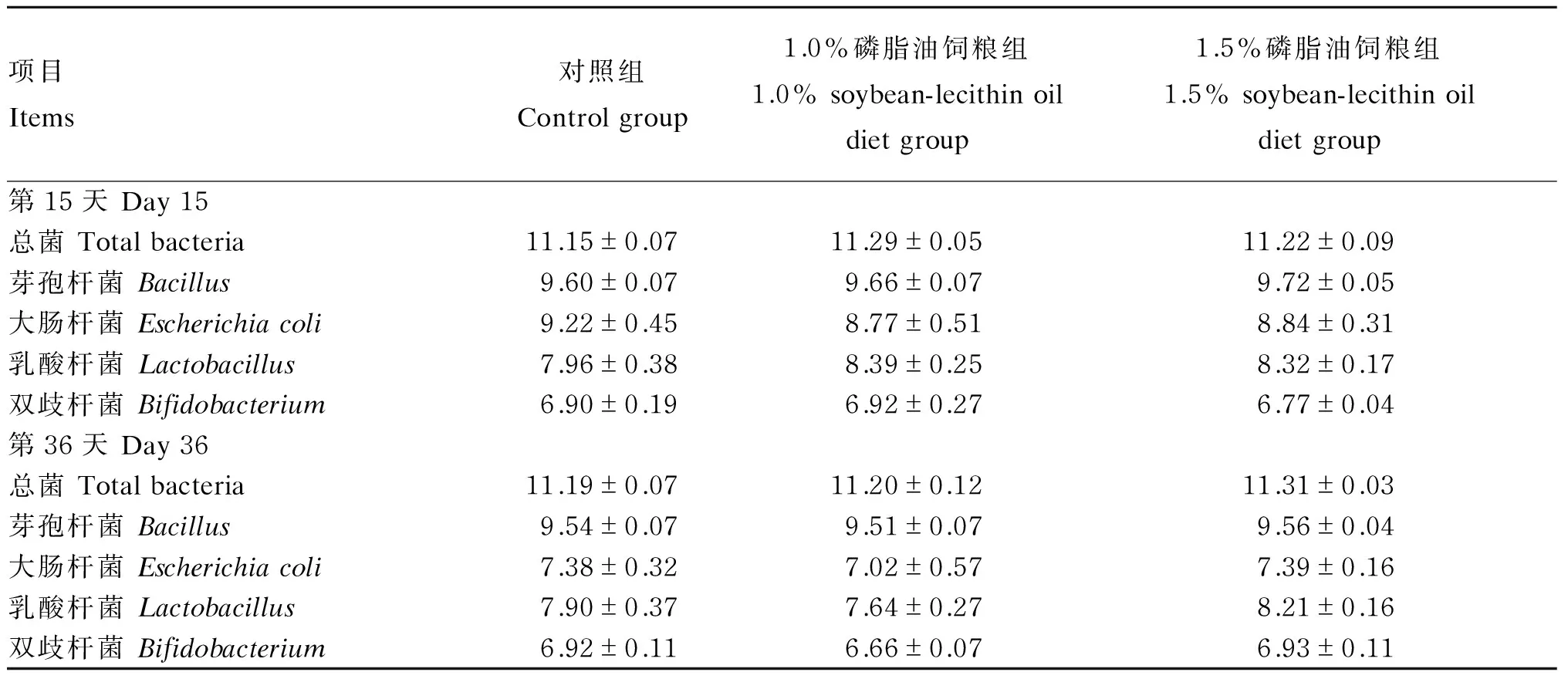
表9 大豆磷脂油对断奶仔猪直肠粪便微生物数量的影响
3 讨 论
3.1 大豆磷脂油对饲粮能量消化率及有效能含量的影响
大豆磷脂油作为一种可替代植物油、降低饲料成本的能量原料,已被应用于畜禽、水产等动物饲料[19]。研究表明,饲粮添加油脂是实现更大体重增加速度的有效方法[20]。不同种类的油脂,因其脂肪酸碳链长度、饱和度的差异,在动物体内的消化吸收各不相同,脂肪酸碳链越短,油脂的消化率越高,不饱和度越高,消化率也越高[21-23]。除此之外,油脂消化能值还与其储存时间、氧化程度、游离脂肪酸含量有关[24]。本试验表明,大豆磷脂油的表观消化能为31.32 MJ/kg,表观代谢能为30.07 MJ/kg。其可能原因是,一方面大豆磷脂油富含亚油酸、亚麻酸等短链不饱和脂肪酸,促进油脂消化吸收;因脂肪酸的不饱和度越高,则消化代谢能值越高[25];另一方面大豆磷脂油富含磷脂,是一种很好的乳化剂,可提高营养物质在小肠的消化吸收能力[26-27]。
3.2 大豆磷脂油对断奶仔猪生长性能的影响
研究表明,添加大豆磷脂油可促进动物生长,提高饲料报酬,降低动物死亡率[28]。王艳青等[29]研究表明,在断奶仔猪饲粮中添加5%大豆磷脂,仔猪ADG显著提高,F/G降低了12.66%。张兆琴等[30]研究发现,饲粮中大豆磷脂添加量与断奶仔猪ADG和ADFI呈正相关,并提出大豆磷脂与饲粮中动物油脂的搭配比例以1∶10为最佳,这与Jones等[31]所提出大豆磷脂与牛油的比例为(0.5~1.0)∶10.0相似。但Overland等[32]研究表明,断奶时间的延长(35 d)或超早期断奶(21 d以前)饲粮中添加大豆磷脂油有降低仔猪生长性能及脂肪利用率的趋势。不同试验结果的差异可能与动物年龄、大豆磷脂的组成和添加量以及试验的持续时间等有关。在本试验中,第15~35天阶段,大豆磷脂油等量和等能替代基础饲粮50%大豆油组,仔猪ADFI分别提高了6.23%和3.13%,ADG分别提高了6.66%和5.28%;第1~35天整个试验阶段,大豆磷脂油等量替代基础饲粮50%大豆油组仔猪ADFI和ADG分别提高了5.34%和5.64%,但差异均不显著。研究表明,由于大豆磷脂具有良好的脂肪香气,能改善饲料适口性[19],促进动物采食。同时,大豆磷脂分子中含有疏水性的脂肪酸链和亲水基团,可起到表面活性剂和乳化剂的作用,能将进入小肠内的脂肪进一步分散,增大脂肪及脂溶性物质与肠黏膜的接触面积,从而提高脂肪的消化、吸收和转运,改善营养物质利用率。此外,由于大豆磷脂油富含不饱和脂肪酸,对幼龄动物器官发育、机体成长具有非常重要的促进作用[31-33]。本研究所用大豆磷脂油产品不但含有较大比例的大豆磷脂,而且含有40%的大豆油,因而不仅能一定比例替代饲粮中的大豆油,而且具有额外的生物活性作用。
3.3 大豆磷脂油对断奶仔猪腹泻的影响
大豆磷脂油是从生产大豆油的油脚中提取出来的产物,富含大量的卵磷脂和脑磷脂[34]。国内外研究均表明,在仔猪饲粮中添加磷脂可提高饲粮蛋白质和能量的消化率,减少因消化不良导致的腹泻,促进代谢[35]。本试验也发现,大豆磷脂油等量替代50%大豆油组仔猪腹泻率和腹泻指数分别降低了5.81%和13.41%。可能原因在于,大豆磷脂油中富含的大量磷脂具有乳化作用,可以弥补断奶仔猪消化机能不完善、胆汁分泌不足的缺陷,从而有助于养分的消化吸收,降低腹泻。然而,大豆磷脂油等能替代50%大豆油组仔猪腹泻率和腹泻指数却分别提高了27.56%和10.98%,原因可能与饲粮中脂类的搭配比例不当有关,但具体原因尚需进一步研究。
3.4 大豆磷脂油对断奶仔猪血清脂质代谢的影响
研究表明,大豆磷脂油具有调控脂质代谢的作用,因为磷脂作为膜结构成分和脂循环运输粒子的表面组分,在心血管系统中起着重要的调节作用。一方面,由于大豆磷脂产品含有大量的不饱和脂肪酸[如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)]和磷脂,动物采食后会增加机体中不饱和脂肪酸水平,从而保护细胞膜的完整性;另一方面,磷脂可通过增加对甘油三酯的运转,以及对胆固醇的乳化、清除作用,从而达到降低血脂的效应[36-37]。大豆磷脂油中的多不饱和脂肪酸能与胆固醇酯化,生成胆固醇酯。当血液中的胆固醇转化成胆固醇酯后,进一步形成胆酸从肠道排出,进而降低血清中总胆固醇含量,防止脂质在肝脏和动脉壁沉积。池莉平等[38]研究表明,大豆磷脂能显著降低大鼠血清中胆固醇、甘油三酯及低密度脂蛋白胆固醇的含量。Lough等[39]研究也发现,添加适当的大豆磷脂可降低血清总胆固醇和低密度脂蛋白胆固醇含量,提高血清高密度脂蛋白胆固醇含量。Spilburg等[40]也报道大豆磷脂可以降低胆固醇的吸收和血浆低密度脂蛋白胆固醇含量,提高高密度脂蛋白胆固醇含量,原因是大豆磷脂激活了脂蛋白脂酶和卵磷脂胆固醇转移酶活性,抑制了肝内皮细胞脂酶活性。王若军等[41]的试验表明,大豆磷脂可完全替代肉鸡饲粮中大豆油,降低腹脂和改善肉质。本研究发现,相对于对照组,大豆磷脂油等能替代50%大豆油组仔猪血清甘油三酯、总胆固醇和高密度脂蛋白胆固醇含量分别降低了7.27%、5.33%和10.53%。这表明饲粮中添加适量的大豆磷脂油确实可调节动物脂质代谢。
3.5 大豆磷脂油对断奶仔猪直肠粪便微生物数量的影响
肠道菌群构成动物肠道的微生物屏障,其动态平衡对动物肠道健康起着至关重要的作用。目前,大豆磷脂油的研究主要集中在对动物生长性能、脂质代谢的影响方面,对肠道菌群的研究缺乏。本研究发现,无论是在试验中期还是试验结束时,饲粮添加大豆磷脂油对仔猪直肠粪便微生物相关指标影响均不显著,仅具有降低大肠杆菌的趋势。在第15天,相对于对照组,大豆磷脂油等量和等能替代50%大豆油组,仔猪直肠粪便大肠杆菌数量分别降低了4.88%和4.12%;在第36天,大豆磷脂油等量替代50%大豆油组大肠杆菌数量降低了4.88%。原因可能与大豆磷脂油中的亚麻酸、亚油酸等中短链不饱和脂肪酸对肠道菌群的调节有关。
4 结 论
本研究结果表明,大豆磷脂油的表观消化能为31.32 MJ/kg,表观代谢能为30.07 MJ/kg。断奶仔猪饲粮添加1.0%大豆磷脂油等量替代基础饲料中的大豆油,有提高仔猪ADFI和ADG、降低腹泻率和直肠粪便大肠杆菌数量的积极作用。
[1] RANA K J,SIRIWARDENA S,HASAN M.R.Impact of rising feed ingredient prices on aquafeeds and aquaculture production[J].Fisheries & Aquaculture Technical Paper,2009.
[2] 陈忠琼,黎晓敏.大豆磷脂及大豆磷脂饲料的应用研究[J].饲料博览,2011(5):16-19.
[3] 史加宁,王瑾,刘滨城,等.大豆磷脂与玉米膨化混合粉的生产工艺及其应用的研究[J].粮食与饲料工业,2010(4):36-38.
[4] 邓玉英,刘桂森,方治山,等.在断奶仔猪日粮中添加不同剂量大豆磷脂的饲喂效果[J].当代畜牧,2009(6):28-29.
[5] 罗士津,瞿明仁.日粮中多不饱和脂肪酸对动物免疫功能影响的研究[J].饲料与畜牧:新饲料,2007(8):10-13.
[6] 和小明.磷脂的营养作用及生理调控功能[J].饲料博览,2006(6):37-40.
[7] LIEBER C S,ROBINS S J, LI J J,et al.Phosphatidylcholine protects against fibrosis and cirrhosis in the baboon[J].Gastroenterology,1994,106:152-159.
[8] 陈吉祥,李广林.脂质体在生物学中的应用新进展[J].甘肃畜牧兽医,2000,30:28-29.
[9] RAMESH S,BALASUBRAMANIAN T.Dietary value of different vegetable oil in black tiger shrimpPenaeusmonodonin the presence and absence of soy lecithin supplementation:effect on growth, nutrient digestibility and body composition[J].Aquaculture,2005,250:317-327.
[10] KIM K D,KIM K M,KIM K W,et al.Influence of lipid level and supplemental lecithin in diet on growth, feed utilization and body composition of juvenile flounder (Paralichthysolivaceus) in suboptimal water temperatures[J].Aquaculture,2006,251:484-490.
[11] HUANG J,YANG D,WANG T.Effects of replacing soy-oil with soy-lecithin on growth performance, nutrient utilization and serum parameters of broilers fed corn-based diets[J].Asian Australasian Joural of Animal Science,2008,20:1880-1886.
[12] LABRUNE H J,REINHARDT C D,DIKEMAN M E,et al.Effects of grain processing and dietary lipid source on performance, carcass characteristics, plasma fatty acids, and sensory properties of steaks from finishing cattle[J].Journal of Animal Science,2008,86:167-172.
[13] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003.
[14] YUAN L,KANG S Y,WARD L A,et al.Antibody-secreting cell responses and protective immunity assessed in gnotobiotic pigs inoculated orally or intramuscularly with inactivated human rotavirus[J].Journal of Virology,1998,72:330-338.
[15] 廖波.25-OH-D3对免疫应激断奶仔猪的生产性能,肠道免疫功能和机体免疫应答的影响[D].博士学位论文.雅安:四川农业大学,2011.
[16] 刁慧.苯甲酸和百里香酚对断奶仔猪生长性能和肠道健康的影响[D].硕士学位论文.雅安:四川农业大学,2013.
[17] QI H W,XIANG Z T,HAN G Q,et al.Effects of different dietary protein sources on cecal microflora in rats[J].African Journal of Biotechnology,2011,10:3704-3708.
[18] FIERER N,JACKSON J A,VILGALYS R,et al.Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J].Applied and Environmental Microbiology,2005,71:4117-4120.
[19] 张鑫,于文,张增欣.磷脂在水产动物营养中应用的研究进展[J].饲料工业,2007,28:43-45.
[20] 乔文慧.大豆磷脂及其在畜禽饲料中的应用[J].吉林畜牧兽医,2004,10:21-22.
[21] CHEVALIER S P,GOUGEON R J,CHOONG N,et al.Influence of adiposity in the blunted whole-body protein anabolic response to insulin with aging[J].The Journals of Gerontology Series A:Biological Sciences and Medical Sciences,2006,61:156-164.
[22] LAWRENCE N J, MAXWELL C V.Effect of dietary fat source and level on the performance of neonatal and early weaned pigs[J].Journal of Animal Science,1983,57:936-942.
[23] CERA K R, MAHAN D C, REINHART G A.Weekly digestibilities of diets supplemented with corn oil, lard or tallow by weanling swine[J].Journal of Animal Science,1988,66:1430-1437.
[24] 徐彬.日粮添加PUFA和维生素E对猪胴体脂肪酸组成和肉质的影响[D].硕士学位论文.河南:河南工业大学,2007.
[25] 张伟敏,钟耕,王炜.单不饱和脂肪酸营养及其生理功能研究概况[J].粮食与油脂,2005(3):13-15.
[26] JENKINS T C.Nutrient digestion, ruminal fermentation, and plasma lipids in steers fed combinations of hydrogenated fat and lecithin[J].Journal of Dairy Science,1990,73:2934-2939.
[27] TOCHER D R,BENDIKSEN E Å,CAMPBELL P J,et al.The role of phospholipids in nutrition and metabolism of teleost fish[J].Aquaculture,2008,280:21-34.
[28] POSTON H A.Effect of body size on growth, survival, and chemical composition of Atlantic salmon fed soy lecithin and choline[J].The Progressive Fish-Culturist,1990,52:226-230.
[29] 王艳青,林发光,顾玉鹏.大豆磷脂对仔猪生产性能的影响[J].饲料博览,2002(9):32-35.
[30] 张兆琴,徐占云,秦睿玲,等.日粮中添加大豆卵磷脂对断奶仔猪的影响研究[J].西北农业学报,2006,15:36-39.
[31] JONES D B,HANCOCK J D,HARMON D L,et al.Effects of exogenous emulsifiers and fat sources on nutrient digestibility,serum lipids,and growth performance in weanling pigs[J].Journal of Animal Science,1992,70:3473-3482.
[32] OVERLAND M, MROZ Z, SUNDST L F.Effect of lecithin on the apparent ileal and overall digestibility of crude fat and fatty acids in pigs[J].Journal of Animal Science,1994,72:2022-2028.
[33] ESH G C, SUTTON T S.The effects of soya lecithin on the absorption, utilization and storage of vitamin A and carotene in the white rat[J].The Journal of Nutrition,1948,36:391-404.
[34] 何晓刚,穆秦,岳登,等.大豆磷脂营养功能及在动物生产中的应用[J].畜牧兽医科技信息,2007(11):13-15.
[35] 蔡元丽,谢幼梅,魏可峰,等.大豆磷脂及其在动物饲料中的应用[J].中国饲料,2002(3):8-10.
[36] SNCHEZ D R, FOX J M,DELBERT G,et al.Dietary effect of fish oil and soybean lecithin on growth and survival of juvenileLitopenaeusvannameiin the presence or absence of phytoplankton in an indoor system[J].Aquaculture Research,2014,45:1367-1379.
[37] 魏玉强,李景伟,毕宇霖,等.大豆磷脂理化性质及其在猪饲料中的应用[J].畜牧与饲料科学,2016,218:16-18.
[38] 池莉平,谭剑斌,陈瑞仪.大豆卵磷脂调节血脂作用的动物实验研究[J].海峡预防医学杂志,2007,13:51-52.
[39] LOUGH D S,SOLOMON M B,RUMSEY T S,et al.Effects of dietary canola seed and soy lecithin in high-forage diets on performance, serum lipids, and carcass characteristics of growing ram lambs[J].Journal of Animal Science,1991,69:3292-3298.
[40] SPILBURG C A,GOLDBERG A C,MCGILL J B,et al.Fat-free foods supplemented with soy stanol-lecithin powder reduce cholesterol absorption and LDL cholesterol[J].Journal of American Dietetic Association,2003,103:577-581.
[41] 王若军,李德发.日粮中添加浓缩大豆磷脂对肉鸡生产性能的影响[J].饲料工业,1999,20:8-10.
*Corresponding author, professor, E-mail: ybingtian@163.com
(责任编辑 武海龙)
Evaluation of Effective Energy Value and Utilization of Soybean-Lecithin Oil in Diets of Weaned Piglets
PU Junning HAN Ge CHEN Daiwen MAO Xiangbing YU Jie ZHENG Ping HE Jun YU Bing*
(KeyLaboratoryforAnimalDisease-ResistanceNutritionofMinistryofEducation,InstituteofAnimalNutrition,SichuanAgriculturalUniversity,Ya’an625014,China)
The study contained two experiments to evaluate the effective energy value of soybean-lecithin oil and to determine the effects of soybean-lecithin oil on growth performance, serum lipid metabolism and rectal microflora number of weaned piglets. Experiment 1 (metabolism experiment): sixteen emasculated pigs (Duroc×Landrance×Yorkshire) with an average body weight of (27.54±1.20) kg were randomly divided into 2 groups with 8 replicates in each group and 1 pig in each replicate. The pigs were fed basal diet and experiment diet which used 4% soybean-lecithin oil replaced basal diet, respectively. The trial lasted for 5 days for adaptation, and 4 days for sampling. Experiment 2 (feeding experiment): fifty four weaned piglets (Duroc×Landrance×Yorkshire, weaned at 23 days of age ) with initial body weight of (6.50±0.48) kg were randomly divided into 3 groups with 6 replicates per group and 3 pigs per replicate. Pigs were fed the basal diet (2% soybean oil, control group), 1.0% soybean-lecithin oil diet (50% soybean oil in basal diet was substituted by the same amount of soybean-lecithin oil, 1.0% soybean oil+1.0% soybean-lecithin oil) and 1.5% soybean-lecithin oil diet (50% digestible energy provided by soybean oil in basal diet was substituted by the same digestible energy of soybean-lecithin oil, 1.0% soybean oil+1.5% soybean-lecithin oil). The whole trial lasted for 35 days. The metabolism experiment results showed that soybean-lecithin oil contained 31.32 MJ/kg apparent digestible energy and 30.07 MJ/kg apparent metabolizable energy. The feeding experiment results showed as follows, compared with the control group: 1) on day 15 to 35, the average daily feed intake (ADFI) of piglets in 1.0% and 1.5% soybean-lecithin oil group was increased by 6.23% and 3.13% (P>0.05), and the average daily gain (ADG) was increased by 6.66% and 5.28% (P>0.05). Furthermore, on day 1 to 35, the ADFI and ADG of piglets in 1.0% soybean-lecithin oil diet group were improved by 5.34% and 5.64% (P>0.05), respectively. 2) The diarrhea rate and diarrhea index of piglets in 1.0% soybean-lecithin oil diet group were decreased by 5.81% and 13.41% (P>0.05), respectively. 3) The content of serum triglyceride (TG) and free fatty acid in serum of piglets in 1.0% soybean-lecithin oil diet group were reduced by 10.91% and 12.80% (P>0.05); the content of TG, total cholesterol and high density lipoprotein cholesterol in serum of piglets in 1.5% soybean-lecithin oil diet group were reduced by 7.27%, 5.33% and 10.53% (P>0.05), respectively. 4) On day 15, the rectal fecalEscherichiacolinumber of piglets in 1.0% and 1.5% soybean-lecithin oil diet group was reduced by 4.88% and 4.12% (P>0.05), respectively; on day 36, the rectal fecalEscherichiacolinumber of piglets in 1.0% soybean-lecithin oil diet group was reduced by 4.88% (P>0.05). In conclusion, the apparent digestible energy and apparent metabolizable energy of soybean-lecithin oil were 31.32 and 30.07 MJ/kg, respectively. 1.0% soybean-lecithin oil replaced equivalent soybean oil in basal diet can improve ADFI and ADG, decrease diarrhea and the rectal fecalEscherichiacolinumber of piglets to some extent.[ChineseJournalofAnimalNutrition, 2017, 29(4):1272-1282]
soybean-lecithin oil; effective energy value; weaned piglets; utilization
10.3969/j.issn.1006-267x.2017.04.024
2016-10-09
四川省科技支撑计划项目(2013NZ0056);广州倚德生物科技有限公司合作项目
蒲俊宁(1990—),男,四川南充人,硕士研究生,从事猪的营养研究。E-mail: 1135422733@qq.com
*通信作者:余 冰,教授,博士生导师,E-mail: ybingtian@163.com
S828
A
1006-267X(2017)04-1272-11
