高效液相色谱法研究瘤胃甲烷菌共存对厌氧真菌代谢产生有机酸特性的影响
2017-04-24李袁飞孙美洲成艳芬朱伟云
李袁飞 孙美洲 成艳芬 朱伟云
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物实验室,南京210095)
高效液相色谱法研究瘤胃甲烷菌共存对厌氧真菌代谢产生有机酸特性的影响
李袁飞 孙美洲 成艳芬*朱伟云
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物实验室,南京210095)
本试验旨在利用建立的高效液相色谱法研究瘤胃甲烷菌共存对厌氧真菌代谢产有机酸特性的影响。根据6种有机酸的化学特性确定紫外检测波长、缓冲液浓度、pH、流速、柱温和进样量等液相色谱条件;利用建立的高效液相色谱法检测厌氧真菌纯培养及厌氧真菌与甲烷菌共培养上清液中6种有机酸的含量。结果表明,高效液相色谱采用的条件为:5 mmol/L磷酸二氢钾-磷酸缓冲液(pH=2.4)作为流动相,流速为0.5 mL/min,柱温25 ℃,进样量为20 μL,214 nm波长检测。6种有机酸能够在30 min内得到良好分离。各种有机酸的线性相关系数均大于0.999,检测限为0.20~1.00 μmol/L,定量限为0.667~3.333 μmol/L,回收率为92.17%~101.61%。甲烷菌共存影响了厌氧真菌的代谢产物。厌氧真菌利用葡萄糖的主要水溶性代谢产物为甲酸、乳酸、乙酸,以及微量琥珀酸、柠檬酸、α-酮戊二酸及乙醇;甲烷菌共存显著降低了上清液中甲酸和乳酸的含量(P<0.05),显著增加了乙酸含量(P<0.05)。综上,本试验利用建立的高效液相色谱法可快捷、灵敏、有效地检测厌氧真菌代谢葡萄糖产生的6种有机酸的含量,并发现甲烷菌共存显著促进了厌氧真菌氢化酶体对碳水化合物的代谢。
高效液相色谱法;有机酸;厌氧真菌;甲烷菌;共培养
厌氧真菌是瘤胃内最先定殖到植物纤维组织上的微生物之一[1]。它们借助强大的假根系统和分泌的一系列木质纤维素降解酶对植物纤维进行高效地降解。厌氧真菌进行混合酸发酵,其代谢产物主要为甲酸、乙酸、乳酸、琥珀酸、乙醇、二氧化碳(CO2)和氢气(H2)[2-4]。甲烷菌严格厌氧,它们不能利用复杂的有机物,只能利用H2、CO2、甲酸、乙酸和甲醇等简单物质作为能量来源。甲烷菌和厌氧真菌可以稳定共存,而且甲烷菌的存在可以显著提高厌氧真菌对底物的降解和利用[5-6]。当甲烷菌共存时,厌氧真菌的主要代谢产物由甲酸、乙酸、氢气和乳酸转变为乙酸、甲烷和乳酸[7-8]。因此,建立厌氧真菌代谢产物中有机酸的检测方法,对于了解甲烷菌共存对厌氧真菌代谢的影响具有重要意义。
目前有关厌氧真菌有机酸检测方法的报道较少,测定的有机酸多集中于含量较高的代谢产物,如甲酸、乙酸和乳酸,而且往往是利用不同的方法分开测定的,耗时费力,也不经济。然而,目前还没有能够同时检测厌氧真菌代谢产生的这些有机酸的方法。近年来的研究发现,厌氧真菌发酵可能产生某些微量代谢产物,如α-酮戊二酸和柠檬酸[9-10]。事实上还没有一种定量检测厌氧真菌代谢产生的这2种微量代谢产物的方法。因此,本研究旨在建立同时检测厌氧真菌代谢产生的6种有机酸(甲酸、乙酸、乳酸、α-酮戊二酸、柠檬酸和琥珀酸)的方法,并使用该方法研究厌氧真菌产有机酸的特性以及甲烷菌共存对厌氧真菌产有机酸的影响。
1 材料与方法
1.1 高效液相色谱仪与试剂
Waters 2489型高效液相色谱仪(Waters,美国),Waters 515泵,2489 UA检测器,HT-330柱温箱(Waters,美国),Agilent SB-Aq色谱柱(26 mm×250 mm,5 μm;Agilent,美国),7725i手动进样器(Rheodyne,美国),UV2450紫外可见光谱仪(Hitachi,日本)。色谱纯甲酸、乙酸、乳酸、α-酮戊二酸、柠檬酸和琥珀酸购于Sigma公司(St. Louis, MO,美国),分析纯磷酸二氢钾(KH2PO4)购于北京化学试剂公司。超纯水(18.2 mΩ/cm)使用MilliQ超低有机物超纯水机制备(Millipore,美国)。
1.2 有机酸标准溶液的配制及标准曲线的建立
准确称取或量取甲酸、乳酸、乙酸、α-酮戊二酸、柠檬酸和琥珀酸,配制成浓度为50~100 mmol/L的母液。分别移取适量该溶液稀释1、5、10、100、200、500和1 000倍,配制成不同浓度的标准品,用0.22 μm的一次性针式过滤器过滤后备用。各有机酸标准品用于确定保留时间,混合标准品用于制作有机酸标准曲线。
1.3 有机酸分析方法的建立
在200~600 nm波长范围内扫描各个有机酸标准溶液,发现在214 nm波长下,整体的吸光度较高,而葡萄糖在此波长下几乎没有吸收,因此选择吸收波长为214 nm作为检测波长。试验中比较了不同浓度KH2PO4-磷酸(H3PO4)(5、10、15、20 mmol/L)缓冲液发现,浓度为5 mmol/L时有机酸分离度最好。在KH2PO4-H3PO4缓冲液浓度为5 mmol/L条件下,用H3PO4调节缓冲液pH为1.6、2.0、2.4、2.7,结果发现有机酸在pH为2.4的流动相中分离度最好。因此选用5 mmol/L KH2PO4-H3PO4缓冲液(pH=2.4)作为流动相,检测波长设定为214 nm。通过综合比较分析,最终确定有机酸高效液相色谱分析条件为:流动相为5 mmol/L KH2PO4-H3PO4缓冲液(pH=2.4),流速为0.5 mL/min,检测波长为214 nm,柱温为25 ℃,进样体积为20 μL。根据该分析条件,检测各有机酸保留时间、建立标准曲线并计算检测限与定量限。
1.4 精密度和回收率的测定
精确吸取适宜浓度的混合标准溶液,按高效液相色谱分析条件连续进样5次,记录峰面积并计算精密度。将同一发酵液样品分装成2份,一份直接测定其中有机酸含量,另外一份添加混合标准品后测定其含量,记录峰面积,平行测定3次,计算回收率,该试验重复5次。
1.5 甲烷菌共存对厌氧真菌代谢的影响
以本实验室从山羊瘤胃液中分离得到的厌氧真菌(属于Piromyces)和甲烷菌(Methanobrevibacterthaueri)共培养[5]为试验菌株,通过添加氯霉素去除甲烷菌以获得厌氧真菌纯培养。参照Barichievich等[11]方法配制培养基,将10 mL生长3 d的培养物接种于已预热至39 ℃的90 mL培养基(4 g/L葡萄糖为底物)中,39 ℃静置培养3 d,参照Marin-Sikkema等[12]方法取上清液并分装于2 mL冻存管,-80 ℃保存,用于厌氧真菌底物及代谢产物分析。
1.6 厌氧真菌底物及代谢产物分析
采用葡萄糖氧化酶/过氧化物酶法测定上清液中葡萄糖含量(南京建成生物工程研究所)。上清液离心后(12 000 r/min、4 ℃离心10 min)与KH2PO4-H3PO4缓冲液(5 mmol/L,pH=2.4)按1∶2比例混匀,0.22 μm过滤后用上述已建立方法检测其中有机酸的含量。参照Edgardo等[13]方法测定上清液中乙醇含量:气相色谱为Agilent 7890B(Agilent,美国);载气[柱前压,高纯氮气(N2)]0.04 MPa;分流比100∶1;KR-9(白酒柱),0.32 m×30 m;火焰离子化检测仪(FID);气化温度150 ℃,柱温105 ℃,检测器温度220 ℃。
1.7 数据处理
数据经Excel 2007初步整理后,利用SPSS 16.0统计软件中独立样本t检验对纯培养和共培养中底物及代谢产物含量进行比较。数据以平均值±标准误表示,显著性水平置于0.05。
2 结果与分析
2.1 厌氧真菌代谢产物高效液相色谱法的建立
2.1.1 保留时间、标准曲线、检测限和定量限的确定
通过各有机酸的单一标准品测定其保留时间(表1),然后利用有机酸混合标准品进行测定分析。结果表明,6种有机酸在30 min内能得到良好的分离效果(图1)。以进样浓度(mmol/L)为横坐标,峰面积(mV·min)为纵坐标,绘制标准曲线,进行线性回归,建立标准曲线回归方程,6种有机酸标准曲线相关系数均大于0.999(表1)。以3倍、10倍信噪比(S/N)的判断标准分别进行6种有机酸的检测限及定量限的计算,其中α-酮戊二酸的检测限最低,为0.20 μmol/L;乙酸的检测限最高,为1.00 μmol/L。α-酮戊二酸的定量限最低,为0.667 μmol/L;乙酸的定量限最高,为3.333 μmol/L(表1)。
2.1.2 精密度和回收率试验
表2为6种有机酸检测的重复性试验结果,由表2可知,各有机酸峰面积的相对标准偏差(relative standard deviation,RSD)的平均值均低于6%,表明该方法具有良好的精密度。表3为该检测方法的回收率试验结果。由表3可知,乳酸的回收率最高,为101.61%;柠檬酸的回收率最低,为92.17%。结果表明各有机酸加样回收率良好。

1:甲酸;2:乳酸;3:乙酸;4:α-酮戊二酸;5:柠檬酸;6:琥珀酸。
1: formate; 2: lactate; 3: acetate; 4: α-ketoglutarate; 5: citrate; 6: succinate.
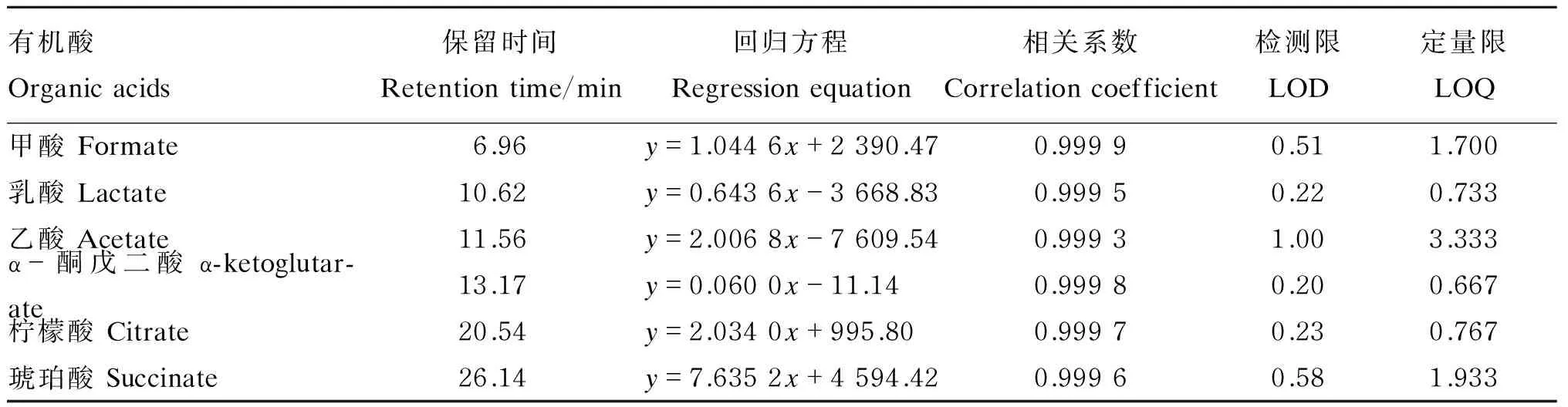
图1 有机酸混合标准品的高效液相色谱图

表2 高效液相色谱检测方法的精密度
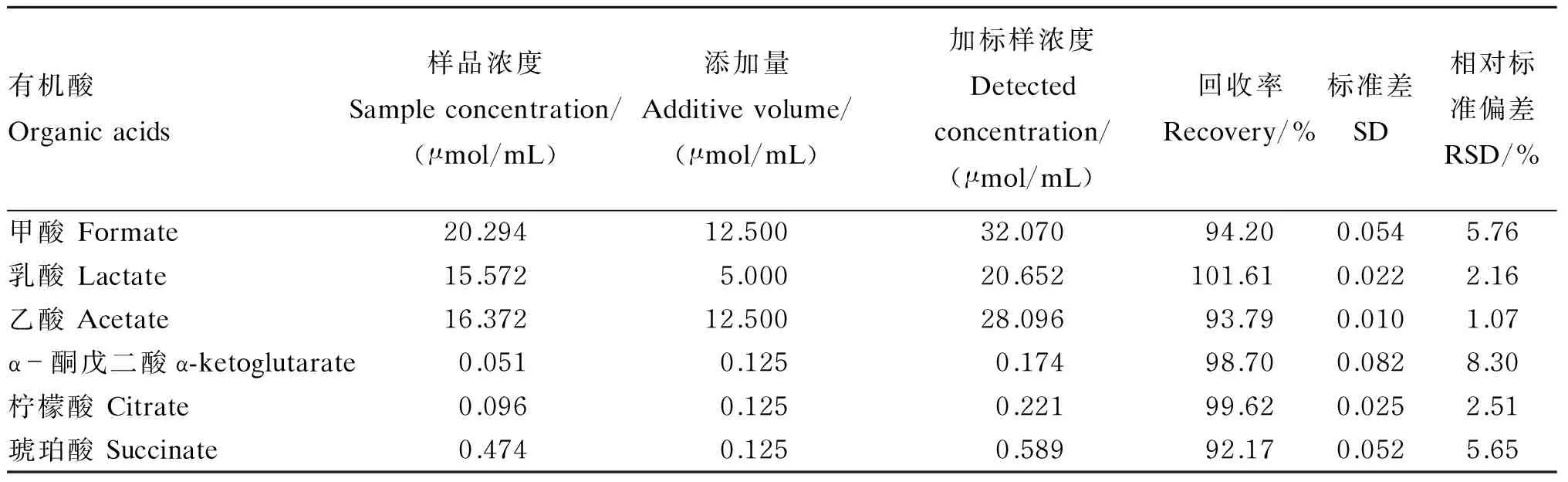
表3 6种有机酸加样回收试验结果
2.2 甲烷菌共存对厌氧真菌葡萄糖代谢的影响
经过72 h培养后,检测发现厌氧真菌纯培养和甲烷菌与厌氧真菌共培养上清液中作为底物的葡萄糖被完全利用,且两者间差异不显著(P>0.05)。利用建立的高效液相色谱法测定有机酸含量时发现,甲烷菌共存影响了厌氧真菌的代谢产物(图2,表4)。由表4可知,厌氧真菌利用葡萄糖的主要水溶性代谢产物为甲酸、乳酸和乙酸。甲烷菌共存显著降低了上清液中甲酸和乳酸的含量(P<0.05),显著增加了上清液中乙酸的含量(P<0.05),对上清液中的微量代谢产物琥珀酸、柠檬酸、α-酮戊二酸和乙醇的含量无显著影响(P>0.05)。

表4 纯培养和共培养上清液中代谢产物含量
同列数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05).
3 讨 论
3.1 检测厌氧真菌代谢的6种有机酸方法的建立
高效液相色谱法具有柱效高、重复性良好、操作方便等特点,并且可以同时定量多种化合物[15]。然而,由于厌氧真菌培养基成分复杂,厌氧真菌代谢产物组分也比较复杂,因此对上清液中有机酸的测定有较大干扰。在条件摸索过程中,笔者发现样品在甲酸目标峰的附近出现了较多杂峰,干扰了甲酸的准确测定。笔者调节了缓冲液pH(1.6~2.7)、缓冲液浓度(5~20 mol/L)、柱温(15~30 ℃)、流动相中甲醇比例和流动相流速等来消除杂峰对甲酸的干扰:缓冲液浓度为5 mmol/L时效果好于其他浓度;pH为2.0和2.4时效果好于其他pH;柱温为30 ℃时效果最好;甲醇的加入与否对结果影响不大;当流速较小时,更有利于各有机酸的分离,然而流速过小会使分析时间过长。通过控制相关因素我们最终得到了最佳组合,最大程度地消除了杂峰对甲酸检测的干扰。
在以往的研究中,厌氧真菌代谢的有机酸往往是利用不同的方法分开测定的,耗时费力,检测灵敏度较低,误差较大,而且测定多集中于甲酸、乙酸、乳酸等含量相对较高的代谢产物,对琥珀酸、柠檬酸和α-酮戊二酸等微量代谢产物的关注则较少。目前还没有一种关于同时检测瘤胃厌氧真菌多种有机酸方法的报道。在以往甲酸采用甲酸脱氢酶法测定[3,8],所需试剂成本较高而且不易保存;乳酸采用气相测定时需衍生化处理[3],因此降低了测定的准确性。本试验结果显示,6种有机酸在30 min内能得到良好的分离效果;各有机酸的回收率在92.17%~101.61%之间,相对标准偏差小于10%。同时,本方法中采用的流动相(KH2PO4-H3PO4缓冲液)浓度低于其他报导[14-15],因而大大降低了高盐对色谱系统的不利影响。而且本方法样品处理简单,整个测定过程中无需应用有毒有害试剂。因此本方法完全满足厌氧真菌发酵液中有机酸的测定。

A:厌氧真菌纯培养上清液样品高效液相色谱图;B:厌氧真菌和甲烷菌共培养上清液样品高效液相色谱图。
A: HPLC chromatograms of anaerobic fungal pure culture supernatant; B: HPLC chromatograms of co-culture of anaerobic fungi and methanogens supernatant.
图2 高效液相色谱分析甲烷菌共存对厌氧真菌代谢产物的影响
Fig.2 Effects of co-cultured methanogens on the metabolites of anaerobic fungi by HPLC
3.2 厌氧真菌发酵葡萄糖的代谢产物和代谢途径
厌氧真菌利用葡萄糖进行混合酸发酵的代谢产物主要为甲酸、乙酸、乙醇、乳酸、CO2和H2[2-3]。与其他好氧真菌不同,厌氧真菌没有线粒体,但其胞内存在一种类似于线粒体的细胞器——氢化酶体(氢体)。厌氧真菌的氢化酶体是细胞内以膜隔离的大约1 μm的小区室,它们在厌氧条件下通过底物水平磷酸化作用产生ATP[12]。厌氧真菌可以同时在细胞质和氢化酶体中进行碳水化合物代谢,细胞质中主要代谢产生乳酸、乙醇和甲酸,而氢化酶体中代谢产生H2、CO2、乙酸和甲酸[16]。本研究中厌氧真菌纯培养的主要代谢产物为甲酸、乳酸和乙酸,以乳酸的浓度为最高,表明有很大一部分的碳水化合物在细胞质中被代谢。Cheng等[10]研究发现,厌氧真菌存在不完整的三羧酸循环(TCA),包括还原支路和氧化支路;其中氧化支路的终产物为α-酮戊二酸,还原支路的终产物为琥珀酸。本试验在厌氧真菌上清液中检测到了代谢产物α-酮戊二酸和琥珀酸,这验证了Kwon等[9]和Cheng等[10]的推测。
3.3 甲烷菌共存对厌氧真菌葡萄糖代谢的影响
在甲烷菌共存情况下,厌氧真菌的主要代谢产物为乳酸和乙酸,以乙酸含量最高。笔者前期的研究表明,在厌氧真菌和甲烷菌共培养的发酵体系中几乎没有氢气的积累,而厌氧真菌纯培养则有氢气积累[6]。甲烷短杆菌属为氢营养型甲烷菌,可以利用氢气或甲酸还原二氧化碳生成甲烷,几乎不利用乙酸[17]。因此,本研究中厌氧真菌与甲烷菌存在着种间氢转移的关系。在甲烷短杆菌存在的情况下,厌氧真菌所产生的代谢产物H2和甲酸会被甲烷菌迅速利用,解除了H2对氢化酶的抑制作用[18]和甲酸对丙酮酸甲酸裂解酶的抑制作用[19],因此氢化酶体中的代谢途径加强,产生的ATP也增多。氢化酶体在产生ATP的同时会伴随着乙酸的生成[20-21]。共培养上清液中乙酸含量显著高于厌氧真菌纯培养组,这表明共培养组中更多的碳水化合物被厌氧真菌氢化酶体所代谢。氢化酶体中含有的氢化酶催化烟酰胺腺嘌呤二核苷酸磷酸(NADPH)生成烟酰胺腺嘌呤二核苷酸(NADH)和氢气,乳酸生成过程中需NADH的参与[4]。当细胞内的NADH减少时,乳酸的生成也会受到影响,因此共培养组的乳酸含量显著低于纯培养组。本研究中,共培养和纯培养发酵液中的琥珀酸、柠檬酸和α-酮戊二酸含量都没有显著差异,这可能是因为从TCA还原支路和氧化支路代谢的碳源量很低且纯培养和共培养所利用底物(葡萄糖)的量无显著差异。
4 结 论
厌氧真菌代谢葡萄糖产生的主要有机酸为甲酸、乳酸、乙酸以及微量的琥珀酸、柠檬酸和α-酮戊二酸。
甲烷菌共存对琥珀酸、柠檬酸、α-酮戊二酸和乙醇的含量无显著影响,却显著减少了甲酸和乳酸的含量,显著增加了乙酸的含量。
[1] EDWARDS J E,KINGSTON-SMITH A H,JIMENEZ H R,et al.Dynamics of initial colonization of nonconserved perennial ryegrass by anaerobic fungi in the bovine rumen[J].FEMS Microbiology Ecology,2008,66(3):537-545.
[2] BORNEMAN W S,AKIN D E,LJUNGDAHL L G.Fermentation products and plant cell wall-degrading enzymes produced by monocentric and polycentric anaerobic ruminal fungi[J].Applied and Environmental Microbiology,1989,55(5):1066-1073.
[3] LOWE S E,THEODOROU M K,TRINCI A P J.Growth and fermentation of an anaerobic rumen fungus on various carbon sources and effect of temperature on development[J].Applied and Environmental Microbiology,1987,53(6):1210-1215.
[4] BOXMA B,VONCKEN F,JANNINK S,et al.The anaerobic chytridiomycete fungusPiromycessp. E2produces ethanol via pyruvate:formate lyase and an alcohol dehydrogenase E[J].Molecular Microbiology,2004,51(5):1389-1399.
[5] JIN W,CHENG Y F,MAO S Y,et al.Isolation of natural cultures of anaerobic fungi and indigenously associated methanogens from herbivores and their bioconversion of lignocellulosic materials to methane[J].Bioresource Technology,2011,102(17):7925-7931.
[6] LI Y F,JIN W,CHENG Y F,et al.Effect of the associated methanogenMethanobrevibacterthauerion the dynamic profile of end and intermediate metabolites of anaerobic fungusPiromycessp. F1[J].Current Microbiology,2016,73:434-441.
[7] BAUCHOP T,MOUNTFORT D O.Cellulose fermentation by a rumen anaerobic fungus in both the absence and the presence of rumen methanogens[J].Applied and Environmental Microbiology,1981,42(6):1103-1110.
[8] CHENG Y F,EDWARDS J E,ALLISON G G,et al.Diversity and activity of enriched ruminal cultures of anaerobic fungi and methanogens grown together on lignocellulose in consecutive batch culture[J].Bioresource Technology,2009,100(20):4821-4828.
[9] KWON M,SONG J,HA J K,et al.Analysis of functional genes in carbohydrate metabolic pathway of anaerobic rumen fungusNeocallimastixfrontalisPMA02[J].Asian-Australasian Journal of Animal Sciences,2009,22(11):1555-1565.
[10] CHENG Y F,JIN W,MAO S Y,et al.Production of citrate by anaerobic fungi in the presence of co-culture methanogens as revealed by1H NMR spectrometry[J].Asian-Australasian Journal of Animal Sciences,2013,26(10):1416-1423.
[11] BARICHIEVICH E M,CALZA R E.Supernatant protein and cellulase activities of the anaerobic ruminal fungusNeocallimastixfrontalisEB188[J].Applied and Environmental Microbiology,1990,56(1):43-48.
[12] MARVIN-SIKKEMA F D,GOMES T M P,GRIVET J P,et al.Characterization of hydrogenosomes and their role in glucose metabolism ofNeocallimastixsp. L2[J].Archives of Microbiology,1993,160(5):388-396.
[13] EDGARDO A,CAROLINA P,MANUEL R,et al.Selection of thermotolerant yeast strainsSaccharomycescerevisiaefor bioethanol production[J].Enzyme and Microbial Technology,2008,43(2):120-123.
[14] 刘晨明,曹宏斌,曹俊雅,等.梯度洗脱高效液相色谱法快速检测厌氧菌代谢物中的有机酸[J].分析化学,2006,34(9):1231-1234.
[15] 王忠永,郑佳音,周铁丽,等.反相高效液相色谱法测定厌氧菌有机酸代谢产物[J].中国微生态学杂志,2007,19(6):527-528.
[16] THEODOROU M K,ZHU W Y,RICKERS A,et al.Biochemistry and ecology of anaerobic fungi[M]//HOWARD D H,MILLER J D.Human and Animal Relationships.Berlin Heidelberg:Springer,1996:265-295.
[17] HEDDERICH R,WHITMAN W B.Physiology and biochemistry of the methane-producing Archaea[M]//DWORKIN M,FALKOW S,ROSENBERG E,et al.The Prokaryotes.New York:Springer,2006:1050-1079.
[18] MARVIN-SIKKEMA F D,RICHARDSON A J,STEWART C S,et al.Influence of hydrogen-consuming bacteria on cellulose degradation by anaerobic fungi[J].Applied and Environmental Microbiology,1990,56(12):3793-3797.
[19] AKHMANOVA A,VONCKEN F G J,HOSEA K M,et al.A hydrogenosome with pyruvate formate-lyase:anaerobic chytrid fungi use an alternative route for pyruvate catabolism[J].Molecular Microbiology,1999,32(5):1103-1114.
[20] MÜLLER M.Review article:the hydrogenosome[J].Microbiology,1993,139(12):2879-2889.
[21] MÜLLER M,MENTEL M,VAN HELLEMOND J J,et al.Biochemistry and evolution of anaerobic energy metabolism in eukaryotes[J].Microbiology and Molecular Biology Reviews,2012,76(2):444-495.
*Corresponding author, associated professor, E-mail: yanfencheng@njau.edu.cn
(责任编辑 武海龙)
Effects of Associated Methanogen on Organic Acid Profile of Metabolism by Anaerobic Fungus Revealed Using High Performance Liquid Chromatography
LI Yuanfei SUN Meizhou CHENG Yanfen*ZHU Weiyun
(JiangsuKeyLaboratoryofGastrointestinalNutritionandAnimalHealth,LaboratoryofGastrointestinalMicrobiology,NanjingAgriculturalUniversity,Nanjing210095,China)
The objective of the present study was to investigate the effects of associated methanogen on organic acid profile of metabolism by anaerobic fungus using the established analytic method of high-performance liquid chromatography (HPLC). The wavelength of detector, concentration of buffer, pH, flow rate, column temperature and volume of injection were determined for HPLC method based on the chemical properties of the organic acids. The established method was then applied to detecting the concentrations of formate, lactate, acetate, α-ketoglutarate, citric acid and succinic acid in the supernatant of fungal mono-culture and co-culture of anaerobic fungi with methanogens. The results showed that the operation condition for HPLC was as follows: 5 mmol/L KH2PO4-H3PO4buffer solution (pH=2.4) at a flow rate of 0.5 mL/min, the column temperature at 25 ℃, injection volume 20 μL and wavelength of detector at 214 nm. The organic acids could be separated and identified by their retention times within 30 min. All the correlation coefficients were no less than 0.999. The limit of detection ranged from 0.20 to 1.00 μmol/L and the limit of quantification ranged from 0.667 to 3.333 μmol/L. The recovery rate varied from 92.17% to 101.61%. The analysis of metabolites in the supernatant of cultures showed that the metabolic profiles of anaerobic fungi were shifted by associated methanogens. The dominant water soluble metabolites of anaerobic fungal pure culture were formate, lactate and acetate. α-ketoglutarate, citric acid, succinic acid and ethanol were detected as well. With the presence of associated methanogens, the concentrations of formate and lactate were significantly decreased (P<0.05), while the concentration of acetate was significantly increased (P<0.05). In conclusion, the six organic acid contents produced by anaerobic fungi can be rapidly and sensitively detected by the established HPLC method. The presence of associated methanogens increases the carbohydrate metabolism in the hydrogenosomes of anaerobic fungi.[ChineseJournalofAnimalNutrition, 2017, 29(4):1198-1204]
high performance liquid chromatography; organic acids; anaerobic fungi; methanogens; co-culture
10.3969/j.issn.1006-267x.2017.04.015
2016-10-01
国家自然科学基金(31101735);中央高校基本科研业务费(KYZ201312);江苏省自然科学基金(BK20141372)
李袁飞(1988—),男,湖南资兴人,博士研究生,从事消化道微生物研究。E-mail: 2014205026@njau.edu.cn
*通信作者:成艳芬,副教授,硕士生导师,E-mail: yanfencheng@njau.edu.cn
S811.6
A
1006-267X(2017)04-1198-07
