核苷和核苷酸类药物抗HBV治疗过程中发生肝细胞癌的临床特征
2017-04-24彭晓华孙琳琳王耀辉谢仕斌
张 英, 刘 明, 彭晓华, 孙琳琳, 王耀辉, 谢仕斌
(中山大学肝脏病医院, 中山大学附属第三医院 感染科, 广州 510630)
核苷和核苷酸类药物抗HBV治疗过程中发生肝细胞癌的临床特征
张 英, 刘 明, 彭晓华, 孙琳琳, 王耀辉, 谢仕斌
(中山大学肝脏病医院, 中山大学附属第三医院 感染科, 广州 510630)
目的 总结核苷和核苷酸类药物(NAs)抗HBV治疗过程中发生肝细胞癌的临床特征。方法 收集2008年1月-2014年9月在中山大学附属第三医院初次诊断为肝细胞癌的患者542例,均为慢性HBV感染者,按是否规范使用NAs治疗分为抗病毒组(130例)及未抗病毒组(412例),回顾性分析比较2组患者的临床资料,包括年龄、性别、肿瘤家族史、HBV感染时间、确诊肝硬化时间、饮酒史、糖尿病史、用药史及实验室检查指标、肝组织病理和影像学检查结果等。符合正态分布的计量资料2组间比较采用t检验,符合偏态分布的计量资料2组间比较采用 Mann-WhitneyU检验,计数资料2组间比较采用χ2检验。结果 与未抗病毒组比较,抗病毒组肝硬化患者的比例显著升高(90.0% vs 78.4%,χ2=8.528,P=0.003);HBeAg阳性率明显升高(29.4% vs 18.5%,χ2=6.794,P=0.009)。抗病毒组HBV DNA构成与未抗病毒组比较,差异有统计学意义(χ2=173.142,P<0.001)。抗病毒组ALT、GGT及AFP与未抗病毒组比较,差异均有统计学意义(P值均<0.001)。与未抗病毒组比较,抗病毒组肝癌多为早、中期肝癌,肝癌癌灶较小、数量较少,较少发生血管受侵或远处转移(P值均<0.001)。抗病毒组中,80%(104/130)的肝癌患者发生在NAs抗HBV治疗的5年内。结论 长期使用NAs抗HBV治疗的部分慢性HBV感染者仍会发生肝癌,尤其是有肝硬化基础的患者;使用NAs抗HBV治疗的患者发生肝癌的病例多出现在抗HBV治疗的5年内;使用NAs治疗的患者发生肝癌时多在早期被诊断,提示规范随访十分重要。
肝炎病毒, 乙型; 癌, 肝细胞; 核苷类; 核苷酸类
慢性HBV感染是肝细胞癌(以下简称肝癌)的高危因素[1]。既往研究显示:HBV感染、男性、高龄(>50岁)、HBV高复制状态、HBeAg阳性、HBV相关的反复肝炎活动、肝硬化基础均与肝癌发生密切相关[2-7]。目前核苷和核苷酸类药物(NAs)已成为抗HBV的主要治疗手段[8],长期治疗可明显降低慢性乙型肝炎患者发生不良临床事件如肝衰竭、肝硬化的风险[10],有研究[9-13]显示NAs治疗可以有效减少肝癌的发生风险。但是,在中长期接受NAs抗HBV治疗的患者中仍有肝癌发生[2],似并不少见。近年来,有研究[9-13]对使用NAs抗HBV治疗的患者发生肝癌的临床特征进行初步分析,但其临床意义仍需进一步阐明。本研究通过回顾性研究,对比长期使用NAs抗HBV治疗发生肝癌的患者与未使用NAs治疗发生肝癌的患者,以期进一步了解NAs治疗下发生HBV相关肝癌患者的临床特征。
1 资料与方法
1.1 研究对象 收集2008年1月-2014年9月中山大学附属第三医院院首次确诊为肝癌的542例患者的临床资料。纳入标准:(1)慢性HBV感染状态,诊断标准符合慢性乙型肝炎防治指南(2015年更新版)[14];(2)规范使用NAs(拉米夫定、阿德福韦、替比夫定、恩替卡韦)抗病毒治疗时间≥6个月,或从未进行抗HBV治疗;(3)肝细胞癌诊断标准符合原发性肝癌诊疗规范(2011年版)[15]。排除标准:(1)合并HCV感染、遗传代谢性肝病、自身免疫性肝病、血吸虫病、HIV感染;(2)其他肿瘤病史;(3)术后病理提示为非肝细胞癌。
1.2 研究方法
1.2.1 收集资料 诊断肝癌时的临床资料:(1)年龄、性别、肿瘤家族史,已知HBV感染时间、确诊肝硬化时间、饮酒史、糖尿病史;(2)NAs用药史;(3)重要临床事件如呕血、大型手术情况;(4)实验室检查资料: HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc及HBV DNA定量,生化学指标如ALT、GGT、TBil、Alb、PT,AFP,组织病理以及影像学检查结果(如肝胆脾胰的形态,肝脏占位数量、大小、位置及与血管的关系等)。1.2.2 分组 根据有无NAs治疗史将所有纳入患者分为抗病毒组和未抗病毒组。

2.1 一般资料 本研究共收集542例肝癌患者的临床资料,单纯依据影像学和AFP临床诊断498例,手术获取病理证实为肝细胞癌44例。其中男492例,女50例,年龄13~86岁,平均(52.06±11.80)岁。其中未抗病毒组412例,抗病毒组130例,未抗病毒组、抗病毒组中诊断肝癌前以每3~6个月间隔在本院随访的分别是28例和69例。抗病毒组中,抗病毒治疗前有肝硬化病史的患者占81.5%(101/124)。2组患者在肝硬化比例、HBV DNA水平及HBeAg阳性率等方面的差异均有统计学意义(P值均<0.05)。与非抗病毒组比较,抗病毒组发生肝癌的患者群体呈现肝硬化比例较高、HBV DNA水平明显低、HBeAg阳性率较高。其他如年龄、性别、家族史等方面的差异无统计学意义(P值均>0.05)(表1)。2.2 诊断肝癌时的生化指标及肿瘤情况 诊断肝癌时,2组间生化指标及肿瘤情况的差异均有统计学意义(P值均<0.05)。抗病毒组呈现出更低的ALT、 GGT和AFP水平,并在肿瘤的分期、大小、癌灶数量、远处转移方面表现出早期化、偏小化、偏单个化和较少远处转移的特点(表2)。

表1 抗病毒组与未抗病毒组一般资料比较
注:因部分患者病例资料不完善,家族史、肝硬化、HBV DNA、HBeAg实录例数与每组的总例数不同

表2 抗病毒组与未抗病毒组生化指标及肿瘤情况
注:因部分患者病例资料不完善,抗病毒组ALT实录例数与总例数不同
2.3 NAs治疗过程中发生肝癌的时点 抗病毒组患者在使用 NAs后发生肝癌的中位时间为3年(0.5~16年),80%的肝癌发生于 NAs治疗后的5年内(表3)。
3 讨论
近年来,长期使用NAs抗HBV治疗明显改善了HBV相关终末期肝病的临床结局。但是,在中长期接受NAs抗HBV治疗的患者中仍常有肝癌发生[4],表明仅通过抑制病毒复制及控制肝脏炎症并不能阻止肝癌的发生。在长期NAs治疗下发生的肝癌与自然状态下发生的肝癌的临床特征有无不同?本研究通过回顾性分析,初步发现有以下特点。
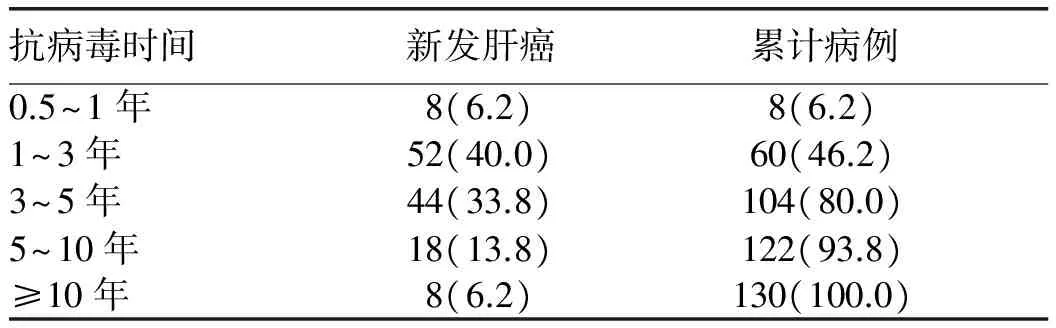
表3 使用NAs抗HBV治疗与肝癌发生时间[例(%)]
注:因部分患者病例资料不完善,抗病毒组ALT实录例数与总例数不同
2组患者在发病年龄、性别、肝癌家族史等方面没有显著性差异,男性患者在全部患者中均占绝大多数。2组患者发生肝癌的平均年龄均在50岁左右,长期NAs抗HBV治疗似并不能改变肝癌的好发年龄,肝癌的发生与乙型肝炎的自然史关系更密切。本研究结果与目前年龄>40岁属于肝癌高危因素之一的观点相符[15],甚至与近年部分研究中使用50岁作为肝癌高发年龄分界的观点也是几近一致的[3,5]。
肝硬化是肝癌的高危因素已成共识[3,5],在长期NAs抗HBV治疗下,肝硬化人群的肝癌发病率也较高。本研究中,肝硬化患者无论在总体还是在各分组中均占极大的比重,抗病毒组肝硬化的比例更高,主要归因于抗病毒组多是因为已存在肝硬化才开始抗病毒治疗,说明肝硬化确是肝癌的高危因素,与既往研究相符[4]。
既往研究认为血清中高水平HBV DNA、ALT可显著增加HBV相关肝癌风险。本研究结果显示,抗病毒组和未抗病毒组之间在HBV DNA水平、HBeAg阳性率及ALT水平等方面的差异显著,与未抗病毒组相比,抗病毒组有更低的HBV DNA水平及ALT水平,主要得益于抗病毒治疗的效果。抗病毒组HBeAg阳性率较高,提示在长时间使用NAs抗HBV治疗的人群中,HBeAg阳性仍是肝癌发生风险的重要预测因素。此外,有8例患者抗病毒治疗时间达10年以上,其中更有1例患者抗病毒治疗时间达16年,均实现病毒学和生化学应答,但仍然发展为肝癌。可见,即使长期使用NAs抗病毒治疗达到完全应答的患者,仍然应注意肝癌的发生。
有研究[8,13,17]发现肝癌多出现在NAs抗病毒治疗的2~5年内。本研究资料显示,80%的肝癌病例发生在NAs抗HBV治疗的5年内,其中时间最长的病例为16年,提示在NAs抗病毒治疗过程中随访的重要性,尤其是在前5年内。
本研究显示抗病毒组在肿瘤评估情况上有明显优势。抗病毒组多为早中期肝癌,癌灶较小、癌灶数量偏单个化、较少出现血管侵犯和远处转移情况,有利于更多的治疗方案选择和更好的预后,主要归因于抗病毒组中的大多数患者定期和规律随访所致,使肝癌得以早期发现。此外,抗病毒组肝癌患者的AFP水平较低,40%的患者在诊断肝癌时AFP<20 ng/ml,30%的患者AFP在20~200 ng/ml,70.8%的患者AFP<200 ng/ml,提示在NAs治疗随访过程中影像学检查的重要性,有轻度AFP升高的患者更要注重影像学检查。
综上,长期接受NAs治疗,尤其有肝硬化基础的患者,仍常有肝癌发生,且多出现在抗HBV治疗的5年内,规范随访是发现早期肝癌的重要措施。
[1] HALEGOUA-DE MARZIO D, HANN HW. Then and now: the progress in hepatitis B treatment over the past 20 years[J]. World J Gastroenterol, 2014, 20(2): 401-413.
[2] YE XQ, GAO FY, SUN L, et al. Improvement of improve the two years survival rate of patients with hepatitis B virus-related primary liver cancer after antiviral treatment[J/CD]. Chin J Exp Clin Infect Dis: Electronic Edition, 2016, 10(3): 304-310. (in Chinese) 叶协琼, 高方媛, 孙乐, 等. 抗病毒治疗提高乙型肝炎病毒相关原发性肝癌患者两年生存率[J/CD]. 中华实验和临床感染病杂志电子版, 2016, 10(3): 304-310.
[3] LIN CL, KAO JH. Risk stratification for hepatitis B virus related hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2013, 28(1): 10-17.
[4] BRUIX J, SHERMAN M. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011, 53(3): 1020-1022.
[5] YANG HI, YUEN MF, CHAN HL, et al. Risk estimation for hepatocellular carcinoma in chronic hepatitis B (REACH-B): development and validation of a predictive score[J]. Lancet Oncol, 2011, 12(6): 568-574.
[6] European Association ror the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1): 167-185.
[7] WONG GL, WONG VW, CHAN HL. Combination therapy of interferon and nucleotide/nucleoside analogues for chronic hepatitis B[J]. J Viral Hepat, 2014, 21(12): 825-834.
[8] WATANABE T, TOKUMOTO Y, JOKO K, et al. Effects of long-term entecavir treatment on the incidence of hepatocellular carcinoma in chronic hepatitis B patients[J]. Hepatol Int, 2016, 10(2): 320-327.
[9] SINGAL AK, SALAMEH H, KUO YF, et al. Meta-analysis: the impact of oral anti-viral agents on the incidence of hepatocellular carcinoma in chronic hepatitis B[J]. Aliment Pharmacol Ther, 2013, 38(2): 98-106.
[10] HOSAKA T, SUZUKI F, KOBAYASHI M, et al. Long-term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection[J]. Hepatology, 2012, 58(1): 98-107.
[11] LIAW YF, SHEEN IS, LEE CM, et al. Tenofovir disoproxil fumarate (TDF), emtricitabine/TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease[J]. Hepatology, 2011, 53(1): 62-72.
[12] PAPATHEODORIDIS GV, MANOLAKOPOULOS S, TOULOUMI G, et al. Virological suppression does not prevent the development of hepatocellular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral antiviral(s) starting with lamivudine monotherapy: results of the nationwide HEPNET. Greece cohort study[J]. Gut, 2011, 60(8): 1109-1116. [13] SINGAL AK, SALAMEH H, KUO YF, et al. Meta-analysis: the impact of oral anti-viral agents on the incidence of hepatocellular carcinoma in chronic hepatitis B[J]. Aliment Pharmacol Ther, 2013, 38(2): 98-106.
[14] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update[J]. J Clin Hepatol, 2015, 31(12): 1941-1960. (in Chinese) 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960.
[15] Ministry of Health of the People′s Republic of China. Diagnosis, management, and treatmen of hepatocellular carcinoma(V2011)[J]. J Clin Hepatol, 2011, 27(11): 1141-1159. (in Chinese) 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011, 27(11): 1141-1159.
[16] Biliary Tract Group, Chinese Society of Surgery, Chinese Medical Association Guidelines for the diagnosis and treatment of hepatolithiasis[J]. Chin J Intect Dis, 2001, 40(1): 56-62. (in Chinese) 中华医学会传染病与寄生虫病学分会, 肝病学分会. 病毒性肝炎防治方案[J]. 中华传染病杂志, 2001, 40(1): 56-62.
[17] SHEN YC, HSU C, CHENG CC, et al. A critical evaluation of the preventive effect of antiviral therapy on the development of hepatocellular carcinoma in patients with chronic hepatitis C or B: a novel approach by using meta-regression[J]. Oncology, 2012, 82(5): 275-289.
引证本文:ZHANG Y, LIU M, PENG XH, et al. Clinical features of patients developing primary hepatocellular carcinoma during anti-HBV therapy with nucleos(t)ide analogues[J]. J Clin Hepatol, 2017, 33(4): 679-683. (in Chinese) 张英, 刘明, 彭晓华, 等. 核苷和核苷酸类药物抗HBV治疗过程中发生肝细胞癌的临床特征[J]. 临床肝胆病杂志, 2017, 33(4): 679-683.
(本文编辑:刘晓红)
Clinical features of patients developing primary hepatocellular carcinoma during anti-HBV therapy with nucleos(t)ide analogues
ZHANGYing,LIUMing,PENGXiaohua,etal.
(LiverHospitalofSunYat-senUniversity,DepartmentofInfectiousDiseases,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China)
Objective To investigate the clinical features of patients developing hepatocellular carcinoma (HCC) during anti-hepatitis B virus (HBV) therapy with nucleos(t)ide analogues (NAs). Methods A total of 542 patients who were diagnosed with HCC for the first time in The Third Affiliated Hospital of Sun Yat-Sen University from January 2008 to September 2014 were enrolled, and they all had chronic HBV infection. According to the presence or absence of standard therapy with NAs, they were divided into antiviral group (130 patients) and non-antiviral group (412 patients). A retrospective analysis was performed for their clinical data, including age, sex, family history of tumor, duration of HBV infection, the time when a confirmed diagnosis of liver cirrhosis was made, history of drinking, history of diabetes, history of medication, laboratory parameters, liver pathology, and imaging findings, and these data were compared between the two groups. Thet-test was used for comparison of normally distributed continuous data between groups, the Mann-WhitneyUtest was used for comparison of non-normally distributed continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. Results Compared with the non-antiviral group, the antiviral group had significant increases in the proportion of patients with liver cirrhosis(90.0% vs 78.4%,χ2=8.528,P=0.003) and HBeAg-positive rate(29.4% vs 18.5%,χ2=6.794,P=0.009). There was a significant difference in the constitution of HBV DNA between the two groups (χ2=173.142,P<0.001), as well as significant differences in alanine aminotransferase, gamma-glutamyl transpeptidase, and alpha-fetoprotein (allP<0.001). Compared with the non-antiviral group, the antiviral group had a higher proportion of patients with early- or intermediate-stage liver cancer, smaller and fewer cancer lesions, and a lower proportion of patients with vascular invasion or distant metastasis (allP<0.001). Among the patients in the antiviral group, 80% (104/130) developed HCC within 5 years of anti-HBV therapy. Conclusion Some patients with chronic HBV infection who receive long-term NAs as the anti-HBV therapy still develop HCC, especially those with liver cirrhosis, and most of these cases occur within 5 years of anti-HBV therapy. Most patients treated with NAs are diagnosed at the early stage of HCC, suggesting that standard follow-up is of vital importance.
hepatitis B virus; carcinoma, hepatocellular; nucleosides; nucleotides
10.3969/j.issn.1001-5256.2017.04.016
2016-10-17;
2016-12-13。
张英(1974-),女,主治医师,主要从事病毒性肝炎的临床诊治研究;刘明(1989-),男,主要从事病毒性肝炎相关疾病的研究。
二者对本文贡献相同,同为第一作者。
谢仕斌,电子信箱:xieshibin1964@163.com。
R735.7
A
1001-5256(2017)04-0679-05
