免疫检查点抑制剂治疗中免疫相关不良反应的临床表现及处理①
2017-04-24王巧红
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海市妇科肿瘤重点实验室,上海200127)
免疫检查点抑制剂治疗中免疫相关不良反应的临床表现及处理①
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海市妇科肿瘤重点实验室,上海200127)
免疫检查点阻断治疗是当今备受瞩目的新兴肿瘤治疗方式。不同于以往其他治疗方式,免疫检查点抑制剂靶向机体免疫系统而非肿瘤细胞,旨在恢复并促进效应T细胞特异性识别和杀伤肿瘤细胞的功能,系统性增强全身的抗肿瘤免疫反应,因而代表了当前肿瘤治疗模式的转变。迄今多个临床试验已证实免疫检查点抑制剂在晚期黑色素瘤、非小细胞肺癌(Non-small-cell lung cancer,NSCLC)及膀胱癌、肾细胞癌(Renal cell carcinoma,RCC)、霍奇金淋巴瘤、卵巢癌等恶性肿瘤中的客观临床作用。然而随着越来越多临床试验的进行,免疫治疗相关不良反应(Immune-related adverse events,irAEs)的发生引起了人们的重视。由于irAEs常常涉及包括皮肤、消化道、肝脏、内分泌、呼吸等多系统,并且可能迅速发展甚至致命,早期识别和处理成为临床医生面临的一大挑战。早期识别免疫检查点抑制剂治疗中的irAEs,并根据相关指南和临床经验做出适当及时的处理,这是免疫检查点抑制剂治疗中不容忽视的内容。本文就常见irAEs的临床表现及处理作一介绍。
1 目前商品化生产的免疫检查点抑制剂
目前已知的免疫检查点包括:程序性死亡蛋白1(Programmed death protein-1,PD-1)、细胞毒T淋巴细胞相关抗原4(Cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)、淋巴细胞活化基因3(Lyphocyte activation gene 3,LAG3)等[1]。免疫检查点分子的效应可以通过单抗阻断共抑制受体或刺激共刺激受体进行调节。表达于T细胞的受体CTLA-4是第一个发现的免疫检查点分子,激活后能抑制早期阶段T细胞的活化从而抑制免疫反应。因此,阻断CTLA-4能激活广泛非特异性的免疫反应。抗CTLA-4药物能有效治疗晚期黑色素瘤,带来总生存期(Overall survival,OS)的获益[2]。2011年,美国FDA批准抗CTLA-4药物Ipilimumab用于晚期黑色素瘤的治疗。
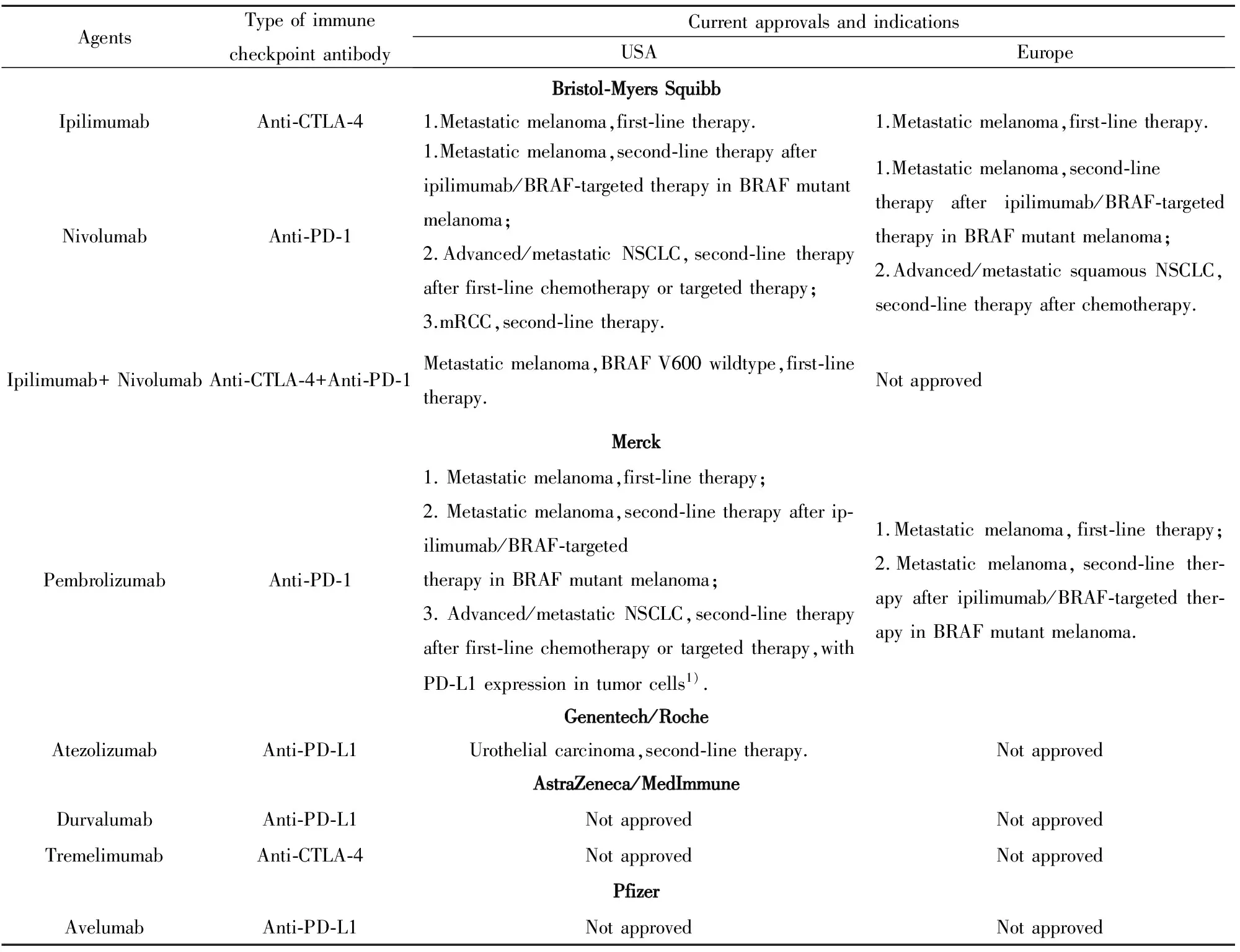
PD-1表达于肿瘤微环境中肿瘤细胞和免疫浸润细胞表面,参与活化T细胞和肿瘤细胞间的反应[3]。肿瘤细胞通过PD-1与配体PD-L1间的相互作用,抑制机体的免疫反应。目前主要的抗PD-1抗体为Nivolumab和Pembrolizumab。三项Pembrolizu-mab的临床试验证实了其在转移性黑色素瘤中的疗效,包括KEYNOTE-001、KEYNOTE-002和KEYN-OTE-006[4-6]。2015年美国临床肿瘤大会(American Society of Clinical Oncology,ASCO)年度会议上,KEYNOTE-001试验显示34%患者获得客观缓解,6%患者获得完全缓解[4-6]。由此美国FDA批准抗PD-1药物Pembrolizumab和Nivolumab用于晚期黑色素瘤、NSCLC和RCC的治疗,它们在多种实体瘤和血液学恶性肿瘤中的疗效也已在多项研究中得到证实[4,7-12]。抗PD-L1药物Atezolizumab在NSCLC和转移性膀胱癌中的疗效已得到证实;Avelumab、Durvalumab等的相关疗效也都在研究中[13,14]。表1汇总了目前商品化生产的免疫检查点抑制剂。
2 irAEs的临床表现
2.1 抗CTLA-4单药 抗CTLA-4药物irAEs最常影响皮肤(44%)及消化道(35%),内分泌系统(6%)和肝脏(5%)相对累及较少[15]。目前认为抗CTLA-4药物irAEs的发病时间有固定模式,一般皮肤毒性发生在治疗开始的3~4周,消化道毒性发生在6~7周,而内分泌病通常发生在治疗9周后[16]。接受Ipilimumab(3 mg/kg,每3周)治疗的晚期黑色素瘤患者中,irAEs发生率约为60%~65%,受累器官分别为皮肤(43%~45%),消化道(29%~32%),内分泌系统和肝脏(6%~8%)。这些irAEs多发生于治疗开始的12周内,主要为1~2级不良反应,缓解的中位时间为4.6周[2,17]。此外,发现抗CTLA-4药物可能具有剂量依赖性,接受Ipilimumab 0.3、3和10 mg/kg治疗的黑色素瘤患者irAEs发生率分别为26%、65%和70%;其中高级别(3~4级)分别为0、7%、25.3%[17]。
表1 目前商品化生产的免疫检查点抑制剂
Tab.1 Current immune checkpoint inhibitors in use
AgentsTypeofimmunecheckpointantibodyCurrentapprovalsandindicationsUSAEuropeBristol⁃MyersSquibbIpilimumabAnti⁃CTLA⁃41.Metastaticmelanoma,first⁃linetherapy.1.Metastaticmelanoma,first⁃linetherapy.NivolumabAnti⁃PD⁃11.Metastaticmelanoma,second⁃linetherapyafteripilimumab/BRAF⁃targetedtherapyinBRAFmutantmelanoma;2.Advanced/metastaticNSCLC,second⁃linetherapyafterfirst⁃linechemotherapyortargetedtherapy;3.mRCC,second⁃linetherapy.1.Metastaticmelanoma,second⁃linetherapyafteripilimumab/BRAF⁃targetedtherapyinBRAFmutantmelanoma;2.Advanced/metastaticsquamousNSCLC,second⁃linetherapyafterchemotherapy.Ipilimumab+NivolumabAnti⁃CTLA⁃4+Anti⁃PD⁃1Metastaticmelanoma,BRAFV600wildtype,first⁃linetherapy.NotapprovedMerckPembrolizumabAnti⁃PD⁃11.Metastaticmelanoma,first⁃linetherapy;2.Metastaticmelanoma,second⁃linetherapyafterip⁃ilimumab/BRAF⁃targetedtherapyinBRAFmutantmelanoma;3.Advanced/metastaticNSCLC,second⁃linetherapyafterfirst⁃linechemotherapyortargetedtherapy,withPD⁃L1expressionintumorcells1).1.Metastaticmelanoma,first⁃linetherapy;2 Metastaticmelanoma,second⁃linether⁃apyafteripilimumab/BRAF⁃targetedther⁃apyinBRAFmutantmelanoma.Genentech/RocheAtezolizumabAnti⁃PD⁃L1Urothelialcarcinoma,second⁃linetherapy.NotapprovedAstraZeneca/MedImmuneDurvalumabAnti⁃PD⁃L1NotapprovedNotapprovedTremelimumabAnti⁃CTLA⁃4NotapprovedNotapprovedPfizerAvelumabAnti⁃PD⁃L1NotapprovedNotapproved
Note:1)PD-L1 expression:if >50% tumor cells stain positive by immunohistochemistry,using PD-L1 IHC 22C3 pharmDx companion diagnostic test.NSCLC:non-small cell lung carcinoma; mRCC:metastatic renal cell carcinoma.
皮肤毒性是抗CTLA-4治疗最常见的免疫相关不良反应,发生率为43%~45%,最常表现为皮疹和瘙痒,其次是白癜风[2,17]。皮疹一般无症状或伴有瘙痒,呈网状分布,躯干和四肢均有累及,具有红斑、水肿、斑丘疹等表现。其他皮肤毒性包括Sweet′s综合征、Stevens Johnson综合征、中毒性表皮坏死松解症和药物超敏反应综合征(Drug reaction with eosinophilia and systemic symptoms,DRESS)等[18-21]。Ipilimumab相关皮疹的Meta分析显示皮疹发生率为24.3%,其中高级别为2.4%;而3 mg/kg与10 mg/kg剂量组皮疹发生率无显著差异[22]。
消化道不良反应是抗CTLA-4治疗的另一重要毒性反应。转移性黑色素瘤或RCC患者中,Ipilimumab相关消化道症状包括腹泻(40%)、腹痛(8%)、恶心/呕吐(6%)及严重黑便和血便(2%)[23]。腹泻和结肠炎是最主要的消化道irAEs,结肠炎具有发生消化道穿孔的潜在危险,从而危及患者生命。鉴于相关死亡事件的报道,临床医生应对相应症状高度重视。根据常见不良反应事件评价标准(Common terminology criteria for adverse events,CTCAE)4.03版,结肠炎和腹泻并不等同,结肠炎指腹泻伴有腹痛、黏液便或血便以及腹膜炎征象;而腹泻仅与大便频率相关。尽管如此,它们的发病在临床上十分相似,大部分结肠炎患者主要表现为腹泻,多数为水样便,严重腹痛或血便较为少见[24,25]。因此在临床实践中,推荐对严重腹泻(≥2级)患者进行乙状结肠镜或结肠镜检查[26]。Ⅲ期试验中,接受高剂量(10 mg/kg)Ipilimumab治疗的黑色素瘤患者结肠炎发生率和严重性更甚,其发生率为15.6%,其中高级别为7.6%[27]。在一项编号为CA184-022的临床试验中,接受Ipilimumab 0.3、3和10 mg/kg治疗的三个剂量组中,患者消化道irAEs的发生率随剂量增加而升高[17]。
抗CTLA-4治疗还能够影响内分泌系统,6%~8%患者发生包括下垂体炎、甲状腺功能紊乱和肾上腺功能不全等不良反应。其中以下垂体炎最为常见,这是一种影响垂体的炎症,患者表现为全垂体功能减退或仅垂体前叶激素缺乏,症状包括疲劳、头痛、眩晕、记忆障碍和视觉障碍等。抗CTLA-4治疗导致的甲状腺功能紊乱包括甲减、甲亢和甲状腺炎。Ⅲ期试验中,治疗相关甲减发生率为1.5%~15%,其中高级别小于5%;而甲亢更少见,发生率仅0.4%~2.3%[4,28]。
肝脏毒性较少见,常表现为无症状的转氨酶升高伴或不伴胆红素升高,常在治疗开始的8~12周出现,也有可能与发烧、疲劳、腹痛等具有相关性[7]。影像学表现包括肝肿大、门静脉及周围淋巴结水肿[29]。其他irAEs包括肺部、神经和肾脏毒性都较为少见,各有个别案例报告。
2.2 抗PD-1/PD-L1单药 抗PD-1/PD-L1药物irAEs与抗CTLA-4药物类似,但是发生率和严重程度均较抗CTLA-4药物低。临床试验KEYNOTE-006中,比较Ipilimumab和Pembrolizumab疗效,接受Pembrolizumab治疗组(10 mg/kg,每2周和10 mg/kg,每3周)irAEs发生率小于Ipilimumab治疗组(3 mg/kg,每3周),分别为13%、10%、20%[4]。发病时间与抗CTLA-4药物接近,首先出现皮肤和消化道毒性,随后累及肝脏和内分泌系统。不同于抗CTLA-4药物,抗PD-1/PD-L1药物的毒性反应似乎与剂量无关。接受Pembrolizumab治疗的Ⅰ期试验中,高级别irAEs的发生率在2 mg/kg剂量组发生率为1%,而在10 mg/kg剂量组为2%,两者无显著差异[5]。
Ⅲ期试验中,皮肤irAEs发生率为4%~15%,其中高级别事件小于2%[4,7,8,10,11,30,31]。与抗CTLA-4药物相似,皮疹最常见的表现为弥漫性斑丘疹。白癜风发生率较抗CTLA-4药物高,接受Pembrolizumab治疗的Ⅲ期试验中,患者白癜风发生率为9%~11%[4]。此外还有包括苔藓样皮炎、大疱性类疱疮、Stevens-Johnson综合征和中毒性表皮坏死松解症等表现。
相比抗CTLA-4治疗,抗PD-1/PD-L1治疗中腹泻/结肠炎的发生率低得多。比较Nivolumab单药、Ipilimumab单药、Nivolumab联合Ipilimumab治疗的Ⅲ期试验,发现Nivolumab单药组腹泻发生率为19.2%,其中1.3%发展为结肠炎;而Ipilimumab单药组腹泻和结肠炎发生率分别为33.1%和11.6%。同样,Pembrolizumab单药和Ipilimumab单药的比较试验中,腹泻和结肠炎的发生率Pembrolizumab单药组(腹泻14.4%,结肠炎3.6%)较Ipilimumab单药组(腹泻22.7%,结肠炎8.2%)更低[4,7,8,10,11,30,31]。不同于抗CTLA-4药物,抗PD-1/PD-L1药物相关腹泻主要为低级别,3~4级发生率小于1%[5]。
下垂体炎更常见于抗CTLA-4治疗,抗PD-1/PD-L1药物相关下垂体炎发生率小于1%。甲亢和甲减相对更多见,发生率分别为1%~6.5%和4%~10%[4,10,11,30,31],多数为低级别,3~4级甲亢或甲减发生率均小于1%[4]。
研究发现抗PD-1/PD-L1药物相关肺炎的发生率为5%或更少[4,7,8,10,11,30,31]。虽然其发生率较其他irAEs低,但是相关肺炎会导致死亡事件的发生。临床试验CA209-003中,3例接受Nivolumab单药治疗患者因治疗相关肺炎而死亡[32]。肺炎的临床表现缺乏特异性,包括上呼吸道感染;新发的咳嗽,通常为持续性干咳;呼吸困难等。
其他如肝脏、肾脏、神经和胰腺irAEs均较少见。接受Nivolumab、Pembrolizumab和Atezolizumab治疗的患者中,转氨酶升高的发生率小于5%,高级别发生率小于2%[4,11,13,14,31]。肾毒性方面,接受Nivolumab和Pembrolizumab治疗的患者中,肾衰的发生率小于2.5%;周围神经病变的发生率为1%或更少;胰腺毒性则表现为无症状的脂肪酶和淀粉酶升高,其中小于1%或更少患者发展为胰腺炎[10,11,33]。
2.3 抗CTLA-4联合抗PD-1/PD-L1 由于两种药物不同的活化机制,作用于淋巴细胞亚型和位置的不同,两者联合使用导致的irAEs发生率和严重程度更高,涉及面也更广。Ⅲ期试验中,irAEs在Nivolumab和Ipilimumab联合治疗组(96%)高于Ipilimumab单药组(86%)和Nivolumab单药组(82%),其中高级别分别为55%、27%和16%[34]。联合治疗irAEs类型与单药治疗相似,评估联合治疗安全性和疗效的Ⅰ期研究中, irAEs发生率为93%。常见不良反应为皮疹(55%)、瘙痒(47%)、疲劳(38%)、腹泻(34%)、恶心(21%)和发热(21%),其中高级别发生率(53%)较单药治疗高。最常见的3~4级反应为脂肪酶升高(13%)、天冬氨酸转氨酶升高(13%)和丙氨酸转氨酶升高(11%),提示了胰腺和肝脏毒性[17]。治疗相关死亡事件包括呼吸衰竭、肺出血、中毒性表皮松解症、重症肌无力、肾衰竭、心包积液和肺炎等。
3 irAEs的临床处理
目前,免疫检查点抑制剂治疗中irAEs的治疗主要依赖临床经验积累。尽管irAEs的发病时间可能存在一定模式,但是在患者治疗的任何时间包括治疗停止后仍然可能发生irAEs,因而临床医生需对irAEs的信号和症状保持警惕,早期识别和处理显得尤为重要。患者教育和密切交流也是irAEs处理的关键因素。临床医生需要告知患者irAEs的症状和体征,为其提供特定教育资料,并在整个治疗过程中与患者保持密切交流,鼓励患者在irAEs症状或体征出现的早期寻求帮助。美国危险评估和缓解策略(Risk evaluation and mitigation strategy,REMS)提供了处理Ipilimumab相关irAEs的指南[35]。抗PD-1/PD-L1单药和联合治疗irAEs的处理与之类似。对于不妨碍日常生活的1~2级不良反应根据症状进行对症处理,通常无须减药或停止治疗。持续性2级不良反应,除对症处理外需暂停治疗。发生3~4级不良反应的患者建议停止治疗并进行多学科会诊。糖皮质激素可用于持续性2级或更严重的irAEs,具体适应症和剂量视irAEs情况而定。通常规定糖皮质激素的使用剂量为中到大剂量(强的松0.5~1 mg/kg),并且必须持续用药至症状缓解、减轻或回到基线水平,随后可以开始减量,持续时间至少1月[16]。
3.1 皮肤毒性 皮疹和瘙痒一般通过药用润肤霜、抗组胺剂和局部糖皮质激素能予以改善,一般无需停止治疗。如果发生危及生命的严重皮疹(3~4级:超过体表面积30%),需要暂时或永久停止治疗。系统性使用糖皮质激素如强的松1~2 mg/(kg·d)(或其他等效剂量),持续时间至少1月。
3.2 消化道毒性 腹泻的早期处理相当重要。1~2级腹泻(1级:<4次/d,2级:4~6次/d)可予止泻药如洛哌丁胺和口服补液对症处理。持续性2级或2级伴有腹痛、黏液便或血便患者,推荐进行乙状结肠镜和结肠镜检查。诊断前需进行巨细胞病毒、病原菌和艰难梭菌毒素检查,以排除缺血或感染等其他原因。患者需暂停治疗,如果症状持续超过1周,口服强的松0.5 mg/(kg·d)。3~4级腹泻或结肠炎(>7次/d,腹膜炎症状或严重腹泻)患者,需立即住院治疗并予静脉用糖皮质激素,同时停止免疫治疗。此类患者必须进行乙状结肠镜检查。患者大便次数的减少以及整体健康的改善提示治疗有效。如果经过5 d静脉糖皮质激素治疗,症状仍无明显改善,考虑加用TNF-α抑制剂英夫利昔(Infliximab)5 mg/kg 治疗[36-38]。使用英夫利昔的患者需密切关注消化道穿孔的发生,一旦怀疑立即考虑外科手术。
3.3 内分泌病 怀疑免疫相关内分泌病时,需进行完整检查以确定垂体、甲状腺、肾上腺和性腺的功能状态,包括促肾上腺皮质激素(ACTH)、皮质醇、催乳素、促甲状腺激素(TSH)、游离T4、卵泡刺激素(FSH)、黄体生成素(LH)和雌二醇/睾酮等。怀疑下垂体炎,尤其伴有头痛或视觉症状时,考虑大脑和垂体的磁共振成像和视觉区域检测。一旦发生下垂体炎,立即开始激素替代治疗(Hormone replacement therapy,HRT),无须等待确诊以免症状加重。一般无须使用免疫抑制剂糖皮质激素,仅伴有大量症状患者,需静脉用甲强龙1~2 mg/kg,症状改善后改为口服强的松1~2 mg/kg,逐渐减量持续时间至少1月,同时应用HRT[16]。甲状腺炎一般无痛也没有明显症状。发生甲亢,可予β-阻滞剂和抗焦虑药对症治疗,除非发生Grave′s病否则无须使用抗甲状腺药物。若甲亢自行消退并发展为甲减,需采用HRT。肾上腺危象是irAEs中内分泌相关最紧急的症状,患者常伴有严重脱水、低血压或休克,需立即住院治疗,静脉用糖皮质激素和盐皮质激素,暂时或永久停止免疫治疗,同时警惕败血症或感染的发生。尽管在应用HRT后内分泌相关症状能缓解,情况稳定患者的检查点抑制剂治疗也可恢复,但免疫治疗相关内分泌病有较高的不可逆风险,因而早期激素水平的监测很有必要。建议所有患者在治疗初检测TSH、ACTH和皮质醇的基线水平,发生任何可疑症状时都应再次检测。在治疗的前3个月每个月进行一次系统性激素水平检查,随后每2个月检查一次。
3.4 肝脏毒性 排除如进展性肝病、病毒性肝炎或同期药物等非炎症因素后,进行肝功能检查、肝脏影像学检查和活检等有助于确定肝脏相关毒性反应。活检一般显示弥漫性淋巴细胞浸润,与免疫相关性肝炎表现一致。肝脏毒性一般无明显症状,因而需密切监测肝功能。2级不良反应(3倍正常上限
3.5 肺炎 免疫检查点抑制剂导致的肺炎恶化迅速,建议对所有患者包括1级症状进行严密随访。需排除感染、自身免疫病如肺结节病加重等情况,必要时考虑气管镜检查和肺部活检。2级症状,暂停免疫治疗,密切监测,静脉用甲强龙1.0 mg/(kg·d),症状改善后改为口服强的松1.0~2.0 mg/(kg·d),疗程持续至少1月。如果症状2周后无改善或加重,按3~4级症状治疗。3~4级症状,停止免疫治疗,密切监测,静脉用甲强龙2.0~4.0mg/(kg·d)。症状改善后改为口服强的松,治疗至少6周后方可减量。如果症状2 d后仍持续或加重,考虑增加其他免疫抑制治疗,如英夫利昔或霉酚酸酯。
大量免疫抑制剂如糖皮质激素或其他免疫抑制治疗的应用,使患者机会感染的风险大大提高。建议对任何irAEs延长免疫抑制治疗时间(大于4~6周)的患者作预防性处理。此外,有学者提出糖皮质激素的免疫抑制作用可能影响免疫检查点治疗的抗肿瘤效应,对此目前无明确数据支持。Ⅱ期临床试验汇总分析显示,抗CTLA-4治疗的139例患者,高剂量糖皮质激素使用并未影响患者客观缓解率(Objective response rate,ORR)[39]。接受Ipilimumab治疗的黑色素瘤患者中,35%患者应用全身性糖皮质激素治疗irAEs,10%患者应用抗TNF-α抗体治疗irAEs,应用糖皮质激素治疗与OS和治疗失败时间(Time to treatment failure,TTF)并无关联[40]。
4 展望
免疫检查点抑制剂是目前广受期待的肿瘤治疗药物,其独特的起效机制对于各种实体瘤和血液学肿瘤都有疗效,然而其起效机制同样会导致特殊的不良反应。早期识别irAEs并及时处理能大大减少对患者的伤害同时降低治疗中止风险。临床医生需对各类irAEs症状和体征保持警惕,密切关注患者变化,对患者实行个性化治疗原则。当然目前仍有许多问题有待解决,如糖皮质激素治疗对抗肿瘤效应的影响,免疫抑制治疗并发症的处理等。相信随着对免疫检查点抑制剂毒性机理的进一步探索,以及更多研究的开展和临床经验的积累,这些问题都能一一解决,从而保障患者的最大获益和最小伤害。
[1] Patel SP,Osada T,Osada K,etal.Modulation of immune system inhibitory checkpoints in colorectal cancer[J].Curr Colorectal Cancer Rep,2013,9(4):391-397.
[2] Hodi FS,O′Day SJ,McDermott DF,etal.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med,2010,363(8):711-723.
[3] Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264.
[4] Robert C,Schachter J,Long GV,etal.Pembrolizumab versus ipilimumab in advanced melanoma[J].N Engl J Med,2015,372(26):2521-2532.
[5] Robert C,Ribas A,Wolchok JD,etal.Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma:a randomised dose-comparison cohort of a phase 1 trial[J].Lancet,2014,384(9948):1109-1117.
[6] Ribas A,Puzanov I,Dummer R,etal.Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma(KEYNOTE-002):a randomised,controlled,phase 2 trial[J].Lancet Oncol,2015,16(8):908-918.
[7] Weber JS,D′Angelo SP,Minor D,etal.Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment(CheckMate 037):a randomised,controlled,open-label,phase 3 trial[J].Lancet Oncol,2015,16(4):375-384.
[8] Motzer RJ,Escudier B,McDermott DF,etal.Nivolumab versus everolimus in advanced renal-cell carcinoma[J].N Engl J Med,2015,373(19):1803-1813.
[9] Le DT,Uram JN,Wang H,etal.PD-1 blockade in tumors with mismatch-repair deficiency[J].N Engl J Med,2015,372(26):2509-2520.
[10] Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J].N Engl J Med,2015,373(2):123-135.
[11] Borghaei H,Paz-Ares L,Horn L,etal.Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J].N Engl J Med,2015,373(17):1627-1639.
[12] Ansell SM,Lesokhin AM,Borrello I,etal.PD-1 blockade with nivolumab in relapsed or refractory Hodgkin′s lymphoma[J].N Engl J Med,2015,372(4):311-319.
[13] Rosenberg JE,Hoffman-Censits J,Powles T,etal.Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy:a single-arm,multicentre,phase 2 trial[J].Lancet,2016,387(10031):1909-1920.
[14] Fehrenbacher L,Spira A,Ballinger M,etal.Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR):a multicentre,open-label,phase 2 randomised controlled trial[J].Lancet,2016,387(10030):1837-1846.
[15] Bertrand A,Kostine M,Barnetche T,etal.Immune related adverse events associated with anti-CTLA-4 antibodies:systematic review and meta-analysis[J].BMC Med,2015,13(1):1-14.
[16] Weber JS,Kahler KC,Hauschild A.Management of immune-related adverse events and kinetics of response with ipilimumab[J].Clin Oncol,2012,30(21):2691-2697.
[17] Wolchok JD,Neyns B,Linette G,etal.Ipilimumab monotherapy in patients with pretreated advanced melanoma:a randomised,double-blind,multicentre,phase 2,dose-ranging study[J].Lancet Oncol,2010,11(2):155-164.
[18] Voskens CJ,Goldinger SM,Loquai C,etal.The price of tumor control:an analysis of rare side effects of anti-CTLA-4 therapy in metastatic melanoma from the ipilimumab network[J].PLoS One,2013,8(1):e53745.
[19] Postow MA.Managing immune checkpoint-blocking antibody side effects[J].Clin Oncol,2015,doi:10.14694/EdBook_AM.2015.35.76.
[20] Pintova S,Sidhu H,Friedlander PA,etal.Sweet′s syndrome in a patient with metastatic melanoma after ipilimumab therapy[J].Melanoma Res,2013,23(6):498-501.
[21] Naidoo J,Page DB,Li BT,etal.Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J].Ann Oncol,2015,26(12):2375-2391.
[22] minkis K,Garden BC,Wu S,etal.The risk of rash associated with ipilimumab in patients with cancer:a systematic review of the literature and meta-analysis[J].J Am Acad Dermatol,2013,69(3):e121-e128.
[23] Beck KE,Blansfield JA,Tran KQ,etal.Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4[J].Clin Oncol,2006,24(15):2283-2289.
[24] Marthey L,Robert C,Nachury M,etal.Mo1318 Ipilimumab colitis:a GETAID multicentric study[J].Gastroenterology,2013,144(5):S635-S636.
[25] Gupta A,De Felice KM,Loftus EV Jr,etal.Systematic review:colitis associated with anti-CTLA-4 therapy[J].Aliment Pharmacol Ther,2015,42(4):406-417.
[26] Dignass A,Lindsay JO,Sturm A,etal.Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2:current management[J].J Crohns Colitis,2012,6(10):991-1030.
[27] Eggermont AM,Chiarion-Sileni V,Grob JJ,etal.Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma(EORTC 18071):a randomised,double-blind,phase 3 trial[J].Lancet Oncol,2015,16(5):522-530.
[28] Abdel-Rahman O,ElHalawani H,Fouad M.Risk of endocrine complications in cancer patients treated with immune check point inhibitors:a meta-analysis[J].Fut Oncol,2016,12(3):413-425.
[29] Kim KW,Ramaiya NH,Krajewski KM,etal.Ipilimumab associated hepatitis:imaging and clinicopathologic findings[J].Invest New Drug,2013,31(4):1071-1077.
[30] Robert C,Long GV,Brady B,etal.Nivolumab in previously untreated melanoma without BRAF mutation[J].N Engl J Med,2015,372(4):320-330.
[31] Herbst RS,Baas P,Kim DW,etal.Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial[J].Lancet,2016,387(10027):1540-1550.
[32] Topalian SL,Hodi FS,Brahmer JR,etal.Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[33] Hamid O,Robert C,Daud A,etal.Safety and tumor responses with lambrolizumab(anti-PD-1)in melanoma[J].N Engl J Med,2013,369(2):134-144.
[34] Larkin J,Hodi FS,Wolchok JD.Combined Nivolumab and Ipilimumab or monotherapy in untreated melanoma[J].N Engl J Med,2015,373(13):1270-1271.
[35] Slatko GH.Risk evaluation and mitigation strategy(REMS):FDA perspective on what physicians need to know[J].Am Fam Physician,2015,92(9):771-772.
[36] Pages C,Gornet JM,Monsel G,etal.Ipilimumab-induced acute severe colitis treated by infliximab[J].Melanoma Res,2013,23(3):227-230.
[37] Minor DR,Chin K,Kashani-Sabet M.Infliximab in the treatment of anti-CTLA4 antibody(ipilimumab)induced immune-related colitis[J].Cancer Biother Radiopharm,2009,24(3):321-325.
[38] Merrill SP,Reynolds P,Kalra A,etal.Early administration of infliximab for severe ipilimumab-related diarrhea in a critically ill patient[J].Ann Pharmacother,2014,48(6):806-810.
[39] Downey SG,Klapper JA,Smith FO,etal.Prognostic factors related to clinical response in patients with metastatic melanoma treated by CTL-associated antigen-4 blockade[J].Clin Cancer Res,2007,13(22 Pt 1):6681-6688.
[40] Yang JC,Hughes M,Kammula U,etal.Ipilimumab(anti-CTLA4 antibody)causes regression of metastatic renal cell cancer associated with enteritis and hypophysitis[J].J Immunother,2007,30(8):825-830.
[收稿2016-09-07 修回2016-10-13]
(编辑 倪 鹏)
10.3969/j.issn.1000-484X.2017.04.029
①本文受国家自然科学基金面上项目(81472843)及上海市科学技术委员会上海市科研计划项目(14ZR1424700)资助。
王巧红(1993年-),女,硕士,主要从事妇科恶性肿瘤临床与基础方面研究,E-mail:wqh930814@126.com。
及指导教师:吴 霞(1973年-),女,博士,副主任医师,副教授,硕士生导师,主要从事妇科恶性肿瘤临床与基础方面的研究,E-mail:wuxia1225@aliyun.com。
R711.75
A
1000-484X(2017)04-0615-06
