应用rmIL-18诱导肿瘤特异性CTL治疗肝癌的实验研究①
2017-04-24米旭光李首庆魏海峰许淑芬方艳秋
米旭光 刘 磊 李首庆 魏海峰 许淑芬 谭 岩 方艳秋
(吉林省人民医院肿瘤综合治疗科,长春130021)
·生物治疗·
应用rmIL-18诱导肿瘤特异性CTL治疗肝癌的实验研究①
米旭光 刘 磊 李首庆 魏海峰 许淑芬 谭 岩 方艳秋
(吉林省人民医院肿瘤综合治疗科,长春130021)
目的:研究rmIL-18在体外培养系统(Coculture system in vitro,CCs)诱导肿瘤特异性细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)及在小鼠体内发挥的抗肝癌效果。方法:采用Stem SepTM免疫磁性细胞分离方法分离培养小鼠脾脏NK细胞、T细胞及DCs,建立体外培养系统;采用不同途径,不同剂量CTL免疫肝细胞癌荷瘤小鼠,研究CTL对荷瘤小鼠肿瘤生长速度和生存时间的影响。结果:rmIL-18能够在体外培养系统中诱导并促进CTL介导的肿瘤特异性杀伤效应;CTL能够明显抑制荷肝癌小鼠的肿瘤生长速度(P<0.01)及明显延长荷瘤小鼠生存时间(P<0.01),并且这种作用随rmIL-18浓度的增加而增强(P<0.01),且肿瘤内注射均优于腹腔内注射(P<0.01)。结论:rmIL-18可以在体外诱导肿瘤特异性CTL并在小鼠体内发挥抗肝癌作用。
体外培养系统;rmIL-18;细胞毒性T淋巴细胞;抗肿瘤
肝癌是一种发病率高、恶性度高、预后较差、严重危害生命的恶性肿瘤,在我国恶性肿瘤的发病率中,男性居第三位,女性居第四位。采用手术、放疗、化疗等综合治疗措施后,肝癌仍居恶性肿瘤死亡率的第一位[1]。近年来,免疫治疗愈来愈受到人们的重视,并且已用于各种肿瘤的实验研究和临床治疗。IL-18具有增强免疫、抗肿瘤、抗感染等重要作用,在肿瘤的生物治疗中表现出了广泛的应用前景[2,3]。本实验研究重组鼠白细胞介素18(recombinant mouse interleukin-18,rmIL-18)在体外培养系统诱导的肿瘤特异性CTL作用和在小鼠体内发挥的抗肝癌作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 H22细胞株为BALB/c小鼠肝细胞癌,由本室经小鼠腹腔传代培养。
1.1.2 实验动物 BALB/c小鼠,雌性,6~8周龄,20~25 g,购自生物制品研究所动物部。
1.1.3 试剂 ①小鼠T细胞富集混合单克隆抗体,含抗CD11b CMac-1、抗CD45R(B220)、抗髓样分化抗原(Gr-1)、抗红细胞样细胞(TER119),0.2 ml可标记1×109细胞;②小鼠NK细胞富集混合单克隆抗体,含抗红细胞样细胞(TER119)、抗CD22、抗F4/80、抗CD5ccy-1、抗髓样分化抗原(Gr-1),0.2 ml可标记1×109细胞;③小鼠树突状细胞富集混合单克隆抗体,含抗CD2、抗CD3、抗CD45R(B220)、抗髓样分化抗原(Gr-1)、抗中性粒细胞抗原(7/4)、抗红细胞样抗原(TER119),0.2 ml可标记1×109细胞。均购于StemCell Technologies,美国。重组细胞因子 rmIL-18 本实验室制备。抗小鼠IFN-γ单抗购于长春博特生物技术有限公司。
1.2 方法
1.2.1 小鼠脾脏纯化NK、DCs和T细胞的制备 采用Stem SepTM免疫磁性细胞分离方法分离培养小鼠脾脏NK细胞、T细胞及DCs。
1.2.1.1 小鼠脾脏单核细胞悬液的制备 无菌条件下取出小鼠脾脏,以200目细胞网分离小鼠脾细胞,制备单核细胞悬液,溶解红细胞,以无血清IMDM培养基洗涤3次,调整细胞浓度至1×108个/ml,以10% FCS IMDM培养液培养备用。
1.2.1.2 分离小鼠脾脏DCs 取含1×109小鼠脾细胞悬液9 ml(含1 mmol/L EDTA无钙镁PBS),加入Stem SepTM小鼠DCs富集混合抗体1 ml。充分混合后,37℃ 5%CO2培养30 min,PBS洗涤3次,再加入四抗体磁珠混合物,37℃ 5%CO2培养30 min,过无菌磁性筛柱,收集未标记的目的细胞,PBS洗涤3次。细胞加入含10 ng/ml GM-CSF、10% FCS的IMDM培养液,培养备用。
1.2.1.3 分离小鼠脾脏NK细胞 取含1×109小鼠脾细胞悬液9 ml(含1 mmol/L EDTA无钙镁PBS),加入Stem SepTM小鼠NK细胞富集混合抗体1 ml。充分混合后,洗涤与磁性分离如1.2.1.2。收集的细胞加入10%FCS的IMDM培养液,培养备用。
1.2.2 建立体外培养系统 实验前,将分离纯化的小鼠脾脏NK细胞、T细胞及DCs按一定的细胞比例加入培养系统,其中NK细胞为16.5%、T细胞为82.7%、DCs为0.8%。
1.2.3 CTL杀伤实验 为观察rmIL-18在CCs中诱导肿瘤特异性CTL的能力,将丝裂霉素(MMC 100 μg/ml)处理1 h的H22细胞按2%的比例加入CCs,再加入不同浓度的rmIL-18(0、10、50、100 ng/ml),37℃ 5%CO2培养96 h后收集细胞,以不同的效靶比(1∶6.25、1∶12.5、1∶25、1∶50)分别检测对125I-UdR标记的H22细胞的特异性杀伤能力。
1.2.4 小鼠肝细胞癌实验动物模型的建立 将生长良好、源于BALB/c小鼠的肝癌细胞H22经PBS洗涤3次,分别取5×105、1×106、2×106个细胞溶于100 μl生理盐水中,接种于3组BALB/c小鼠右肋部皮下(day 0),作为皮下接种肝癌的实验动物模型。确定建立肝细胞癌荷瘤小鼠的合适H22细胞浓度。
1.2.5 应用肿瘤特异性CTL免疫荷瘤小鼠 采用不同途径,不同剂量rmIL-18免疫肝细胞癌荷瘤小鼠,研究肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度和生存时间的影响。实验动物肿瘤直径的测量方法(皮下荷瘤模型):肿瘤直径(mm)=(肿瘤最长直径+肿瘤最短直径)/2。
1.3 统计学方法 两组显著性差异用t检验,生存率用Kaplan-Meier乘积限法估计。
2 结果
2.1 rmIL-18在CCs中诱导肿瘤特异性CTL 以不同浓度的rmIL-18诱导的肿瘤特异性CTL以不同的效靶比(1∶6.25、1∶12.5、1∶25、1∶50)分别检测对125I-UdR标记的H22细胞的特异性杀伤能力。结果表明(图1),在CCs中,rmIL-18能够促进CTL介导的肿瘤特异性杀伤效应,这种杀伤作用与rmIL-18的含量呈剂量依赖关系,即随rmIL-18的浓度增高而增加。
2.2 在CCs中IFN-γ对rmIL-18诱导肿瘤特异性CTL的影响 我们观察了IFN-γ在CCs中对rmIL-18诱导肿瘤特异性CTL的影响,在肿瘤抗原刺激的CCs中,加入不同浓度的rmIL-18,再加入抗IFN-γ单抗(5 μg/ml),培养96 h,以50∶1的效靶比检测IFN-γ对rmIL-18诱导的肿瘤特异性CTL产生的影响,结果表明(图2),加入抗IFN-γ单抗及对照单抗均对rmIL-18诱导的肿瘤特异性CTL产生过程无明显影响,证明rmIL-18诱导的肿瘤特异性CTL的过程与IFN-γ的产生无关。
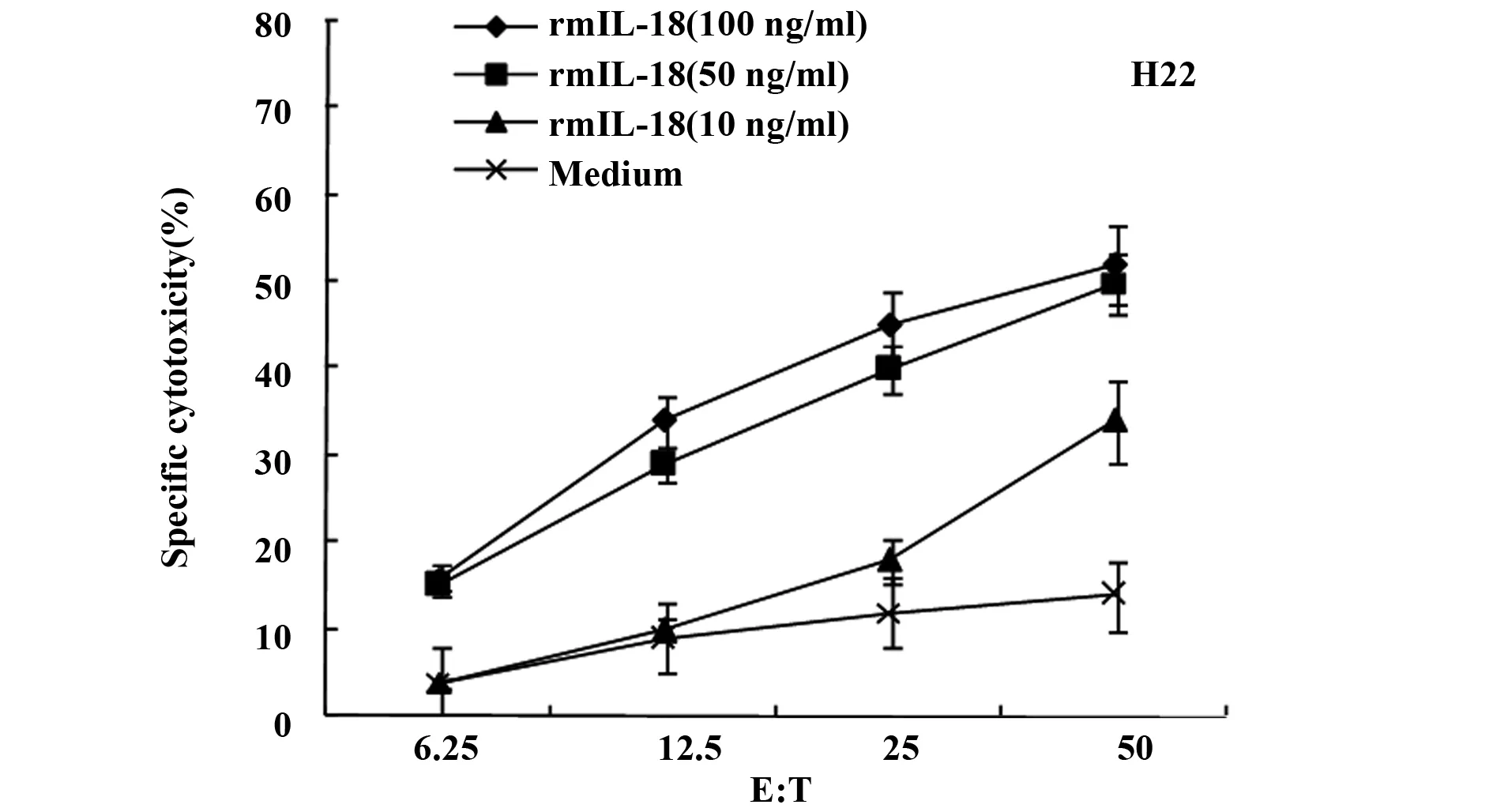
图1 在体外培养系统中rmIL-18诱导的H22特异性CTL杀伤活性Fig.1 Effect of rmIL-18 on induction of tumor-specific CTL activity in coculture system
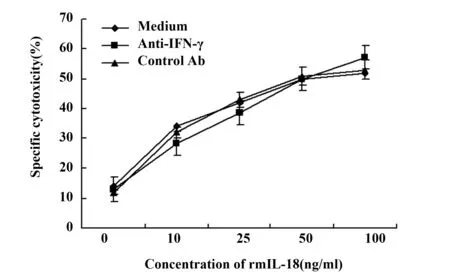
图2 抗IFN-γ抗体对rmIL-18诱导H22特异性CTL的影响(E∶T=50∶1)Fig.2 Effect of anti-IFN-γ on rmIL-18 induced H22 tumor-specific CTL activity in coculture system(E∶T=50∶1)

图3 不同途径应用肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度的影响Fig.3 Tumor diameters of mice after administration tumor-specific CTLs with different routes
2.3 不同途径输入肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度和生存时间的影响 将30只荷瘤小鼠随机分成3组,分别在接种肿瘤后第10天开始,经肿瘤内或腹腔内输入肿瘤特异性CTL,1×106100 μl/只,对照组经腹腔输入生理盐水,100 μl/只,隔1 d注射1次,共计10次。每周测量荷瘤小鼠肿瘤直径,以观察经不同途径输入肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度的影响(图3)。结果表明,无论是经腹腔或经肿瘤内输入肿瘤特异性CTL,均能明显抑制荷瘤小鼠的肿瘤生长速度(P<0.01),但经肿瘤内输入肿瘤特异性CTL对荷瘤小鼠肿瘤生长的抑制作用明显高于经腹腔输入组(P<0.01)。进一步观察不同途径应用肿瘤特异性CTL对荷瘤小鼠生存时间的影响(图4)。结果表明,不同途径
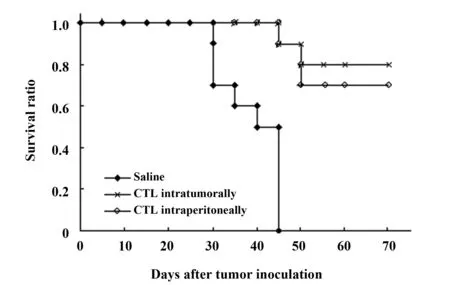
图4 不同途径应用肿瘤特异性CTL对荷瘤小鼠生存时间的影响Fig.4 Survival of mice inoculated into flanks with H22 cells after immunotherapy with tumor-specific CTLs with different routes
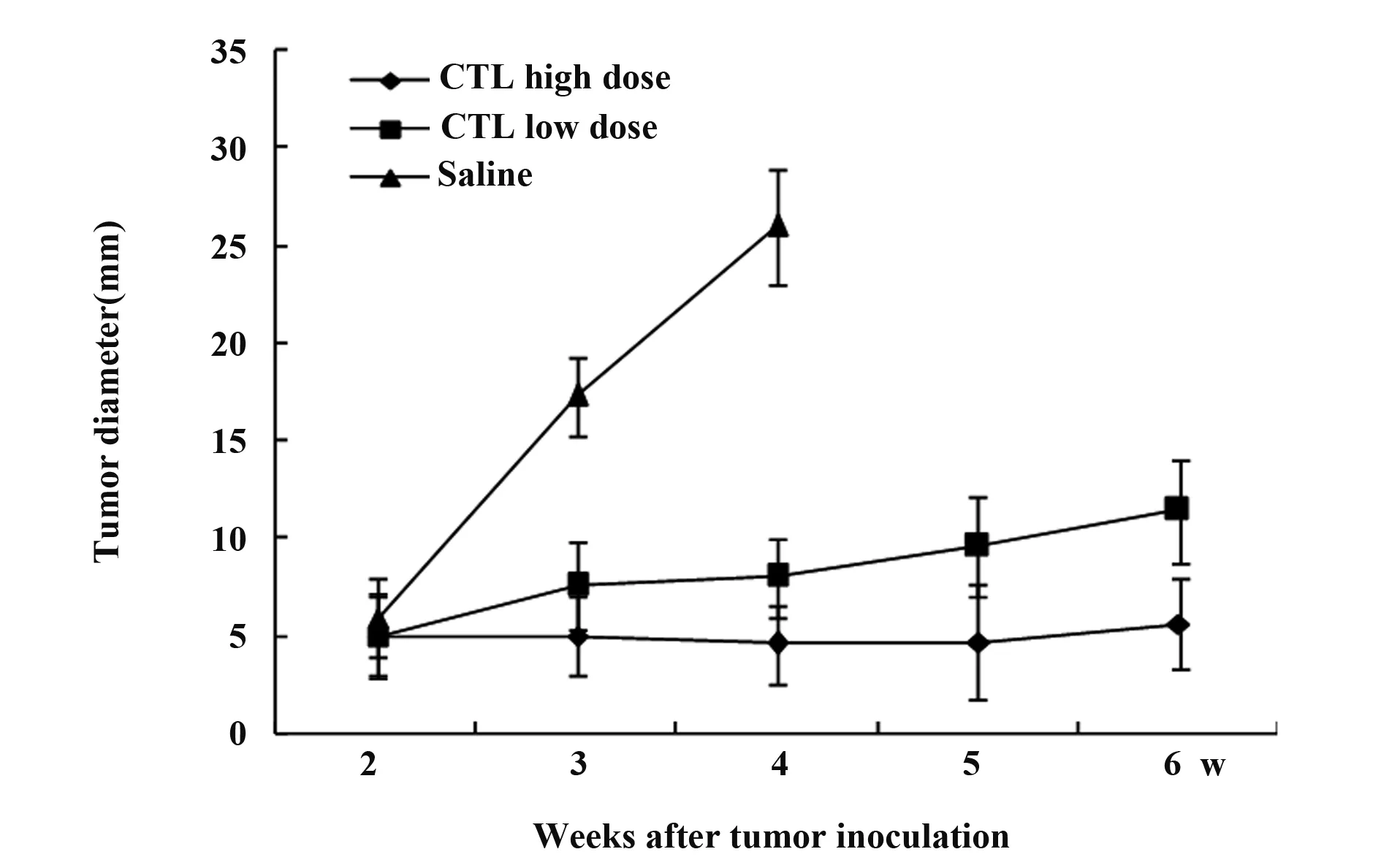
图5 不同剂量肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度的影响Fig.5 Tumor diameters of mice after administration tumor-specific CTLs with different dosage
应用肿瘤特异性CTL均能延长荷瘤小鼠的生存时间(P<0.01),对照组小鼠在45 d全部死亡。观察60 d,应用肿瘤特异性CTL治疗的荷瘤小鼠有半数以上存活,两者无差异。
2.4 不同剂量肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度的影响 将30只皮下接种1×106100 μl H22细胞的BALB/c小鼠随机分成3组,分别在接种肿瘤后第10天开始腹腔内输入rmIL-18诱导的肿瘤特异性CTL或生理盐水(1×106/100 μl/只,1×107/100 μl/只,生理盐水100 μl/只),隔1 d输入1次,共计10次。每周测量荷瘤小鼠肿瘤直径,以观察rmIL-18诱导的肿瘤特异性CTL对荷瘤小鼠肿瘤生长速度的影响(图5)。结果表明,与对照组相比,腹腔内输入rmIL-18诱导的肿瘤特异性CTL能明显抑制荷瘤小鼠肿瘤生长速度(P<0.01),并且随输入CTL的数量增多,这种抑制作用明显增强(P<0.01)。
3 讨论
肝癌严重威胁生命,虽然早期诊治水平不断提高,但预后仍然很差。随着肿瘤生物治疗的迅速发展,癌症的免疫治疗法已被认为是继手术、放疗、化疗之后第四种疗法。肿瘤的细胞因子治疗是免疫治疗的重要策略之一,越来越受到重视,已经是研究重点和临床应用的典型疗法[4]。
IL-18的抗肿瘤效应初期是由NK细胞介导的,IL-18是通过增强NK细胞的活性来表现其抗肿瘤效果的[5]。有研究发现经IL-18预处理过的荷瘤鼠均可存活,表明IL-18在体内有很强的抗肿瘤活性,且IL-18能相继诱导NK细胞和CTL细胞的抗肿瘤作用[6,7]。IL-18处理后的荷瘤小鼠表现出免疫记忆功能,对再接种的肿瘤会有明显的抵抗作用,这种抵抗作用是由细胞毒性CD4+细胞完成的[8]。IL-18亦可以诱导CTL细胞的产生,促进其成熟和增殖,有效杀伤肿瘤细胞,发挥抗肿瘤效果[9,10]。
在本实验室以往的研究中,证实了IL-18首先通过增加NK细胞的活性作用,诱导快速有效的肿瘤杀伤作用,继之使DCs成为有效的抗原提呈细胞,然后,引起强的由CD4+CTL 和CD8+CTL介导的特异性的抗肿瘤免疫反应[11-13]。在本文中我们应用rmIL-18和小鼠脾细胞纯化的NK细胞、树突状细胞、T细胞结合的体外培养系统,在包括2‰经丝裂霉素处理的肿瘤细胞存在的情况下,培养96 h后,成功的诱导出肿瘤特异性CTL,建立了一种在体外快速有效的扩增肿瘤特异性CTL方法。随后,我们观察了在CCs中诱导出的H22特异性CTL在体内的抗肿瘤作用。经肿瘤内或腹腔内输入肿瘤特异性CTL均能够明显抑制荷肝癌小鼠的肿瘤生长速度(P<0.01)及明显延长荷瘤小鼠生存时间(P<0.01),并且这种作用随CTL细胞数量的增加而增强(P<0.01)。但肿瘤内输入肿瘤特异性CTL抑制荷瘤小瘤的肿瘤生长速度优于腹腔内输入,并且随输入CTL的数量增多,这种抑制作用明显增强,此与CTL杀伤肿瘤细胞方式有关,而在延长荷瘤小鼠的生存时间方面两者并无统计学意义差异。
综上所述,通过IL-18在CCs中诱导的肿瘤特异性CTL均可以起到良好的杀伤肿瘤细胞的作用,本研究为肿瘤细胞因子免疫疗法提供了实验依据和研究方向。
[1] Chu Q,Xu H,Gao M,etal.Liver-targeting resibufogenin-loaded poly(lactic-co-glycolic acid)-d-α-tocopheryl polyethylene glycol 1000 succinate nanoparticles for liver cancer therapy[J].Int J Nanomedicine,2016,11(1):449-463.
[2] Swann JB,Smyth MJ.Immune surveillance of tumors[J].J Clin Invest,2007,117(5):1137-1146.
[3] Ma Z,Li W,Yoshiya S,etal.Augmentation of immune checkpoint cancer immunotherapy with IL-18[J].Clin Cancer Res,2016,22(12):2969-2980.
[4] Zhang L,Zhu W,Li J,etal.Clinical outcome of immunotherapy with dendritic cell vaccine and cytokine-induced killer cell therapy in hepatobiliary and pancreatic cancer[J].Mol Clin Oncol,2016,4(1):129-133.
[5] Stegmann KA,De Souza JB,Riley EM.IL-18-induced expression of high-affinity IL-2R on murine NK cells is essential for NK-cell IFN-γ production during murine Plasmodium yoelii infection[J].Eur J Immunol,2015,45(12):3431-3440.
[6] Liu W,Hu M,Wang Y,etal.Overexpression of interleukin-18 protein reduces viability and induces apoptosis of tongue squamous cell carcinoma cells by activation of glycogen synthase kinase-3β signaling[J].Oncol Rep,2015,33(3):1049-1056.
[7] Fabbi M,Carbotti G,Ferrini S.Context-dependent role of IL-18 in cancer biology and counter-regulation by IL-18BP[J].J Leukoc Biol,2015,97(4):665-675.
[8] Ghaffari-Nazari H,Tavakkol-Afshari J,Jaafari MR,etal.Improving multi-epitope long peptide vaccine potency by using a strategy that enhances CD4+T help in BALB/c mice[J].PLoS One,2015,10(11):e0142563.
[9] Verardi PH,Legrand FA,Chan KS.IL-18 expression results in a recombinant vaccinia virus that is highly attenuated and immunogenic[J].J Interferon Cytokine Res,2014,34(3):169-178.
[10] Mozaffari Namin B,Soltan Dallal MM,Ebrahimi Daryani N.The effect of campylobacter concisus on expression of IL-18,TNF-α and p53 in Barrett′s cell lines[J].Jundishapur J Microbiol,2015,8(12):e26393.
[11] 方艳秋,谭 岩,段秀梅,等.IL-18在体外培养系统中诱导肿瘤快速杀伤效应及肿瘤特异性CTL[J].免疫学杂志,2004,20(4):251-255.
[12] Markowitz GJ,Yang P,Fu J,etal.Inflammation-dependent IL18 signaling restricts hepatocellular carcinoma growth by enhancing the accumulation and activity of tumor-infiltrating lymphocytes [J].Cancer Res,2016,76(8):2394-2405.
[13] 郝明志,林海澜,陈起忠,等.重组人血管内皮抑制素联合肝动脉介入治疗对中晚期肝癌无疾病进展生存期的影响[J].临床肝胆病杂志,2016,32(1):92-96.
[收稿2016-01-04]
(编辑 许四平)
Experimental study of tumor-specific CTL induced by rmIL-18 treated on hepatocellular carcinoma
MIXu-Guang,LIULei,LIShou-Qing,WEIHai-Feng,XUShu-Fen,TANYan,FANGYan-Qiu.
JilinProvincePeople′sHospital,Changchun130021,China
Objective:To research rmIL-18 in vitro culture system CCs induce tumor-specific cytotoxic T lymphocytes CTL and anti-tumor effect in mice.Methods:Used Stem SepTMimmune magnetic cells separation method to culture mouse spleen NK cells,T cells and DCs,established culture systems in vitro;used of different approaches,different doses rmIL-18 to immunize HCC tumor-bearing mice,researched the effect of rmIL-18 on tumor growth rate and survival time.Results:rmIL-18 could induce and promote tumor-specific CTL-mediated killing effects in vitro culture system;tumor-specific CTL could significantly inhibit tumor growth(P<0.01) of and prolong the survival time of liver cancer tumor-bearing mice(P<0.01),and the effect was increased with rmIL-18 concentration increased(P<0.01),and intratumoral injection was superior to intraperitoneal injection(P<0.01).Conclusion:rmIL-18 can induce tumor-specific CTL in vitro and play a role in anti-liver cancer in mice.
CCs;rmIL-18;CTL;Anti-tumor
10.3969/j.issn.1000-484X.2017.04.014
①本文受吉林省科技发展计划项目(20140519018JH)、吉林省人社厅省人才开发基金(2016年度)和吉林省科技厅重点实验室项目(20122113)资助。
米旭光(1983年-),男,博士,助理研究员,主要从事肿瘤靶向治疗的科研工作,E-mail:mixg699@163.com。
及指导教师:方艳秋(1968年-),女,博士,教授,主要从事肿瘤免疫治疗相关研究,E-mail:yq.fang@163.com。
R735.7
A
1000-484X(2017)04-0545-04
