miR-126-3p在甲状腺癌中的表达及其功能研究
2017-04-24黄致远张建新
蔡 洲 黄致远 张建新
(武汉科技大学城市学院医学部,武汉430083)
miR-126-3p在甲状腺癌中的表达及其功能研究
蔡 洲 黄致远①张建新①
(武汉科技大学城市学院医学部,武汉430083)
目的:探讨微小分子核糖核酸(miR)-126-3p在甲状腺癌中的表达,探讨其生物学功能。方法:RT-PCR检测35例甲状腺癌、癌旁组织以及三种甲状腺癌细胞系(TPC-1、FTC-133、8505C)中miR-126-3p表达量;将甲状腺癌细胞分为类似物组(mimic)和对照组(NC),分别转染miR-126-3p mimic及阴性对照质粒。两组细胞增殖、凋亡分别采用Brdu-ELISA法和流式细胞术检测, Transwell小室法检测两组细胞迁移和侵袭。结果:35例癌组织中miR-126-3p相对表达量显著低于癌旁组织(0.384±0.028 vs 0.981±0.039,t=10.291,P<0.05);在三种甲状腺癌细胞中,TPC-1细胞中miR-126-3p相对表达量最低;与NC组比较,mimic组甲状腺癌细胞TPC-1增殖受到显著的抑制,第3天两组间开始表现出统计学差异(P<0.05);与NC组比较,mimic组甲状腺癌细胞TPC-1凋亡显著增加[(15.32±3.20)% vs (8.12±1.17)%,t=4.623,P<0.05],迁移受到抑制(26.68±4.48 vs 82.21±3.65,t=17.789,P<0.05),侵袭受到抑制(12.28±1.03 vs 34.43±2.10,t=8.103,P<0.05)。结论:甲状腺癌组织中miR-126-3p表达降低,上调miR-126-3p表达可以显著抑制甲状腺癌细胞增殖、促进凋亡、抑制迁移和侵袭,miR-126-3p可能作为一种抑癌基因在甲状腺癌中发挥重要的生物学功能。
miR-126-3p;甲状腺癌;增殖;凋亡;迁移;侵袭
甲状腺癌作为一种常见的内分泌系统恶性肿瘤,其发病率一直表现出了较为明显的上升趋势[1]。肿瘤细胞是一种增殖过剩的未分化细胞,具有生长过剩和凋亡减少的特性,而临床研究也充分表明甲状腺癌具有多灶性以及区域淋巴结转移的倾向[2]。为此,了解肿瘤细胞的发生机制并探寻具有特异性的预测分子有助于提高甲状腺癌的临床诊疗水平,并改善患者预后。
微小分子核糖核酸(miR)是近年来的研究热点,这是一种不具有编码蛋白功能的RNA分子,其调控的生理与病理过程主要通过与下游的靶向信使RNA 3′端非编码区结合。诸多研究均表明,miRNA表达或者功能异常与多种肿瘤的发生和发展密切相关[3-5]。miR-126-3p定位在表皮生长因子样结构域7(EGFL7)基因的7号内含子上,一部分随宿主基因EGFL7被转录,并由转录因子家族Ets1调控。已有研究发现,miR-126-3p在内皮细胞以及肺腺癌、乳腺上皮细胞中低表达,此外还能调节血管生成[6-9]。miR-126-3p在甲状腺癌中如何表达及其生物学功能研究目前尚未见报道,为此,本研究探讨分析了miR-126-3p在甲状腺癌中的表达及其生物学功能。
1 材料与方法
1.1 病理组织和细胞系 收集2014年1月~2016年4月35例广州军区武汉总医院获得的甲状腺癌及癌旁组织标本,甲状腺癌均经病理诊断确诊,标本获取前均未进行化疗、放疗等。标本的获取均获得了患者的知情同意。35例患者中女25例,男10例;年龄34~66岁,平均49.8岁。标本获取后立即保存于中性福尔马林溶液中。人甲状腺癌细胞系TPC-1、FTC-133、8505C均在10%胎牛血清的DMEM培养基中培养,常规条件下培养并取对数生长期的细胞用于后续的实验。
1.2 方法
1.2.1 实时定量逆转录-聚合酶链反应(RT-PCR)检测标本和细胞系中miR-126-3p表达 按照TRIzol试剂盒(美国Invitrogen公司)说明提取甲状腺癌组织、癌旁组织以及各细胞系中总RNA。按照试剂盒说明合成cDNA,逆转录反应条件:37℃30 min,94℃ 2 min。按照 RT-PCR试剂盒(美国GeneCopoeia公司)扩增,扩增条件:94℃ 2 min,95℃10 s,72℃ 45 s,扩增40个循环;72℃退火延伸10 min。以RNU6B为内参,扩增结束后绘制溶解曲线并采用2-ΔΔCt计算miR-126-3p相对表达量。
1.2.2 过表达质粒转染 miR-126-3p类似物(mimic)及阴性对照质粒均购自上海吉玛生物公司。将细胞系中miR-126-3p表达最低(或最高)的一种细胞系接种于6孔板中,每孔细胞数2×106个。DMEM培养基培养,当细胞汇合度大于50%时按照脂质体LipofectamineTM2000(美国Promega公司)说明分别取对数生长期细胞转染mimic和阴性对照质粒。继续培养并加入培养基至终体积为2 ml。
1.2.3 Brdu-ELISA法检测细胞增殖 将转染后的甲状腺癌细胞制成细胞浓度为1×105个/ml的单细胞悬液并接种于96孔板,每孔接种0.5 ml即2×104个。每孔加入BrdU标记液2 020 μl,常温孵育后加入HRP以及Fix Denat标记的抗BrdU 抗体。洗涤,然后加入TMB底物液显色;酶标仪(上海赛默飞世尔公司)测定终止反应后的吸光值。从第1天开始,至第5天结束。观察两组不同时间点空斑形成情况(PFU)。每组重复5次计算平均值。
1.2.4 、流式细胞术检测细胞凋亡 将转染48 h后的甲状腺癌细胞PBS洗涤,采用离心机(意大利,A.L.C公司)离心,弃上清液后用Binding buffer重悬细胞并加入碘化丙啶和Annexin V-FITC,室温避光孵育20 min。将细胞制成细胞浓度为1×105个/ml的单细胞悬液,上流式细胞仪(美国,FCMXBD公司)检测凋亡细胞比例。每组重复5次计算平均值。
1.2.5 Transwell小室法检测细胞迁移和侵袭 液化冻存的Matrigel并稀释至1 mg/ml(无血清DMEM培养液),加入Transwell小室(每孔100 μl),在37℃环境下包被1 h后培养液洗涤3次。分别向预先未包被Matrigel(迁移试验)和包被Matrigel(侵袭试验)的上部培养嵌室内加入100 μl(2.5×104个)转染24 h后的细胞悬液,在底部培养室加入正常DMEM培养液,常规培养24 h(5%CO2、37℃)。嵌室内的液体吸去后多聚甲醛固定,并用结晶紫染色,PBS漂洗后在光镜下计算细胞数。每个孔随机选取5个视野计算平均值。

2 结果
2.1 甲状腺癌组织及细胞中miR-126-3p低表达 35例癌组织中miR-126-3p相对表达量显著低于癌旁组织(0.384±0.028 vs 0.981±0.039,t=10.291,P<0.05)(图1A);在三种甲状腺癌细胞中,TPC-1细胞中miR-126-3p相对表达量最低(图1B),将作为后续功能学实验的细胞系。
2.2 上调miR-126-3p表达对甲状腺癌细胞TPC-1增殖的影响 Brdu-ELISA检测结果显示,与NC组比较,转染miR-126-3p mimic上调miR-126-3p表达后,甲状腺癌细胞TPC-1增殖受到显著抑制,第3天开始两组间差异呈现统计学意义(P<0.05),见图2。
2.3 上调miR-126-3p表达对甲状腺癌细胞TPC-1凋亡的影响 流式细胞仪对甲状腺癌细胞TPC-1凋亡进行检测,结果见图3A。转染miR-126-3p mimic上调miR-126-3p表达后,甲状腺癌细胞TPC-1凋亡显著增加[mimic vs NC:(15.32±3.20)% vs (8.12±1.17)%,t=4.623,P<0.05](图3B)。
2.4 上调miR-126-3p表达对甲状腺癌细胞TPC-1迁移的影响 图4A为上调miR-126-3p表达后,甲状腺癌细胞TPC-1迁移的染色光镜图。

图1 甲状腺癌组织及细胞中miR-126-3p相对表达量Fig.1 miR-126-3p relative expression in tissue and cells of thyroid cancerNote:Compared with adjacent nontumor,*.P<0.05.
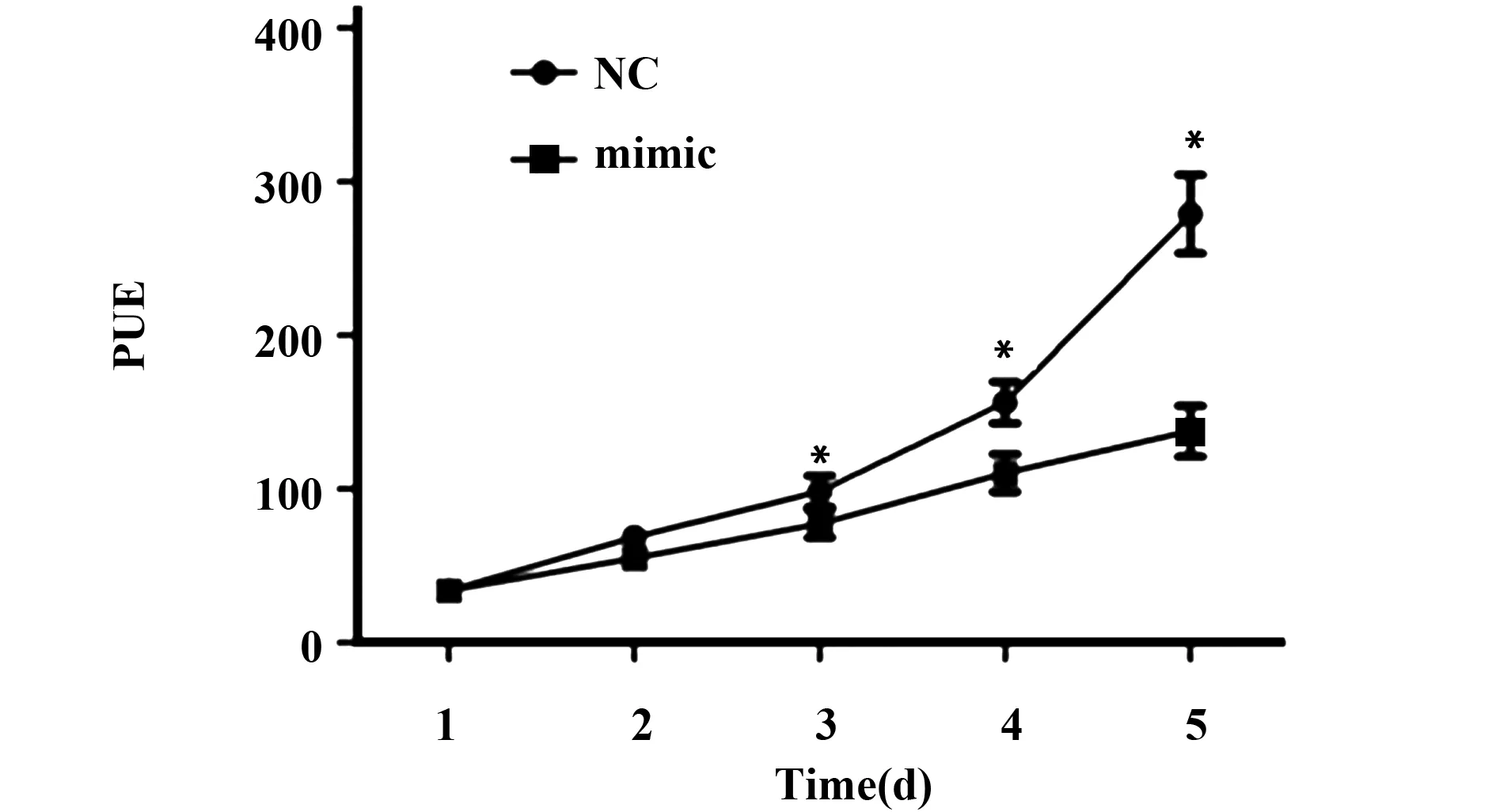
图2 上调miR-126-3p表达抑制甲状腺癌细胞增殖Fig.2 Up-regulation of miR-126-3p expression inhibits proliferation of thyroid cancer cellsNote:Compared with NC,*.P<0.05.
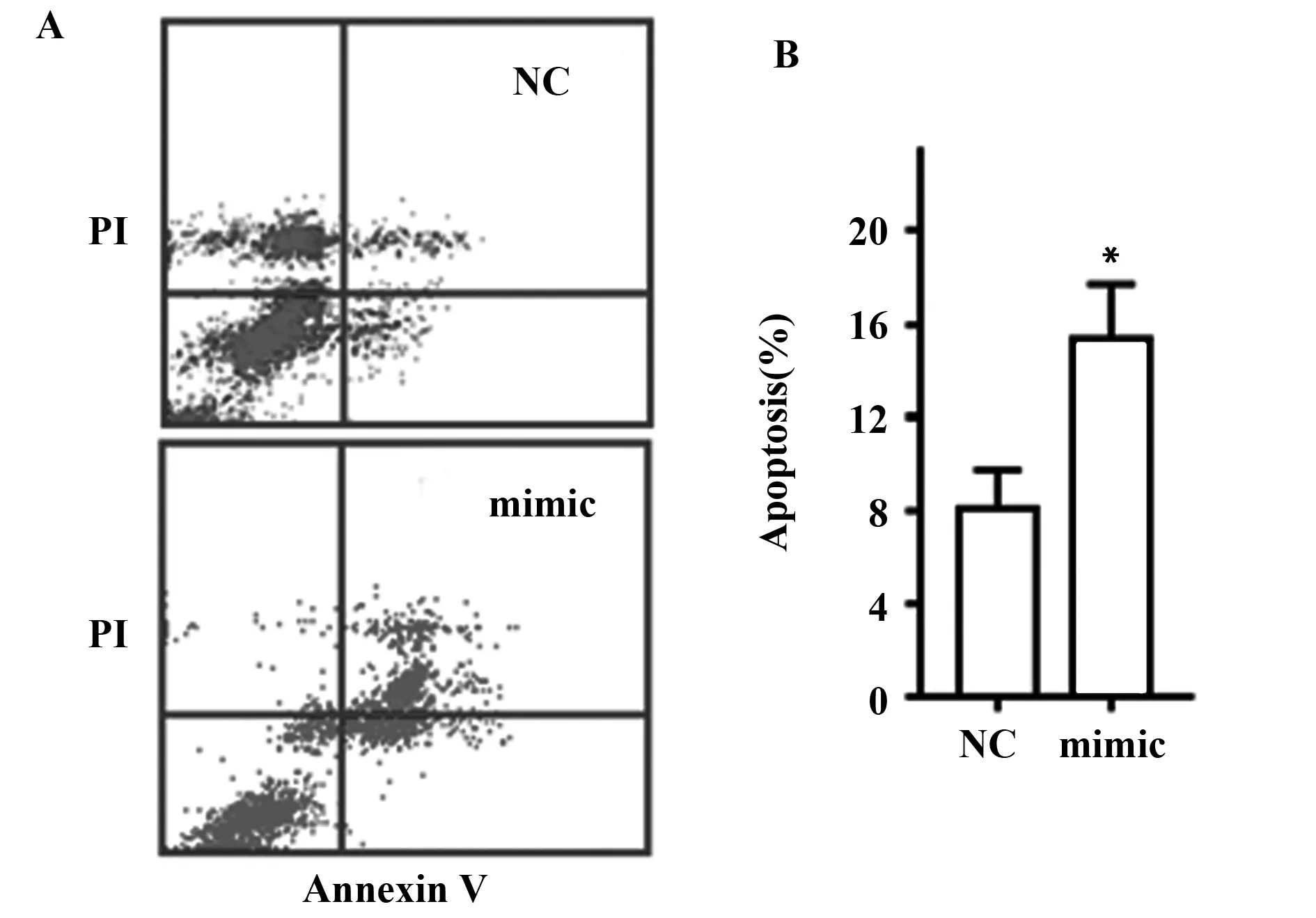
图3 上调miR-126-3p表达促进甲状腺癌细胞凋亡Fig.3 Up-regulation of miR-126-3p expression promoted apoptosis of thyroid cancer cellsNote:Compared with NC,*.P<0.05.
由图4A结果可见,转染miR-126-3p mimic上调miR-126-3p表达后,甲状腺癌细胞TPC-1迁移受

图4 上调miR-126-3p表达抑制甲状腺癌细胞迁移Fig.4 Up-regulation of miR-126-3p expression suppressed migration of thyroid cancer cellsNote:Compared with NC,*.P<0.05.

图5 上调miR-126-3p表达抑制甲状腺癌细胞侵袭Fig.5 Up-regulation of miR-126-3p expression suppressed invasion of thyroid cancer cellsNote:Compared with NC,*.P<0.05.
到抑制(mimic vs NC:26.68±4.48 vs 82.21±3.65,t=17.789,P<0.05)(图4B)。
2.5 上调miR-126-3p表达对甲状腺癌细胞TPC-1侵袭的影响 图5A是转染miR-126-3p mimic上调miR-126-3p表达后的甲状腺癌细胞TPC-1侵袭受到抑制的染色光镜图。
由图5A结果可见,转染miR-126-3p mimic上调miR-126-3p表达后,甲状腺癌细胞TPC-1侵袭受到抑制(mimic vs NC:12.28±1.03 vs 34.43±2.10,t=8.103,P<0.05)(图5B)。
3 讨论
甲状腺癌是源于内分泌器官甲状腺组织的恶性肿瘤,恶性程度较低,发病率居头颈部肿瘤的首位。甲状腺癌占所有恶性肿瘤的2.6%,占内分泌肿瘤的94.5%,而其中超过90%为甲状腺乳头状癌。甲状腺癌女性多于男性,多数患者存在颈淋巴结转移。手术、同位素治疗、辅助放射治疗和甲状腺素抑制治疗是甲状腺癌临床常用的治疗手段,一般而言,经过合理治疗后甲状腺癌患者的预后较好,5年生存期可达95%。也有部分患者由于肿瘤的侵袭性高、分化发展趋势明显,发展为未分化癌和低分化癌,影响了患者的预后和生活质量。为此,了解甲状腺癌的发生机制并探寻具有特异性的预测分子有助于提高此病的临床诊疗水平,并改善患者预后。
目前,诸多研究已经对甲状腺癌的分子发病机制进行了研究,主要包括①RAS、BRAF突变以及编码β-catenin基因突变等细胞内信号传导异常[10];②PPFP、RET重排,MET过表达等细胞外信号接受异常[11];③线粒体基因改变[12];④抑癌基因甲基化等基因改变[13];⑤P53突变等抑制基因突变[14]。
miR具有多种生物学功能,能调控多种生理与病理过程,近年来其在肿瘤中的作用研究越来越广泛。关于miR在甲状腺癌中的研究,Gu等[15]认为miR-539在甲状腺癌中扮演着抑癌基因的作用,能够靶向调控CARMA1调节甲状腺癌细胞的迁移和侵袭。Salajegheh等[16]认为miR-205在甲状腺癌中能够调节血管生成,通过招募101例甲状腺癌患者,并与收集的14个结节性甲状腺肿和7个正常甲状腺组织进行对比,结果发现,癌组织中VEGFA mRNA和 miR-205分别呈现出高表达和低表达,两者呈负相关;癌细胞株转染miR-205 mimic之后,VEGFA基因和蛋白表达显著降低,细胞增殖受到抑制,细胞周期阻滞在G0/G1,细胞凋亡显著增加,首次证明了miR-205在甲状腺癌中的血管生成作用和抑癌基因角色。本研究利用RT-PCR检测了甲状腺癌组织和癌旁组织中miR-126-3p表达量,发现癌组织中miR-126-3p相对表达量显著低于癌旁组织,表明miR-126-3p在甲状腺癌的发生发展中可能发挥抑癌基因作用,对甲状腺癌的早期诊断、治疗指导和预后评估具有潜在利用价值。
增殖能力增强、凋亡减少以及侵袭和迁移能力增强是肿瘤细胞的常见生物学特点,也是肿瘤生长、进展、复发和转移的基础。为了进一步研究miR-126-3p在甲状腺癌中的功能,本研究选择三种甲状腺癌细胞系,测定了miR-126-3p表达量。选择表达量最低的TPC-1细胞,采用了RNA瞬时转染技术,通过转让miR-126-3p mimic提高miR-126-3p表达。分别采用Brdu-ELISA法、流式细胞术检测过表达miR-126-3p对TPC-1细胞增殖、凋亡的影响,采用 Transwell小室法检测对细胞迁移和侵袭的影响。结果发现,上调miR-126-3p表达后甲状腺癌细胞的增殖、迁移和侵袭受到显著的抑制,而细胞凋亡明显增强。表明miR-126-3p具有抑制甲状腺癌发生发展的作用,可能作为一种抑癌基因在甲状腺癌中发挥重要的生物学功能。
由于miR-126-3p在三种甲状腺癌中表达量较低,为此本研究只进行了mimic转染。后续还需要继续研究其他甲状腺癌细胞系中miR-126-3p表达量并选择表达量较高的细胞系进行抑制物(Inhi-bitor)转染,进行正反两个方面验证,分析敲低miR-126-3p表达对甲状腺癌细胞生物功能的影响。
此外,miR并不具备编码蛋白的功能,其通过靶向结合下游的信使RNA 3′端非编码区发挥生物功能。因此,本研究只是初步探讨了miR-126-3p在甲状腺癌中的表达和生物学功能,关于其具体的下游靶点和分子信号机制将作为今后研究的内容深入开展。
[1] Hanley JP,Jackson E,Morrissey LA,etal.Geospatial and temporal analysis of thyroid cancer incidence in a rural population[J].Thyroid,2015,25(7):812-822.
[2] Sun SP,Zhang Y,Cui ZQ,etal.Clinical application of carbon nanoparticle lymph node tracer in the VI region lymph node dissection of differentiated thyroid cancer[J].Genet Mol Res,2014,13(2):3432-3437.
[3] Zuberi M,Khan I,Mir R,etal.Utility of serum miR-125b as a diagnostic and prognostic indicator and its alliance with a panel of tumor suppressor genes in epithelial ovarian cancer[J].PLoS One,2016,11(4):e0153902.
[4] Flores-Pérez A,Marchat LA,Rodríguez-Cuevas S,etal.Suppression of cell migration is promoted by miR-944 through targeting of SIAH1 and PTP4A1 in breast cancer cells[J].BMC Cancer,2016,16(1):379.
[5] Xu DD,Zhou PJ,Wang Y,etal.Reciprocal activation between STAT3 and miR-181b regulates the proliferation of esophageal cancer stem-like cells via the CYLD pathway[J].Mol Cancer,2016,15(1):40.
[6] Olivieri F,Bonafè M,Spazzafumo L,etal.Age-and glycemia-related miR-126-3p levels in plasma and endothelial cells[J].Aging(Albany NY),2014,6(9):771-787.
[7] Chen Q,Hu H,Jiao D,etal.miR-126-3p and miR-451a correlate with clinicopathological features of lung adenocarcinoma:The underlying molecular mechanisms[J].Oncol Rep,2016,36(2):909-917.
[8] Cui WI,Li Q,Feng L,etal.MiR-126-3p regulates progesterone receptors and involves development and lactation of mouse mammary gland[J].Mol Cell Biochem,2011,355(1-2):17-25.
[9] Pitzler L,Auler M,Probst K,etal.miR-126-3p promotes matrix-dependent perivascular cell attachment,migration and intercellular interaction[J].Stem Cells,2016,34(5):1297-1309.
[10] Murugan AK,Qasem E,Al-Hindi H,etal.Classical V600E and other non-hotspot BRAF mutations in adult differentiated thyroid cancer[J].J Transl Med,2016,14(1):204.
[11] Vu-Phan D,Grachtchouk V,Yu J,etal.The thyroid cancer PAX8-PPARG fusion protein activates Wnt/TCF-responsive cells that have a transformed phenotype[J].Endocr Relat Cancer,2013,20(5):725-739.
[12] Johnson JM,Lai SY,Cotzia P,etal.Mitochondrial metabolism as a treatment target in anaplastic thyroid cancer[J].Semin Oncol,2015,42(6):915-922.
[13] Stephen JK,Chen KM,Merritt J,etal.Methylation markers for early detection and differentiation of follicular thyroid cancer subtypes[J].Cancer Clin Oncol,2015,4(2):1-12.
[14] Cui B,Yang Q,Guan H,etal.PRIMA-1,a mutant p53 reactivator,restores the sensitivity of TP53 mutant-type thyroid cancer cells to the histone methylation inhibitor 3-Deazaneplanocin A[J].J Clin Endocrinol Metab,2014,99(6):E962-70.
[15] Gu L,Sun W.MiR-539 inhibits thyroid cancer cell migration and invasion by directly targeting CARMA1[J].Biochem Biophys Res Commun,2015,464(4):1128-1133.
[16] Salajegheh A,Vosgha H,Md Rahman A,etal.Modulatory role of miR-205 in angiogenesis and progression of thyroid cancer[J].J Mol Endocrinol,2015,55(3):183-196.
[收稿2016-07-25 修回2016-10-09]
(编辑 倪 鹏)
Expression of miR-126-3p in thyroid cancer and function research
CAIZhou,HUANGZhi-Yuan,ZHANGJian-Xin.
DepartmentofMedicine,CityCollegeofWuhanUniversityofScienceandTechnology,Wuhan430083,China
Objective:To investigate the expression of miR-126-3p in thyroid cancer and the biological function.Methods:The expression of miR-126-3p in thyroid carcinoma,adjacent tissues and three types of thyroid cancer cells(TPC-1,FTC-133,8505C) were detected by RT-PCR;thyroid cancer cells were divided into analogue group(mimic) and control group(NC),which were respectively with the transfection of miR-126-3p mimic and negative control plasmid.The proliferation and apoptosis in two groups were respectively detected by Brdu-ELISA and flow cytometry.The migration and invasion were detected by Transwell Chambers method.Results:The expression of miR-126-3p in thyroid carcinoma was significantly lower than adjacent tissues(0.384±0.028 vs 0.981±0.039,t=10.291,P<0.05);the expression of miR-126-3p in TPC-1 was the lowest among three types of thyroid cancer cells.Compared with NC group,the proliferation of TPC-1 in mimic group was significantly inhibited,the same with migration(26.68±4.48 vs 82.21±3.65,t=17.789,P<0.05)and invasion(12.28±1.03 vs 34.43±2.10,t=8.103,P<0.05),which the apoptosis was significantly increased[(15.32±3.20)% vs (8.12±1.17)%,t=4.623,P<0.05].Conclusion:The miR-126-3p expression is reduced in thyroid cancer tissue,overexpression of miR-126-3p significantly suppresses the proliferation,migration and invasion of thyroid cancer cells,and promotes the apoptosis,miR-126-3p can play an important biological function as a cancer suppressor gene in thyroid cancer.
miR-126-3p;Thyroid cancer;Proliferation;Apoptosis;Migration;Invasion
10.3969/j.issn.1000-484X.2017.04.022
蔡 洲(1977年-),男,硕士,讲师,主要从事生物化学与分子生物学专业的教学和科研工作,E-mail:caizhou867@163.com。
R736.1
A
1000-484X(2017)04-0584-05
①广州军区武汉总医院普外科,武汉430070。
