抑制TGF-β1对慢性环孢素肾病小鼠Smad2/3及ILK信号分子的影响①
2017-04-24曾强林白志勋杨亦彬
曾强林 白志勋 王 丹 杨亦彬
(遵义医学院附属医院肾病风湿科,遵义563003)
抑制TGF-β1对慢性环孢素肾病小鼠Smad2/3及ILK信号分子的影响①
曾强林 白志勋 王 丹 杨亦彬
(遵义医学院附属医院肾病风湿科,遵义563003)
目的:特异性抑制TGF-β,观察Smad2/3、ILK信号蛋白变化,评估TGF-β1/Smad/ILK信号通路在环孢素肾病 (CCN) 模型小鼠小管间质纤维化中的作用。方法:BALB/c小鼠随机分成:环孢素模型组 (CMG)、干预模型组(IMG)、溶媒对照组(SCG)、低盐对照组 (LCG)和正常对照组 (NCG)。CMG与IMG组采用低盐饲养并环孢素60 mg/(kg·d)灌胃,从第28天腹腔给予TGF-β1特异抑制剂SB-431542 10 mg/(kg·2 d),第38天后采样,比较各组血清肌酐(Scr);观察肾组织羟脯氨酸(Hyp)含量及其病理变化,免疫组化或Western blot观察TGF-β1、P-Smad2/3、ILK表达,RT-PCR检测TGF-β1、Smad2/3及ILK mRNA表达。结果:CMG和IMG小鼠SCr显著升高 (P<0.01),肾小管结构不同程度损伤,间质炎性细胞增多,蓝色胶原染色不同程度增多,肾组织Hyp含量明显增多(P<0.01),其中IMG上述指标较CMG明显改善。CMG和IMG小鼠肾小管间质TGF-β1、P-Smad2/3及ILK基因和蛋白表达明显增强 (P<0.01),而IMG上述因子表达明显低于CMG (P<0.05)。肾脏Hyp含量与Scr、TGF-β1、P-Smad 2/3、ILK水平呈正相关(r=0.860、 0.711、0.776、0.676,均P<0.01)。 结论:TGF-β1/Smads信号通路是CCN模型小鼠肾间质纤维化重要机制之一;ILK参与CCN小管间质纤维化,且可能系TGF-β1/Smads信号通路下游因子参与CCN小管间质纤维化进程。
环孢素肾病;环孢素A;小管间质纤维化;转化生长因子-β1/Smads;整合素连接激酶
环孢素A(Cyclosporine-A,CsA)是目前广泛应用于器官移植的免疫抑制剂,但其慢性毒副作用导致的慢性环孢素肾病(Chronic cyclosporine nephro-pathy,CCN)严重影响到移植患者和移植物的长期存活[1,2]。CCN发病机制十分复杂,其突出的病理改变为小管间质纤维化(Tubule interstitial fibrosis,TIF)。业已证明TIF是各种慢性肾脏疾病进展至终末期肾脏病的共同途径,并涉及多种信号传导通路激活,其中转化生长因子β1 (Transforming growth factor-β1,TGF-β1)/Smads是公认的组织纤维化重要信号通路之一[3,4],而近年来发现整合素连接激酶(Integrin-linked kinase,ILK)可能作为TGF-β1/Smads信号通路下游因子参与纤维化进展[5]。基于前期发现CNN肾脏存在TGF-β1、Smads基因异常表达,并与肾小管间质纤维化程度相关[6],本研究旨在通过阻断性实验以进一步观察TGF-β1/Smads/ILK在CCN小管间质纤维进程中作用。
1 材料与方法
1.1 材料
1.1.1 主要实验材料 清洁级雄性BALB/c小鼠50只,6~8周龄,体重约16~18 g(北京华阜康生物科技有限公司);环孢素口服溶液(中美华东制药);SB-431542(Sigma);羟脯氨酸试剂盒(南京建成);免抗小鼠TGF-β1、p-Smad2/3、ILK一抗、荧光标记二抗、兔二步法检测试剂盒(PV-6001);SP试剂盒(中杉金桥);RNA逆转录试剂盒、SYBR®Premix Ex TaqTM试剂盒(大连宝生物)。
1.1.2 模型建立及分组 小鼠适应性喂养1周后,随机分为5组:环孢素模型组[CsA model group,CMG,CsA 60 mg/(kg·d)灌胃]、干预模型组 (Interventional model group,IMG)、溶媒对照组(Solvent control group,SCG)、低盐对照组(Low salt control group,LCG)和正常对照组(Normal control group,NCG),10只/组。CsA以橄榄油为溶媒稀释,按60 mg/(kg·d) 灌胃,干预组于第28天腹腔注射TGF-β特异抑制剂SB-431542 10 mg/(kg·2 d),共10 d。正常对照组予以标准饲料喂养,其余各组均予以 0.042%低盐饲料饲养(广东省医学实验动物中心加工)。第38天麻醉后摘眼球取血,分离血清,-20℃保存备用,生理盐水自腹主动脉灌注后摘除双侧肾脏,置福尔马林溶液和液氮保存备用。
1.2 方法
1.2.1 肾组织羟脯氨酸测定 碱水解法,严格按试剂盒说明操作。
1.2.2 免疫组织化学 取福尔马林固定肾组织,石蜡包埋,3 μm切片,逐步脱蜡至水,双氧水除内源性过氧化物酶,PBS冲洗,抗原热修复后,加入TGF-β1(1∶200)、p-Smad2/3(1∶200)、ILK(1∶100)一抗,4℃孵育过夜。复温并PBS冲洗后加入相应二抗,DAB显色,苏木素复染,封片。采用PBS代替一抗作为阴性对照。每张切片随机取5个视野,采用IP-Win32分析染色结果,Image-proplus 6.0读取积分光密度值(IOD值)进行半定量分析。
1.2.3 Western blot检测ILK 冰上剪碎肾组织,加入RIPA和PMSF混合液裂解后提取总蛋白,BCA法蛋白定量后,SDS-聚丙烯酰胺凝胶电泳,电转运至PVDF膜上,脱脂牛奶封闭1 h,分别加入ILK(1∶500)一抗、荧光标记二抗(1∶10 000)并孵育、洗涤,ECL显影,Odyssey 近红外双色激光成像系统扫描分析,以β-actin作为内参。
1.2.4 RT-PCR 肾组织匀浆后用Trizol试剂盒提取RNA,Nano-Drop 1000测定RNA的纯度及浓度。严格按试剂盒说明书逆转录合成cDNA,PCR扩增目的基因片段,引物由大连宝生物公司设计合成(见表1)。以Ct值为统计参数,按2-ΔΔCt法计算TGF-β1、Smad 2/3和ILK mRNA的相对表达量。
表1 RT-PCR引物序列对
Tab.1 Primer sequences of RT-PCR
2 结果
2.1 小鼠一般情况变化 给CsA 1周后,垫料潮湿逐渐加重,并出现异常酸臭气味,动物毛色暗淡无光,体型瘦弱,直到实验终点无小鼠死亡。
2.2 血肌酐水平 两个CsA模型组 (CMG、IMG) 血肌酐水平明显升高(P<0.01),但IMG低于CMG(P<0.01),见表2。
2.3 病理组织学变化 Masson染色显示CMG及IMG小鼠肾组织都有不同程度的间质纤维化,部分小管腔缩小、闭塞,其中IMG纤维化程度相对较轻,见图1。
2.4 肾组织Hyp含量检测 两模型组(CMG、IMG)小鼠Hyp含量较三个对照组(SCG、LCG、NCG)显著增高(P<0.01),IMG肾脏Hyp含量低于
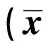
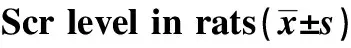

GroupsScr(μmol/L)CMG 78 000±13 6142)IMG 38 500±4 2431)3)SCG27 200±6 099LCG18 571±8 223NCG20 444±6 386
Note:Compared with three control group,1)P<0.05, 2)P<0.01;compared with CMG, 3)P<0.05.
CMG(P<0.01),见表3。
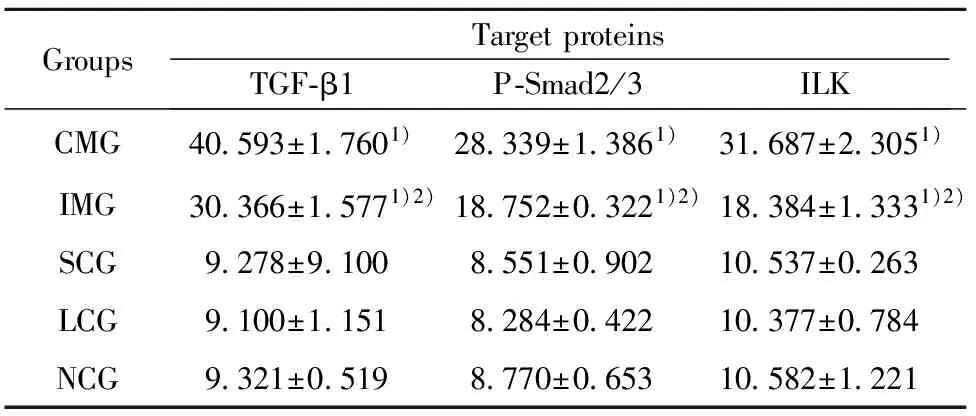
2.5 各组大鼠肾组织免疫组化结果 CMG及IMG肾组织TGF-β1、P-Smad2/3及ILK表达明显增多(P<0.01),突出表现在小管间质,但IMG上述三个指标表达均明显低于CMG(P<0.01),见表4、图 2~4。
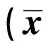
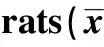

GroupsHypcontent(μg/mg)CMG0 395±0 0261)IMG0 280±0 0501)2)SCG0 158±0 025LCG0 162±0 034NCG0 177±0 048
Note:Compared with three control group,1)P<0.01;compared with CMG,2)P<0.01.
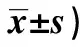

GroupsTargetproteinsTGF⁃β1P⁃Smad2/3ILKCMG40 593±1 7601)28 339±1 3861)31 687±2 3051)IMG30 366±1 5771)2)18 752±0 3221)2)18 384±1 3331)2)SCG9 278±9 1008 551±0 90210 537±0 263LCG9 100±1 1518 284±0 42210 377±0 784NCG9 321±0 5198 770±0 65310 582±1 221
Note:Compared with three control group,1)P<0.01;compared with CMG,2)P<0.01.

图1 小鼠肾组织Masson染色结果(× 400)Fig.1 Representative renal tissue section stained by Masson(×400)

图2 各组小鼠肾组织TGF-β1 免疫组化图(×400)Fig.2 Representative TGF-β1 immunostaining in renal tissue of rats(×400)
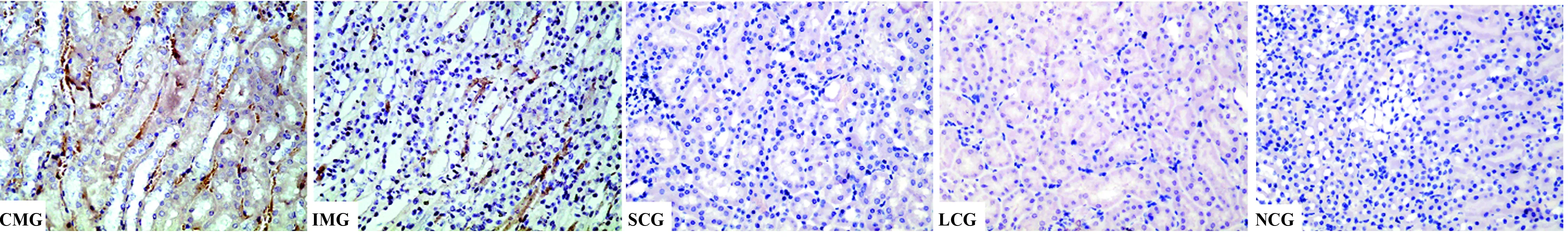
图3 各组小鼠肾组织P-Smad 2/3 免疫组化图(×400)Fig.3 Representative P-Smad2/3 immunostaining in renal tissue of rats(×400)
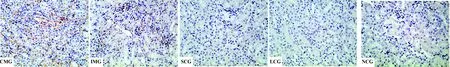
图4 各组小鼠肾组织ILK免疫组化图(×400)Fig.4 Representative ILK immunostaining in renal tissue of rats(×400)

图5 各组小鼠肾组织ILK蛋白表达Fig.5 Expression of ILK protein in renal tissue of ratsNote:Compared with three control group,△.P<0.01;compared with CMG,*.P<0.01.
2.6 ILK蛋白印迹结果 CMG及IMG小鼠肾组织 ILK表达水平明显升高(P<0.01),但IMG表达水平明显低于CMG(P<0.01),见图5。
2.7 肾组织TGF-β1、Smad2/3及 ILK mRNA表达(RT-PCR) CMG以及IMG肾组织TGF-β1、Smad2/3及 ILK mRNA表达明显上调(P<0.01),但IMG 上述3个指标表达明显低于CMG(P<0.05),见表5。
2.8 指标相关性分析 肾脏Hyp含量与Scr、TGF-β1、P-Smad2/3、ILK水平呈正相关(r=0.860、 0.711、0.776、0.676,均P<0.01)。
3 讨论
CsA是神经钙调蛋白抑制剂,作为抗排斥反应药物极大促进器官移植领域发展,但却存在严重肾
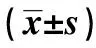
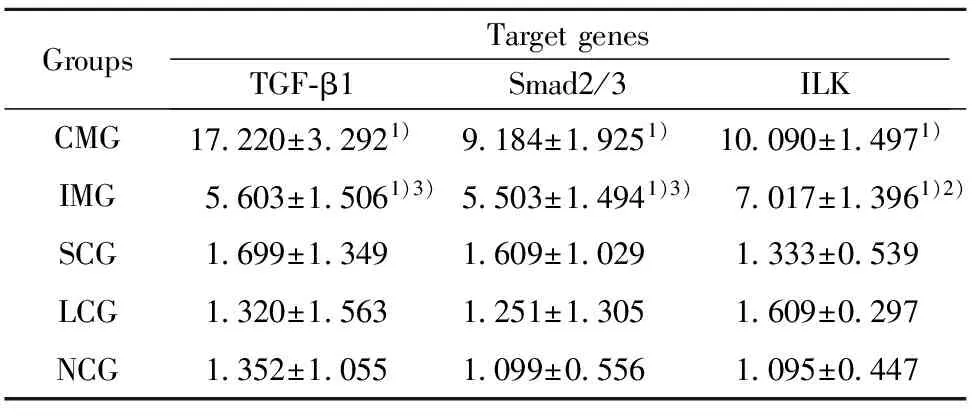
GroupsTargetgenesTGF⁃β1Smad2/3ILKCMG17 220±3 2921)9 184±1 9251)10 090±1 4971)IMG5 603±1 5061)3)5 503±1 4941)3)7 017±1 3961)2)SCG1 699±1 3491 609±1 0291 333±0 539LCG1 320±1 5631 251±1 3051 609±0 297NCG1 352±1 0551 099±0 5561 095±0 447
Note:Compared with three control group,1)P<0.01;compared with CMG,2)P<0.05,3)P<0.01.
毒性作用,其急性肾毒性损害多可通过换药或减量得以改善,而慢性肾毒性导致移植肾CCN受医学界关注[7,8]。CCN最主要的病理表现是慢性肾纤维化,其发病机制主要涉及肾素血管紧张素系统 (RAS)激活、肾小管上皮细胞-间叶细胞转分化、氧化应激、纤维化细胞因子表达上调、炎症反应以及肾脏慢性缺血缺氧等[9,10]。
小管间质纤维化是各种慢性肾脏疾病进展至终末期肾衰竭共同途径,有效防治和延缓小管间质纤维化已成为研究热点[11],其过程涉及多种细胞信号传导通路的参与,其中TGF-β/Smads被认为在慢性肾纤维化进程中具有重要作用[3,4]。Smads是TGF-β受体作用的最直接底物,可分为通路限制性R-Smad(Smad1/2/3/5/8/9)、共同通路性C-Smads(Smad4)、抑制性I-Smads(Smad6/7)。TGF-β与其受体结合并磷酸化Smad2和Smad3化,发挥促纤维化作用,而Smad7通过竞争性结合TGF-β1受体实现对Smad2/3磷酸化进程的抑制而发挥负性调节[12]。有学者发现CCN大鼠肾脏存在TGF-β1、Smad2/3表达上调,其异常表达与肾小管间质纤维化程度相关,而槲皮素、瑞舒伐他汀、抗氧化剂等可改善相关因子表达及纤维化程度[6,13,14]。为进一步证实TGF-β1/Smad2/3通路在CsA致小管间质纤维化中的作用,本实验通过BALB/c小鼠灌胃CsA建模,给予TGF-β1特异性抑制剂(SB-431542),观察到模型小鼠肾小管间质纤维化、肾功异常的同时,TGF-β1、Smad2/3 mRNA和蛋白表达明显上调,经TGF-β1特异性抑制剂干预处理后,肾组织TGF-β1、Smad2/3基因和蛋白表达水平较CsA模型组明显下调,血肌酐下降,肾羟脯氨酸含量及小管间质纤维化程度减轻,说明TGF-β1/Smads信号通路激活参与了CsA致慢性小管间质纤维化进程。
ILK是一种生物学活性多样化的丝氨酸/苏氨酸蛋白激酶,通过多种信号通路介导细胞骨架相关蛋白与整合素的连接、调节细胞表型、细胞外基质积聚等生物学过程。近年来研究显示上皮细胞向间充质细胞转分化(Epithelial-mesenchymal transiton,EMT)是肾脏纤维化重要机制之一,而ILK在肾脏纤维化进程中具有重要作用[15],且ILK可能作为TGF-β1/Smads信号通路下游因子参与纤维化进程[5]。有学者发现肾脏间质炎症和纤维化区域,其调控小管上皮细胞转分化的相关因子如TGF-β1、p-Smad2/3、ILK、β1-integrin、P38MAPK、Wnt5b、β-catenin等高表达,并认为TGF-β1/Smad、ILK、Wnt/β-catenin是肾脏纤维化重要信号通路[15,16],但在CCN中尚未见相关报道。本实验发现CCN模型小鼠肾脏ILK基因和蛋白表达明显上调,且与TGF-β1、Smad2/3、羟脯氨酸等中正相关,说明ILK激活参与CCN小管间质纤维化进程;给予TGF-β1特异性抑制剂后,其小鼠ILK基因和蛋白表达下调、血肌酐及肾组织羟脯氨酸含量下降,提示ILK可能作为TGF-β1/Smad2/3下游因子参与小管间质纤维化进程。有研究显示TGF-β1可诱导肾小管上皮细胞细胞上调ILK、α-SMA、pSmad2/3表达,下调E-cadh-erin 和Smad7表达,从而促进细胞EMT[5];而抑制ILK可明显改善TGF-β1诱导肾小管上皮细胞、足突细胞转分化,亦可降低输尿管梗阻、阿霉素肾病模型肾脏纤维化程度[17,18],这些结果提示ILK系TGF-β1/Smads信号通路下游分子,抑制或阻断ILK的表达和功能,对防治CCN具有积极意义。
[1] Tedesco D,Haragsim L.Cyclosporine:a review[J].J Transplant,2012,2012:230386.
[2] Issa N,Kukla A,Ibrahim HN.Calcineurin inhibitor nephrotoxicity:a review and perspective of the evidence[J].Am J Nephrol,2013,37(6):602-612.
[3] Meng XM,Tang PMK,Li J,etal.TGF-β/Smad signaling in renalbrosis[J].Front Physiol,2015,6:82.
[4] Samarakoon R,Overstreet JM,Higgins PJ.TGF-beta signaling in tissue fibrosis:redox controls,target genes and therapeutic opportunities[J].Cell Signal,2013,25(1):264-268.
[5] Qi F,Cai P,Liu X,etal.Adenovirus-mediated P311 inhibits TGF-β1-induced epithelial-mesenchymal transition in NRK-52E cells via TGF-β1-Smad-ILK pathway[J].Biosci Trends,2015,9(5):299-306.
[6] 谭州科,罗 茜,杨 蝶,等.槲皮素通过转化生长因子-β1/Smad通路减轻孢素诱导的大鼠肾小管间质纤维化[J].中华实验外科杂志,2015,32(8):1933-1935.
[7] Sereno J,Vala H,Nunes S,etal.Cyclosporine A-induced nephrotoxicity is ameliorated by dose reduction and conversion to sirolimus in the rat[J].J Physiol Pharmacol,2015,66(2):285-299.
[8] Camilleri B,Bridson JM,Halawa A.Calcineurin inhibitor-sparing strategies in renal transplantation:where are we? a comprehensive review of the current evidence[J].Exp Clin Transplant,2016,14(5):471-483.
[9] Hesselink DA,Bouamar R,van Gelder T.The pharmacogenetics of calcineurin inhibitor-related nephrotoxicity[J].Ther Drug Monit,2010,32(4):387-393.
[10] Yoon SP.Insights into the possible mechanism of cyclosporine-induced chronic nephrotoxicity;arteriolopathy[J].Nephrourol Mon,2012,4(2):489-490.
[11] Lee SY,Kim SI,Choi ME.Therapeutic targets for treating fibrotic kidney diseases[J].Transl Res,2015,165(4):512-530.
[12] Meng XM,Huang XR,Xiao J,etal.Disruption of Smad4 impairs TGF-beta/Smad3 and Smad7 transcriptional regulation during renal inflammation and fibrosis in vivo and in vitro[J].Kidney Int,2012,81(3):266-279.
[13] Nam HK,Lee SJ,Kim MH,etal.Rosuvastatin attenuates inflammation,apoptosis and fibrosis in a rat model of cyclosporine-inducednephropathy[J].Am J Nephrol,2013,37(1):7-15.
[14] Damiano S,Ciarcia R,Montagnaro S,etal.Prevention of nephrotoxicity induced by cyclosporine-A:role of antioxidants[J].J Cell Biochem,2015,116(3):364-369.
[15] Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212-222.
[16] Kim MK,Maeng YI,Sung WJ,etal.The differential expression of TGF-β1,ILK and wnt signaling inducing epithelial to mesenchymal transition in human renal fibrogenesis:an immunohistochemical study[J].Int J Clin Exp Pathol,2013,6(9):1747-1758.
[17] Li Y,Tan X,Dai C,etal.Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(9):1907-1918.
[18] Kang YS,Li Y,Dai C,etal.Inhibition of integrin-linked kinase blocks podocyte epithelial-mesenchymal transition and ameliorates proteinuria[J].Kidney Int,2010,78(4):363-373.
[收稿2016-06-12]
(编辑 张晓舟)
Effect of inhibiting TGF-β1 on Smad2/3 and ILK signaling molecules in chronic cyclosporine A nephropathy in mouse
ZENGQiang-Lin,BAIZhi-Xun,WANGDan,YANGYi-Bin.
DepartmentofNephrology&Rheumatology,AffiliatedHospitalofZunyiMedicalCollege,Zunyi563003,China
Objective:To investigate the effect of specific inhibition of transforming growth factor-β1 (TGF-β1) with SB-431542 on the Smad2/3 and integrin-linked kinase (ILK) signaling molecules in tubule interstitial fibrosis(TIF)-induced cyclosporine A(CsA) in mouse.Methods:50 BALB/c mice were randomly divided into 5 groups (10 mice per group):the CsA model group (CMG),the interventional model group (IMG),the solvent control group (SCG),the low-salt control group (LCG),and the normal control group (NCG).The model mouse was established with low-sodium diet and intragastric administration of cyclosporine A,which was dissolved in olive oil at a dose of 60 mg/(kg·d).After 4 weeks,a specific inhibitor of TGF-β1 (SB-431542 )was administered intraperitoneally with 10 mg/(kg·2 d) for 10 days (every other days).Mice were sacrificed at day 38.Serum creatinine (Scr) was measured,hydroxyp roline (Hyp)level and morphological changes of renal tissue were analyzed,expression levels of TGF-β1,P-Smad 2/3 and ILK were respectively detected by immunohistochemistry or Western blot,mRNA levels of TGF-β1,Smad 2/3 and ILK were respectively detected real-time polymerase chain reaction (RT-PCR).Results:Compared with three control groups (NCG,LCG and SCG),mice weight was decreased significantly,Scr level was increased significantly in two modeling groups (CMG and IMG) (P<0.01),and these changes in CMG were more obvious than those of IMG (P<0.05).Different levels of tubulointerstitial injury,interstitial infiltration of inflammatory cells and blue collagen staining in two modeling groups were observed,and particularly evident in CMG.TGF-β1,P-Smad2/3 and ILK immunostaining were mainly expressed in tubulointerstitium.The TGF-β1,P-Smad2/3 and ILK mRNA and immunostaining levels in two modeling groups were significantly increased as compared with three control groups (P<0.01),but their levels in IMG were significantly lower than those of CMG (P<0.05).The level of Hyp in renal tissue was positively correlated with Scr,TGF-β1,Smad2/3 and ILK (r=0.860,0.711,0.776,0.676,P<0.01).Conclusion:The activation of the TGF-β1/Smads signaling pathway plays an important role in the development of chronic CsA-induced TIF.The activation of ILK is closely correlated with the development of TIF,and may be used as a downstream factor of TGF-β1/Smads signaling pathway in regulating CsA-induced TIF.
Chronic cyclosporine nephropathy;Cyclosporine-A;Tubuleinterstitial fibrosis;TGF-β1/Smads;Integrin-linked kinase
10.3969/j.issn.1000-484X.2017.04.007
①本文为贵州省教育厅自然科学基金项目(黔教科2010044)和遵义市科技计划项目[遵市科合社字(2012)42号]。
曾强林(1985年-),男,硕士,住院医师,主要从事免疫抑制剂肾损害和慢性肾纤维化方面的研究。
及指导教师:杨亦彬(1962年-),男,博士,教授,主要从事慢性肾脏病、免疫抑制剂肾损害方面的研究,E-mail:yyb1011@sina.com。
R979.5 R692
A
1000-484X(2017)04-0511-05
