IL-22经Wnt/β-catenin通路抑制肝星状细胞致纤维化作用①
2017-04-24雷荣娥胡榜利张沛玲覃山羽姜海行
石 城 雷荣娥 胡榜利 张沛玲 覃山羽 姜海行
(广西医科大学第一附属医院消化内科,南宁530021)
IL-22经Wnt/β-catenin通路抑制肝星状细胞致纤维化作用①
石 城 雷荣娥 胡榜利 张沛玲 覃山羽 姜海行
(广西医科大学第一附属医院消化内科,南宁530021)
目的:研究IL-22抑制HSC致肝纤维化的作用和机制,探索Wnt/β-catenin通路在肝星状细胞(HSC)激活过程中的作用。方法:采用TGF-β1激活HSC,荧光定量PCR和Western blot检测细胞激活过程中β-catenin、α-SMA的mRNA和蛋白表达变化情况。应用不同浓度和不同时间的重组大鼠IL-22刺激大鼠HSC,CCK8法检测细胞增殖率,流式细胞术检测细胞凋亡率。采用TGF-β1预处理HSC,再用最适浓度IL-22干预,对比干预前后HSC增殖情况,并检测β-catenin、α-SMA的mRNA和蛋白表达变化情况。结果:TGF-β1激活HSC后,β-catenin、α-SMA的mRNA和蛋白表达水平显著升高(P<0.05)。IL-22以浓度依赖性和时间依赖性抑制HSC增殖(P<0.05),并降低β-catenin、α-SMA的mRNA和蛋白表达水平(P<0.05),但对HSC凋亡率无显著影响(P>0.05)。IL-22可以显著抑制TGF-β1诱导的HSC激活,并显著降低β-catenin、α-SMA的mRNA和蛋白表达水平(P<0.05)。结论:Wnt/β-catenin参与了HSC激活和分泌α-SMA过程, IL-22以浓度依赖性和时间依赖性抑制HSC活性,这种作用可能是通过抑制Wnt/β-catenin通路实现的。
肝星状细胞;白介素-22;Wnt/β-catenin通路
肝硬化是临床常见重大疾病之一,目前仍未有较好的治疗方法。肝纤维化是各种慢性肝病向肝硬化发展所共有的病理改变和必经途径,肝星状细胞(Hepatic stellate cell,HSC)的激活在肝纤维化的发生中起中心环节作用[1]。多种免疫因素通过激活HSC,促使其大量表达α-平滑肌肌动蛋白(α-SMA)和胶原蛋白,进而形成胶原纤维和细胞外基质,最终导致肝纤维化的发生和发展。
Wnt/β-catenin通路是机体调控器官发育,细胞增殖、迁移、分化、极化等过程中的重要通路之一,其中β-catenin是该通路的关键因子[2]。研究表明,异常激活的Wnt/β-catenin通路参与多种疾病发生过程,且Wnt/β-catenin通路的β-catenin在HSC激活过程中也发挥重要作用,抑制β-catenin表达可以降低HSC活性,减少胶原纤维的合成与分泌[3,4]。
IL-22是IL-10家族的成员,多种免疫细胞可以分泌IL-22。有研究表明IL-22通过抑制HSC活性减轻肝纤维化,用IL-22干预小鼠肝纤维化模型可以降低肝纤维化形成以及加速肝纤维降解[5]。然而IL-22抗肝纤维化的机制目前研究甚少。本研究将探索Wnt/β-catenin通路在IL-22抑制HSC的作用机制,为IL-22在抗肝纤维化的应用提供重要实验依据。
1 材料与方法
1.1 材料 大鼠肝星状细胞株HSC-T6购自ATCC(American Type Culture Collection)公司并液氮保存使用;重组大鼠白介素-22(rrIL-22)、重组大鼠TGF-β1(rrTGF-β1)购买自R&D公司;总RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒购买自宝生物工程(大连)有限公司;引物由上海生物工程技术服务公司设计合成;低温高速离心机(Eppendrof公司);流式细胞凋亡检测试剂盒(BD公司);流式细胞仪FACS Calibur(BD公司);蛋白裂解液RIPA和BCA蛋白定量试剂盒(碧云天生物技术研究所);PMSF蛋白酶抑制剂(Sigma公司);单克隆β-catenin山羊抗兔一抗、单克隆α-SMA山羊抗兔一抗(Abcam公司);GAPDH内参抗体(碧云天生物技术研究所);0.45 μm PVDF膜(Merck Millipore公司);荧光二抗(Li-COR公司);Odyssey红外激光成像系统(Li-COR公司)。
1.2 方法
1.2.1 细胞培养与处理 HSC用含10%胎牛血清的高糖DMEM培养液培养,37℃、5%CO2、饱和湿度培养箱中培养,含EDTA的0.25%胰蛋白酶消化,每2 d传代一次。
1.2.2 CCK8法检测细胞增殖率 HSC细胞悬液(1×105ml-1)接种至96孔板(100 μl/孔),不同浓度或不同时间的IL-22处理,每孔加CCK8试剂10 μl,37℃避光孵育2 h,酶标仪测定450 nm处的OD值,细胞增殖率按公式计算:细胞增殖率(%)=[A(加药)-A(空白)]/[A(未加药)-A(空白)]×100%。
1.2.3 流式细胞术检测细胞凋亡率 HSC经不同浓度IL-22处理后,使用不含EDTA胰酶消化收集细胞,4℃ 1 000 r/min离心5 min,预冷PBS洗涤细胞3次,1×Binding buffer重悬细胞并调整细胞浓度至1×106ml-1,取100 μl细胞悬液至Falcon流式管中,加5 μl FITC Annexin V和5 μl PI,室温(25℃)避光孵育15 min后加400 μl 1×Binding buffer,1 h内流式细胞仪检测,用CellQuest软件分析1×105个细胞样品。
1.2.4 q-PCR检测mRNA表达水平 HSC经不同浓度IL-22处理以及TGF-β1激活后IL-22处理,PBS洗涤细胞2次,按总RNA提取试剂盒说明书提取细胞总RNA,按逆转录试剂盒说明书将mRNA逆转录成cDNA,SYBR-Green荧光定量试剂盒检测目的基因mRNA表达水平,基因引物序列见表1。ABI公司StepOnePlus荧光定量PCR仪检测,采用两步法PCR标准扩增程序:95℃ 30 s、95℃ 5 s、60℃ 30 s,40个循环。采用2-ΔΔCT计算目的基因与内参基因GAPDH的相对表达量。
1.2.5 Western blot检测蛋白表达水平 HSC经不同浓度IL-22处理以及TGF-β1激活后再予IL-22处理,含EDTA胰酶消化收集细胞,1 000 r/min离心5 min,PBS洗涤细胞3次,RIPA裂解液与PMSF蛋白酶抑制剂按100∶1预混,25 cm2贴壁细胞加 300 μl 预混液冰上裂解15 min,4℃ 14 000 r/min离心 15 min 后取上清。BCA法测蛋白浓度,4份蛋白溶液与一份5×蛋白上样缓冲液混匀后95℃ 10 min。等量蛋白(20 μg)上样于10%SDS-PAGE胶中电泳90 min 分离,分离后的蛋白转印至PVDF膜上,室温下(25℃)5%脱脂牛奶封闭1 h,4℃一抗孵育过夜,TBST溶液洗膜3次,10 min/次。室温下(25℃)荧光二抗孵育1 h,TBST溶液洗膜3次,10 min/次,荧光信号用Odyssey红外激光成像系统检测,蛋白灰度分析用Odyssey软件进行。
表1 目的基因引物序列
Tab.1 Primers for target gene
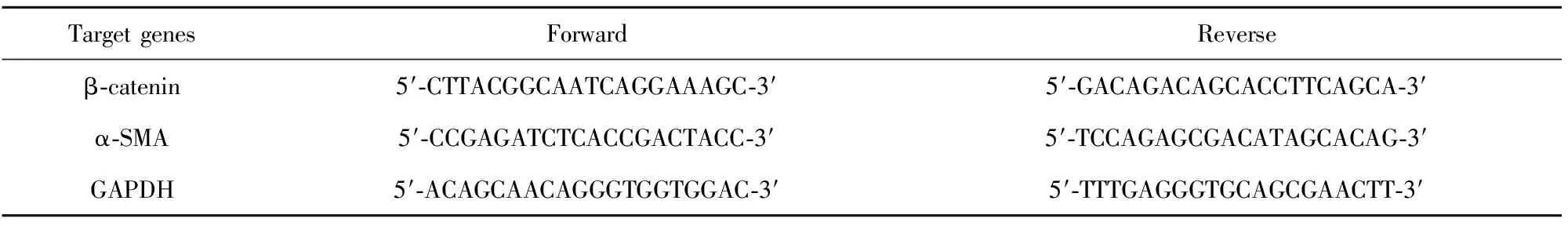
TargetgenesForwardReverseβ⁃catenin5′⁃CTTACGGCAATCAGGAAAGC⁃3′5′⁃GACAGACAGCACCTTCAGCA⁃3′α⁃SMA5′⁃CCGAGATCTCACCGACTACC⁃3′5′⁃TCCAGAGCGACATAGCACAG⁃3′GAPDH5′⁃ACAGCAACAGGGTGGTGGAC⁃3′5′⁃TTTGAGGGTGCAGCGAACTT⁃3′

2 结果
2.1 HSC激活过程中Wnt/β-catenin通路和α-SMA改变 分别使用0、2.5、5 ng/ml浓度的TGF-β1干预HSC 48 h,检测干预后细胞内β-catenin和α-SMA的mRNA和蛋白水平变化,结果显示β-catenin 和α-SMA的mRNA和蛋白水平均随着TGF-β1浓度增加而升高,见图1A、B,提示HSC激活过程中伴随着Wnt/β-catenin通路激活和α-SMA表达改变。
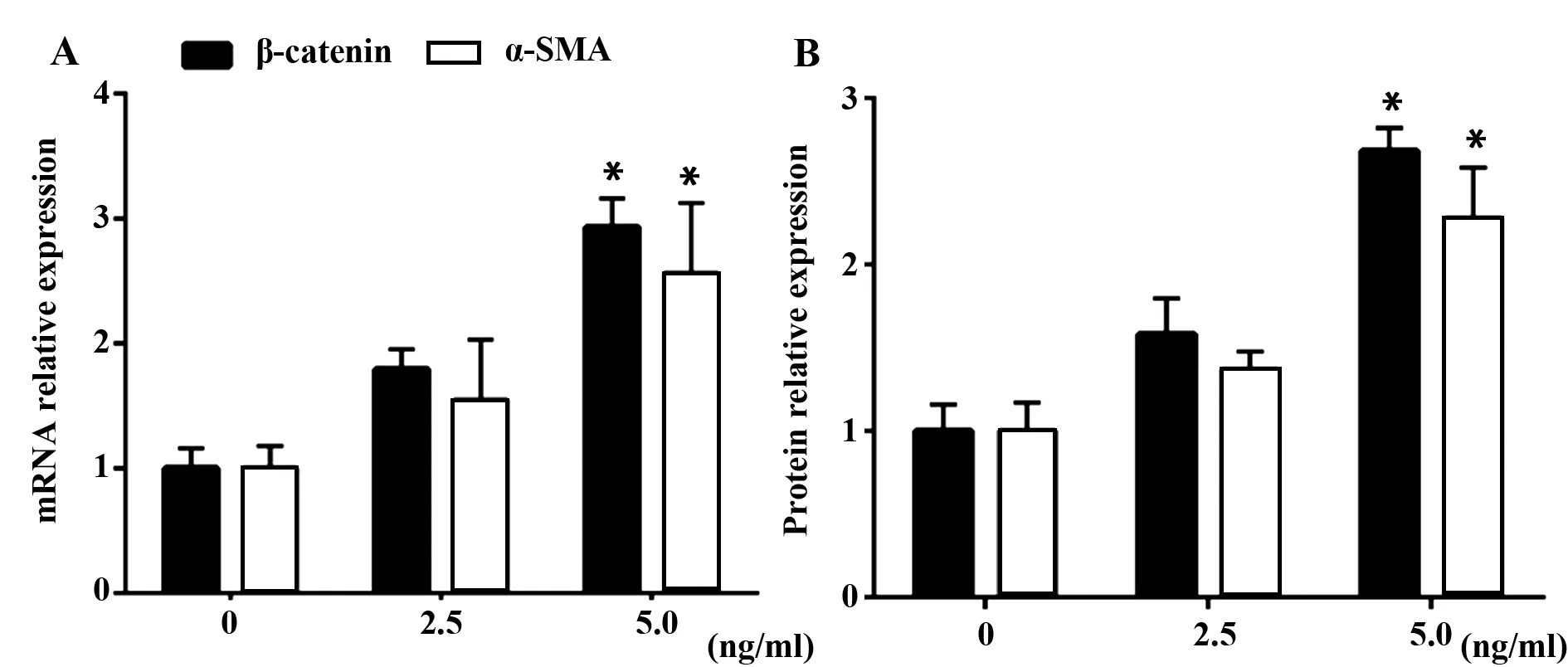
图1 TGF-β1促进肝星状细胞β-catenin和α-SMA表达Fig.1 TGF-β1 promotes HSC to secret β-catenin and α-SMANote:A.mRNA levels;B.Protein levels;There was a significant differences of mRNA and protein levels between the 5 ng/ml and 0 ng/ml of TGF-β1 group,*.P<0.05.
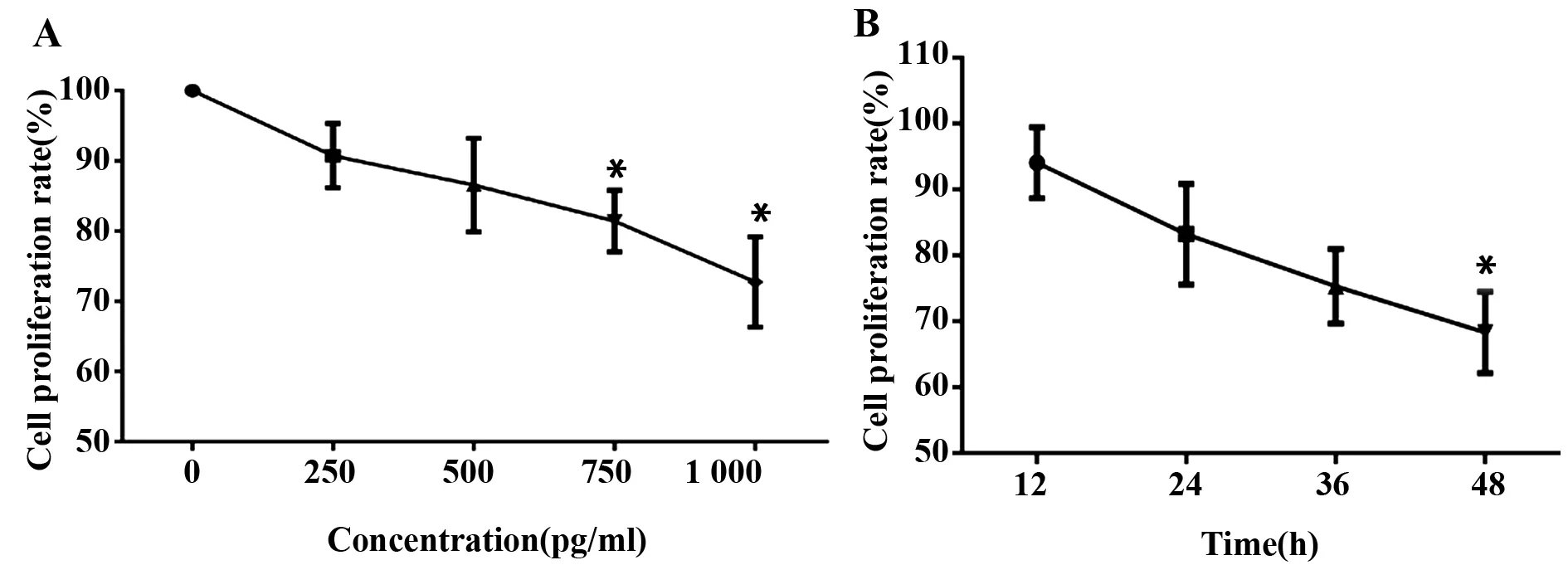
图2 IL-22抑制肝星状细胞增殖Fig.2 IL-22 inhibits proliferation of HSCNote:A.Concentration dependent manner;B.Time dependent manner;The cell proliferation rates was significantly decreased in 750 pg/ml and 1 000 pg/ml group compared with 0 pg/ml group,and also remarkably decreased in 48 h group compared with 12 h group after IL-22 intervention,*.P<0.05.
2.2 IL-22抑制HSC的增殖能力 分别使用0、250、500、750、1 000 pg/ml浓度IL-22干预HSC 48 h后,观察细胞的增殖情况,结果显示HSC增殖率随着IL-22浓度增加呈下降趋势,到750 pg/ml时的细胞增殖率显著大于0 pg/ml(P<0.05),见图2A;再以1 000 pg/ml浓度IL-22分别干预HSC 12、24、36、48 h,观察细胞的增殖和凋亡情况,结果显示HSC增殖率随IL-22浓度增加呈下降趋势,在干预后48 h最显著(P<0.05),见图2B。
HSC凋亡率随着IL-22浓度增加呈升高趋势,但各个浓度组间差异无统计学意义(P>0.05),见图3A;且IL-22干预的各时间段之间细胞凋亡率差异亦无统计学意义(P>0.05),见图3B。
2.3 IL-22抑制TGF-β1激活的HSC的增殖 以1 000 pg/ml 浓度IL-22 干预HSC 48 h后,与未干预的HSC相比,干预后HSC增殖率显著下降,差异有统计学意义(P<0.05);采用5 ng/ml浓度的TGF-β1预处理HSC 24 h,再给予1 000 pg/ml浓度的IL-22干预HSC 48 h,结果显示(见图4),TGF-β1干预HSC后细胞激活,细胞增殖率明显升高; 激活后的HSC再予IL-22干预,细胞增殖受到抑制,与未进行IL-22干预的HSC相比,干预后的HSC增殖率被显著抑制(P<0.05)。
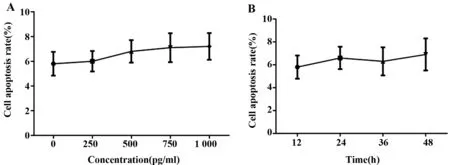
图3 IL-22不影响肝星状细胞凋亡Fig.3 IL-22 has no significant effect on apoptosis of HSCNote:A.Different concentration;B.Different time.
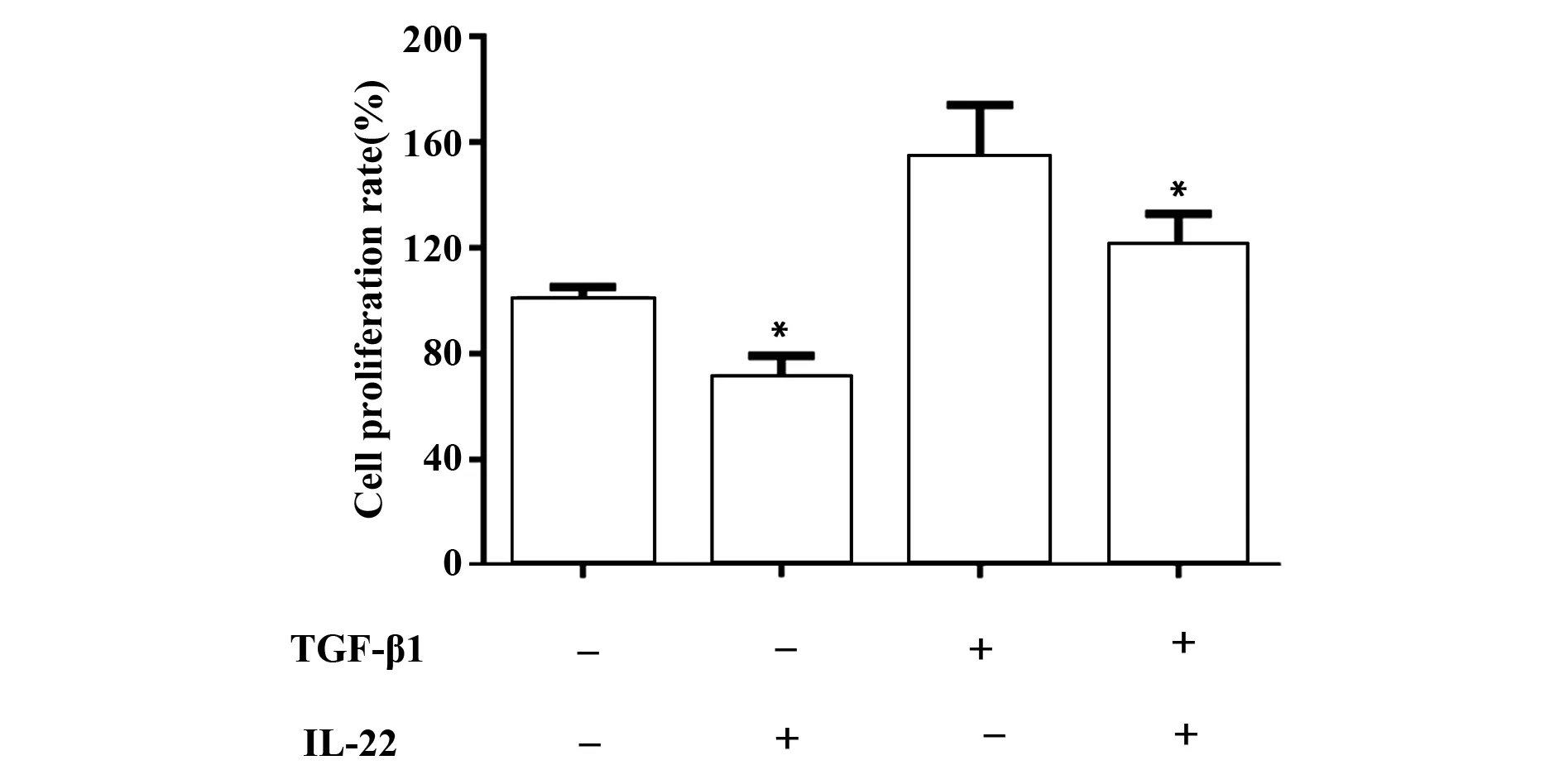
图4 不同TGF-β1/IL-22组合干预HSC后细胞增殖率变化情况Fig.4 Cell proliferation rates of HSC treated with different combination of TGF-β1 and IL-22Note:IL-22 significantly inhibits proliferation of HSC in both TGF-β1 negative and positive group,*.P<0.05.

图5 不同TGF-β1/IL-22组合干预HSC后β-catenin/α-SMA表达情况Fig.5 Expression levels of β-catenin,α-SMA mRNA and protein of HSC treated with different combination of TGF-β1 and IL-22Note:A.mRNA levels;B.protein levels;C.WB figure;IL-22 significantly inhibits the expression of β-catenin/α-SMA mRNA of HSC both in TGF-β1 negative and positive group,*.P<0.05.
2.4 IL-22抑制HSC和TGF-β1激活后HSC内的β-catenin、α-SMA表达水平 以1 000 pg/ml浓度IL-22 干预HSC 48 h后,细胞内的β-catenin、α-SMA mRNA和蛋白表达水平下调,差异有统计学意义(P<0.05)。采用5 ng/ml浓度的TGF-β1预处理HSC 24 h,再给予1 000 pg/ml浓度的IL-22干预HSC 48 h,发现与未干预的HSC相比,干预后HSC的β-catenin、α-SMA mRNA和蛋白表达水平显著降低(P<0.05)。提示IL-22可以抑制HSC细胞活性,进而抑制α-SMA的表达及Wnt/β-catenin信号通路的激活,并且对于TGF-β1激活后的HSC,IL-22同样具有抑制细胞活性作用,见图5。
3 讨论
肝脏自身是一个巨大的免疫器官,肝组织内有多种免疫细胞,这些免疫细胞及其分泌的细胞因子参与机体的多种生理、病理过程,且免疫因素在肝纤维化发生发展过程中发挥多种调节作用。IL-22是IL-10家族的成员,多种免疫细胞可以分泌IL-22。IL-22在促进抗微生物免疫及组织修复过程中扮演重要角色,通过与细胞表面受体IL-10R2和IL-22R1结合,进而激活胞浆内的多条信号通路来发挥生物学效应[6]。既往有研究表明,IL-22可以通过激活STAT3信号通路抑制HSC活性,降低HSC分泌细胞外基质,进而改善肝脏纤维化状态,促进肝纤维的好转[7]。
Wnt/β-catenin通路属于新兴研究的细胞通路,近年来的研究也表明该通路亦参与到组织器官纤维化过程中,但其参与组织器官纤维化的机制并没有被明确[8]。目前国内外均有研究证实Wnt/β-catenin通路与HSC的活化、肝纤维化的形成存在着一定关系。有学者使用带有商陆抗病毒蛋白的质粒,通过尾静脉注射对CCl4诱导的肝纤维化大鼠进行基因转染,观察到商陆抗病毒蛋白可以通过下调β-catenin表达来减轻肝纤维化的发生[9]。最近,研究发现miR-17-5p可以经诱导激活Wnt/β-catenin通路促进HSC激活,促进胶原纤维和α-SMA的合成与分泌,进而促进肝纤维化的发展[10]。
TGF-β1是较强的HSC激活因子[11],本研究中,我们使用TGF-β1刺激HSC,发现HSC激活过程中,β-catenin、α-SMA的mRNA和蛋白表达均随着TGF-β1刺激增大而升高,表明HSC激活可以激活Wnt/β-catenin通路,并分泌大量的致纤维化因子。因此,通过抑制相关通路的激活可以抑制HSC活性,进而减少肝纤维化的进展。我们还发现,IL-22可以以浓度依赖性和时间依赖性抑制HSC增殖,并降低HSC表达α-SMA的水平;此外,IL-22还可以拮抗TGF-β1诱导HSC的激活,降低其活性,提示IL-22是一个较强的抗纤维化因子,深入研究其作用机制可为抗肝纤维化的研究提供新的思路。
在IL-22抑制HSC的作用机制方面,本研究发现IL-22可以降低β-catenin的mRNA和蛋白表达水平,并且抑制TGF-β1诱导HSC中β-catenin的表达,提示IL-22可能经抑制Wnt/β-catenin通路来发挥抗纤维化作用。然而,本研究发现IL-22仅抑制HSC增殖,对其凋亡没有显著影响,我们推测这可能与Wnt/β-catenin通路的作用有关。有研究表明,细胞浆内的β-catenin被IL-22抑制后,β-catenin与转录因子T细胞因子/淋巴增强因子(T cell factor/Lymphoid enhancer-binging factor,TCF/LEF)结合下降,而TCF/LEF可以调控细胞的增殖过程,对细胞的凋亡并无显著影响[12]。
总之,本研究表明,Wnt/β-catenin参与了HSC激活和分泌α-SMA过程,而IL-22可以以浓度依赖性和时间依赖性抑制HSC活性,这种抑制作用是通过抑制Wnt/β-catenin通路实现的。本研究结果深化了IL-22抗肝纤维化作用的认识,为今后研发新的抗肝纤维化药物提供了重要的实验基础。
[1] Duval F,Moreno-Cuevas JE,Gonzalez-Garza MT,etal.Liver fibrosis and protection mechanisms action of medicinal plants targeting apoptosis of hepatocytes and hepatic stellate cells[J].Adv Pharmacol Sci,2014,2014:373295.
[2] Li J,Ji L,Chen J,etal.Wnt/beta-catenin signaling pathway in skin carcinogenesis and therapy[J].Biomed Res Int,2015,2015:964842.
[3] Lin X,Kong LN,Huang C,etal.Hesperetin derivative-7 inhibits PDGF-BB-induced hepatic stellate cell activation and proliferation by targeting Wnt/beta-catenin pathway[J].Int Immunopharmacol,2015,25(2):311-320.
[4] Ge WS,Wang YJ,Wu JX,etal.beta-catenin is overexpressed in hepatic fibrosis and blockage of Wnt/beta-catenin signaling inhibits hepatic stellate cell activation[J].Mol Med Rep,2014,9(6):2145-2151.
[5] Lu DH,Guo XY,Qin SY,etal.Interleukin-22 ameliorates liver fibrogenesis by attenuating hepatic stellate cell activation and downregulating the levels of inflammatory cytokines[J].World J Gastroenterol,2015,21(5):1531-1545.
[6] Dudakov JA,Hanash AM,van den Brink MR.Interleukin-22:immunobiology and pathology[J].Annu Rev Immunol,2015,33:747-785.
[7] Kong X,Feng D,Wang H,etal.Interleukin-22 induces hepatic stellate cell senescence and restricts liver fibrosis in mice[J].Hepatology,2012,56(3):1150-1159.
[8] 卜海激,朱明华.Wnt5a作用及信号转导通路研究进展[J].中华病理学杂志,2015,44(7):535-538.
[9] Li W,Zhu C,Chen X,etal.Pokeweed antiviral protein down-regulates Wnt/beta-catenin signalling to attenuate liver fibrogenesis in vitro and in vivo[J].Dig Liver Dis,2011,43(7):559-566.
[10] Yu F,Lu Z,Huang K,etal.MicroRNA-17-5p-activated Wnt/beta-catenin pathway contributes to the progression of liver fibrosis[J].Oncotarget,2016,7(1):81-93.
[11] Inagaki Y,Okazaki I.Emerging insights into Transfor ming growth factor beta Smad signal in hepatic fibrogenesis[J].Gut,2007,56(2):284-292.
[12] Brown-Clay JD,Shenoy DN,Timofeeva O,etal.PBK/TOPK enhances aggressive phenotype in prostate cancer via β-catenin-TCF/LEF-mediated matrix metalloproteinases production and invasion[J].Oncotarget,2015,6(17):15594-15609.
[收稿2016-08-30 修回2016-11-08]
(编辑 倪 鹏)
IL-22 inhibits liver fibrosis induced by hepatic stellate cells via Wnt/β-catenin signal pathway
SHICheng,LEIRong-E,HUBang-Li,ZHANGPei-Ling,QINShan-Yu,JIANGHai-Xing.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China
Objective:To investigate the effects and mechanisms of interleukin-22(IL-22) on inhibiting liver fibrosis induced by HSC,and explore the role of Wnt/β-catenin pathway in the activation of hepatic stellate cells(HSC).Methods:Rat HSC was activated by TGF-β1,and the mRNA and protein levels of β-catenin and α-SMA were detected by q-PCR and Western blot,respectively.HSC was treated with different hours and concentration of recombinant rat protein IL-22.The cell proliferation rates were detected by CCK8,cell apoptosis rates were tested by flow cytometry.HSC were treated with optimal concentration of IL-22 after activated by TGF-β1,the cell proliferation rates,mRNA and protein levels of β-catenin and α-SMA were compared of before and after intervention.Results:The mRNA and the protein levels of β-catenin and α-SMA were significantly increased after activated by TGF-β1(P<0.05).IL-22 inhibiting the proliferation of HSC in a dose-and time-dependent manner (P<0.05) and decreased the mRNA and the protein expression level of β-catenin and α-SMA(P<0.05),but had no significant effect on apoptosis rates(P>0.05).IL-22 significantly inhibited the activation of HSC induced by TGF-β1 and remarkably decreased the mRNA and the protein expression level of β-catenin and α-SMA(P<0.05).Conclusion:The Wnt/β-catenin pathway may participates in the process of HSC activation and α-SMA secretion,and IL-22 inhibits biological function of HSC in a dose- and time-dependent manner.This effect probably via inhibited the Wnt/β-catenin signal pathway.
Hepatic stellate cells;Interleukin-22;Wnt/β-catenin signal pathway
10.3969/j.issn.1000-484X.2017.04.005
①本文受国家自然基金(81260083)和广西研究生教育创新计划项目(YCBZ2015025)资助。
石 城(1990年-),男,硕士,主要从事肝纤维化免疫方面的研究。
及指导教师:姜海行(1963年-),男,博士,教授,博士生导师,主要从事肝病临床与基础方面的研究, E-mail:gxjianghx@163.com。
R575.2
A
1000-484X(2017)04-0502-05
