HCoV-OC43逃避人树突状细胞免疫清除机制的初步研究①
2017-04-24庹玖玲黄旭斌罗洪娇曹开源
杨 权 庹玖玲 黄旭斌 罗洪娇 周 凯 张 甜 曹开源 徐 霖
(广州医科大学基础学院病原生物学与免疫学教研室,广州511436)
·基础免疫学·
HCoV-OC43逃避人树突状细胞免疫清除机制的初步研究①
杨 权 庹玖玲②③黄旭斌④罗洪娇②③周 凯②③张 甜②③曹开源②③徐 霖②③
(广州医科大学基础学院病原生物学与免疫学教研室,广州511436)
目的:了解人冠状病毒OC43(Human coronavirus OC43,HCoV-OC43)逃避人树突状细胞(Dendritic cell,DC)免疫监视作用的初步机制。 方法:利用HCoV-OC43阳性病人的标本感染BSC-1细胞分离OC43病毒,相差显微镜观察细胞病变(Cytopathic effect,CPE),实时荧光定量聚合酶链反应(Real-time PCR)进行鉴定;利用人细胞因子GM-CSF和IL-4联合体外诱导DC分化,于诱导7 d后用HCoV-OC43病毒感染DC。采用透射电镜观察DC感染后的形态,Real-time PCR检测DC功能相关细胞因子的表达水平;流式细胞术检测DC比例及其功能相关共刺激分子的表达。结果:成功建立HCoV-OC43体外感染DC的体系。HCoV-OC43能感染DC并刺激其产生免疫应答,但培养上清中不能检测到病毒核酸;HCoV-OC43感染会导致DC细胞表达IFN-α、IFN-β、CCL3和CCL5的量显著下调,但其共刺激分子HLA-DR、CD1c和CD86的表达不受抑制。 结论:HCoV-OC43可感染人DC细胞并刺激其产生免疫应答,但不能产生活的子代病毒;HCoV-OC43可通过抑制宿主DC细胞IFN-α等相关炎症因子和趋化因子的分泌,来实现免疫逃逸。
人冠状病毒OC43;人树突状细胞;细胞因子;免疫逃逸
冠状病毒(Coronavirus, CoV)是目前已知的基因组最大的RNA病毒, 1937年首次从鸡身上分离得到,由于其病毒包膜上有形似皇冠的棘突而命名为冠状病毒[1]。动物感染了冠状病毒可引起一系列的疾病,包括支气管炎、肠胃炎、脑炎、腹泻、腹膜炎和呼吸道疾病等[2]。目前发现的人冠状病毒(Human coronavirus,HCoV)主要有6个亚型:HCoV-229E、HCoV-OC43、SARS-CoV、HCoV-NL63、HCoV-HKU1和MERS-CoV,其传播分布于世界各地[1,3-5]。HCoV感染通常不会引起严重的疾病,但SARS-CoV和MERS-CoV的爆发[6-9],提示高致病性CoV可传播到人群当中并对人类生命健康造成严重的威胁。目前对HCoV的致病性及机体抗病毒感染的研究较少,其机制尚未完全清楚。已有研究表明,病毒与宿主固有免疫细胞之间的相互作用是病毒致病的重要环节,对于病毒感染及免疫反应至关重要。树突状细胞(Dendritic cell,DC)是体内最重要的固有免疫细胞之一[10],作为功能最强的专职性抗原提呈细胞,担负着激发免疫应答,联结固有免疫与适应性免疫应答的重要功能,是产生抗病毒免疫的关键环节,是抗病毒感染最重要的“哨兵”,能启动天然免疫和获得性免疫系统发挥抗病毒免疫反应[11]。病毒可通过多种机制来干扰DC的作用,从而实现免疫逃逸,包括抑制DC的发生发展、成熟以及功能等[12-14]。但是目前HCoV-OC43与宿主DC之间的相互作用少见报道。为此,本研究通过利用HCoV-OC43体外感染人DC细胞,检测感染体系中CD11c+DC的比例、细胞因子表达量以及共刺激分子的表达情况,初步了解HCoV-OC43免疫逃逸的机制。
1 材料与方法
1.1 材料 HCoV-OC43阳性病人咽拭子标本由十二五国家科技重大专项“传染病监测技术平台”华南监测实验室提供;猴肾细胞系BSC-1由香港大学惠赠;健康人外周血由广东省血液中心提供;MEM基础培养基购自Hyclone公司;RPMI1640基础培养基、胎牛血清(FBS)、青霉素、链霉素、DEPC水和Trizol Reagent购自Invitrogen 公司; Ficoll淋巴细胞分离液(密度1.077/ml)购自天津市灏洋生物制品科技有限公司;Hu-GM-CSF和Hu-IL-4购自PeproTech公司;LPS购自Sigma-Aldrich 公司;QIAamp® minElute® Virus Spin RNA提取试剂盒购自QIAGEN公司;Revert Aid First Strand cDNA Synthesis Kit 购自Thermo公司;iQ Supper MIX购自BIO-RAD 公司;Premix Ex Taq® Version 2.0、pMD®18-T Vector和SYBR® Premix Ex TaqTM购自宝生物工程(大连)有限公司;抗人CD11c、CD1c、HLA-DR和CD86购自ebioscience公司;Mastercycler PCR仪和Mastercycler ep realplex 2购自Eppendorf公司;凝胶成像系统和电泳仪购自BIO-RAD 公司;细菌培养箱和CO2培养箱购自Thermo公司;倒置显微镜购自Olympus公司;10色分析型流式细胞仪购自Beckman Coulter公司。
1.2 方法
1.2.1 HCoV-OC43分离培养 取生长状态好的BSC-1细胞,接种到6孔板中进行培养,接种密度约50%。待细胞长到70%~80%时进行病毒感染,感染MOI=0.1。用MEM基础培养基补足感染标本体积至200 μl,缓慢加入细胞表面,对照组加入200 μl MEM基础培养基。37℃细胞培养箱中孵育1 h后,加入2 ml的MEM基础培养基培养。当病变细胞达80%左右时将细胞和上清一起收集,反复冻融3次制成病毒液,冻存于-80℃备用。
1.2.2 HCoV-OC43鉴定 取200 μl病毒液,用QIAamp®minElute®Virus Spin RNA提取试剂盒提取病毒RNA。取10 μl病毒RNA,用RevertAid First Strand cDNA Synthesis Kit进行逆转录合成cDNA。随后,利用Real-time PCR对HCoV-OC43进行鉴定,上游引物:5′-CGATGAGGCTATTCCG-ACTAGGT-3′;下游引物:5′-CCTTCCTGAGCCTTCAATATAGTAACC-3′;探针:FAM-TCCGCCTGGCACGGTACTCCCT-TAMAR。反应体系为:10 μl 2×iQ Supper MIΧ,0.25 μmol/L引物和探针各0.5 μl,2 μl cDNA模板和6.5 μl DEPC水。反应程序为:94℃ 5 min,94℃ 15 s,55℃ 1 min,第二步开始45个循环,第三步收集荧光。
1.2.3 病毒拷贝数计算标准曲线制备 利用HCoV-OC43鉴定的上下游引物对其高度保守的NP基因进行扩增。扩增体系为:10 μl Premix Ex Taq,10 μmol/L上下游引物各1 μl,2 μl 病毒cDNA,6 μl DEPC水。扩增程序为:95℃ 5 min,95℃ 30 s,52℃ 40 s,72℃ 1 min,72℃ 10 min,第2~4步35个循环。扩增产物鉴定纯化后进行转化,挑取阳性菌落送至上海英骏公司进行测序。对测序通过的菌液进行质粒抽提,以不同浓度的质粒为模板进行Real-time PCR检测。根据如下公式计算相应浓度下质粒的拷贝数:(6.02×1 023)×(ng/μl×10-9)/(DNA length×660)=copies/μl,根据拷贝数及相应CT值读数制作标准曲线。
1.2.4 人DC体外诱导分化 用人淋巴细胞分离液对健康人外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)进行分离,操作步骤严格按照说明书进行。成功分离后,加入1 ml RPMI1640培养液重悬PBMC,计数。按细胞数量计算接种孔数,每孔接种4×106细胞,4 ml培养基;按比例加入各种培养因子,使终浓度为:10%胎牛血清(FBS)、1%双抗(链霉素和青霉素)、50 ng/ml Hu-GM-CSF和10 ng/ml Hu-IL-4;用RPMI1640 培养基将细胞悬液浓度调整至1×106cells/ml,混匀,接种;每隔3 d更换新鲜培养液:吸弃3 ml旧培养液,加入3 ml含各种培养因子的新的完全培养液。
1.2.5 Real-time检测细胞因子的表达 DC培养第7天,将2×106(MOI=0.5)HCoV-OC43颗粒均匀加入DC培养体系中,对照组加入同体积的病毒颗粒溶剂。分别收集HCoV-OC43感染人DC后6 h和24 h的细胞,2 000 r/min离心5 min,弃上清。利用Trizol Reagent提取细胞总RNA。取0.5 μg RNA,用RevertAid First Strand cDNA Synthesis Kit进行逆转录合成cDNA。利用Real-time PCR反应检测实验组与对照组中与DC功能相关的细胞因子的表达,引物序列如表1所示。反应体系如下:10 μl SYBR Green Mix,2 μmol/L上下游引物各2 μl,2 μl cDNA,4 μl DEPC水。反应程序如下:95℃ 3 min,95℃ 10 s,60℃ 35 s,第二步开始40个循环。
1.2.6 流式细胞术检测DC表型 DC培养第5天,加入LPS(1 μg/ml)刺激DC成熟。LPS加入后48 h,将2×106(MOI=0.5)HCoV-OC43颗粒均匀加入DC培养体系中,对照组加入同体积的病毒颗粒溶剂。共培养72 h后,收集细胞,2 000 r/min离心5 min,弃上清;按说明书用量将适量抗体加入100 μl PBS中,混匀,加入细胞沉淀中,涡旋混匀,4℃ 避光孵育30 min;加入3 ml PBS缓冲液终止染色,2 000 r/min离心5 min,弃上清;向细胞沉淀中加入500 μl含2%多聚甲醛的PBS缓冲液重悬细胞,涡旋混匀后用流式细胞仪进行检测,读取50 000个细胞,结果在CellQuest(Becton Dickinson,Mountain View,CA)软件上进行分析。
1.2.7 电子显微镜观察DC细胞 DC培养第7天,将2×106(MOI=0.5)HCoV-OC43颗粒均匀加入DC培养体系中,对照组加入同体积的病毒颗粒溶剂。37℃细胞培养箱中共培养12 h后,弃培养上清,加入2 ml PBS缓冲液洗涤2次。向培养体系中加入原细胞培养液,37℃细胞培养箱中培养12 h后,吹打收集半悬浮细胞,2 000 r/min离心5 min,收集上清Real-time PCR检测HCoV-OC43核酸,细胞沉淀经2.5%戊二醛-锇酸固定,送至中山医学院电镜室进行超薄切片和透射电镜观察。
表1 Real-time PCR 检测细胞因子引物序列
Tab.1 Primers for Real-time PCR detection of cytokines

GeneForwardprimer(5′-3′)Reverseprimer(5′-3′)IL⁃1βTCCAGGGACAGGATATGGAGTCATCTTTCAACACGCAGGAIL⁃6ATGAGGAGACTTGCCTGGTGGGGTCAGGGGTGGTTATTGIL⁃8CAAACCTTTCCACCCCAAAGCCCTCTTCAAAAACTTCTCCIL⁃10GCTGAGAACCAAGACCCAGAGCATTCTTCACCTGCTCCACIL⁃12TCACAAAAGATAAAACCAGCACAGCACAGGGCCATCATAAAAGIFN⁃αCTCCTGGCACAGATGAGGAGATGGTTTCAGCCTTTTGGAIFN⁃βTCTCCTGTTGTGCTTCTCCAGATGTCAAAGTTCCTCCTGTCCTNFCGTGGAGCTGAGAGATAACCAGCTCTTGATGGCAGAGAGGACCL⁃3TGCAACCAGTTCTCTGCATCTTTCTGGACCCACTCCTCACCCL⁃5ATCTGCCTCCCCATATTCCTACACACTTGGCGGTTCTTTCMIP⁃1αCTCTGCACCATGGCTCTCTGCAACTGTGGAATCTGCCGGGAGGTGTAGMCP⁃1CATTGTGGCCAAGGAGATCTGCTTCGGAGTTTGGGTTTGCTTIP⁃10CTGACTCTAAGTGGCATTTGATGGCCTTCGATTCTGβ⁃actinCCCAAGGCCAACCGCGAGAAGATGTCCCGGCCAGCCAGGTCCAG
2 结果
2.1 HCoV-OC43分离培养和鉴定 HCoV-OC43阳性标本接种靶细胞BSC-1后第6天,大部分细胞发生病变,出现CPE(图1A),与阴性对照组相比,接种病毒的细胞出现皱缩、变圆和细胞融合等现象,符合HCoV-OC43典型细胞病变的表现。通过构建阳性质粒(图1B),制作得到病毒拷贝数计算公式:Y=-0.986 2X+42.822(X:CT值读数,Y:log2拷贝数/μl)。Real-time PCR检测结果显示,收集的病毒培养液CT值读数为19.76,通过计算得出与阴性对照相比,实验组培养体系中病毒拷贝数扩增了105倍,说明HCoV-OC43分离培养成功。
2.2 电子显微镜观察HCoV-OC43感染后人DC形态 病毒感染24 h后收集细胞进行电子显微镜观察,同时收集上清进行Real-time PCR检测。结果表明(图2),与对照组相比,病毒感染组的DC细胞突触变短变粗,并可观察到胞浆内形成的病毒颗粒与囊泡,表明OC43可被DC识别、摄取、加工和提呈。但培养上清中未能检测到病毒核酸的存在,表明OC43虽可感染DC,但不能释放出成熟的子代病毒。
2.3 HCoV-OC43感染抑制DC功能相关细胞因子表达 分别收集病毒感染6 h和24 h后的DC细胞,检测与DC功能相关的细胞因子的表达。病毒感染初期,DC表达IFN-α的量显著上升(P<0.01,图3),随着感染时间的推移,IL-1β、IL-8及趋化因子IP-10的表达显著增强(P<0.01,图3)。但随着时间的延长,Ⅰ型干扰素(IFN-α及IFN-β)和趋化因子CCL3和CCL5(P<0.01,图3)的表达显著下降。这些结果表明HCoV-OC43能快速刺激DC发生免疫应答反应,但感染一段时间后,DC部分功能细胞因子的表达会受到显著抑制。
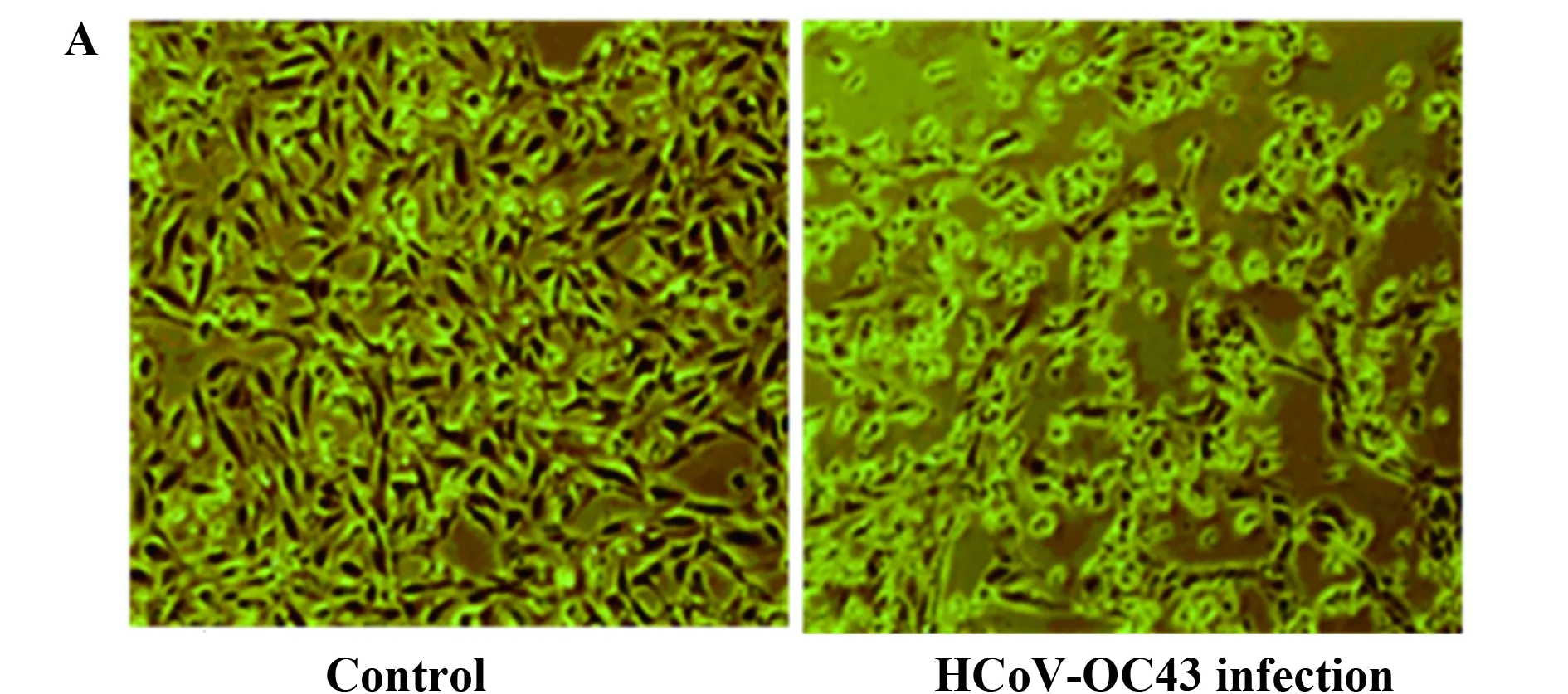
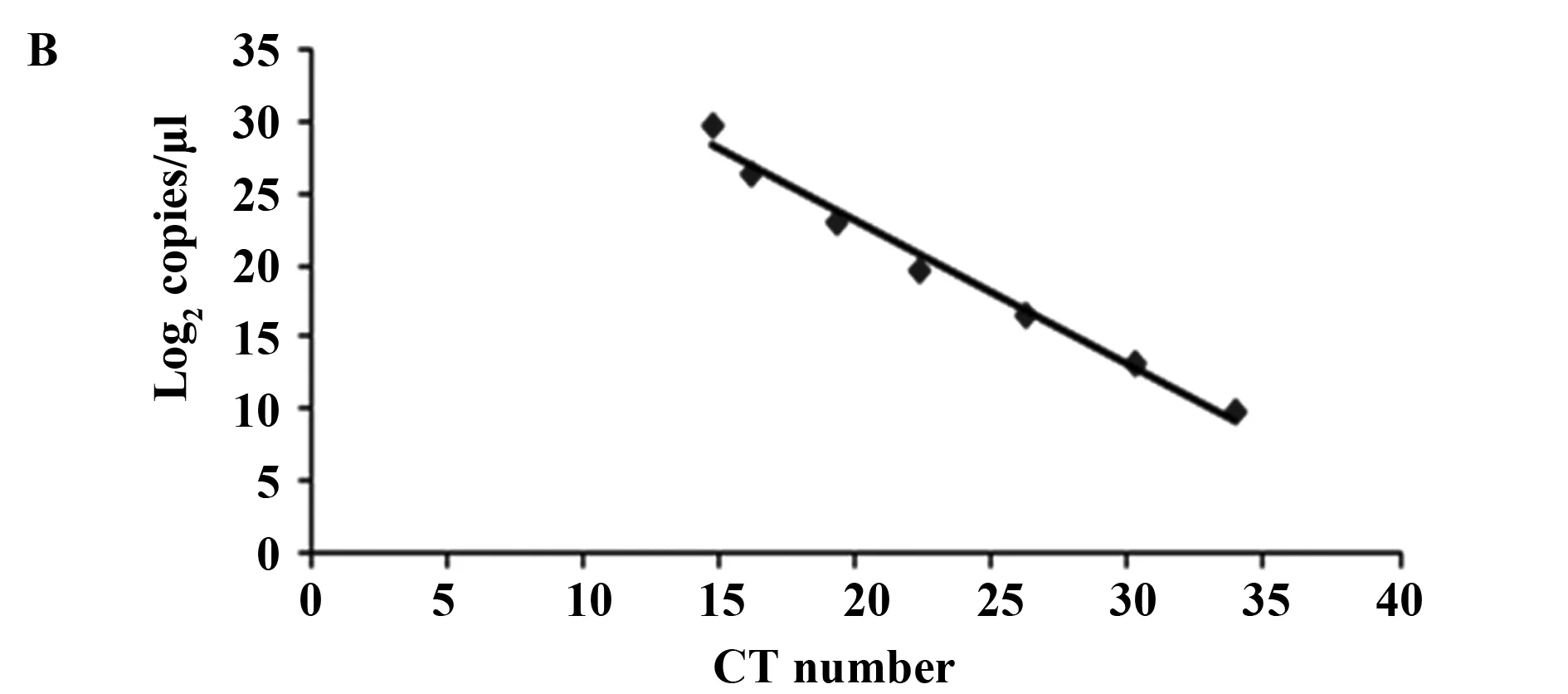
图1 HCoV-OC43分离培养CPE观察和病毒拷贝数计算标准曲线Fig.1 CPE of BSC-1 cells inoculated with HCoV-OC43 and standard curve for calculation of HCoV-OC43 copiesNote:Isolation and CPE observation of HCoV-OC43 on BSC-1 cells.A and standard curve for calculation of OC43 copies B.

图2 电子显微镜观察HCoV-OC43感染的人树突状细胞Fig.2 Electron microscope observation of human DC infected by HCoV-OC43
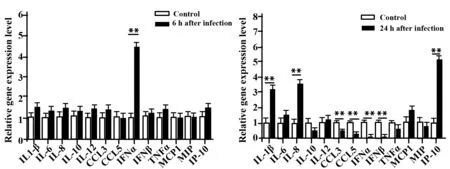
图3 Real-time PCR检测OC43病毒感染6 h和24 h后DC功能相关细胞因子的表达Fig.3 Expression level analysis of DC function related cytokines after infected with OC43 virus for 6 h and 24 h using Real-time PCRNote:**.P<0.01 vs control group.

图4 流式细胞术检测DC的比例及共刺激分子的表达Fig.4 Flow cytometry analysis of DC proportion and expression level of costimulatory molecules
2.4 HCoV-OC43感染不影响DC 共刺激分子的表达 DC培养第5天,加入LPS刺激其成熟,48 h后加入HCoV-OC43共培养。病毒感染72 h后,收集细胞进行流式细胞术检测。结果表明我们的体系诱导出来的是CD11c+CD1c-HLA-DR+DC,其CD86呈弱阳性表达(图4A)。与对照组相比,HCoV-OC43感染能显著促进成熟DC细胞HLA-DR平均荧光强度(P<0.05,图4B),同时CD86的表达也发生上调,说明HCoV-OC43能激活成熟DC产生抗病毒免疫反应,其共刺激分子的表达并不受病毒感染的影响。此外, HCoV-OC43感染成熟DC可导致CD1c呈弱阳性表达,说明病毒感染可能会改变培养体系中DC的分化和亚型分布。
3 讨论
病毒与宿主固有免疫细胞之间的相互作用是病毒致病的重要环节,对于病毒感染及免疫反应至关重要,其中又以IFN在抗病毒感染的固有免疫中的作用最为关键。病毒进入机体后,可被DC模式识别受体识别,并通过一系列级联反应引起IFN-α、IFN-β的分泌,这是机体天然免疫系统应对病毒感染的第一道防线[15]。迄今为止已报道了来自于93种不同病毒的超过170种由病毒编码产生的干扰素拮抗物质,作用于干扰素环路中的诱导活化、信号传导、效应发挥的不同环节[16]。研究病毒的免疫逃逸机制已经成为阐明病毒致病性的关键环节,具有十分重要的科学和实践意义。自1967年Mclntosh等[6]用人胚气管培养法从感冒病人中分离出HCoV-OC43病毒株以来,已证实人感染HCoV-OC43的症状主要为普通感冒,约占普通感冒的15%~30%,且基本都不属于下呼吸道感染[7],表明其致病力较低,但其在人群中的高感染率和反复感染性提示OC43可能已经较好地适应了人免疫力,具有一定的免疫逃逸机制。目前已有学者对HCoV-229E和HCoV-SARS的致病性及免疫逃逸机制进行了研究,但HCoV-OC43与人DC相互作用及其免疫逃逸机制目前尚不清楚。
Kuri等[17]研究发现HCoV-229E和HCoV-SARS等多种HCoV均具有抗干扰素反应的作用,HCoV-229E可感染肺泡巨噬细胞,并抑制其IFN-α和IFN-β的产生,但不抑制其CCL3和CCL4的分泌[18]。目前,HCoV-OC43在DC中是否能产生类似的抗干扰素的免疫逃逸效应少见相关文献报道。本研究首先在体外分离得到HCoV-OC43,并建立体外感染体系,对HCoV-OC43的致病性及免疫逃逸机制进行了初步研究。HCoV-OC43并不能像HCoV-229E一样杀死DC细胞[19],培养上清中也检测不到HCoV-OC43的核酸,但是我们发现与Law等[20]对HCoV-SARS的研究结果相似,HCoV-OC43感染后,DC细胞突触会变短变粗,细胞内颗粒增多,并可观察到胞浆及囊泡内摄取和加工的病毒颗粒。本研究结果表明HCoV-OC43可感染人DC细胞但不能释放成熟子代病毒,DC胞浆内的病毒可被其加工提呈,刺激产生相应的抗病毒免疫应答。
对DC功能相关细胞因子表达分析的结果显示,在病毒与DC接触的初期(感染6 h),IFN-α的表达迅速增多,到24 h时,IL-1β、IL-8及IP-10产量也相继增多,说明HCoV-OC43入侵后,DC会迅速分泌包括IFN-α在内的相关的炎症因子,刺激自身的成熟及迁移到外周启动后续免疫反应。但是在病毒感染24 h时,我们发现Ⅰ型干扰素(IFN-α和IFN-β)的表达出现了显著下调,同时趋化因子CCL3和CCL5表达也明显下降。Ⅰ型干扰素及其他一些炎症因子(如IL-1β、IL-6、IL-8和TNF-α等)产生后,可激活下游信号通路,从而引发更多抗病毒反应,抑制病毒的复制与增殖[21]:干扰素可干扰病毒本身的复制,诱导NK细胞和巨噬细胞杀死或吞噬已被病毒感染的细胞,从而增强DC对T细胞的抗原提呈能力,对抗病毒感染等[22]。趋化因子CCL3可募集及激活中性粒细胞;CCL5可募集白细胞到炎症位点,同时诱导NK细胞增殖与活化[23,24]。这些结果说明HCoV-OC43可能通过抑制Ⅰ型干扰素及趋化因子CCL3和CCL5分泌的相关信号通路,损害DC、中性粒细胞及NK细胞等相关免疫细胞的功能,实现免疫逃逸,干扰机体的抗病毒反应,这些免疫逃逸机制可能是HcoV-OC43感染后不能产生持久有效的免疫力的原因之一。
与Law等[20]对HCoV-SARS的研究结果相似,本研究对DC表面标志物的分析发现HCoV-OC43感染能显著增加成熟DC的HLA-DR的表达(P<0.05),CD86的表达也发生上调。此外,与对照组相比, HCoV-OC43感染成熟DC可导致CD1c呈弱阳性表达,说明HCoV-OC43共培养可能会影响培养体系中DC的分化和亚型分布。本研究结果显示,HCoV-OC43与DC相互作用并不抑制DC的成熟及共刺激能力,尽管Ⅰ型干扰素及部分趋化因子的表达受到抑制,DC在HCoV-OC43感染和抗原刺激后仍可产生抗病毒免疫应答反应,此发现也可从一定程度上解释HcoV-OC43感染人后并不能导致严重的呼吸道疾病的特点。
综上所述,本课题对HCoV-OC43致病性及免疫逃逸机制的初步研究结果显示,HCoV-OC43与DC相互作用后并不抑制DC的成熟及共刺激能力,DC在受到感染和抗原刺激后仍可产生抗病毒免疫应答;但HCoV-OC43能显著抑制DC细胞的Ⅰ型干扰素及趋化因子CCL3和CCL5的表达,产生免疫逃逸,其作用可能与其致病特点有关。本研究结果为进一步阐明HCoV-OC43的致病性及免疫逃逸机制奠定了基础,为HCoV与免疫系统相互作用的研究提供了重要的参考依据,为HCoV的疫苗制备和抗病毒药物的研究提供了新的线索及思路。
[1] 李金萍.冠状病毒概述[J].生命科学仪器,2007,5(1):43-46.
[2] Dijkman R,van der Hoek L.Human coronaviruses 229E and NL63:close yet still so far[J].J Formos Med Assoc,2009,108(4):270-279.
[3] Rota PA,Oberste MS,Monroe SS,etal.Characterization of a novel coronavirus associated with severe acute respiratory syndrome[J].Science,2003,300(5624):1394-1399.
[4] van der Hoek L,Pyrc K,Jebbink MF,etal.Identification of a new human coronavirus[J].Nat Med,2004,10(4):368-373.
[5] Woo PC,Lau SK,Chu CM,etal.Characterization and complete genome sequence of a novel coronavirus,coronavirus HKU1,from patients with pneumonia[J].J Virol,2005,79(2):884-895.
[6] McIntosh K,Dees JH,Becker WB,etal.Recovery in tracheal organ cultures of novel viruses from patients with respiratory disease[J].Proc Natl Acad Sci U S A,1967,57(4):933-940.
[7] Do minguez SR,Robinson CC,Holmes KV.Detection of four human coronaviruses in respiratory infections in children:a one-year study in Colorado[J].J Med Virol,2009,81(9):1597-1604.
[8] van der Hoek L,Pyrc K,Berkhout B.Human coronavirus NL63,a new respiratory virus[J].FEMS Microbiol Rev,2006,30(5):760-773.
[9] Raj VS,Osterhaus AD,Fouchier RA,etal.MERS:emergence of a novel human coronavirus[J].Curr Opin Virol,2014,5:58-62.
[10] 贾 原,李文丽,李 芳,等.维生素C对DC细胞功能调控影响研究[J].中国免疫学杂志,2015,31(10):1324-1328.
[11] Satpathy AT,Wu X,Albring JC,etal.Re(de)fining the dendritic cell lineage[J].Nat Immunol,2012,13(12):1145-1154.
[12] Desforges M,Miletti T,Gagnon M,etal.HCoV-229E infects and activates monocytes[J].Adv Exp Med Biol,2006,581:511-514.
[13] Hahm B,Trifilo MJ,Zuniga EI,etal.Viruses evade the immune system through type I interferon-mediated STAT2-dependent,but STAT1-independent,signaling[J].Immunity,2005,22(2):247-257.
[14] Pacanowski J,Kahi S,Baillet M,etal.Reduced blood CD123+(lymphoid)and CD11c+(myeloid)dendritic cell numbers in primary HIV-1 infection[J].Blood,2001,98(10):3016-3021.
[15] Tang F,Du Q,Liu YJ.Plasmacytoid dendritic cells in antiviral immunity and autoimmunity[J].Sci China Life Sci,2010,53(2):172-182.
[16] Versteeg GA,Garcia-Sastre A.Viral tricks to grid-lock the type I interferon system[J].Curr Opin Microbiol,2010,13(4):508-516.
[17] Kuri T,Eriksson KK,Putics A,etal.The ADP-ribose-1′′-monophosphatase domains of severe acute respiratory syndrome coronavirus and human coronavirus 229E mediate resistance to antiviral interferon responses[J].J Gen Virol,2011,92(Pt 8):1899-1905.
[18] Funk CJ,Wang J,Ito Y,etal.Infection of human alveolar macrophages by human coronavirus strain 229E[J].J Gen Virol,2012,93(Pt 3):494-503.
[19] Mesel-Lemoine M,Millet J,Vidalain PO,etal.A human coronavirus responsible for the common cold massively kills dendritic cells but not monocytes[J].J Virol,2012,86(14):7577-7587.
[20] Law HK,Cheung CY,Ng HY,etal.Chemokine up-regulation in SARS-coronavirus-infected,monocyte-derived human dendritic cells[J].Blood,2005,106(7):2366-2374.
[21] Stetson DB,Medzhitov R.Type I interferons in host defense[J].Immunity,2006,25(3):373-381.
[22] Fensterl V,Sen GC.Interferons and viral infections[J].Biofactors,2009,35(1):14-20.
[23] Sherry B,Tekamp-Olson P,Gallegos C,etal.Resolution of the two components of macrophage inflammatory protein 1,and cloning and characterization of one of those components,macrophage inflammatory protein 1 beta[J].J Exp Med,1988,168(6):2251-2259.
[24] Maghazachi AA,Al-Aoukaty A,Schall TJ.CC chemokines induce the generation of killer cells from CD56+cells[J].Eur J Immunol,1996,26(2):315-319.
[收稿2016-08-21 修回2016-10-25]
(编辑 许四平)
Preliminary mechanism study of HCoV-OC43 escape from human dendritic cell immune elimination
YANGQuan,TUOJiu-Ling,HUANGXu-Bin,LUOHong-Jiao,ZHOUKai,ZHANGTian,CAOKai-Yuan,XULin.
DepartmentofPathogenBiology&Immunology,CollegeofBasicSciences,GuangzhouMedicalUniversity,Guangzhou511436,China
Objective:To study the possible immune escape mechanisms of HCoV-OC43 from human dendritic cells(DC).Methods:HCoV-OC43 was isolated from clinical specimen using BSC-1 cells and identified by Real-time PCR,and the cytopathic effect was observed by phase contrast microscope.DCs were induced in vivo using hu-GM-CSF and IL-4 cytokines,and after 7 days of differentiation,DCs were infected by HCoV-OC43.The morphology of HCoV-OC43 infected DC was observed by transmission electron microscope,and the cytokines related to DC functions were detected by Real-time PCR after infection.DC proportion and function related co-stimulatory molecules were analyzed by flow cytometry.Results:In vitro HCoV-OC43 infected human DC model was successfully built.HCoV-OC43 can infect DC and generate immune response of DC in vitro,but no virus nucleonic acid could be detected in culture supernatant.The DC expression of IFN-α,IFN-β,CCL3 and CCL5 were significant decreased when infected with HCoV-OC43,but the expression of costimulatory molecules including HLA-DR,CD1c and CD86 were not affected by HCoV-OC43 infection.Conclusion:Human DC could be infected by HCoV-OC43 and generate immune response,but could not produce progeny virus.HCoV-OC43 may escape from immune response by suppressing the expression of IFN-α and other inflammatory cytokines and chemokines in DC.
Human coronavirus OC43;Human dendritic cells;Cytokine;Immune escape
10.3969/j.issn.1000-484X.2017.04.002
①本文受国家传染病防治科技重大专项(No.2012ZX10004-213)、国家自然科学基金项目(No.81000230)和广东省自然科学基金青年项目(No.A030310282)资助。
杨 权(1985年-),男,博士,讲师,主要从事髓系细胞分化机制方面的研究,E-mail:yquangy2015@163.com。
及指导教师:徐 霖(1976年-),女,博士,副教授,主要从事病毒和肿瘤学相关研究,E-mail:xulin@mail.sysu.edu.cn。
R373.1 R392.12
A
1000-484X(2017)04-0488-06
②中山大学热带病防治研究教育部重点实验室,广州510080。
③中山大学香港大学粤港传染病监测联合实验室,广州510080。
④中山大学附属第一医院MICU室,广州510080。
