人端粒酶逆转录酶基因修饰内皮祖细胞移植对大鼠肢体缺血的实验研究
2017-04-24宋庆宏
宋庆宏,江 涛
人端粒酶逆转录酶基因修饰内皮祖细胞移植对大鼠肢体缺血的实验研究
宋庆宏1,江 涛2
目的:探讨人端粒酶反转录酶(hTERT)修饰的内皮祖细胞(EPCs)移植对SD大鼠缺血肢体治疗机制和规律。
内皮祖细胞;移植;缺血;端粒酶逆转录酶;大鼠
自2002年Tateishi等学者将自体骨髓干细胞移植和自体外周血干细胞移植治疗下肢缺血[1],取得成功以来,采用干细胞移植治疗肢体缺血逐渐成为研究的热点问题。近些年来国内外已有多项研究表明干细胞移植治疗下肢缺血可以取得较好疗效[2-4]。内皮祖细胞 (endothelial progenitor cells,EPCs)分泌的相关因子是促血管形成较强的因子,EPCs的研究发现开创了治疗血管新生的时代[5-7]。实验研究表明,EPCs可以分化为骨、软骨、脂肪、肌腱和肌肉等多种中胚层细胞,能够促进多种活体病损组织的修复,且EPCs具有分离、增值潜能高,稳定性较好等优点[8-10]。本研究基于EPCs的这些优点,采用人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)修饰EPCs,探讨hTERT修饰后的EPCs对SD大鼠缺血肢体的治疗机制和规律,为优化EPCs移植治疗肢体缺血提供理论依据。
1 材料和方法
1.1 实验动物和主要试剂、仪器 清洁级SD大鼠64只,雌雄各半,体质量为250~310 g,实验中对动物处置方法符合动物伦理学要求。DMEM/F12培养基、质量百分比为5%胎牛血清(FBS)(美国Gibco BRL公司);PKH-26、谷氨酞胺(Sigma公司);25%胰蛋白酶(GibcoBRL公司);LipofectamineTM2000、Trizol(Invitrogen公司):RT-PCR反转录试剂盒(艾康生物技术有限公司);Taq酶(加拿大BBI公司产品);dNT(TaKaRa公司);Western blot化学发光试剂(Santa cruz公司);兔抗人hTERT抗体、HRP一羊抗兔IgG,PVDF膜(Pierce公司);5 μL微量注射器(Hamilton,美国);主要实验仪器有二氧化碳培养箱(RS Biotech公司,英国)、荧光倒置显微镜(Nikon公司,日本)及超净工作台(苏州安泰空气技术公司)等。
1.2 EPCs的制备、鉴定及标记 采用腹腔注射法对各组大鼠行麻醉处理,皮肤经消毒后,依序切开皮肤、皮下肌肉,直至暴露出股骨和胫骨,并取出股骨和胫骨,将骨头的干骺端去掉,使骨髓腔其充分的显露,吸取少量的淋巴细胞分离液对骨髓腔行多次冲洗,将冲洗液收集到试管后备用,离心后分离出单个核细胞:取洁净离心管一只,将大鼠的淋巴细胞通过用注射器分离液6 mL注入离心管,然后加入6 mL的细胞悬液,将离心管置于离心机后,以离心机转数为2500 r/min,离心25 min,进行离心,离心完毕后将其取出,用事先准备好的PBS进行细胞冲洗,共进行2次;再次将离心管置入离心机中,调整离心机参数为1500 r/min,10 min,进行离心,毕后取出离心管,吸上清液并弃去,向离心管中加入EGM-2 MV完全培养基,用胶头滴管对其反复进行吹打直至将细胞沉淀吹打至悬浮状态为止,吸取少量细胞悬液将其接种到培养皿中,接种密度为1×106/m,接种完毕将其置于培养箱中进行培养,至第4 d末进行培养液的更换,同时将未贴壁的细胞一同丢弃,此后每3 d进行一次培养液的更换,当细胞贴壁为80%后时,通过胰酶消化,以1∶2~1∶3的比例进行传代。流式细胞仪检测细胞表面CD133、VEGFR-2和vWF的表达。吸取PKH-26液5 μL至1.5 mL的EP管中,加入1 mL完全培养液,吹打均匀,即得PKH-26标记液。PKH-26标记效果在荧光显微镜下观察。标记率=视野内阳性细胞总数/视野内细胞总数×100%。
1.3 PLXSN-hTERT转染及体外检测 取生长良好的第四代EPCs,培养在含10%小牛血清的DMEM培养基中,置饱和湿度5%CO2,37℃恒温密闭式培养箱中培养。每2 d传代1次,于实验时取对数生长期的细胞,按6×104个/孔将EPCs接种于24孔板中,PLXSN-hTERT转染需在3 d后进行,用PBS洗涤两次,细胞培养面积的完全覆盖需要根据感染倍数(multiple infection,MOI)=105稀释的PLXSN-hTERT。在37℃恒温下孵育2 h,加入胎牛血清和L-DMEM培养基继续培育1周后进行下列实验。PLXSN-hTERT转染即分为3组:对照组、空载病毒组、hTERT转染组。总蛋白在经离心后的细胞悬液收集目的细胞提取,Bradford法测定蛋白的浓度,Quantity one图像分析3次试验。
1.4 EPCs的PKH-26标记 将5 μL PKH-26液吸取至1.5 mL的EP管后,加入1 mL完全培养液,均匀吹打后,即得PKH-26标记液。用PBS洗3次贴壁达90%吸弃培养液的融合细胞,加入PKH-26标记液,于37℃饱条件下,湿度恒温培养箱中孵育20 min,吸弃标记液,加入5 mL的培养液孵育10 min后吸弃,重复清洗2次。在荧光显微镜下观察PKH-26标记后的效果。选取5个随机视野,PKH-26阳性细胞计数,计算标记率。标记率=视野内阳性细胞总数/视野内细胞总数×100%,将终浓度调为1×1010/L备用。
1.5 动物模型的制备及骨髓细胞移植 SD大鼠以200 g/L的乌拉坦按1.2 g/kg经腹腔内注射麻醉后,自其左腹股沟韧带至膝关节上下行一纵行切口,分别结扎股动脉及分支,以微量加样器自结扎处以下2 cm开始,以每0.2 cm为一注射点,于内收肌和腓肠肌共注射5点,每注射点各注射60 μL,缺血对照组为300 μL培养液,hTERT治疗组大鼠注射含5 μg基因pcDNA3-hTERT的DNA-脂质体复合物,EPCs治疗组大鼠注射3×106个EPCs,转染hTERT基因的EPCs治疗组大鼠注射含3×106个hTERT基因的EPCs。观察5 min,如无异常,逐层关闭切口。
1.6 动脉造影及毛细血管密度的测定 ⑴动脉造影:于术后4周在实验动物的穿刺腹主动脉推注70%泛影葡胺2 mL,行DSA。⑵毛细血管密度的测定:取左侧腓肠肌组织制作石蜡切片,利用小鼠抗大鼠Ⅷ因子抗体(1∶50,NeoMaker Biotech)和山羊抗小鼠IgG抗体-HRP多聚体(北京中杉生物技术公司)行免疫组织化学染色。每个标本随机取20个视野,在高倍镜(400倍)下计算新生血管数量及荧光显微镜观察计算每个视野中的PKH-26阳性细胞数,取其均值作为各组的PKH-26阳性细胞数。
1.7 RT-PCR检测hTERT基因的体内表达 用液氮将各组大鼠移植区组织磨成粉末,加Trizol,振荡混匀,离心5 min。将上清液(约450 μL)加入150 μL无水乙醇,混匀并全部转移到UNQ-10柱里离心,收集管内的RNA样品,可立即使用或者-70℃保存。按Reverse Transcription system Kit说明合成cDNA。PCR引物根据Genbank中登录的hTERT cDNA全长序列设计两对引物,扩增hTERT cDNA全长序列上游引物:5'-ATGAATTCATGGGGGTGCACGAATGTCC-37,下游引物:5'-GCCTCGAGTCATCTGT CCCCTG TCCTGC-3’,预期扩增片段长582 bp。RT-PCR法鉴定hTERT在各组中表达的上游引物为:5'-TCATCTGTGACAGCCGAGTC-3’下游引物为5'-CACTGACGGCTTTATCCACA-3’,预期扩增片段长288 bp。β-actin上游引物为5-AGA GGGAAATCGTGCGTGAC-3,下游引物为5-ACATCTGCTGGAAGGTGGAC-3,产物大小224 bp;均由上海生工生物工程公司合成.PCR反应条件为:96℃预变性5 min后行30个循环,每循环95℃30 s,60℃30 s,72℃30 s,循环结束后72℃延伸10 min。2%琼脂糖凝胶电泳检测PCR产物,紫外灯下观察结果并拍照,再经图像分析系统进行电泳条带的扫描分析。hTERT mRNA的含量依据PCR扩增条带扫描密度和hTERT待测PCR扩增条带的扫描密度推断。
2 结果
2.1 培养的内皮祖细胞形态 培养4~5 d后,有丝分裂长梭形或多角形细胞明显增多;培养8~9 d,呈单层的漩涡状或辐射状生长细胞铺满培养瓶底面(图1A)。流式细胞仪检测结果显示CD29,CD49,CD90,CD105和HLA-1阳性,内皮祖细胞均一性好,纯度达96%以上(图1B)。
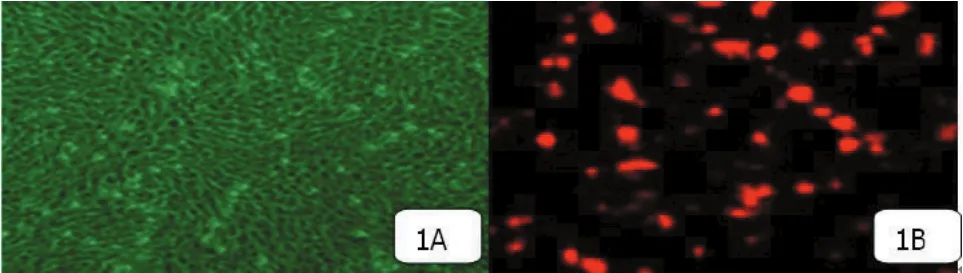
图1 EPCs的形态观察(×200)
2.2 内皮祖细胞免疫表型的鉴定 贴壁细胞均高表达内皮祖细胞表型CD29,CD90,CD49,CD105和HLA-1,不表达或低表达造血细胞表型CD34,CD45,低表达内皮细胞表型CD31。24 h时,PKH-26标记的EPCs在荧光显微镜下呈红色荧光,FCM检测细胞标记率达100%。
2.3 外源hTERT基因在人EPCs中的表达 Western blot鉴定结果显示,转染质粒pcDNA3-hTERT后的人EPCs中能够检测到hTERT蛋白的表达(图2),其蛋白条带位置(34 KDa)与阳性对照即人胎肝细胞L02一致,而未经转染的人EPCs中无hTERT蛋白的表达。

图2 hTERT基因在人EPCs中hTERT蛋白的电泳表达
2.4 大鼠动脉造影 大鼠动脉造影结果见图3。缺血对照组股动脉及其分支均未显影;hTERT治疗组和EPCs治疗组可见中等量新生血管,两组效果相似;转染hTERT基因的EPCs治疗组可见有大量新生血管新生,丰富的侧枝循环建立。
2.5 荧光显微镜观察测定结果 荧光显微镜在高倍镜(200倍)观察结果显示大鼠腓肠肌组织制作石蜡切片中的PKH-26阳性细胞数:缺血对照组为(0±0.00)个/HP,hTERT治疗组为(0±0.00)个/HP,EPCs组为(27.46±5.48)个/HP,转染hTERT基因的EPCs治疗组为(54.37±8.34)个/HP,各组之间差异显著(P<0.05),见图4。

图3 大鼠动脉造影结果
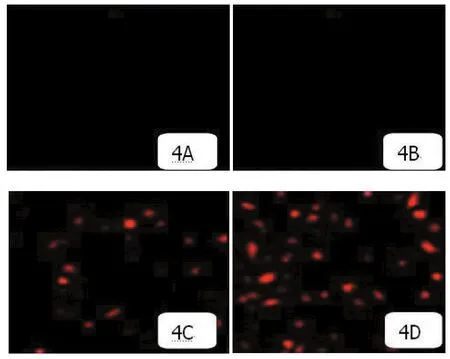
图4 4周后各组大鼠腓肠肌组织中的PKH-26阳性细胞数(免疫荧光,×200)
2.6 RT-PCR检测大鼠hTERT基因的体内表达
hTERT mRNA特异引物扩增(见图5),结果为:转染hTERT基因的EPCs治疗组和hTERT治疗组均有扩增,其中转染hTERT基因的EPCs治疗组表达高于hTERT治疗组,其hTERT mRNA相对含量分别为(0.89±0.06)、(0.29±0.04)(P<0.05)。
3 讨论
近年干细胞移植与基因治疗联合,促进移植细胞的定向分化及提高移植疗效的研究得到了广泛的重视。内皮祖细胞(endothelial progenitor cells, EPCs)是一类能够进入循环、增殖并分化为成熟血管内皮细胞的前体细胞,具有不断更新的多分化潜能。一方面EPCs有促进组织器官尤其是缺血组织器官的微血管修复,对胚胎时期及出生后成体的血管生成中起到重要作用。另一方面,EPCs本身也可以分泌一些细胞因子像血管内皮生长因子(VEGF)、bFGF等,这些因子会由于旁分泌效应对内皮细胞的增殖及血管修复起到积极作用,也就是血管生成增强效应,这样使血供也得到了改善。EPCs发挥作用的前提是细胞的归巢,即组织损伤促进释放一些信号分子,移植的EPCs会发生定向趋化迁移,在损伤部位发挥修复和再生的作用。有近年干细胞移植联合基因治疗,促进移植细胞的定向分化及提高移植疗效的研究越来越受重视[11]。hTERT是一个新的神经递质,它及其受体广泛分布于人与动物的大脑中,其能以自分泌或旁分泌的方式,结合细胞表面特异性的细胞受体端粒酶反转录酶受体来发挥作用[12]。有研究表明[13],当肢体缺血发生后,hTERT可抑制自由基链式反应,降低多种内源性致伤因子对缺血区的损伤,改善细胞内Ca超载,并可通过两种相互作用的通道明显的抑制缺血、缺氧性损伤后的细胞凋亡。有研究报道在人和鼠的肢体发生缺血、缺氧性损伤后,内源性hTERT-R表达明显上调进而发挥保护作用,而外源性hTERT可使其保护作用增强[14-15]。本研究将携带端粒酶反转录酶基因的pcDNA3-hTERT重组质粒转染人EPCs,移植到大鼠缺血模型下肢,以期促进EPCs的增值、迁延、分化以及引导血管内皮细胞归巢,促进新生血管形成,改善肢体缺血状况。

图5 各组大鼠hTERT基因的电泳表达
研究结果显示,本组64只大鼠均造模成功,并进入结果分析。通过Western blot检测显示转染人hTERT基因的人内皮祖细胞体外能表达hTERT。通过动脉造影观察到移植后4周,缺血对照组大鼠股动脉及其分支均未显影,hTERT治疗组和EPCs治疗组可见中等量新生血管,两组效果相似,转染hTERT基因的EPCs治疗组治疗组能够观察到大量新生血管新生以及丰富的侧枝的循环建立。通过检测大鼠毛细血管密度发现,hTERT治疗组和EPCs治疗组均较缺血对照组新生血管数量增加,转染hTERT基因的EPCs治疗组可进一步增强疗效,hTERT治疗组和EPCs治疗组两组之间差异无明显统计学意义。通过荧光显微镜观察到PKH-26标记的EPCs存活情况可见,转染hTERT基因的EPCs治疗组PKH-26阳性细胞数明显增加。通过RT-PCR检测显示,转染 hTERT基因的EPCs治疗组和hTERT治疗组均有扩增,转染hTERT基因的EPCs治疗组hTERT mRNA相对含量表达高于hTERT治疗组。结果提示hTERT及EPCs单独治疗组可以促新生血管形成,而将hTERT修饰后的EPCs治疗大鼠肢体缺血后对新生血管的形成更进一步加强。本研究结果表明hTERT基因修饰的EPCs移植对大鼠肢体缺血具有保护作用,能进一步提高EPCs移植对治疗肢体缺血的效果,可为肢体缺血的治疗提供了新的实验依据。
综上所述,EPCs移植是治疗肢体缺血的新的治疗手段,动物实验及临床实验研究均表明其具有相当可观的前景。我们的研究结果证明了EPCs作为种子细胞可为肢体缺血疾病的治疗发挥可观作用。但目前关于干细胞基因治疗肢体缺血性疾病的研究尚处在初期阶段,且其具体作用机制及安全性等问题还有待于在今后的深人研究中解决。未来的研究中设想将干细胞移植、细胞因子、基因治疗与常规治疗联合应用,可能会拥有更广阔的应用前景。我们相信在不久的将来EPCs移植治疗肢体缺血将在临床上广为开展。
[1]Tateishi-Yuyama E,Matsubara H,Murohara T,et al.Therapeutic angiog enesis for patients with limb ischaemia byautologous transplantation of bone-marrow cells:a pilot study anda randomised controlled trial[J].Lancet,2002,360(9331):427-435.
[2]刘坤,杨琨,罗军,等.结扎腹主动脉加双侧腹壁阴部动脉在大鼠后肢缺血模型中的应用[J].中国普外基础与临床杂志,2010,17(3):258-262.
[3]Higashi Y,Azuma N,Takeishi Y,et al.Effect of a Low-Intensity Pulsed Ultrasound Device,SX-1001,on Clinical Symptoms in Buerger Disease With Limb Ischemia[J].Int Heart J,2015,56(6):632-638.
[4]Fierro FA,Kalomoiris S,Sondergaard CS,et al.Effects on proliferation and differentiation of multipotent bone marrow stromal cells engineered to express growth factors for combined cell and gene therapy[J].Stem Cells,2011,29(11):1727-1737.
[5]张喜成,何延政,李国英,等.肢体缺血大鼠外周血内皮祖细胞的培养与鉴定[J].中华实验外科杂志,2004,21(7):871.
[6]佟铸,谷涌泉,李建新,等.骨髓单个核细胞和骨髓源内皮祖细胞移植促进血流重建的比较研究[J].中国普通外科杂志,2009,18(12):1259-1262.
[7]Grad NO,Emoke P,Mironiuc IA.Isolation,culture and detection of mesenchymal stem cells in tissues from critical limb ischemia model in rat[J].Clujul Med,2013,86(1):65-68.
[8]赵瑾,李杨,黄磊,等.肢体缺血后适应对小鼠脑缺血再灌注损伤的影响及机制[J].中国病理生理杂志,2010,26(6):1096-1101.
[9]王海涛,姜维良,孙占峰,等.自体骨髓单个核细胞移植治疗大鼠后肢缺血[J].基础医学与临床,2009,(02):183-187.
[10]Zaccagnini G,Palmisano A,Canu T,et al.Magnetic Resonance Imaging Allows the Evaluation of Tissue Damage and Regeneration in a Mouse Model of Critical Limb Ischemia[J].Plos One,2015,10 (11):0142111.
[11]刘坤,罗军,娄繁,等.大鼠骨髓基质细胞的体外培养和鉴定[J].中国普外基础与临床杂志,2009,(11):875-879.
[12]Nishibe T,Yamamoto K,Seike Y,et al.Endovascular Therapy for Femoropopliteal Artery Disease and Association of Risk Factors With Primary Patency:The Implication of Critical Limb Ischemia and TASC II C/D Disease[J].Vasc Endovascular Surg,2015,49(8):236-241.
[13]Kobayashi N,Hirano K,Nakano M,et al.Clinical effect of wound depth in critical limb ischemia with tissue loss after endovascular treatment[J].J Vasc Surg,2015,62(6):1564-1574.
[14]Wang DJ,Tian H,Zhuang BX,et al.Effects of intraperitoneal hydrogen injection on nitric oxide synthase mRNA and malondialdehyde following limb ischemia-reperfusion in rabbits[J].Acta Orthop TraumatoloTurc,2015,49(5):558-564.
[15]Dubsky M,Jirkovska A,Bem R,et al.Treatment of critical limbischemia and diabetic foot disease by the use of autologous stem cells[J].Vnitr Lek,2011,57(5):451-455.
(收稿:2016-01-26 修回:2016-05-20)
(责任编辑 王 丰)
Experimental Study on the Effect of Human Telomerase Reverse Transcriptase Gene Modified Endothe-lial Progenitor Cells Transplantation on Limb Ischemia in Rats
SONG Qing-hong,JIANG Tao
Depart-ment of Vascular Surgery,Tianjin University of Traditional Chinese Medicine,Tianjin(300190),China
Objective To investigate the mechanism and regulation of hTERT modified endothelial progenitor cells(EPCs)transplantation on ischemic limb of SD rats. Methods EPCs were cultured and identified after Lipofectamine stably transfected PLXSN-hTERT EPCs expression by Western blot identification of exogenous human hTERT gene in endothelial progenitor cells.Sixty-four male SD rats were randomly divided into 4 groups:A,B,C and D.Each group had a total of 16 rats.After ligation of the femoral artery and branches of the left hind limbs,the hind limb ischemia model was constructed,the adductor and gastrocnemius muscle were injected 5 points,each point injection 60 L.A group rats were injected with 300 L medium,B group rats were injected with 5 g of PLXSN-hTERT gene DNA-liposome complexes,C group rats were injected with 4×106EPCs,and D group rats were injected with 4×106 hTERT gene EPCs.RT-PCR angiography was performed to detect the expression of hTERT gene and neovascularization in 4 weeks after transplantation,and the survival of PKH-26 labeled EPCs was evaluated by fluorescence microscope. Results All of the 64 rats were successfully constructed,and the results of Western blot showed that human endothelial progenitor cells transfected with human hTERT gene could express hTERT in vitro 4 weeks after transplantation and angiography.A group rat femoral artery and its branches were not visualized,B group and C group showed moderate neovascularization(effects of the two groups were similar),D group can further enhance the effect.The number of PKH-26 positive cells were:[A,B,C and D four groups(0±0.00),(0±0.00),(27.46±5.48),(54.37±8.34)/HP,P<0.05].In vivo expression of hTERT gene in RT-PCR,D group and B group were transfected with hTERT gene amplification, hTERT mRNA relative content of D group was higher in B group(0.89±0.06,0.29±0.04,P<0.05). Conclusion Using Htert modified EPCs transplantation to treat limb ischemia in rats,can make hTERT gene stable and effective expression,and its effect is better than the direct gene injection.
Endothelial progenitor cells;transplantation;ischemia;telomerase reverse transcriptase;rat
Q95-33;R654.4
A
1007-6948(2017)02-0155-06
10.3969/j.issn.1007-6948.2017.02.014
1.天津中医药大学(天津 300100)
2.天津市人民医院普外科(天津 300121)
江涛,E-mail:642403512@qq.com
方法:EPCs原代培养及鉴定后,脂质体法将PLXSN-hTERT稳定转染EPCs,Western blot鉴定外源hTERT基因在内皮祖细胞中的表达。64只雄性SD大鼠随机单位组设计分为4组:缺血对照组(A组)、hTERT治疗组(B组)、EPCs治疗组(C组)、转染hTERT基因的EPCs治疗组(D组),每组16只。结扎大鼠左股动脉及分支,构建后肢缺血模型。于内收肌和腓肠肌共注射5点,每点注射60 μL,A组注射300 μL培养液,B组注射DNA-脂质体复合物,C组注射4×106个EPCs,D组注射4×106个含hTERT基因的EPCs。于移植后4周行动脉造影,采用RT-PCR检测hTERT基因的体内表达,评价血管新生情况;荧光显微镜观察PKH-26标记的EPCs存活情况。结果:64只大鼠均造模成功。Western blot结果显示转染人hTERT基因的人内皮祖细胞体外能表达hTERT。移植后4周动脉造影显示,A组大鼠股动脉及其分支均未显影,B组和C组可见中等量新生血管,两组效果相似,C组可见有大量新生血管及丰富的侧枝循环建立。B组和C组均较A组新生血管数量增加,D组可进一步增强疗效PKH-26阳性细胞数:ABCD四组分别为[(0±0.00),(0±0.00),(27.46±5.48),(54.37±8.34)]个/HP;P<0.05。RT-PCR检测hTERT基因的体内表达,D组和B组均有扩增,D组hTERT mRNA相对含量高于B组。D组和B组hTERT mRNA相对含量分别为(0.89±0.06,0.29±0.04;P<0.05)。结论:通过人端粒酶反转录酶(hTERT)修饰的内皮祖细胞(EPCs)移植治疗大鼠肢体缺血,可以让hTERT基因稳定有效持续的表达,其效果优于直接基因注射。
