茶树磷酸烯醇式丙酮酸转运子CsPPT2基因的克隆和分析
2017-04-22纪志芳甘玉迪陈常颂杨鼎俊孙康黎星辉陈暄
纪志芳,甘玉迪,陈常颂,杨鼎俊,孙康,黎星辉,陈暄*
1. 南京农业大学茶叶科学研究所, 江苏 南京 210095;2. 福建省农业科学院茶叶研究所,福建 福安 355015
茶树磷酸烯醇式丙酮酸转运子CsPPT2基因的克隆和分析
纪志芳1,甘玉迪1,陈常颂2,杨鼎俊1,孙康1,黎星辉1,陈暄1*
1. 南京农业大学茶叶科学研究所, 江苏 南京 210095;2. 福建省农业科学院茶叶研究所,福建 福安 355015
以茶树(Camellia sinensis)白叶1号为材料,应用RT-PCR和RACE技术克隆获得茶树磷酸烯醇式丙酮酸转运子家族一个基因 CsPPT2的 cDNA序列,并与茶树体内另一个磷酸烯醇式丙酮酸转运子家族的基因CsPPT1在不同时期和不同部位的表达进行比较。CsPPT2的cDNA全长1 469 bp,其中开放阅读框(ORF)为1 218 bp,编码 406个氨基酸。通过生物学信息分析表明,CSPPT2蛋白分子量为 44.6 kD,理论等电点为9.90,CsPPT2有6个跨膜区,属于疏水性叶绿体跨膜蛋白。聚类分析显示,茶树磷酸烯醇式丙酮酸转运子家族分为2个亚组,而CsPPT1与CsPPT2属于不同亚组。荧光定量结果分析表明,两个基因可能在茶树体内功能不同,CsPPT2在所考察的组织中均有表达,且在根和成熟叶片中表达量远大于CsPPT1;CsPPT1在茎和复绿前的幼嫩芽叶中表达量高于 CsPPT2。在白化期起始时 CsPPT2有短暂的升高,但伴随白化受到较大的抑制,表明CsPPT2的表达抑制可能是白叶1号低儿茶素高氨基酸品质形成的关键因素。
茶树;白叶1号;磷酸烯醇式丙酮酸转运子;CsPPT2;表达分析
磷酸烯醇式丙酮酸转运子(PPT)作为植物初级代谢和次级代谢体系的重要枢纽[1],其生理功能是在C3植物中将PEP从细胞质转运到质体内,通过莽草酸代谢途径生成各类芳香族氨基酸或合成蛋白质,或作为植物体内其他许多次级代谢物质的底物来源[2-3]。理论上,PPT基因突变是致死的,但在拟南芥 cue1( Chlorophyll a/b binding protein gene underexpressed 1)[4-5]突变体的研究中发现是AtPPT1发生了突变,表现为叶片白化。进一步的研究表明,拟南芥 cue1突变体未致死的原因在于拟南芥体内除了突变的AtPPT1之外还存在着第2个PPT基因AtPPT2[6],而维持突变体生存的原因是两个基因在植物体内的表达部位不相同,有一定的互补作用[7]。另有研究表明,PPT在不同植物器官中起着不同的作用,在叶片叶绿体以及一些生长的种子中PPT是作为输入者将 PEP转运至质体中,而根中是作为溢流阀调节 PEP在根中的积累量[8]。目前,在拟南芥、油菜、水稻中均对PPT1基因的功能进行了研究,发现PPT1基因在油菜籽粒的油份等物质中积累[9],对拟南芥[7]和水稻[10]的叶色调控有一定的作用,而其他PPT基因除拟南芥外则鲜有研究。
白叶1号(安吉白茶)是一种自然突变体,因其春季新梢叶色的可逆性白化及白化期新梢较高的游离氨基酸含量而受到广泛关注和利用[11-12]。根据白叶1号阶段性白化过程中叶片颜色的变化可将白叶 1号新梢生育过程细分为5个典型的生育阶段:返白前,白化初期,白化中期,白化盛期,复绿初期。白叶1号在每年春季新梢萌发时期,芽头呈微绿色,当叶片展开后很快白化成乳白色,白化现象在新梢一芽二叶期前后最为明显,在春茶后期叶片颜色又逐步转绿,直至完全复绿[13]。研究表明CsPPT基因相关功能对于探究白叶 1号白化期间儿茶素含量上升的机理具有重要参考价值,其中CsPPT1具有为莽草酸途径提供PEP的作用[14]。本研究从家族内另一个基因入手,克隆得到茶树一个新的磷酸烯醇式丙酮酸转运子基因CsPPT2,并对其进行了生物学信息分析,同时与CsPPT1进行了不同组织、白化过程不同时期表达的比较分析,为深入研究该基因在白叶 1号白化过程中莽草酸途径中各种次生代谢物含量的变化机理提供一定的理论依据。
1 材料与方法
1.1 试验材料
本研究所用茶树品种白叶 1号采自南京仕必瑞生物科技有限公司,选择茶树白化的5个阶段(返白前、白化初期、白化中期、白化盛期、复绿初期)的一芽二叶,另于2016年9月3日分别取一年生白叶1号茶树的根、嫩茎、叶和叶脉,所取样品立即放于液氮中冷冻,随后储存在–70℃冰箱保存待用。
EASYspin PlusRNA提取试剂盒购自北京艾德莱生物,E.Z.N.A.TMGel Extraction Kit D2500-02购自OMEGA。pEASY-T1 Simple克隆载体、pEASY-Blunt Zero克隆载体、Trans1-T1克隆感受态细胞购于南京百斯凯科技有限公司。Marker、PrimeSTAR ®HS DNA Polymerase、反转录试剂盒 PrimeScriptTMRT reagent Kit、Wizard DNA Clean-Up System(Promega)试剂盒、SYBRPremix Ex-Taq试剂盒等均购于TaKaRa公司,引物合成及测序由南京金斯瑞公司完成。
1.2 RNA的提取与cDNA的合成
使用EASYspin PlusRNA提取试剂盒提取茶树不同时间段和不同组织的 RNA,利用微量紫外检测仪NanoDrop测定RNA浓度。用PrimeScriptTMRT reagent Kit将RNA反转录成cDNA。
1.3 CsPPT2基因的克隆
根据NCBI GenBank中登录的其他物种,如葡萄、蓖麻、草莓、大豆、黄瓜等的PPT2基因的序列设计本实验所需的引物(表 1)。以茶树芽头 cDNA为模板进行基因中间片段PCR扩增,普通 PCR程序为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。扩增体系为:ddH2O 11.9 μL,10× r-Taq Buffer (Mg2+free) 2 μL,dNTP Mixture (2.5 mmol·L-1) 1.6 μL,MgCl2(25 mmol·L-1) 1.2 μL,上、下游引物各1 μL,Temple 1 μL,5 U·μL-1r-Taq 0.3 μL。3′-RACE 和5′-RACE扩增同上述方法,拼接出茶树PPT2全长序列。最后再设计特异引物,采用PrimeSTAR ®HS DNA Polymerase进行PCR扩增出基因全长。琼脂糖凝胶电泳分离 PCR产物后回收目的条带。PCR 产物连接到pEASY-T1 Simple克隆载体并转入Trans1-T1克隆感受态细胞中,进行克隆鉴定和序列测序。
1.4 CsPPT2基因生物信息学分析
利用NCBI数据库中BLAST进行同源比对分析,用ORF Finder分析开放阅读框;使用 MEGA 5.1构建系统进化树进行聚类分析;使用 ProtParam tool(http://web.expasy.org/ protparam)计算蛋白质的相对分子质量和理论等电点;利用 DNAMAN进行蛋白质亲/疏水性分析;通过 TMHMM(http://www.cbs. dtu.dk/services/TMHMM)进行跨膜结构域的分析;采用NetPhos Sever3.0(http://www.cbs. dtu.dk/services/NetPhos)进行磷酸化位点预测与分析;在线软件TargetP 1.1 Serve(http://www. cbs.dtu.dk/services/TargetP)进行亚细胞定位预测。

表1 CsPPT2克隆引物Table 1 Primer sequences for the amplification ofCsPPT2
1.5 实时荧光定量PCR反应与基因表达分析
使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒将反转录后,以茶树β-actin基因(Accession No. HQ420251)作为看家基因[15],利用IQTM5 multicolor real time PCR detection system(Bio-rad,USA)进行实时荧光定量PCR反应,PCR程序为:95℃ 30 s;95℃ 5 s,60℃ 30 s,72℃ 30 s,40个循环。20 μL体系为:ddH2O 8.2 μL,SYBR ExTaqⅡ 10 μL,上、下游引物各0.4 μL,cDNA 1 μL。采用法分析结果。试验数据采用 SPSS 17.0进行统计处理,利用邓肯式新复极差法做显著性分析。
2 结果与分析

图1 茶树CsPPT2基因的克隆Fig. 1 Amplification ofCsPPT2gene fromCamellia sinensis
2.1 CsPPT2基因的克隆
以茶树芽头cDNA为模板克隆CsPPT2基因:中间片段长度为638 bp(图1-A),BlastX比对证明该片段与其他物种的PPT基因具有较高的相似性,以此片段为基础设计基因特异性引物(表 1)获得 992 bp的 3′端序列(图1-B)和 475 bp的 5′端序列(图 1-C);经DNAMAN 拼接后预测全长 cDNA的开放阅读框(ORF),根据该序列设计ORF扩增引物获得长 1 218 bp的片段。ORF产物测序后与拼接结果比对,确认获得了 1 469 bp的茶树CsPPT2基因的cDNA全长序列(图1-D),编码406个氨基酸(图2)。
2.2 CsPPT1和CsPPT2氨基酸比较分析
对比CsPPT1和CsPPT2基因氨基酸序列,结果如图3,二者相似性为62.04%,但2个基因的结构域位置相似。
2.3 CsPPT2基因氨基酸序列的聚类分析
将茶树CsPPT2基因氨基酸序列与GenBank中登录的其他物种PPT基因的氨基酸序列进行比对,利用MEGA5中的最大似然法制作CsPPT2与其他物种PPT基因的系统发育树,进行聚类分析(图4)发现,整个PPT家族大致可以分为2类,PPT1、PPT2。CsPPT1和CsPPT2分别属于不同的亚组。其中CsPPT1与单子叶植物玉米、水稻和粟的亲缘关系更近,CsPPT2与双子叶植物芝麻和番茄亲缘关系较近。与拟南芥中情况不同的是,在茶树中,与 C4植物的PPT基因亲缘关系更近的是CsPPT1。
2.4 CsPPT2基因编码蛋白的生物信息学分析
2.4.1CsPPT2基因氨基酸序列的理化性质分析
CsPPT2基因对应的氨基酸序列分析结果表明,茶树CsPPT2基因编码的氨基酸数目为406个(图 2),分子量为 44 627.44,理论等电点为 9.90。负电荷氨基酸残基数为(Asp+Glu)16个,正电荷残基数为(Arg+Lsy)34个。不稳定系数为39.16,属于稳定蛋白。脂肪系数为105.89,总平均亲水性为0.453。
2.4.2CsPPT2基因跨膜区域结构预测

图2 CsPPT2基因核苷酸序列及推测的氨基酸序列Fig. 2 Deduced nucleotide and amino acid sequences ofCsPPT2gene

图3 CsPPT1与CsPPT2基因氨基酸序列比对Fig. 3 Alignment of amino acid sequences ofCsPPT1andCsPPT2

图4 CsPPT2的聚类分析Fig. 4 Phylogenetic tree ofCsPPT2
采用TMHMM分析发现,CsPPT2共有6个跨膜结构域(图 5),预测位置分别在105~122、132~154、167~189、227~249、279~301、372~394。推测该蛋白可能为跨膜蛋白。茶树CsPPT2蛋白氨基酸N端和C端均处于细胞膜内部。与CsPPT1不同的是,CsPPT1有7个跨膜区域。
2.4.3CsPPT2基因亚细胞定位预测
利用 TargetP 1.1 Server在线软件预测CsPPT2蛋白的亚细胞定位情况如表 2。显示叶绿体转运肽定位的可能性最大,得分为0.986 ,而作为线粒体靶向肽和信号肽定位的可能性很小,得分仅为0.021和0.003。
2.4.4CsPPT2基因亲/疏水性分析
利用 Protscal在线预测软件绘制茶树CsPPT2的亲/疏水性序列图谱(图6),发现,茶树CsPPT2亲水性氨基酸少于疏水性氨基酸,根据正值越大疏水性越大的规律判断,茶树CsPPT2蛋白属于疏水性蛋白。
2.4.5CsPPT2磷酸化位点预测
磷酸化修饰预测发现整个蛋白质多肽链中分值大于 0.5的氨基酸位点共有 42个,且非均匀分布在整个多肽链中,其中 27个丝氨酸残基(Ser)可能发生磷酸化,分别位于肽链的第9、17、35、40、41、42、44、48、52、54、57、60、66、85、96、165、178、187、194、238、250、266、307、309、316、369、378个位点;13个苏氨酸残基(Thr)可能发生磷酸化,分别位于肽链的第 12、65、93、135、137、145、158、163、178、184、198、220、375个位点;1个酪氨酸残基(Tyr)可能发生磷酸化,位于肽链的第4个位点(图7)。
2.5 CsPPT1和CsPPT2基因相对表达量比较分析
分别提取一年生白叶1号茶苗不同部位,包括根、嫩茎、叶、叶脉白叶 1号在白化前期、白化期和白化后期一芽二叶叶片的mRNA进行实时荧光定量 RT-PCR分析(图8)。CsPPT2在茶树的根、茎、叶、叶脉中均有表达,表达量由高到低依次为:根、叶、嫩茎和叶脉,其中,在根中表达量最多。
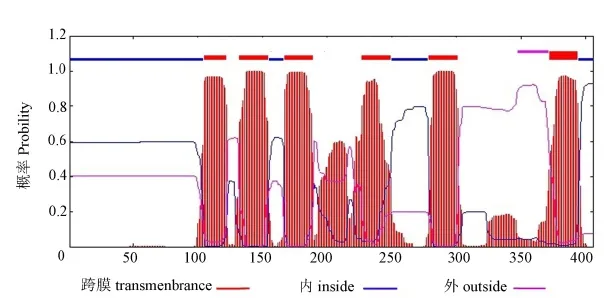
图5 CsPPT2的跨膜结构预测Fig. 5 The predictedCsPPT2transmemberence domains

表2 CsPPT2的亚细胞定位的预测Table 2 The subcellular localization prediction ofCsPPT2

图6 CsPPT2疏水性预测Fig. 6 Predicted hydrophobic properties ofCsPPT2

图7 CsPPT2磷酸化预测Fig.7 Phosphorylation prediction ofCsPPT2
将CsPPT1和CsPPT2不同部位的基因表达量进行比较分析可以看到,两个基因在根、茎、叶和叶脉中都有表达,CsPPT2在根和叶中表达显著高于CsPPT1,尤其在根部其表达量可达CsPPT1表达量的 40倍,而CsPPT1则在茎中表达多于CsPPT2(图8)。
在白化过程的不同时期,CsPPT1的表达量均高于CsPPT2,而且,结果显示白化开始后CsPPT1呈下降的趋势,CsPPT2也在白化中期急剧下降(图9)。

图8 CsPPT1和CsPPT2在茶树不同组织的表达量Fig. 8 The expression profiles ofCsPPT1 andCsPPT2in different tissues

图9 CsPPT1和CsPPT2在茶树新梢不同生育阶段的表达量Fig. 9 The expression profiles ofCsPPT1 andCsPPT2in different stages
3 结论与讨论
磷酸烯醇式丙酮酸(PEP)作为植物初生和次生代谢重要的平衡点,但在 C3植物,如豌豆、菠菜、拟南芥、花菜等[16-19]的叶绿体和绝大多数非绿质体内没有从糖酵解完全合成PEP所需要的所有酶,所以并不具备合成PEP的能力。因此,叶绿体内的PEP只能通过磷酸烯醇式丙酮酸转运子(PPT)从细胞质获取[20],所以,PPT在C3植物中起着初级和次级代谢途径的桥梁作用[1],PPT功能对植物的重要性由此可见。
在拟南芥中,有两个功能性的PPT基因,分别是AtPPT1和AtPPT2,而AtPPT1的突变会导致一系列的表型如叶片白化、氨基酸含量上升及莽草酸途径产物减少等现象[2,21],这与白叶1号白化期表型基本一致。与拟南芥不同的是,通过对白叶1号不同组织实时荧光定量发现,CsPPT2在所考察的组织中均有表达,且根和成熟叶片中大量表达,CsPPT1相对于CsPPT2表达量均低,但在嫩茎中和嫩叶中表达量高于CsPPT2,这说明CsPPT2可能在茶树中发挥着主要的作用。在拟南芥中AtPPT1主要在叶和根的维管组织中表达,AtPPT2在几乎所有的叶片中表达,而不在根部表达[6];而CsPPT2在茶树根和叶中却大量表达,这表明在茶树体内主要由CsPPT2完成PEP的转运等生理功能,所以当CsPPT2表达发生变化会引起茶树体内莽草酸途径的变化,从而对白叶1号的品质产生影响。与CsPPT1仅在幼嫩组织中表达不同,CsPPT2在白化期开始表达量略有上升而后却剧烈下降,结合CsPPT2在成熟叶片中较大的表达量可以看出,在茶树新梢萌芽过程中,CsPPT1首先发挥作用,但随着叶片的成长发育,其功能由CsPPT2取代,本应随着叶片的成熟表达量逐步上升,CsPPT2的表达在白化过程中受到了较强的抑制,也就是白化过程首先延缓CsPPT2的正常表达,影响了茶树叶片中 PEP的正常运输,导致莽草酸合成途径受到抑制,使得新梢中儿茶素含量降低;不能进入叶绿体的 PEP在胞质中积累导致胞质中丙酮酸含量上升,刺激TCA循环,使得谷氨酸积累,导致茶氨酸合成途径增强,含量上升,最终形成白叶1号低儿茶素高氨基酸的品质。
[1]Fischer K, Kammerer B, Gutensohn M, et al. A new class of plastidic phosphate translocators: a putative link between primary and secondary metabolism by the phosphoenolpyruvate/phosphate antiporter [J]. Plant Cell, 1997, 9: 453-462.
[2]Voll L, Husler R E, Hecker R, et al. The phenotype of the Arabidopsis cue1 mutant is not simply caused by a general restriction of the shikimate pathway [J]. Plant Journal, 2003, 36: 301-317.
[3]Kerbarh O, Bulloch E M M, Payne R J, et al. Mechanistic and inhibition studies of chorismate-utilizing enzymes [J]. Biochemical Society Transactions, 2005, 33: 763-766.
[4]Li H, Culligan K, Dixon RA, et al. Expression of the functional mature chloroplast triose phosphate translocator in yeast internal membranes and purification of the histidine-tagged proteion by a single metalaffinity chromatography step [J]. Proc Natl Acad Sci, 1993, 90: 2155-2159.
[5]Streatfield SJ, Weber A, Kinsman EA, et al. The phosphoenolpyruvate/phosphater translocator is required for phenolic metabolism, plastid cell development and plastid-dependent nuclear gene expression [J]. Plant Cell, 1999, 11: 1609-1621.
[6]Knappe S, Flugge UI, Fischer K. Analysis of the plastidic phosphate translocator gene family in Arabidopsis and identification of new phosphate translocator-homologous transporters, classified by their putative substrate-binding site [J]. 2003, 131(3): 1178-1190.
[7]Knappe S, Lö ttgert T, Schneider A, et al. Characterization of two functional phosphoenolpyruvate/phosphate translocator (PPT) genes in Arabidopsis–AtPPT1 may be involved in the provision of signals for correct mesophyll development [J]. The Plant Journal, 2003, 36(3): 411-420.
[8]Staehr P, Lö ttgert T, Christmann A, et al. Reticulate leaves and stunted roots are independent phenotypes pointing at opposite roles of the phosphoenolpyruvate/phosphate translocator defective in cue1 in the plastids of both organs [J]. Front Plant Sci, 2014, 5: 126.
[9]杨坤, 吴学龙, 郎春秀, 等. 甘蓝型油菜 PEP转运子BnPPT1基因的克隆、序列分析和表达模式[J]. 浙江农业学报, 2011, 23(1): 1-7.
[10]吴学龙. PPT1基因调控植物生长发育的研究及叶脉特异表达增强子的分离应用[D]. 杭州: 浙江大学, 2013: 12-131.
[11]成浩, 李素芳, 陈明, 等. 安吉白茶特异性状的生理生化本质[J]. 茶叶科学, 1999, 19(2): 87-92.
[12]李素芳, 成浩, 虞富莲, 等. 安吉白茶阶段性返白过程中氨基酸的变化[J]. 茶叶科学, 1996, 16(2): 153-154.
[13]李素芳, 陈树尧, 成浩. 茶树阶段性返白现象的初步研究[J]. 中国茶叶, 1994, 16(2): 26-27.
[14]赵真, 陈暄, 王明乐, 等. 茶树磷酸烯醇式丙酮酸转运子基因CsPPT的克隆与表达分析[J]. 茶叶科学, 2015, 35(5): 491-500.
[15]孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量 PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
[16]Bagge P, Larsson C. Biosynthesis of aromatic amino acids by highly purified spinach chloroplasts-Compartmentation and regulation of the reactions [J]. Physiol Plantarum, 1986, 68(4): 641-647.
[17]Van Der Straeten D, Rodrigues-Pousada RA, Goodman HM, et al. Plant enolase: Gene structure, expression and evolution [J]. Plant Cell, 1991, 3: 719-735.
[18]Journet EP, Douce R. Enzymic capacities of purified cauliflower bud plastids for lipidsynthesis and carbohydrate metabolism [J]. Plant Physiol, 1985, 79: 458-467.
[19]Schulze-Siebert D, Heineke D, Scharf H, et al. Pyruvate-derived amino acids in spinach chloroplasts: Synthesis and regulation during photosynthetic carbon metabolism [J]. Plant Physiol, 1984, 76: 465-471.
[20]Prabhaka V, Lö ttgert T, Gigolashvili T, et al. Molecular and functional characterization of the plastid-localized Phosphoenolpyruvate enolase (ENO1) from Arabidopsis thaliana [J]. FEBSLet, 2009, 583: 983-991.
[21]Li HM, Culligan K, Dixon RA, et al. CUE1: a mesophyll cell-specific positive regulator of light-controlled gene expression in Arabidopsis [J]. Plant Cell, 1995, 7: 1599-1610.
Cloning and Expression Analysis of Phosphoenolpyruvate Transporter Gene CsPPT2 in Tea Plant(Camellia sinensis)
JI Zhifang1, GAN Yudi1, CHEN Changsong2, YANG Dingjun1, SUN Kang1, LI Xinghui1, CHEN Xuan1*
1. Tea Research Institute, Nanjing Agricultural University, Nanjing 210095, China; 2. Tea Research Institute, Fujian Academy of Agricultural Sciences, Fu′an 355015, China
A full length cDNA sequence of phosphoenolpyruvate transporter gene (CsPPT2) was obtained from tea plant(Camellia sinensis) cultivar ‘Baiye 1’ by polymerase chain reaction (PCR) and rapid amplification of cDNA ends PCR(RACE-PCR). The nucleotide sequence length of this gene was 1469 bp, containing a complete open reading frame (1218 bp) encoding 406 amino acids. Bioinformatic analysis showed that the predicted molecular weight of the protein was 44.6 kD, and the theoretic isoelectric point was 9.90. CsPPT2 has 6 trans-membrane regions, which may belong to the hydrophobic chloroplast trans-membrane protein. Phylogenetic tree analysis showed the phosphoenolpyruvate transporter family in tea plant could be divided into two subgroups, with CsPPT1 and CsPPT2 belonged to different subgroups. The expression of CsPPT1 and CsPPT2 were compared in different periods and plant organs. It showed that CsPPT2 was expressed in all tested tissues, with higher expression level in roots and mature leaves than those of CsPPT1. But the expression level of CsPPT1 in young shoots was higher than CsPPT2. CsPPT2 was transiently elevated at the beginning of the albino, but inhibited during the development ofalbino, indicates that the inhibition of the expression of CsPPT2 may act as a key factor for low-catechins and high-amino acids in ‘Baiye 1’.
Camellia sinensis, Baiye 1, phosphoenolpyruvate transporter, CsPPT2, expression analysis
S571.1;Q52
A
1000-369X(2017)02-149-11
2017-02-14
2017-02-22
现代农业产业技术体系建设专项资金(CARS-23)、江苏高校优势学科建设工程资助项目、国家自然科学基金(31570691)、江苏省科技支撑计划(BE2009313-1)
纪志芳,女,硕士研究生,主要从事茶树遗传育种和茶叶生化研究。*通讯作者:chenxuan@njau.edu.cn
