普洱茶渥堆发酵中可降解咖啡碱真菌菌株的筛选和鉴定
2017-04-22马存强周斌星王洪振王潘
马存强,周斌星,王洪振,王潘
1. 云南农业大学龙润普洱茶学院,云南 昆明 650201;2. 昆明大朴茶业有限公司,云南 昆明 650224;3. 安徽农业大学茶与食品科技学院,安徽 合肥 230036
普洱茶渥堆发酵中可降解咖啡碱真菌菌株的筛选和鉴定
马存强1,2,周斌星1,3*,王洪振1,王潘1
1. 云南农业大学龙润普洱茶学院,云南 昆明 650201;2. 昆明大朴茶业有限公司,云南 昆明 650224;3. 安徽农业大学茶与食品科技学院,安徽 合肥 230036
为了在普洱茶渥堆发酵中筛选出可降解咖啡碱的菌株,采用咖啡碱液体筛选培养基从不同阶段普洱茶发酵样中筛选目标菌株,结合菌落特征、分生孢子结构以及 18 S rDNA序列对目标菌株进行鉴定。并将目标菌株接种至茶叶内进行单菌种发酵,通过高效液相色谱法(HPLC)测定咖啡碱、茶碱、可可碱、3-甲基黄嘌呤等嘌呤碱含量。结果表明,在普洱茶发酵样中筛选出一株有效降解咖啡碱的菌株,此菌株在 48 h内对咖啡碱的降解率为87.7%。经鉴定为聚多曲霉(Aspergillus sydowii),序列相似性为99.8%。在聚多曲霉茶叶单菌种发酵中,咖啡碱含量急剧下降,在发酵结束时仅占干物质重的(0.414±0.077)%;茶碱质量分数大幅度上升,由最初的不足0.1%上升至(2.129±0.246)%,成为主要的嘌呤碱;可可碱含量无显著变化(P<0.05);3-甲基黄嘌呤有大幅度增加,增幅达130%。本文首次从发酵茶叶中筛选出可降解咖啡碱的菌株,探究了微生物发酵中咖啡碱的转化产物,为低咖啡碱普洱茶的开发提供了菌种。
聚多曲霉;咖啡碱;茶碱;普洱茶;渥堆发酵
咖啡碱(1,3,7-三甲基黄嘌呤)是茶叶中主要的嘌呤碱和重要的呈味物质。咖啡碱含量相对稳定,仅受到采摘季节[1]和茶树品种[2]等因素的影响。在绿茶、红茶、乌龙茶等茶叶加工过程中,咖啡碱均无显著变化[3-4]。
黑茶是中国特有的微生物主导下的后发酵茶类[5]。普洱茶作为黑茶的一种,在中国西南地区已有数百年历史。渥堆发酵(后发酵,固态发酵)是普洱茶品质形成的关键工序。在渥堆发酵过程中,咖啡碱呈增加或减少的变化趋势[6-9]。前人通过茶叶单菌种发酵发现,在顶头孢霉菌(Cephalosporium acremonium)茶叶发酵中,咖啡碱升高 60%~70%,在烟曲霉菌 ( Aspergillus fumigatus) 和 乳 酸 菌(lactobacillus)茶叶发酵中,咖啡碱含量无显著变化[10]。然而,在酵母菌(Saccharomycetes sp.)、黑曲霉菌(Aspergillus niger)茶叶发酵中,咖啡碱含量有小幅下降[10-11]。由此可见,微生物对咖啡碱等嘌呤碱含量有明确作用[12]。本文以普洱茶渥堆发酵样为材料,旨在筛选鉴定出可降解咖啡碱的有效菌株,并将目标菌株接种至茶叶中进行单菌种发酵,探究咖啡碱的降解转化产物,为低咖啡碱普洱茶的开发提供菌种。
1 材料与方法
1.1 材料与试剂
普洱茶渥堆发酵样、云南大叶种晒青毛茶均由昆明大朴茶业有限公司提供。
咖啡碱(≥99%)、可可碱(≥99%)、茶碱(≥99%)、3-甲基黄嘌呤(≥99%)等标准品(美国sigma公司)。DNA Marker、PCR扩增引物、IST1(5′-TCCGTAGGTGAACCTGCG G-3′)和IST4(5′-TCCTCCGCTTATTGATAG C-3′)(日本TaKaRa公司)。
咖啡碱液体筛选培养基[13]:Na2HPO40.12 g·L-1、K2HPO41.3 g·L-1、MgSO4·7H2O 0.3 g·L-1、CaCl20.3 g·L-1、咖啡碱1.2 g·L-1,pH 5.5,121℃灭菌15 min。
1.2 仪器与设备
高效液相色谱仪(安捷伦 1200)、BH-2 OLYMPUS光学显微镜(日本奥林巴斯公司)、PCR扩增仪(Bio-Rad)、DNA自动测序仪(ABI Prism 3730)。
1.3 降解咖啡碱菌株的初筛、复筛
参照文献[13],无菌操作称取1 g不同阶段渥堆茶样,加入50 mL无菌咖啡碱液体筛选培养基的接种瓶,摇匀,30℃摇床培养,转速为180 r·min-1,培养48~72 h。培养液于3 000×g离心30 min,取1 mL上清液,与9 mL无菌生理盐水混合均匀后,依次稀释级数为10-1、10-2、10-3、10-4、10-5,采取涂布法接种至PDA培养基,每个稀释度3个平行,2次重复,27℃倒置培养。菌落长出后,挑取单菌落在PDA培养基平板上划线分离纯化。挑取单菌落镜检无杂菌后,将纯化的菌株分别接种到咖啡碱筛选液体培养基中,30℃,180 r·min-1,摇床培养 48 h,比较其OD600nm菌体生长量,初步筛选出可利用咖啡碱的菌株。
将初筛得到的各菌株分别接种于种子培养基中,30℃,180 r·min-1培养12 h,调整种子液的菌数为108CFU·mL-1,以2%的接种量接到液体发酵培养基中,30℃,180 r·min-1培养48 h,并以不接种的空白组作为对照。发酵前后培养液在3 000×g离心30 min,取上清液采用HPLC法,对发酵前后咖啡碱的含量进行测定和比较。计算各菌株的咖啡碱降解率,筛选出咖啡碱降解能力最强的菌株。
1.4 菌株的鉴定
菌落及菌株形态观察:无菌操作接种在PDA和察氏培养基上,27℃培养7 d后观察菌落形态,并在显微镜下观察细胞形态。分子鉴定方法如下:DNA提取:目标菌株分别接种至PDA培养基以及察氏固态培养基,27℃培养观察菌落生长状况,并用高倍显微镜观察菌株形态特征。将目标菌株接种至察氏(CYA)液态培养基中培养,收集菌丝体,-80℃冷冻干燥后采取真菌 DNA提取试剂盒法提取DNA。
PCR扩增:ITS序列通过引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和IST4(5′-TCCTCCGCTTATTGATATGC-3′)进行扩增。PCR反应程序为:95℃预变性5min;94℃变性1 min;54℃退火1 min;72℃延伸1.5 min;共35个循环;72℃延伸10 min。程序结束后进入10℃状态。
rDNA序列分析:对PCR产物通过DNA自动测序仪进行测序,将所获序列提交到NCBI的Genbank数据库进行同源序列搜索,并调出相关菌株ITS1-5.8S-ITS2 rRNA基因序列,用 ClustalX1.8软件进行多序列比对,通过MEGA4软件选用Kimura2-parameter距离模型计算进化距离,用Nerghbor-Joining法构建系统发育树,1 000次随机抽样计算Bootstrap值以评估系统发育的置信度。
1.5 目标菌株茶叶发酵
称取20 g晒青毛茶与12.25 mL蒸馏水混合,1×105Pa灭菌后,每培养瓶接种1 mL目标菌株的种子菌悬液(108CFU·mL-1),并以接种1 mL无菌水的发酵组作为对照。接种瓶均放置于恒温恒湿培养箱内(30℃,85%)进行培养。参照普洱茶渥堆发酵方法,每5 d取样1次,测定茶样中咖啡碱、可可碱、茶碱、3-甲基黄嘌呤等嘌呤碱含量。
1.6 测定方法
咖啡碱、可可碱、茶碱等嘌呤碱含量测定采取HPLC法。
上样液制备:称取3 g磨碎试样于500 mL锥形瓶中,加沸蒸馏水 450 mL,立即移入沸水浴,浸提45 min(每隔l0 min摇动1次)。浸提完毕后立即趁热减压过滤,并定容至500 mL。茶汤经 0.45 µm水系膜过滤后进样,进样量为10 µL。用于降咖啡碱菌株筛选的液态筛选培养基用去离子水稀释5倍过滤后,直接用HPLC测定咖啡碱保留量,并按照咖啡碱降解率计算公式:Y=[(a–b)/a]×100%计算咖啡碱的降解率。式中:a为初始咖啡碱质量浓度(g·L-1);b为剩余咖啡碱质量浓度(g·L-1);y为咖啡碱降解率(%)。
色谱条件[14]为:流动相为乙腈和 0.2%乙酸水溶液的混合液,A相为乙腈,B相为0.2%乙酸水溶液,梯度洗脱,流速为1 mL·min-1,色谱柱:安捷伦反相Cl8色谱柱(250 mm×4.6 mm,5 μm);检测波长为280 nm;柱温为30℃。洗脱程序为:0 min,A相:8%,B相:92%;50 min,A相:31%,B相:69%。采取梯度洗脱。后运行10 min后进下一样品。
2 结果与分析
2.1 可降解咖啡碱菌株的初筛结果
通过初筛得到 11个菌株能在以咖啡碱为唯一碳源和氮源的培养基上生长良好(表1)。根据 OD600nm的测定,PE-5菌株、PE-3菌株和PE-8菌株的生长速度较快,说明这3个菌株利用代谢咖啡碱的能力较强。
2.2 可降解咖啡碱菌株的复筛结果
将初筛得到的 11个菌株接种于种子培养基中培养12 h,以2%的接种量接到液体发酵培养基中培养48 h,重复2次。取发酵前后培养液的上清液用HPLC法测定咖啡碱的量,以计算各菌株的咖啡碱降解率。发现PE-5菌株对咖啡碱的降解能力最强,在 48 h内可降解1.05 g·L-1咖啡碱,降解率达 87.7%(表 2)。对比表1和表2可知菌株的咖啡碱降解量基本与 OD600nm值成正比,即菌液的 OD600nm值越高,微生物代谢越旺盛,对咖啡碱降解量越大,咖啡碱的降解率越高。反之亦然。最终筛选出PE-5菌株,根据菌落特征、细胞形态和 18 S rDNA序列,对其进行进一步的鉴定。
2.3 菌株鉴定结果
PE-5在PDA培养基以及察氏培养基上的菌落特征如图1所示。菌落在PDA培养基培养7 d时,菌落直径达2.9 cm,菌落中央凸起,絮粉状,橄榄绿,边缘为乳白色整齐;菌落背面乳黄色。在察氏琼脂培养基培养7 d时,菌落直径2.3 cm,质地为丝绒状至絮状,致密,边缘整齐;颜色呈浅土黄色,中间淡肉桂色;有红色渗出液;菌落背面呈淡黄至肉桂红,稍有放射状沟纹,色素扩散于基质中。

表1 可降解咖啡碱菌株的初筛结果Table 1 Results of preliminary screening for the caffeine-degradation strains

表2 可降解咖啡碱菌株的复筛结果Table 2 Results of repeated screening for caffeine-degradation strains
PE-5菌株在电子显微镜下的分生孢子结构如图2所示。菌丝不规则地分枝、有隔膜,分生孢子头呈球形至辐射形,直径为 52~125 μm,小分生孢子头似青霉状,呈疏松柱形或散乱;分生孢子梗直接生于基质或生于气生菌丝,壁较厚、光滑;顶囊较小,近球形或稍呈椭圆形,表面几乎全部可育;产孢结构双层,即梗基、瓶梗。有的小分生孢子头仅分生孢梗茎顶端稍膨大后生出产孢细胞,有时还可见气生菌丝上直接生有瓶梗;分生孢子为球形或近球形,直径2.5~3.5 μm,壁明显粗糙,具小刺。
PE-5菌株的18 S rDNA序列在NCBI使用Blast比对,表明PE-5与Aspergillus sydowiiNRRL250同源性最高,为 99.8%。基于ITS1-5.8S-ITS2 rRNA基因系统发育分析,构建PE-5的系统进化树(图3)。结合目标菌株菌落特征、分生孢子结构,可以确定 PE-5为Aspergillus sydowiiNRRL250(GenBank登录号为EF652450),属于曲霉属真菌。
2.4 HPLC法可靠性分析结果
咖啡碱、可可碱、茶碱、3-甲基黄嘌呤等嘌呤碱的保留时间、线性范围、标准曲线方程、相关性系数、检测限(LOD)、定量限(LOQ)见表3。由此可知,该方法可用于茶样中嘌呤碱含量的测定。
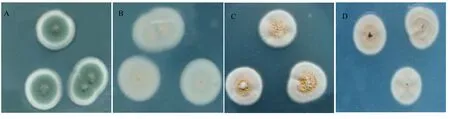
图1 PE-5在培养基上的菌落特征Fig. 1 Colony morphology of PE-5 on culture medium

图2 PE-5在电子显微镜下的形态特征Fig. 2 Morphological characteristics of PE-5 under transmission electron microscope
2.5 聚多曲霉茶叶发酵中咖啡碱等嘌呤生物碱含量变化
咖啡碱、可可碱、茶碱是茶叶中主要的嘌呤碱。在一般茶叶中,咖啡碱含量占茶叶干重的2%~5%;可可碱(3,7-二甲基黄嘌呤)为0.2%~0.4%;茶碱(1,3-二甲基黄嘌呤)为0.008%~0.02%[15]。在茶树[Camellia sinesis(L.)O. Kuntze]生理中,可可碱是咖啡碱合成的直接前体物质[16];茶碱和 3-甲基黄嘌呤是咖啡碱的主要降解产物[17]。另外,在茶树[Camellia sinesis(L.)O. Kuntze]与咖啡树(CoffeaarabicaL.)的咖啡碱降解代谢中,茶碱是主要限速步骤。然而,在微生物发酵中咖啡碱的降解代谢产物与降解途径尚不清楚。本实验以筛选鉴定出的聚多曲霉为试验菌种,通过茶叶单菌种发酵探究微生物作用下的咖啡碱降解代谢产物。
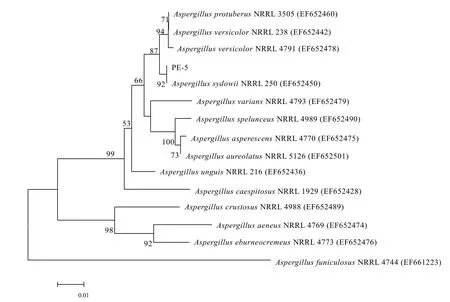
图3 目标菌株的系统进化树Fig. 3 Phylogenetic tree of the target strains
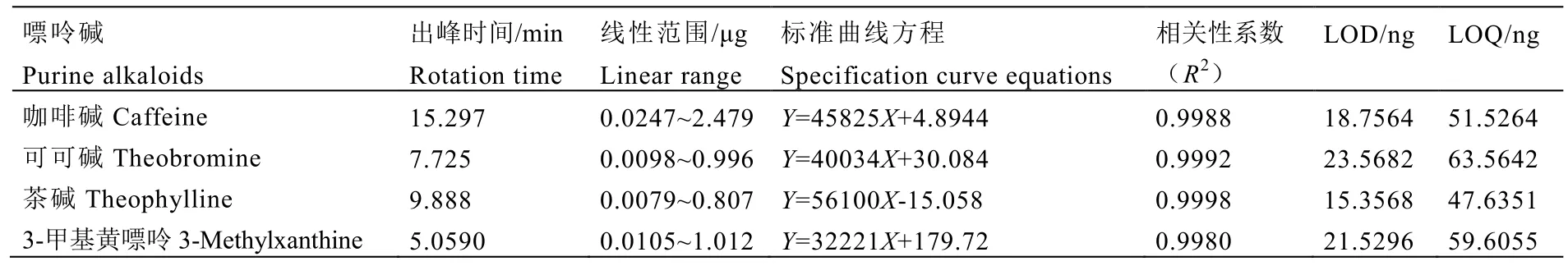
表3 不同嘌呤碱的检测限、定量限、线性范围、相关性系数Table 3 Limit of detection, limit of quantification, linear range and correlation coefficient of purine alkaloids
咖啡碱含量的变化趋势如图4(A)所示,在灭菌处理的对照组中,咖啡碱基本稳定,无显著变化;在接种发酵组中,咖啡碱质量分数急剧下降,从最初的(3.531±0.0733)%下降至(0.593±0.0518)%,发酵结束时,咖啡碱质量分数仅为 0.414%。整体上,在聚多曲霉茶叶发酵中,咖啡碱的降解率为 88.76%。茶碱含量变化见图4-B。在无菌处理的对照组中,茶碱质量分数基本维持在0.01%以下;在接种发酵组中,茶碱大幅度升高,从最初的不足0.01%增加至(2.129±0.246)%,并成为主要的嘌呤碱。由图4-C可知,可可碱含量相对稳定,发酵前后无显著性变化。由图4-D可知,3-甲基黄嘌呤在接种发酵中有大幅度增加,由最初的(0.658±0.08)%增加至(1.513±0.24)%,增加幅度为130%。由此可知,聚多曲霉能大幅度降低咖啡碱含量,对茶碱、3-甲基黄嘌呤也有明显影响。
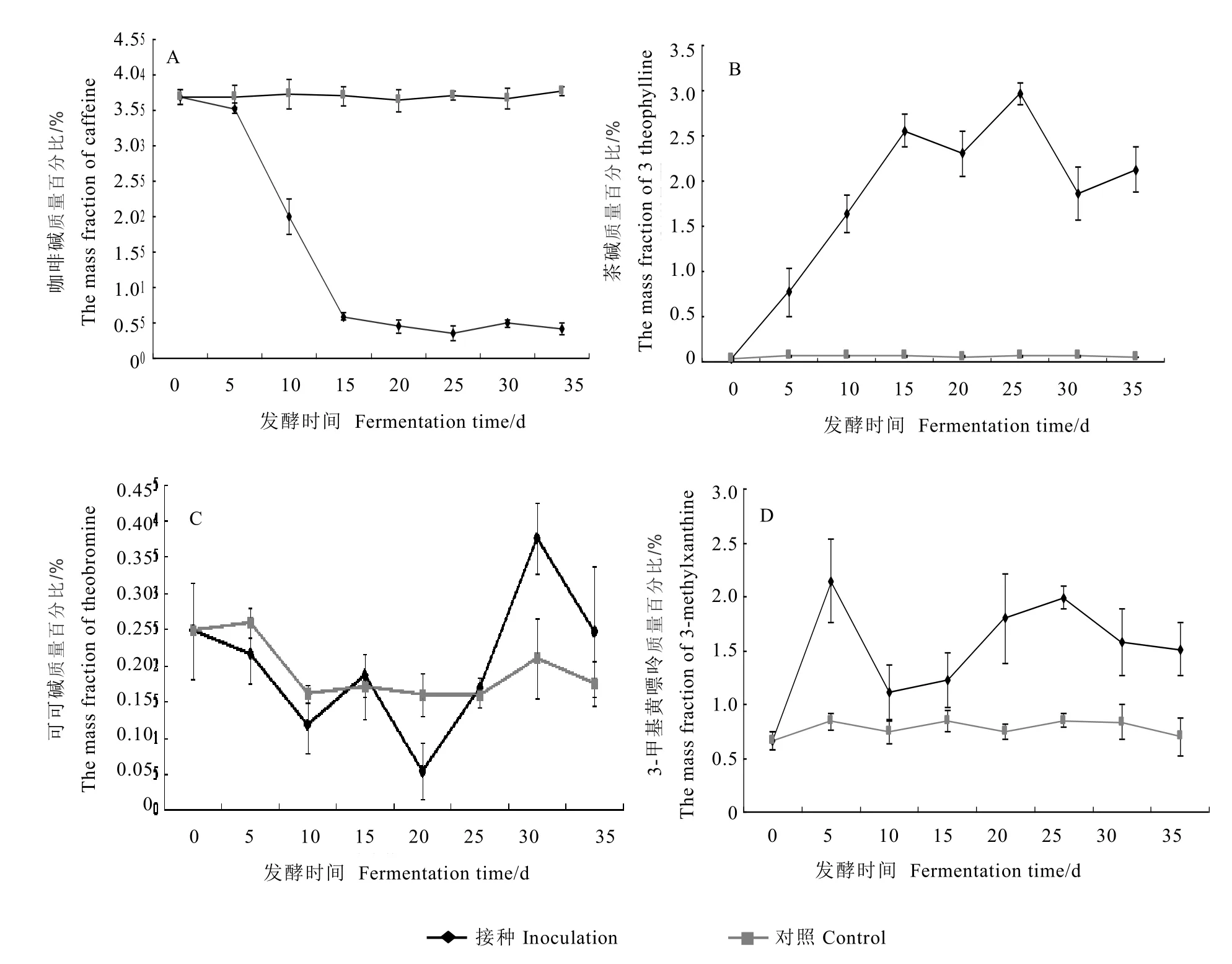
图4 普洱茶发酵过程中咖啡碱(A)、茶碱(B)、可可碱(C)、3-甲基黄嘌呤(D)含量变化Fig. 4 The dynamic changes of caffeine(A), theophylline (B), theobromine(C) and 3-methylxanthine(D) diversification in pu-erh tea during solid-state fermentation
3 讨论与结论
虽然在茶园和咖啡园的土壤[18-20]中已经筛选出多株具有降解咖啡碱的有效菌株,但在固态发酵茶样中分离鉴定降解咖啡碱的菌株从未见报道。本文以不同阶段的普洱茶发酵样为材料,通过咖啡碱液体筛选培养基的初筛与复筛,分离鉴定出一株可降解咖啡碱的有效菌株。鉴定为聚多曲霉(Aspergillus sydowii),相似性高达99.8%。在咖啡碱质量浓度为1.2 g·L-1的筛选培养基中,该菌株48 h内对咖啡碱的降解率为87.7%。
在前人研究中,聚多曲霉能分泌产生多种具有抗癌活性的吲哚生物碱和杂氧蒽酮[21-22],为重要的医药微生物。为探究该菌株对咖啡碱等嘌呤碱的影响,本文将聚多曲霉接种至茶叶中进行单菌种发酵,并以无菌处理作为对照。在接种发酵中,咖啡碱含量急剧下降,发酵结束时咖啡碱的降解率为 88.76%,含量仅占干物质重的 0.414%左右,符合国际低咖啡碱茶咖啡碱质量分数低于1%的基本要求。因此聚多曲霉或可用于低咖啡碱普洱茶的开发。另外,在接种发酵过程中,茶碱含量大幅度上升,发酵结束时质量分数为(2.129±0.246)%,成为发酵样中的主要嘌呤碱。3-甲基黄嘌呤含量也有大幅度增加。
普洱茶是以地理标志保护范围内的云南大叶种[Camellia sinensis Var. assamica (Mast.) Kitamura]晒青毛茶为原料,利用一定工艺制成的具有独特品质特征的茶叶[23]。现代研究证实,普洱茶具有减少腰部脂肪堆积、抗氧化、抗癌以及降低动脉硬化风险等功效[24-26]。利用特定微生物接种发酵开发具有某种功能性成分的普洱茶成为当务之急。本文通过对普洱茶发酵过程中特定微生物的筛选,鉴定出一株降咖啡碱的优势菌株,为低咖啡碱普洱茶产品的开发提供了菌种。
[1]Wei Kang, Wang Li-Yuan, Zhou Jian, et al. Comparison of catechins and purine alkaloids in albino and normal green tea cultivars (Camellia sinensis L.) by HPLC [J]. Food Chemistry, 2012, 130: 720-724.
[2]Wang L Y, Wei K, Jiang Y W, et al. Seasonal climate effects on fl avanols and purine alkaloids of tea (Camellia sinensis L.) [J]. Eur Food Res Technol, 2011, 233: 1049-1055.
[3]Zuo Yuegang, Chen Hao, et al. Simultaneous determination of catechins, caffeine and gallic acids in green, Oolong, black and Pu-erh teas using HPLC with a photodiode array detector [J]. Talanta, 2002, 57: 307-316.
[4]Ferda Sari Y, Sedat Velioglu. Changes in theanine and caffeine contents of black tea with different rolling methods and processing stages [J]. Eur Food Res Technol, 2013, 237: 229-236.
[5]Zhang Liang, Zhang Zhengzhu, Zhou Yibin, et al. Chinese dark teas: postfermentation, chemistry and biological activities [J]. Food Research International, 2013, 53: 600-607.
[6]Zhang Liang, Li Ning, Ma Zhizhong, et al. Comparison of the chemical constituents of aged Pu-erh tea, ripened Pu-erh tea, and other teas using HPLC-DAD-ESI-MS [J]. J Agric Food Chem, 2011, 59: 8754-8760.
[7]Lv Hai peng, Zhang Yingjun, Lin Zhi, et al. Processing and chemical constituents of Pu-erh tea: a review [J]. Food research international, 2013, 53: 608-618.
[8]Wang Di, Xu Kunlong, Zhang Ying, et al. Acute and subchronic oral toxicities of Pu-erh black tea extract in Sprague-Dawley rats [J]. Journal of Ethnopharmacology, 2011, 134: 156-164.
[9]Wang Di, Xiao Rong, Hu Xueting, et al. Comparative safety evaluation of Chinese Pu-erh green tea extract and Pu-erh black tea extract in Wistar rats [J]. J Agric Food Chem, 2010, 58: 1350-1358.
[10]Qin Jinhua, Li Ning, Tu Pengfei, et al. Change in tea polyphenol and purine alkaloid composition during solid-state fungal fermentation of post fermented tea [J]. J Agric Food Chem, 2012, 60: 1213-1217.
[11]Wang Xiaogang, Wan Xiaochun, Hu Shuxia, et al. Study on the increase mechanism of the caffeine content during the fermentation of tea with microorganisms [J]. Food Chemistry, 2008, 107: 1086-1091.
[12]Ma Cunqiang, Yang Chao, Zhou Binxing, et al. Recent progress in microbial metabolism of purine alkaloids in fermented tea [J]. Food Chemistry, 2014, 35(21): 292-296.
[13]Gokulakrishnan S, Chandraraj K, Gummadi S, et al. A preliminary study of caffeine degradation by Pseudomonas sp. GSC 1182 [J]. International Journal of Food Microbiology, 2007, 113: 346-350.
[14]马存强,李静,杨超, 等. 建黑曲霉发酵对咖啡碱代谢的影响[J]. 江西农业学报, 2014,26( 5) :42-46.
[15]Yang XR, Ye CX, Xu JK, et al. Simultaneous analysis of purine alkaloids and catechins in Camellia sinensis, Camellia ptilophylla and Camellia assamica var. kucha by HPLC [J]. Food Chem, 2007, 100: 1132-1136.
[16]Ashihara H, Suzuki. Distribution and biosynthesis of caffeine in plants [J]. Front Biosci, 2004, 9: 1864-1876.
[17]Ashihara H, Gillies FM. Metabolism of caffeine and related purine alkaloids in leaves of tea (Camellia sinensis L.) [J]. Plant Cell Physiol, 1997, 38(4): 413-419.
[18]Woolfolk CA. Metabolism of M-methylpurines by a Pseudomonas putida strain isolated by enrichment on caffeine as the sole source of carbon and nitrogen [J]. J Bacteriol, 1975, 123: 1088-1106.
[19]Gutié rrez-Sá nchez G, Roussos S, Augur C. Effect of caffeine concentration on biomass production, caffeine degradation, and morphology of Aspergillus tamarii [J]. Folia Microbiol, 2013, 58:1 95-200.
[20]Gokulakrishnan S, Chandraraj K, Sathyanarayana N. Gummadi. A preliminary study of caffeine degradation by Pseudomonas sp. GSC1182 [J]. International Journal of Food Microbiology, 2007, 113: 346-350.
[21]He Fei, Sun Lin, Liu Kaisheng, et al. Indole alkaloids from marine-derived fungus Aspergillus sydowii SCSIO00305[J]. J Antibiotics 2012, 65: 109-111.
[22]Song Xianqin, Zhang Xin, Han Qiuju, et al. Xanthone derivatives from Aspergillus sydowii, an endophytic fungus from the liverwort Scapania ciliata S. Lac and their immunosuppressive activities [J]. Phytochemistry Letters, 2013, 6: 318-321.
[23]蔡新, 张理珉, 杨善禧, 等. GB/T 22111—2008 地理标志产品 普洱茶[S]. 北京: 中国标准出版社, 2008.
[24]Zhao Hang, Zhang Min, Zhao Lu, et al. Change of constituents and activity to apoptosis and cell cycle during fermentation of tea[J]. International Journal of Molecular Sciences, 2011, 12: 1862-1875.
[25]Way Tzongder, Lin Huiyi, Kuo Daih Huang, et al. Pu-erh tea attenuates hyperlipogenesis and induces hepatoma cells growth arrest through activating AMP-Activated Protein Kinase (AMPK) in human HepG2 cells [J]. J Agric Food Chem, 2009, 57: 5257-5264.
[26]Lee LK, Foo KY. Recent advances on the beneficial use and health implication of Pu-erh tea [J]. Food Research International, 2013, 53: 619-628.
Screen and Identification of Fungi Strain Degrading Caffeine in Pu-erh Tea during Solid-state Fermentation
MA Cunqiang1,2, ZHOU Binxing1,3*, WANG Hongzhen1, WANG Pan1
1. LongRun Pu-erh Tea College, Yunnan Agricultural University, Kunming 650201, China; 2. Kunming Dapu Tea Industry co., Kunming 650224, China; 3. College of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China
To identify fungi strain involved in caffeine degradation in Pu-erh tea, caffeine liquid medium was used to screen target strain in Pu-erh tea of different stages during solid-state fermentation. The candidate strains were then analyzed for colony morphology, morphological characteristics and 18 S rDNA. The target strain was inoculated into tea for fermentation. Caffeine, theophylline, theobromine and 3-methylxanthine were determined by HPLC during the fermentation process. Results showed that the most effective strain was isolated from Pu-erh tea during solid-state fermentation, which could degrade 87.70% caffeine within 48 hours and was identified as Aspergillus sydowii with similarity of 99.8%. During the inoculated fermentation with Aspergillus sydowii, caffeine declined sharply and only 0.414%±0.077% (w/w) was reserved. Theophylline increased significantly from less than 0.1% (w/w) to 2.129% ±0.246% (w/w) and became the major purine alkaloid. Theobromine was relatively stable without significant change (P<0.05). The 3-Methylxanthine content had an obvious increase by 130%. The fungi stain was firstly isolated and identified to be involved in caffeine degradation, which confirmed fungus will facilitate the production of decaffeinated Pu-erh tea. In addition, caffeine biotransformation products were developed.
Aspergillus sydowii, caffeine, theophylline, Pu-erh tea, solid-state fermentation
TS272.5+4;Q946.88
A
1000-369X(2017)02-211-09
2017-02-10
2017-02-15
紫鹃茶树调控花色苷生物合成的MBW转录因子复合体研究(C161104)、中国现代农业产业技术体系(CARS-23)
马存强,男,硕士研究生,主要从事茶叶加工与综合利用研究。*通讯作者:bxzhou01@126.com
