不同冷冻方式对斑点叉尾鮰鱼片品质的影响
2017-04-20彭欢欢刘小莉张金振李莹周剑忠刘源
彭欢欢,刘小莉,张金振,李莹,周剑忠,刘源
(1.上海海洋大学食品学院,上海201306;2.江苏省农业科学院农产品加工研究所,江苏南京210014;3.中国农业科学院蜜蜂研究所,北京100093)
不同冷冻方式对斑点叉尾鮰鱼片品质的影响
彭欢欢1,刘小莉2,*,张金振3,李莹2,周剑忠2,刘源1
(1.上海海洋大学食品学院,上海201306;2.江苏省农业科学院农产品加工研究所,江苏南京210014;3.中国农业科学院蜜蜂研究所,北京100093)
研究不同的低温冷冻预处理方式,即-20℃慢冻、-20℃、-40℃、-60℃速冻至-20℃,进行鮰鱼片的冷冻,随后于-20℃冻藏,考察储藏期间鮰鱼片理化性质的变化情况。结果表明,随着冻藏时间的延长,不同方式的冻结鮰鱼pH值、Ca2+-ATPase活性、活性巯基均呈下降趋势,MDA值、TVB-N值、表面疏水性呈上升趋势,速冻处理组的样品各指标变化趋势明显低于或迟缓于慢冻组,且速冻温度越低,效果越显著。考虑到成本因素,可以结合其他保鲜手段适当提高冻结温度至-20℃~-40℃以保证产品品质。
斑点叉尾鮰鱼;速冻;温度;品质
斑点叉尾鮰,又称沟鲶、河鲶、美洲鲶,属于鲶形目,鮰科,叉尾鮰属,是一种原产于美洲的大型淡水鱼类。鮰鱼全身光滑无鳞,具有肉质细嫩、肉色白、无肉间细刺、易切片、营养价值高等优点,有人体必需的8种氨基酸和多种维生素以及大量的不饱和脂肪酸[1],深受国内外消费者喜爱。
斑点叉尾鮰鱼是美国主要淡水养殖品种之一,其产量超过美国淡水养殖总产量的一半以上[2]。我国于1978年和1984年相继从日本和美国引进养殖,并于1987年获得繁殖成功,目前已在我国20多个省市养殖,产量高达16.2 t/hm2[3]。但斑点叉尾鮰体脂含量非常高,鲜销产量不及其他淡水鱼类,为了解决供销关系的平衡,保证养殖业的持续发展,需要对其进行加工处理,延长产业链,提高附加值。
冷冻鱼片是目前较为普遍的一种斑点叉尾鮰加工方式,可用于出口或国内销售延长货架期。冻藏作为主要的保鲜、保藏方法,已广泛应用于水产品的贮藏、运输、销售和加工中。然而鱼类在冻藏过程中会发生一系列的变化,例如蛋白质变性、ATP降解、脂肪氧化等,严重影响着冻品的质量,降低了鱼类的商品价值和营养价值[4]。尤其是斑点叉尾鮰鱼脂肪含量高,更易在长期低温贮藏过程中发生脂肪氧化,进而加速蛋白质变性。
冷冻加工过程中冻结速率是影响冰晶形成数量、大小和分布的一个重要因素。多项研究表明[5-7],冻结速率越高,原料质构特性保持得越好。合理的冻结方式对生产高质量产品具有重要意义。
本文采用4种不同的冻结方式(-20℃慢冻、-20℃、-40℃、-60℃速冻),以pH值、丙二醛(MDA)、挥发性盐基氮(TVB-N)、Ca2+-ATPase活性、活性巯基、表面疏水性等指标来研究预处理过程中冻结速率对鮰鱼品质的影响,为鱼片的加工利用提供理论依据和技术指导。
1 材料与方法
1.1 材料、试剂与仪器
鲜活斑点叉尾鮰鱼[每条(1 500±150)g]:南京佳鸿水产商行。
高氯酸、磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钾、盐酸、三羟甲基氨基甲烷(Tris):国产分析纯;5,5’-二硫代双-硝基苯甲酸(DTNB)、1-苯胺基-8-奈基磺酸盐(ANS):Sigma公司。BCA法蛋白定量测试盒、丙二醛(MDA)试剂盒、超微量Ca2+-ATP酶测试盒:南京建成生物工程研究所。
DW-150低温试验箱:南京泰斯特试验设备;DW-4OL278医用低温保存箱:海尔集团;SynergyH1酶标仪:美国柏腾仪器有限公司;T25匀质分散机:德国IKA公司;UV-1600PC紫外分光光度计:上海美谱达仪器有限公司;3K15高速离心机:北京五洲东方科技发展有限公司。
1.2 方法
1.2.1 材料预处理
鮰鱼敲晕后切除鱼头,去内脏、鱼皮,流水清洗干净后沥干10 min,剖片、清洗、整形、控水、分级、备用,切分成2 cm×2 cm×2 cm大小的鱼片。
1.2.2 冻结、冻藏及解冻
将整理好的鮰鱼片随机分成4组并分别处理,处理方式如下并贮藏:
1)慢速冻结:将鱼片直接置于-20℃冰箱中缓慢冻结;
2)快速冻结:分别设置低温试验箱温度为-20℃、-40℃、-60℃,待腔体温度稳定至设置值后,将温度记录仪探头插入鱼片样品中心进行冻结至-20℃,然后置于-20℃冰柜中贮藏;
冻藏过程中定期取样测定。试验时,取适量冻鱼片置于(4±1)℃冰箱中解冻12 h,解冻后样品用于各项指标的测定。
1.2.3 提取和测定方法
1.2.3.1 肌原纤维蛋白的提取[8]
称取5 g样品加10 mL、4℃预冷的去离子水,12 000 r/min匀浆30 s,10 000 r/min、4℃离心20 min,弃去上清液,沉淀中加入去离子水,再重复提取一次。沉淀中再加入20 mL、4℃预冷的0.05 mol/L磷酸缓冲液(pH 7.2)(其中补充0.6 mol/L的NaCl),12 000 r/min匀浆30 s,10 000 r/min、4℃离心20 min,收集上清液。沉淀用上述步骤再重复提取一次,合并上清即为肌原纤维蛋白粗提取液,其浓度采用BCA试剂盒测定。
1.2.3.2 pH值的测定
取鱼肉样品2 g,加入9倍体积的煮沸冷却后的纯水,匀浆,10000r/min离心10min,取上清液测定pH值。
1.2.3.3 丙二醛(MDA)含量测定
取鱼肉样品2 g,加入9倍体积的煮沸冷却后的纯水,匀浆,取匀浆液测丙二醛含量采用MDA试剂盒进行测定。
1.2.3.4 挥发性盐基氮的测定
挥发性盐基氮(TVB-N)测定采用GB/T 5009.44-2003半微量定氮法进行测定,略有改动。事先配制5%高氯酸溶液,样品5 g,加入20 mL高氯酸提取,匀浆,10 000 r/min离心10 min,取上清。沉淀中再加入20 mL高氯酸重复上述提取步骤2次,合并上清,定容到65 mL。上清用于测TVB-N。
1.2.3.5 Ca2+-ATPase活性的测定
准确称取待测样品,加入9倍体积的生理盐水,冰水浴条件下12 000 r/min匀浆30 s,2 500 r/min,离心10 min,取上清液用生理盐水稀释至适当浓度,采用超微量Ca2+-ATPase测试盒测定。
1.2.3.6 活性巯基(SH)的测定[9]
取1.2.3.1中提取的蛋白溶液0.5 mL,加入4.5 mL的0.2mol/LTris-HCl缓冲液(pH6.8)。取该混合液1mL,加入0.1 mL 0.1%DTNB,40℃温育25 min,测定412 nm处的吸光度。空白样用0.6 mol/L KCl(pH 7.0)代替样品。SH基团含量的计算公式如下:
-SH含量(nmol/mg蛋白质)=(A×n)/(ε×p)×106
式中:A表示412 nm波长处的吸光度;n表示稀释倍数;ε表示摩尔吸光系数13 600 L/(mol·cm);p表示蛋白质质量浓度,mg/mL。
1.2.3.7 表面疏水性的测定[9]
取1.2.3.1中提取的蛋白溶液,用0.1 mol/L、pH 7.0的磷酸盐缓冲液溶解,ANS浓度为8 mmol/L备用。用10 mmol/L磷酸缓冲液(pH 6.0,含0.6 mol/L NaCl)稀释至0.125、0.25、0.5、1 mg/mL。取4 mL上述各浓度的肌原纤维蛋白溶液,与30 μL ANS混合。测定ANS-蛋白结合体的荧光强度,激发波长374 nm、发射波长485 nm。以荧光强度对肌原纤维蛋白浓度做图,所得到的曲线斜率即表示为蛋白表面疏水性指数SoANS。
1.3 数据差异性分析
本试验数据为3次重复的平均值。采用SPSS 13.0软件进行数据统计和方差显著性分析。
2 结果与分析
2.1 冻结速率对鮰鱼pH值的影响
冻结速率对鮰鱼pH值的影响见图1。
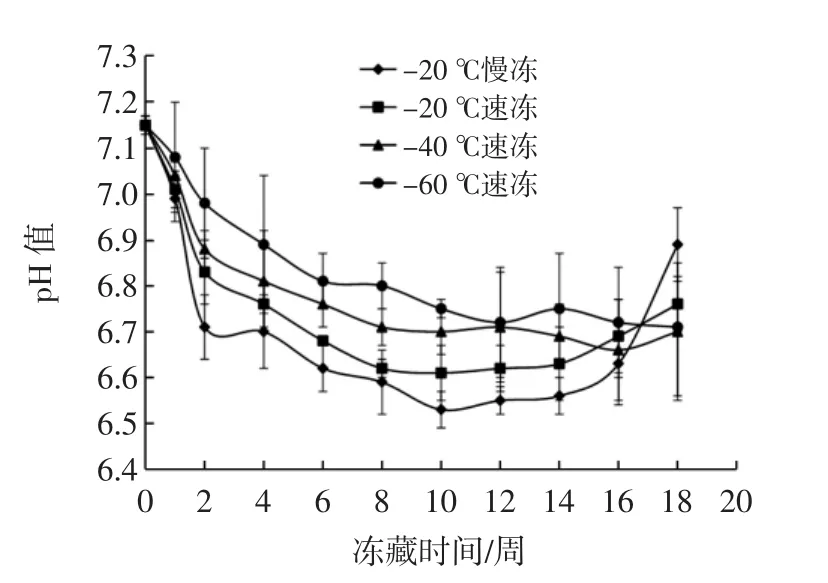
图1 冻结速率对鮰鱼pH值的影响Fig.1 Effect of freezing methods on pH value of channel catfish fillets
由图1可知:-20℃慢冻组pH值先下降后上升,-20℃速冻组pH值变化趋势与慢冻组类似,但比较平缓。-40、-60℃速冻组在18周储藏期内保持降低趋势。pH值的下降是因为当动物呼吸停止时,血液停止循环引起供氧停止,组织呼吸转变成无氧糖酵解途径,体内糖原开始分解并产生乳酸,使肌肉的pH值下降。pH值达最低时,表明已达到僵硬高峰,随后pH值又缓慢回升,说明僵硬过程结束,蛋白质在酶类作用下逐渐分解并产生氨基酸及其它碱性物质,此外,细菌也利用氨基酸和其它含氮小分子产生氨及胺类等碱性物质,使pH值回升并进入解僵阶段[5]。
速冻条件下冻藏,pH值下降程度较小,特别是-40℃以下速冻条件冻藏pH值变化相对缓慢,最终pH值为6.7左右,更有利于品质的保证。胡亚芹等[6]研究发现,经过3种不同冻结方式(-40℃液氮冻结、-30℃平板冻结、-18℃冰柜直接冻结)冻结至中心温度-18℃,并于-18℃环境中贮藏带鱼70 d,63 d左右pH值达到最低值时带鱼达到僵硬高峰,63 d后其pH值上升。
2.2 冻结速率对脂肪氧化的影响
硫代巴比妥酸试验法(即TBA值法)是测定肉类食品中脂肪氧化情况通常采用的方法。丙二醛作为过氧化脂质降解的特征产物,能够与硫代巴比妥酸缩合,形成红色产物,在532 nm处有最大吸收峰,其强度和含量呈线性关系,能够反映肉及肉类制品中脂肪氧化变质程度,是肉类食品安全性的重要指标。
很多试验已经证明,即使在很低的温度下,脂肪氧化也会进行[10]。鮰鱼是一种高脂肪的鱼类,其所含的脂肪酸大多数为不饱和脂肪酸,很容易发生脂质氧化,且在冻结过程中鮰鱼的自由水在不断减少,组织液的浓度逐渐增大,使其氧化速度加快。另外,冻结速率不同,形成的冰晶体大小不同,因而对组织机械损伤程度不同,暴露在空气中的损伤面积会增加脂质氧化的可能。冻结速率对脂肪氧化的影响见图2。
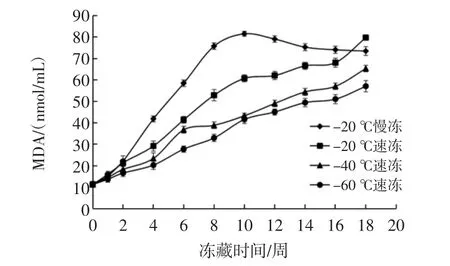
图2 冻结速率对鮰鱼片MDA值的影响Fig.2 Effect of freezing methods on MDA of channel catfish fillets
图2结果显示,4种冻结条件下冻藏的鮰鱼,随时间延长,其MDA值均呈上升趋势,且-20℃慢冻处理的样品比其它3种方式上升速率显著加快。-40℃以下处理的样品差异不显著。-20℃慢冻处理的样品在10周储藏期后MDA含量又趋于降低,这可能是由于二级氧化产物醛、酮类物质进一步降解造成的。Aubourg等[11]研究也发现次级产物MDA可与鱼肉中的氨基相互作用生成l-氨基-3-氨基丙烯,从而导致MDA含量的下降。
2.3 冻结速率对挥发性盐基氮的影响
鮰鱼蛋白质含量较高,在冻结过程中低温虽然可以抑制大多数微生物的活动,但仍有部分微生物的生长繁殖和酶解作用会使鮰鱼中蛋白质分解,蛋白质分解产生氨及胺类等碱性含氮物,挥发性盐基氮含量(TVB-N值)可反映出蛋白质分解程度和腐败程度。冻结速率对挥发性盐基氮的影响见图3。

图3 冻结速率对鮰鱼TVB-N值的影响Fig.3 Effect of freezing methods on TVB-N of channel catfish
由图3看出,4种冻结条件下冻藏的鮰鱼,随着时间延长,其TVB-N值均呈上升趋势,且-20℃慢冻条件冻藏明显比其它3种上升速率快。前期TVB-N变化缓慢可能是氨基酸经脱氨基作用释放出氨态氮,而二甲胺DMA和三甲胺TMA等低级胺类化合物产生的可能性不大,所以上升慢;而后期,微生物活动加强,大量的氨基酸被微生物分解,脱氨基作用加剧,导致TVB-N上升迅速[12-14]。速冻处理显著延缓了TVB-N值的增加,根据GB 2733-2005《鲜、冻动物性水产品卫生标准》规定,淡水鱼的挥发性盐基氮≤20 mg/100 g,说明即使慢冻处理的鮰鱼片也能很好地维持TVB-N在较低的水平,保持良好的新鲜度。
2.4 冻结速率对Ca2+-ATPase活性的影响
Ca2+-ATPase活性源于肌球蛋白的球状头部结构,其活性与头部区域密切相关,可作为判断冷冻储藏期间,肌原纤维蛋白结构特别是肌球蛋白头部结构变化的较为灵敏的指标[15]。在冻藏过程中,肌球蛋白球状头部构象发生改变或者相互聚集,将造成肌原纤维蛋白Ca2+-ATPase活性的下降[16]。冻结速率对Ca2+-ATPase活性的影响见图4。

图4 冻结速率对肌原纤维蛋白Ca2+-ATPase性的影响Fig.4 Effect of freezing methods on Ca2+-ATPase activity of myofibrillar protein
由图4可知,随着冻藏时间的延长,4种冻结条件下样品的Ca2+-ATPase活性明显降低,冻藏结束后,-20℃慢冻、-20℃速冻、-40℃速冻、-60℃速冻处理的样品 Ca2+-ATPase活性分别为 0.21、0.61、0.88、0.97 μmol Pi/(mg蛋白·min),与初始样品相比分别降低了85.5%、58.8%、40.3%和34.5%。本研究中速冻处理对延缓样品中Ca2+-ATPase活性的下降有显著的效果,且-40℃以下的低温显著优于-20℃,-40℃和-60℃处理间差异不显著。很多研究得出了相似的结论。Xiong等[17]研究发现,在-18℃冻藏30 d后,草鱼肉蛋白的Ca2+-ATPase活性降低了71.4%。Herrera等[18]在研究壳聚糖对狗母鱼鱼糜的抗冻作用时,发现在-25℃冻藏6个月期间,狗母鱼鱼糜的Ca2+-ATPase活性减小为初始的12.1%。阴晓菲[19],Benjakul[20]等研究发现冻藏期间鱼蟹类的Ca2+-ATPase活性均在前2~3月下降较快,后期变化不大,这与本试验研究结果一致。
2.5 冻结速率对巯基含量的影响
巯基是肌原纤维蛋白中大量活性和功能基团的重要组成部分,具有较高反应活性,对于维持蛋白空间结构稳定、及其理化和功能性质具有重要意义[16,21],其含量的变化能够反映出蛋白质变性集合的程度,巯基含量下降的主要原因是疏基氧化形成二硫键所致[22]。大量研究发现,在蛋白质冻藏过程中,活性巯基易于氧化成二硫键,改变蛋白质的空间结构[16]。冻结速率对巯基含量的影响见图5。

图5 冻结速率对鮰鱼肌原纤维蛋白活性巯基含量的影响Fig.5 Effect of freezing methods on active sulfhydryl content of myofibrillar protein
由图5可知,随着冻藏时间的延长,肌原纤维蛋白样品的巯基含量明显降低,第2周和第10周分别出现速度下降拐点,-20℃慢冻、-20℃速冻、-40℃速冻和-60℃速冻巯基含量第2周结束时分别下降到初始值的78.8%、81.7%、84.0%、87.6%,10周后分别为初始值的57.1%、64.2%、65.5%、69.1%,18周储藏期结束后残余含量分别为42.1%、45.0%、49.9%、60.1%。在不同条件的冻藏下,鮰鱼的活性巯基含量均在前10周有较快的下降速率。曾名湧等[23]认为,这种现象是因为肌原纤维蛋白中有一部分活性巯基位于分子外侧,在冻藏初期蛋白质结构未发生重大变化时就能够被氧化。此外,蛋白质分子聚合体的形成会覆盖一些巯基,而使能够检测到的游离的巯基部分减少,导致了巯基含量下降。巯基的下降伴随着Ca2+-ATPase活性的降低,这可能是因为肌球蛋白构象发生改变,特别是头部区域的变化。这些变化导致了活性巯基的暴露,使其更易发生氧化或二硫键交换,从而巯基含量下降[24]。
2.6 冻结速率对表面疏水性的影响
蛋白质的表面疏水性反映的是蛋白质分子表面的疏水性残基的相对含量,新鲜鱼肉蛋白质的疏水性基团倾向位于蛋白质分子内部,具有较低的表面疏水性。冻藏初期,折叠态的肌原纤维蛋白分子开始伸展,原先位于蛋白质多肽链内部的疏水性基团外露,引起蛋白质分子表面疏水性的上升[25]。冻结速率对表面疏水性的影响见图6。

图6 冻结速率对鮰鱼肌原纤维蛋白表面疏水性的影响Fig.6 Effect of freezing methods on surface hydrophobicity of myofibrillar protein
由图6可以看出,随冻藏时间的延长,表面疏水性表现出增大的趋势,冻藏结束时,-20℃慢冻样品相对初始值增加了1.73倍,Zhou等[26]研究发现,罗非鱼糜在-18℃冻藏24周后,样品表面疏水性相对初始值增加了2倍。-20℃速冻样品和-40℃速冻样品分别增加了1.24倍和1.07倍,-60℃速冻样品组变化比较缓慢,增加了57%,最终都远大于冻藏前水平,表明冻藏改变了肌原纤维蛋白的结构。Ren等[27]研究发现,冻藏12周后,-18℃和-50℃下样品疏水性相对初始值分别增加了54%和39%。
3 结论
冻结处理时,在缓慢冻结条件下,冰晶先在溶液温度较低的细胞外液生成,随着冻结温度下降,细胞内部的水分也开始通过细胞膜往外迁移,使细胞外冰晶长大,这种冻结方式形成的冰晶量少且粗大,多呈块状或柱状。冻结速度越快,则冻制产品温度下降越快,鱼肉组织中生成的冰晶越细小,且基本上均匀分布在细胞内,对鱼肉品质破坏较小[28]。因此冷冻加工过程中应尽快使物料通过最大冰晶形成带,迅速达到所需冻藏温度,使生成的冰晶细小且分布均匀,从而减小蛋白质冻结中的变性程度。
本研究结果表明经过速冻的鮰鱼片的各项理化指标显著优于在冰柜中缓慢冻结的鮰鱼,前者通过最大冰晶生成带的时间短,形成的冰晶体小,对鮰鱼造成的肌肉损伤小,但-40℃以下的低温对品质变化的影响差异不大,且超低温处理的成本相对较高。结合目前我国企业实际生产条件,在-20℃~-40℃范围内尽可能采用低温速冻,可以很好地保持鮰鱼片的冷冻品质。
[1] 宋丽丽,毛金林,陈杭君,等.冻藏对斑点叉尾鮰鱼片蛋白质冷冻变性和肌原纤维超微结构的影响[J].中国食品学报,2013,13(1): 62-66
[2]王广军.我国大陆斑点叉尾鮰鱼养殖现状分析[J].渔业致富指南, 2006(15):11-13
[3]李林,严朝晖,肖友红.斑点叉尾鮰国内市场现状及产业发展前景浅析[J].中国水产,2012(9):35-36
[4]侯温甫,薛长湖,杨文鸽,等.低温速冻处理对鲻鱼冻藏生化特性的影响[J].渔业科学进展,2006,27(3):73-77
[5]廖媛媛,欧昌荣,汤海青,等.三种冻结方式对大黄鱼品质的影响[J].现代食品科技,2014(7):218-223
[6]胡亚芹,胡庆兰,杨水兵,等.不同冻结方式对带鱼品质影响的研究[J].现代食品科技,2014(2):23-30
[7] 欧阳杰,谈佳玉,沈建.速冻方式与温度对鲍鱼品质的影响[J].现代食品科技,2014(6):214-218
[8] Fang Y,Rustad T,Xu Y,et al.Endogenous proteolytic enzymes-A study of their impact on cod (Gadus morhua)muscle proteins and textural properties in a fermented product[J].Food Chemistry,2015, 172:551-558
[9] Benjakul S,Sutthipan N.Muscle changes in hard and soft shell crabs during frozen storage[J].Lebensmittel-Wissenschaft und-Technologie,2009,42(3):723-729
[10]赵巧灵,廖明涛,刘书臣,等.蓝鳍金枪鱼脂肪氧化和鱼肉色泽的变化研究[J].中国食品学报,2014,14(7):79-86
[11]Aubourg S P.Interaction of malondialdehyde with biological molecules-new trends about reactivity and significance[J].International Journal of Food Science&Technology,1993,28(4):323-335
[12]Bindu J,Ginson J,Kamalakanth C K,et al.Physico-chemical changes in high pressure treated Indian white prawn (Fenneropenaeus indicus)during chill storage[J].Innovative Food Science& Emerging Technologies,2013,17(1):37-42
[13]Briones-Labarca V,Perez-Won M,Zamarca M,et al.Effects of high hydrostatic pressure on microstructure,texture,colour and biochemical changes of red abalone(Haliotis rufecens)during cold storagetime[J].Innovative Food Science&Emerging Technologies,2012, 13(1):42-50
[14]Sykes A V,Oliveira A R,Domingues P M,et al.Assessment of European cuttlefish (Sepia officinalis,L.)nutritional value and freshness under ice storage using a developed Quality Index Method (QIM)and biochemical methods[J].Lebensmittel-Wissenschaft und-Technologie,2009,42(1):424-432
[15]Shao D,Atungulu G G,Pan Z,et al.Characteristics of Isolation and Functionality of Protein from Tomato Pomace Produced with Different Industrial Processing Methods[J].Food&Bioprocess Technology,2014,7(2):532-541
[16]Wang L,Xiong G,Peng Y B,et al.The Cryoprotective Effect of Different Konjac Glucomannan(KGM)Hydrolysates on the Glass Carp (Ctenopharyngodon idella)Myofibrillar During Frozen Storage[J]. Food&Bioprocess Technology,2014,7(12):3398-3406
[17]Xiong G Q,Cheng W,Ye L X,et al.Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp(Ctenopharyngodon idella)[J].Food Chemistry, 2009,116(2):413-418
[18]Herrera J R,Mackie I M.Cryoprotection of frozen-stored actomyosin of farmed rainbow trout(Oncorhynchus mykiss)by some sugars and polyols[J].Food Chemistry,2004,84(1):91-97
[19]Benjakul S,Sutthipan N.Muscle changes in hard and soft shell crabs during frozer storage[J].LWT-Food Science and Technology, 2009,42(3):723-729
[20]阴晓菲,范鸿冰,郑超,等.不同冻结方式对草鱼鱼片冻藏-冷藏期间蛋白质生化特性的影响[J].中国农业大学学报,2013,18(6): 158-163
[21]Jiang S T,Hwang B S,Tsao C Y.Effect of storage temperatures on the formation of disulfides and denaturation of milkfish actomyosin (Chanos)[J].Journal of Food Science,1988,53(5):1333-1335
[22]Ko Wen-Cheng,Yu Chi-Cheng,Hsu Kuo-Chiang.Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J].Food Science and Technology,2007,103(7):560-564
[23]曾名湧,黄海,李八方.鲫鱼肌原纤维蛋白生化特性在冻藏过程中的变化[J].青岛海洋大学学报,2003,33(2):192-198
[24]郭圆圆,孔保华.冷冻贮藏引起的鱼肉蛋白质变性和物理化学特性的变化[J].食品科学,2011,32(7):335-340
[25]Riebroya S,Benjakula S,Visessanguan W,et al.Acid-induced of natural actomyosin from Atlantic cod (Gadus morhua)and burbot (Lota lota)[J].Food Hydrocolloids,2009,23(1):26-39
[26]Zhou A M,Benjakul S,Pan K,et al.Cryoprotective effects of trehalose and sodium lactate on tilapia(Sarotherodon nilotica)surimi during frozen storage[J].Food Chemistry,2005,32(7):93-96
[27]Ren L N,Xu Y S,Jiang Q X,et al.Investigation on structural changesofmyofibrillarproteinsfromsilver carp(Hypophthalmichthys molitrix)during frozen storage[J].Food Science and Technology Research,2013,19(6):1051-1059
[28]黄海,辛荣,王秀敏.鱼肉蛋白在低温贮藏时生化特性变化研究进展[J].食品研究与开发,2009,30(2):149-154
Effects of Freezing Methods on Quality of Channel Catfish Fillets
PENG Huan-huan1,LIU Xiao-li2,*,ZHANG Jin-zhen3,LI Ying2,ZHOU Jian-zhong2,LIU Yuan1
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2.Institute of Agricultural Products Processing,Jiangsu Academy of Agricultural Science,Nanjing 210014,Jiangsu,China;3.Institute of Apicultural Research,CAAS,Beijing 100093,China)
Effectsofdifferentfreezingmethods,including slow fridge freezing at-20℃,rapid freezing at-20℃,-40℃and-60℃respectively,on the quality of channel catfish fillets stored at-20℃,were evaluated.The results showed that during the storage at-20℃,pH value,Ca2+-ATPase activity and total sulfhydryl content decreased,while MDA contents,TVB-N contents and surface hydrophobicity increased continuously.The changing extents of each characteristic with rapid freezing methods were much lower than those with fridge freezing.With the consideration of cost,low temperature with the range between-20℃and-40℃would be suitable to maintain the quality of catfish fillets,with the combination of other preservative methods.
Channel Catfish fish;freezing methods;temperature;quality
10.3969/j.issn.1005-6521.2017.08.042
2016-08-01
江苏省农业科技自主创新资金项目(CX(15)1013)
彭欢欢(1991—),女(汉),硕士研究生,研究方向:水产品加工与贮藏。
*通信作者:刘小莉(1981—),女(汉),副研究员,博士,研究方向:食品科学。
