甜面酱保温发酵过程中微生物的研究
2017-04-20叶碧霞左勇赖琳陈乐春
叶碧霞,左勇,赖琳,陈乐春
(四川理工学院生物工程学院,四川自贡 643000)
甜面酱保温发酵过程中微生物的研究
叶碧霞,左勇*,赖琳,陈乐春
(四川理工学院生物工程学院,四川自贡 643000)
采用分离计数方法探究甜面酱保温发酵过程中的微生物组成及变化规律,并对优势菌株进行初步分离与鉴定。结果表明:甜面酱保温发酵过程中,细菌数量先上升后下降,霉菌数量则呈下降趋势,未检测出酵母。通过分离获得4株优势霉菌和5株优势细菌,经初步鉴定,其中2株为米曲霉,1株为黑曲霉,1株为根霉,2株为芽孢杆菌属,其余3株分别为假单胞菌属、链球菌属及德克斯氏菌属。生理效价检测结果表明:链球菌属细菌产酸及氨基态氮能力较强,分别为1.2%,0.43%;黑曲霉产糖化酶活力较高,约为352.33U/g,M2米曲霉菌株产蛋白酶活力较高,为53.7U/g。
甜面酱;保温发酵;微生物;生理效价
甜面酱是以面粉或小麦为原料,经微生物发酵酿制而成的一种半固态调味品。其酿制过程通常包含原料蒸煮、通风制曲、拌盐水发酵等阶段[1]。原料经蒸煮初步糊化后,在通风制曲阶段霉菌生长繁殖并分泌大量的糖化酶、蛋白酶等,拌盐水发酵初期主要是多种酶类降解大分子物质为小分子的还原糖、多肽等的过程。随着发酵进行,细菌利用小分子糖类和氨基酸等生长发酵产酸、氨基酸等物质,这些物质进一步构成了甜面酱的风味和营养成分[2,3]。整个酿制过程中,微生物发酵剂质量优劣直接关乎甜面酱成品的滋味、香气以及口感等。因而,优良的发酵菌株对于开发酱类发酵剂十分重要。
基于此,本研究以不同保温发酵阶段的甜面酱酱醪为研究对象,研究甜面酱保温发酵过程中的微生物变化规律。通过对甜面酱保温发酵过程中的微生物进行分离、计数,以期获得甜面酱在保温发酵过程中的微生物组成情况。同时,通过传统分离鉴定获得发酵过程中的优势菌群,探讨优势菌株应用于甜面酱酿制过程的可能,旨在拓宽甜面酱酿制菌种的选择范围,为改善甜面酱的质量风味提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 面酱样品
来源于四川省自贡市某食品厂。以拌盐水后入室内保温发酵池发酵起始记为0天。保温发酵周期通常为60天,保温阶段1周进行1次倒醅,故样品采集时间设置为0,7,14,21,35,49,56,60天。
1.1.2 微生物平板计数与分离培养基
细菌采用牛肉膏蛋白胨培养基,霉菌采用PDA培养基,酵母采用麦氏培养基。
1.2 主要仪器
HH-S恒温水浴锅 江苏省金坛市正基仪器有限公司;AR1140电子天平 奥豪斯公司;立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;HL MJ-250恒温恒湿箱 上海齐欣科学仪器有限公司;SKY-2012C恒温摇床 上海沪粤明科学仪器有限公司。
1.3 试验方法
1.3.1 不同发酵时期甜面酱中微生物的分离计数
1.3.1.1 样品处理
无菌条件下,称取10g甜面酱样品于盛有90mL无菌水的250mL锥形瓶中,35℃,270r/min条件下振摇30min。
1.3.1.2 分离计数
微生物的计数:平板菌落计数法[4]。
1.3.2 优势菌种的鉴定
鉴定方法:微生物形态学鉴定、常规生理生化鉴定等[5-10]。
1.3.3 优势菌种的生理效价测定
1.3.3.1 霉菌的生理效价测定
糖化酶的测定:斐林试剂标准糖液反滴定法测定[11];蛋白酶活力的测定:福林-酚试剂法[12];黄曲霉素:薄层色谱层析法[13]。
1.3.3.2 细菌的生理效价测定
总酸(以乳酸计)及氨基态氮的测定:酸碱滴定法及甲醛滴定法[14]。
2 结果与分析
2.1 甜面酱保温发酵过程中微生物的变化情况
甜面酱在保温发酵过程中,微生物之间的相互作用,降解原料中的大分子物质。通过分离计数,获得甜面酱保温发酵不同时间段的微生物组成及变化情况,见图1。

图1 甜面酱保温发酵过程中微生物的变化规律Fig.1 The change rule of microorganism in sweet flour paste during the insulation fermentation
由图1可知,甜面酱保温发酵过程中,发酵初期,霉菌占据优势,随着发酵的进行,霉菌数量开始下降,而细菌逐渐呈上升趋势,约1周以后,细菌数量也开始下降;发酵后期,微生物数量维持在较低的水平。其原因可能是:霉菌经通风制曲阶段大量产孢子得以生长繁殖,拌盐水进入保温发酵初期,有氧环境转变为无氧状态,加之高盐的环境不利于霉菌的生长,所以出现数量的逐渐下降;细菌在保温发酵的初期数量呈现上升,这与生长环境的改变相关,随着发酵的进行,酱醪粘稠度增加,传质与传氧能力减弱,同时pH逐渐降低,过酸的环境抑制微生物的生长,因而导致微生物数量均呈现下降趋势。整个保温过程未检测出酵母菌,可能由于保温发酵是通过控制整个发酵过程较高的品温(38~45℃)以实现大分子物质的快速降解,而酵母菌通常适宜的生长温度在28~30℃,保温发酵环境不利于酵母菌的生长繁殖,因此通过传统的分离计数未能检测出酵母菌,这与曾灿伟[15]、沈芳等[16]的研究结果相一致。
老福无可奈何地说:“好,这次就听您的,等您出院了吧。以后别再给我找这种事了,我不是心理医生,没工夫老陪他们聊天。”
2.2 甜面酱保温发酵过程中优势菌种的分离与鉴定
2.2.1 霉菌的分离与鉴定
由2.1试验结果可知,霉菌主要是在制曲阶段大量存在,保温发酵的初期主要是通过其分泌的各种酶类起作用,降解原料中的大分子物质。从不同发酵时间段的甜面酱酱醪中,分离出4株典型霉菌菌株,经形态学初步鉴定为米曲霉、黑曲霉以及根霉,其形态学鉴定结果见表1。
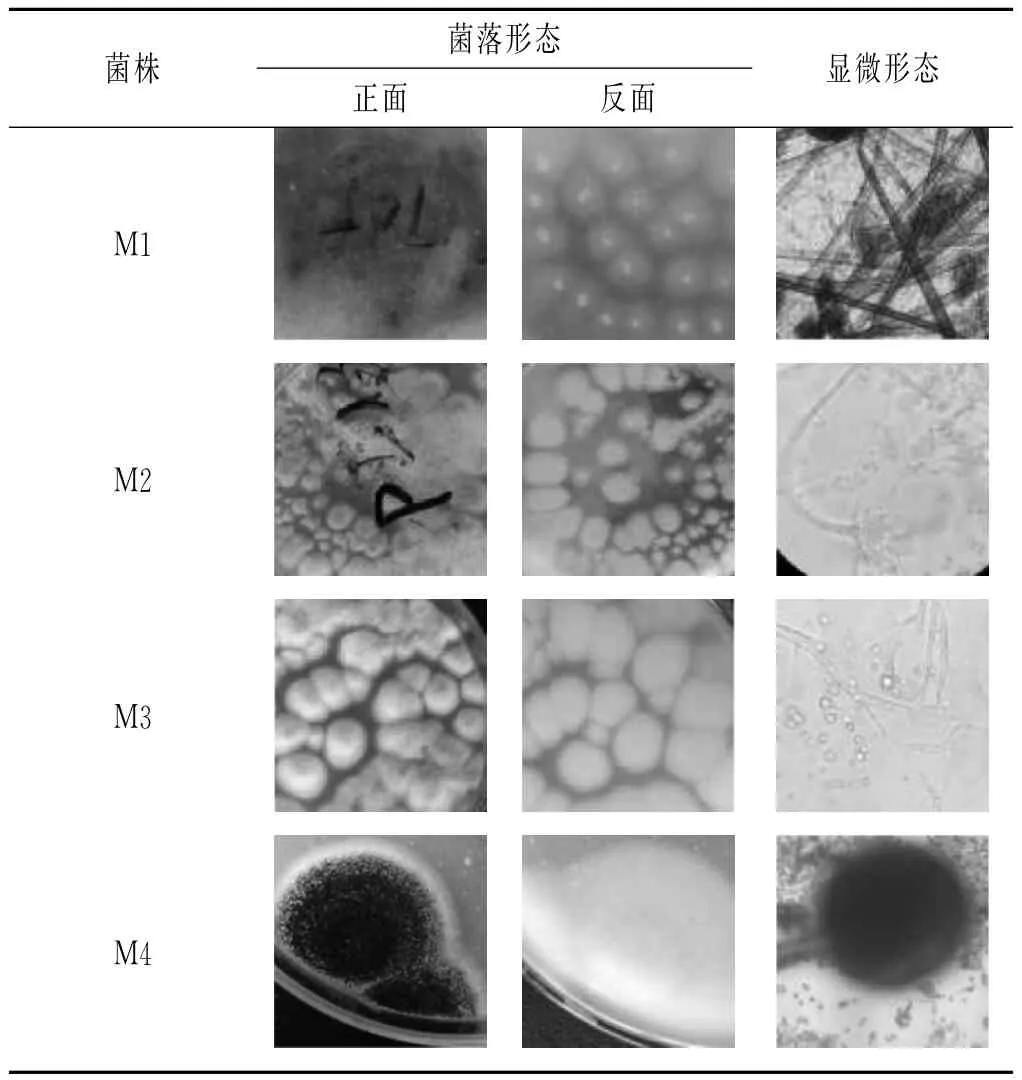
表1 甜面酱中分离的霉菌形态观察Table 1 The result of morphologic observation of moulds separated from sweet flour paste
由表1可知,M1号菌株,菌落疏松,生长繁殖较快,菌落初期呈现白色,后变为黑褐色,与基质相接处假根发达,分枝多。显微镜下观察,孢子囊呈球形,分生孢子呈椭圆形且为黄褐色,初步鉴定为根霉属。M2,M3号菌落质地疏松,初为白色、黄色,后变为褐色至淡绿褐色。显微镜下观察,分生孢子头呈放射状,顶囊近似球形,初步鉴定为米曲霉属。M4号菌株菌落最初为白色,形态近似圆形,表面粗糙,呈粉状,菌丝为白色,孢子为黑色,在PDA培养基上正面为黑色,背面为白色。显微镜下观察,分生孢子头的顶囊近似球形,小梗双层,第一层粗大,第二层相对短小,呈放射排列,布满整个顶囊,呈现黑色,顶端有链形孢子,初步鉴定为黑曲霉属。
2.2.2 细菌的分离与鉴定
从不同发酵时间段的甜面酱酱醪中,分离出5株典型细菌菌株。经微生物形态学以及生理生化鉴定,初步确定有2株细菌为芽孢杆菌属,其余3株分别为假单胞菌菌属、链球菌属及德克斯氏菌属。细菌菌落及个体形态观察鉴定结果见表2,细菌部分生理生化试验测定结果见表3。

表2 甜面酱中分离的细菌形态观察Table 2 The result of morphologic observation of bacteria separated from sweet flour paste
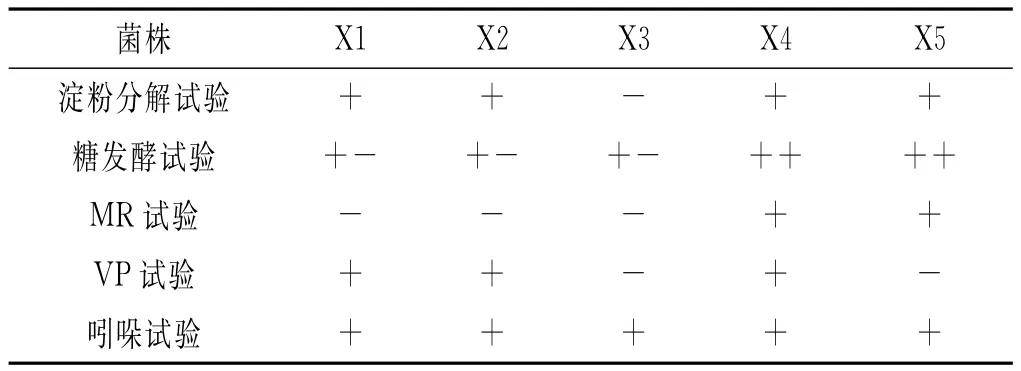
表3 细菌生理生化试验结果Table 3 The result of physiological and biochemical test
由表2和表3可以初步判定X1和X3为芽孢杆菌属,X2号菌株为假单胞菌属,X4号菌株为链球菌属,X5号菌株为德克斯氏菌属。
2.3 甜面酱保温发酵过程中优势菌种的生理效价测定结果
2.3.1 霉菌生理效价测定结果
2.3.1.1 霉菌产蛋白酶及糖化酶能力比较
不同菌株产蛋白酶及糖化酶活力大小测定结果见图2。
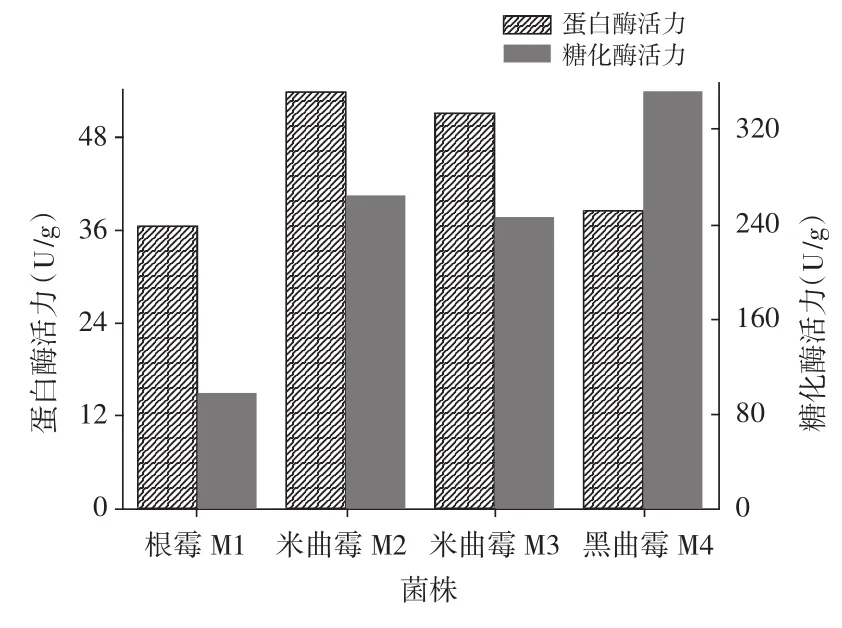
图2 霉菌产蛋白酶及糖化酶能力的比较Fig.2 Comparation on capacity of producing protease and glucoamylase of moulds
由图2可知,霉菌在传统酱类酿制过程中的主要作用是分泌多种酶类,包括蛋白酶、糖化酶以及酯化酶等。在多种酶类的共同作用下,原料中的淀粉、蛋白等大分子物质被降解为还原糖、多肽等小分子物质,这些小分子进一步被分解代谢转化,构成甜面酱的主体呈香呈味物质。因此,通过测定蛋白酶活力及糖化酶活力作为衡量菌株质量优劣的一个重要标志。米曲霉产蛋白酶活力高于根霉及黑曲霉菌株所产蛋白酶活力,产糖化酶活力较高的菌株为黑曲霉。就产两种酶活能力大小而言,米曲霉及黑曲霉两者可以相互弥补不足,因而可考虑将两者混合应用于面酱的酿制过程中。
2.3.1.2 霉菌产毒素的测定结果
试验中分离而得的霉菌,考虑其有产黄曲霉毒素的可能[17,18],因此需对分离而得的霉菌菌株检测是否产毒素,从而确保菌株的安全性。采薄层色谱法检测是否存在黄曲霉毒素,结果见表4。

表4 霉菌产黄曲霉毒素情况Table 4 Aflatoxin production by moulds
由表4可知,从甜面酱中分离而来的4株霉菌均不产黄曲霉毒素,可以认为菌株具有使用安全性,能够作为生产用的安全菌株。
2.3.2 细菌生理效价测定结果
通过测定总酸及氨基态氮的含量来反映5株优势细菌的产酸以及产氨基态氮的能力大小,细菌发酵产酸以及产氨基态氮含量测定结果见图3。

图3 细菌产酸及氨基态氮能力的比较Fig.3 Comparation on capacity of producing acid and amino nitrogen of bacteria
由图3可知,甜面酱酿造过程中,细菌主要出现在发酵阶段,细菌利用霉菌产酶降解生成的小分子糖类以及氨基酸等生长发酵产酸和氨基酸等物质,这些物质又构成了酱类成品的风味成分以及营养成分。链球菌产酸及氨基态氮的能力优于其他菌株。有研究表明:链球菌属中的乳链球菌被广泛应用于食品生产领域[19]。可考虑将链球菌属菌株添加入保温发酵后期,以增加总酸以及氨基态氮的含量,达到提高甜面酱品质的目的。
3 结论
通过对甜面酱保温发酵过程的菌相进行初步分析,保温发酵前期微生物数量较多,随着发酵进行,酱醪pH降低,溶氧量下降,微生物大量死亡,中后期生物量维持在较低水平,在整个保温发酵过程中未检测出酵母的存在。在甜面酱保温发酵过程中,通过传统分离方式获得4株优势霉菌以及5株优势细菌,经初步鉴定,4株霉菌包括2株米曲霉、1株根霉以及1株黑曲霉;5株优势细菌分别为2株芽孢杆菌属、1株假单胞菌属、1株链球菌属以及1株德克斯氏菌属。对优势霉菌菌株生理效价测定结果显示:M2号米曲霉菌株产蛋白酶活力较高,黑曲霉菌株产糖化酶活力较高,通过检测霉菌不产黄曲霉毒素,证明菌株有安全使用性,因此在后期研究中可以考虑将两种菌株混合利用,弥补单一菌株酶活力的不足。细菌的生理效价检测结果表明:链球菌属菌株的产酸及氨基态氮能力强于其余4株菌,因而可考虑将链球菌属菌株添加入保温发酵后期,以增加总酸及氨基态氮含量,为提高甜面酱品质提供一定参考。
[1]冯治平,吴士业.酶促法甜面酱生产工艺条件研究[J].食品科学,2008,29(9):358-360.
[2]李萍萍,邓静,吴华昌,等.甜面酱自然发酵过程中理化指标及酶活动态变化研究[J].食品科技,2013(6):290-294.
[3]黄明泉,王璐,张璟琳,等.甜面酱的鲜味成分分析[J].现代食品科技,2015(2):285-293.
[4]沈萍,陈向东.微生物学实验[M].北京:北京高等教育出版社,2007:28-34.
[5]Yang J,Yin K,Tan X,et al.Isolation and characterization of microbes from Pericarpium citri reticulatae[J].Acta Microbiologica Sinica,2015,55(6):700-706.
[6]中国科学院.常见与常用真菌[M].北京:科学出版社,1978.
[7]罗雪云,刘宏道.食品卫生微生物检验标准手册[M].北京:中国标准出版社,1995.
[8]魏景超.真菌鉴定手册[M].北京:科学出版社,1973.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10]布坎南,吉本斯.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社,1984.
[11]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2014:618-619.
[12]SB/T 10317-1999,蛋白酶活力测定[S].
[13]陈建民,张雪辉,杨美华,等.黄曲霉毒素检测方法研究进展[J].中国中药杂志,2005,30(24):1890-1894.
[14]刘绍.食品分析与检验[M].武汉:华中科技大学出版社,2011.
[15]曾灿伟.甜面酱酿制过程中的菌相分析及风味成分研究[D].武汉:湖北工业大学,2009.
[16]沈芳,吴华昌,邓静,等.四川甜面酱不同发酵工艺中的菌相分析[J].中国调味品,2013,38(6):41-45.
[17]Chang P K,Scharfenstein L L,Solorzano C D,et al.High sequence variations in the region containing genes encoding a cellular morphogenesis protein and the repressor of sexual development help to reveal origins of Aspergillus oryzae[J].Int J Food Microbiol,2015,200:66-71.
[18]Ling Li,Ye Zheng-mao,Wang Su-yuan,et al.Isolation and study on the aflatoxin genes of aflatoxin-producing fungi in paprika samples in Chengdu[J].Journal of Sichuan University(Medical Science Edition),2015,46(5):684-687.
[19]倪珊珊,黄丽英.乳酸链球菌素和乳酸乳球菌在食品工业中的应用[J].食品工业,2015,36(11):244-247.
Research on Microorganism in Sweet Flour Paste during the Insulation Fermentation
YE Bi-xia,ZUO Yong*,LAI Lin,CHEN Le-chun
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
The number and species of microorganisms and the physiological potency of the main microorganisms are analyzed by the traditional methods of isolation and identification.The results show that the number of bacteria increases at the early storage time and then decreases,while the number of moulds gradually decreases,yeasts are not detected in sweet flour paste during the insulation fermentation.Four kinds of main moulds and five kinds of bacteria are acquired by traditional separation method,which include 2strains of Aspergillus oryzae,1strain of Aspergillus niger,1strain of Rhizopus sp.,2strains of Bacillus sp.,1strain of Pseudomonas sp.,1strain of Streptococcus sp.and 1strain of Dexter Escherichia sp.by preliminary identification.Physiological potency test results show that the ability to produce acid and amino nitrogen of Streptococcus sp.is the strongest,and the yield of acid and amino nitrogen is 1.2%and 0.43% respectively.The capacity of producing glucoamylase of Aspergillus nigeris relatively strong,and the ability is up to 352.33U/g.The ability to produce protease of Aspergillus oryzae M2is quite strong,approaching to 53.7U/g.
sweet flour paste;insulation fermentation;microorganism;physiological potency
TS264.24
A
10.3969/j.issn.1000-9973.2017.04.017
1000-9973(2017)04-0080-05
2016-10-25 *通讯作者
四川省教育厅重大培育项目(15CZ0022);2015大学生创新创业训练计划项目(y2015011)
叶碧霞(1991-),女,硕士,研究方向:发酵工程;左勇(1972-),男,教授,主要从事发酵食品方面的研究。
