传统豆瓣辣酱发酵过程细菌群落演替与发酵过程的对应关系
2017-04-20于松峰郑宇杨帅谢晓林王敏
于松峰,郑宇,杨帅,谢晓林,王敏
(天津科技大学生物工程学院工业发酵微生物教育部重点实验室,天津 300457)
传统豆瓣辣酱发酵过程细菌群落演替与发酵过程的对应关系
于松峰,郑宇,杨帅,谢晓林,王敏*
(天津科技大学生物工程学院工业发酵微生物教育部重点实验室,天津 300457)
传统豆瓣辣酱发酵采用开放式自然发酵工艺,发酵过程微生物群落组成复杂,完成蛋白质、糖类、脂肪等大分子的降解,并代谢产生多种风味物质,赋予豆瓣辣酱酱酯香浓郁、味鲜辣醇和的独特口感。文章对宁夏豆瓣辣酱发酵过程中细菌群落组成和发酵过程主要参数进行了分析,利用典范对应分析(CCA)的方法对宁夏豆瓣辣酱发酵过程中微生物和发酵过程主要参数的相关性进行了研究。利用变性梯度凝胶电泳(PCR-DGGE)技术分析了豆瓣辣酱长达2年发酵时间细菌群落组成的变化,共检测出细菌22种,包括乳杆菌属3种,明串珠菌属2种,魏斯式菌属3种,芽孢杆菌属3种,克雷伯菌属2种等,细菌多样性呈先减少后增加的趋势。
豆瓣辣酱;传统发酵食品;变性梯度凝胶电泳;微生物群落;典范对应分析
中国传统豆瓣辣酱是以脱壳的蚕豆瓣、辣椒、食盐、面粉为主要原料,经制曲、微生物发酵而制成的传统调味酱,它以色泽油润红亮、酱酯香浓郁、味鲜辣醇和、体态粘稠绒实等特点而著称,能够增加菜肴的色、香、味、形,从而受到广大消费者的喜爱[1]。豆瓣辣酱生产普遍采用传统的开放式发酵工艺,经甜瓣子制作、辣椒胚制作及混合后发酵生香三个重要阶段完成豆瓣辣酱的发酵,酱醅颜色逐渐由白色变为深褐色。发酵过程微生物群落消长演替,完成了蛋白质、糖类、脂肪等大分子降解,不仅提高了产品的营养价值,还形成了产品特有的风味和滋味。豆瓣辣酱发酵过程有乳酸菌、芽孢杆菌属、嗜盐四联球菌、鲁氏酵母等多种微生物参与其发酵过程[2-5]。传统豆瓣辣酱微生物菌群主要采用实验室分离分析的方法,近年来,随着科学技术的发展,PCR-DGGE等分子生物学技术常应用于传统发酵食品分析微生物群落组成分析[6,7]。采用DGGE技术不需要对样品微生物进行培养,具有可靠性高、速度快、重复性强、能够弥补传统方法分析微生物群落的不足和局限性等多种优点。
根据GB/T 20560-2006《地理标志产品郫县豆瓣》要求,pH、总酸、氨基酸态氮和食盐是其主要理化指标,对产品的品质有较大的影响。鲜、咸是豆瓣辣酱的重要指标,其指标一般用氨基酸态氮和氯化钠含量表示。宁夏豆瓣辣酱不用达到郫县豆瓣要求,但其是主要指标。豆瓣辣酱生产过程中的成分变化与微生物菌群的变化密不可分[8]。发酵过程中微生物在所产酶的作用下分解原料生成脂肪酸、有机酸和氨基酸等,并代谢产生乳酸、酒精以及多种风味物质[9],对酱醅体系pH值和产品风味产生影响。微生物群落组成决定了发酵过程中化合物的组成和变化,反过来盐度、水分等环境因子对微生物的生长也有重要影响[10]。
本文采用DGGE技术对宁夏豆瓣辣酱发酵过程细菌菌群演替进行分析,在此基础上首次采用CCA方法分析微生物群落组成与发酵过程主要参数之间的关系,研究结果将为进一步理解传统豆瓣辣酱发酵机理奠定基础。
1 材料与方法
1.1 实验材料
从生产车间分别采集豆瓣辣酱发酵7,90,180, 270,390,720天的样品,自发酵池表面30cm处五点法取样,混匀装入无菌瓶中,6个阶段的样品依次标记为#1,#2……#6,每个样品3个平行。采集后的样品立即放入冰盒中运回实验室,保存于4℃冰箱中。
1.2 实验方法
1.2.1 豆瓣辣酱发酵过程主要参数变化
采集传统豆瓣辣酱样品,对国标中注明的pH、总酸、氨基酸态氮以及食盐、水分等参数进行测定,分析其在2年发酵期间的变化。
1.2.2 豆瓣辣酱发酵过程细菌群落组成分析
1.2.2.1 样品总DNA的提取和细菌16SrDNA V3区的扩增
取豆瓣辣酱样品10.0g,放入50mL的无菌离心管中,加入一定量的PBS无菌水,漩涡振荡5~10min,然后用灭过菌的纱布过滤,2000r/min离心2min,取上清液,8000r/min离心15min,弃去上清液,用PBS洗涤沉淀,8000r/min离心15min,弃去上清液,收集菌体[11]。
采用深加工食品DNA提取试剂盒按照说明书提取豆瓣辣酱样品的基因组。以提取豆瓣辣酱样品的宏基因组DNA为模板,进行细菌16SrDNA V3区PCR扩增,引物为338f-GC和518r[12]。PCR反应体系(50μL):上下游引物各0.2μmol/L,0.2mmol/L dNTPs,5μL 10×Ex Taq buffer,0.025UEx Taq HS DNA聚合酶,1μL DNA(<500ng),补ddH2O至50μL。
PCR扩增条件:94℃预变性5min;20个循环(每个循环退火温度降0.5℃):94℃变性1min,62~52℃退火45s,72℃延伸1min;15个循环:94℃变性1min,52℃退火45s,72℃延伸1min;72℃终延伸10min。PCR产物用3%(W/V)的琼脂糖进行凝胶电泳检测。
1.2.2.2 细菌群落组成分析
采用Bio-Rad Dcode突变检测系统,对样品提取DNA的PCR产物进行DGGE检测。丙烯酰胺凝胶浓度为8%,细菌16SrDNA片段的变性胶浓度为30%~60%,待胶凝固后,将胶板放入电泳装置中,加入1×TAE电泳缓冲液,设置电泳温度为60℃,每个加样孔点样30μL,80V电泳11h[13]。
电泳结束后,将胶卸下放入Dugreen染色液中染色30min,用凝胶成像仪观察DGGE胶,并拍照。
在紫外照射下,用灭菌刀进行切割回收目的条带,加入50μL无菌水4℃过夜,然后以其为模板进行无GC-发卡的PCR扩增。PCR扩增程序:94℃预变性5min;30个循环:94℃变性1min,55℃退火45s,72℃延伸1min;72℃终延伸10min。将PCR产物送至金唯智生物科技有限公司进行测序。所得序列在GeneBank数据库中进行检索和同源性比较。
1.2.2.3 发酵过程细菌多样性分析
采用软件Quantity One读取DGGE图谱上不同条带的光密度值,并进行UPMGA(非加权组平均算法)聚类分析。并根据DGGE数字化后的数据计算微生物多样性指数,包括Berger-Parker指数(d)、Mar galef指数(dMa)、Simpson指数(D)、Shannon指数(H')、Pielou指数(Je)。其中Berger-Parker指数(d)用来表示物种的优势度,Mar galef指数(dMa)用来表示物种的丰富度,Simpson指数(D)用来度量物种多样性的概率,Shannon指数(H')用来说明群落多样性的高低,而Pielou指数(Je)用来表示群落的均匀程度,其计算公式[14,15]见表1。
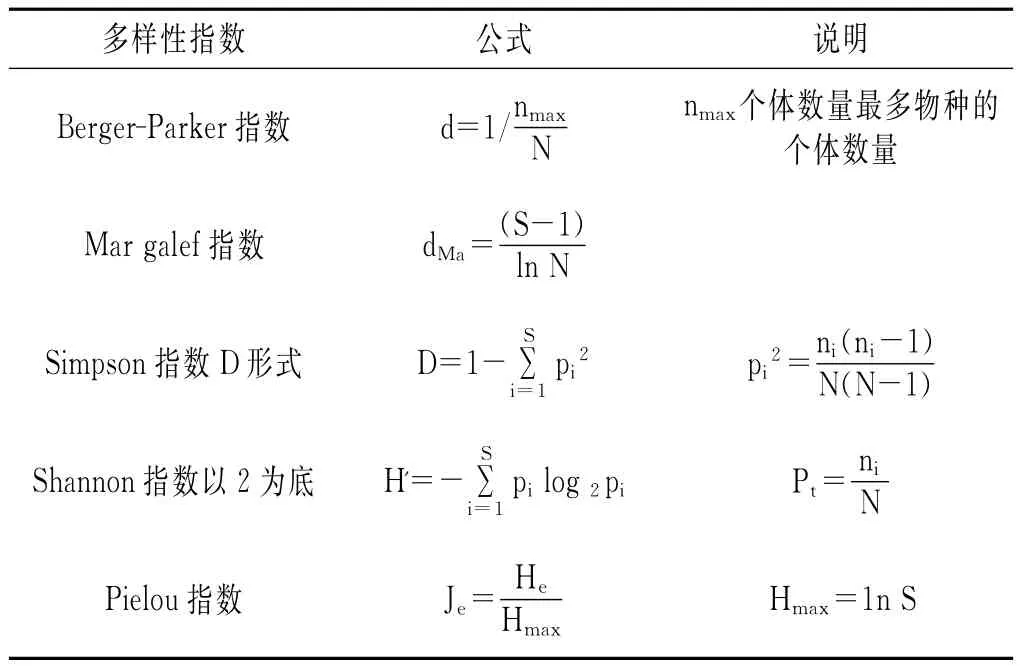
表1 多样性指数计算公式Table 1 The caculation formula of diversity indexes
1.2.3 典范对应分析
建立两个矩阵,微生物丰度矩阵和主要参数矩阵,矩阵行为发酵时间,列为物种。微生物丰度数据统一使用百分比,不同主要参数之间如果存在单位不同的情况需先将数据标准化处理以消除不同量纲之间的影响,再利用Canoco for Windows 4.5用于典范对应分析,数据标准化采用SPSS 19.0。
1.3 分析方法
称取约10.0g已研磨均匀的样品置于100mL小烧杯中,加入50mL水,充分搅拌移入容量瓶中定容至100mL,混匀过滤得到样品稀释液备用。总酸、氨基态氮和食盐根据GB/T 5009.40-2003中规定的方法进行测定。
1.3.1 水分含量的测定
采用直接干燥法,参照GB 5009.3-2010规定的方法测定。
1.3.2 pH值的测定
使用pH计测定[16]:称取1.0g左右样品于25mL小烧杯中,加入蒸馏水10mL,用玻璃棒充分搅拌,静置10~15min,测量上清液的pH值,重复3次求平均值。
2 结果与分析
2.1 宁夏豆瓣辣酱发酵过程主要参数变化规律
对豆瓣辣酱样品的pH、总酸、氨基酸态氮、食盐和水分进行了分析。豆瓣辣酱发酵过程曲线见图1。
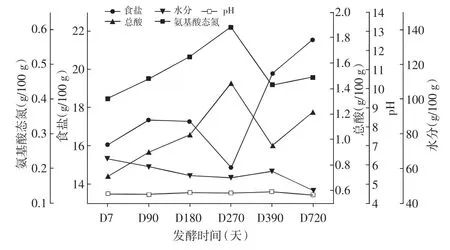
图1 豆瓣辣酱发酵过程曲线Fig.1 The fermentation process curve of spicy bean paste
由图1可知,在豆瓣辣酱发酵过程中水分含量呈现逐渐降低的趋势,与起始发酵相比,发酵结束时水分减少了28.48%。由于水分的挥发,食盐含量呈现逐渐增加的趋势。食盐浓度是豆瓣辣酱发酵过程的重要参数,一定的盐度可以抑制污染微生物的生长,一些耐盐微生物能够生长代谢,完成发酵过程,因此发酵过程需要根据盐度及水分变化补充一定量的盐水,从而保证发酵顺利进行[17]。发酵过程豆瓣辣酱的总酸含量在前270天逐渐上升,最高达到(1.44±0.05)g/100g,随后略有下降。pH值在整个豆瓣辣酱发酵过程中维持在4.43~4.61之间,变化趋势与总酸的变化趋势一致。氨基酸是豆瓣辣酱最主要的一类风味物质,是评判豆瓣辣酱质量的重要指标[18,19]。在豆瓣辣酱发酵阶段,氨基酸态氮含量变化趋势呈现出先增加后降低的趋势,在发酵270天时其含量达到最高(0.61±0.09)g/100g,此后维持在0.44~0.46g/100g之间。
2.2 发酵过程细菌群落组成分析
2.2.1 发酵过程细菌群落DGGE分析
对豆瓣辣酱发酵过程不同发酵时期的样品进行DGGE分析,不同位置的条带代表不同种属的细菌,条带的荧光强度则反映该细菌的丰富度。条带粗黑,则该种细菌的相对浓度较高,反之则较小,结果见图2。
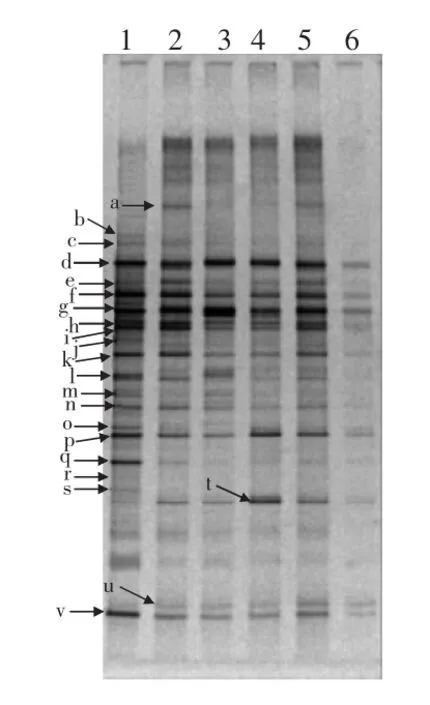
图2 宁夏豆瓣辣酱发酵过程中细菌群落DGGE分析图谱Fig.2 DGGE profiles of bacterial community during fermentation process of Ningxia spicy bean paste
共检测到22个条带,将其切胶回收后扩增测序,PCR产物测序结果比对见表2。
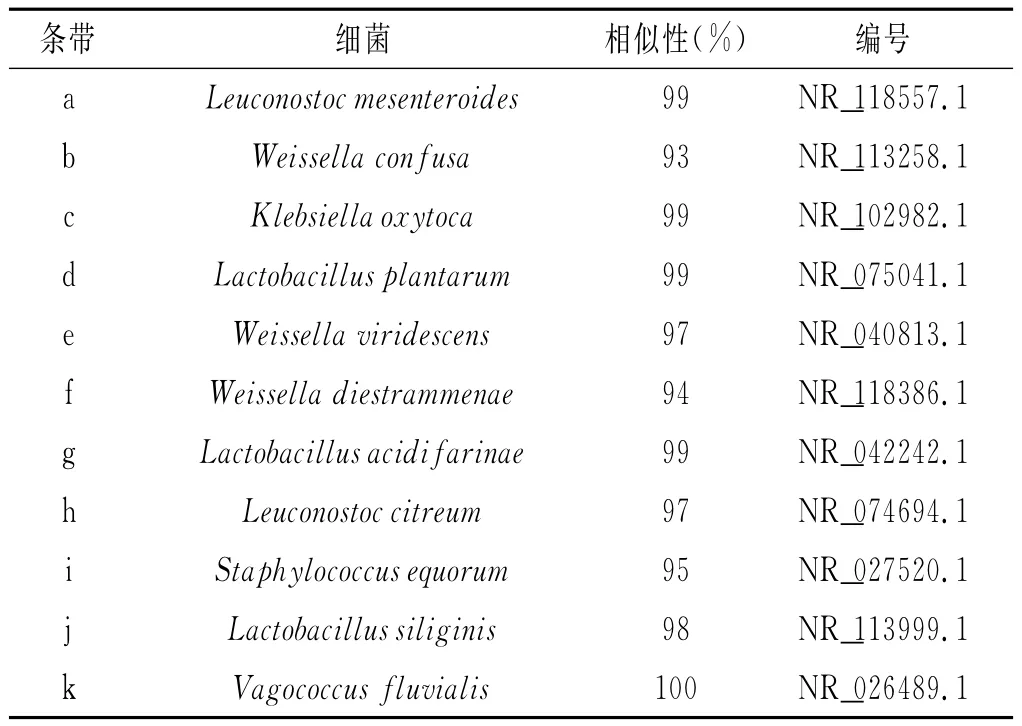
表2 细菌群落组成分析Table 2 Analysis of the bacterial community composition
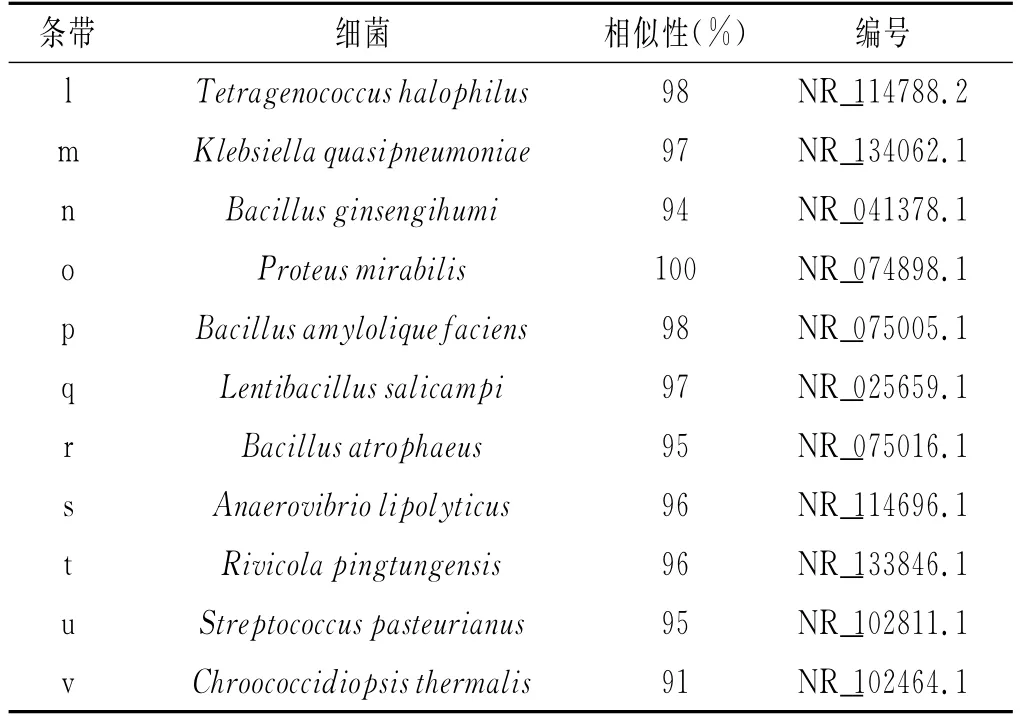
续 表
2.2.2 细菌DGGE图谱聚类分析
根据DGGE图谱数字化后的数据,采用UPMGA算法对豆瓣辣酱发酵过程中微生物群落DGGE指纹图谱进行聚类分析,结果见图3。
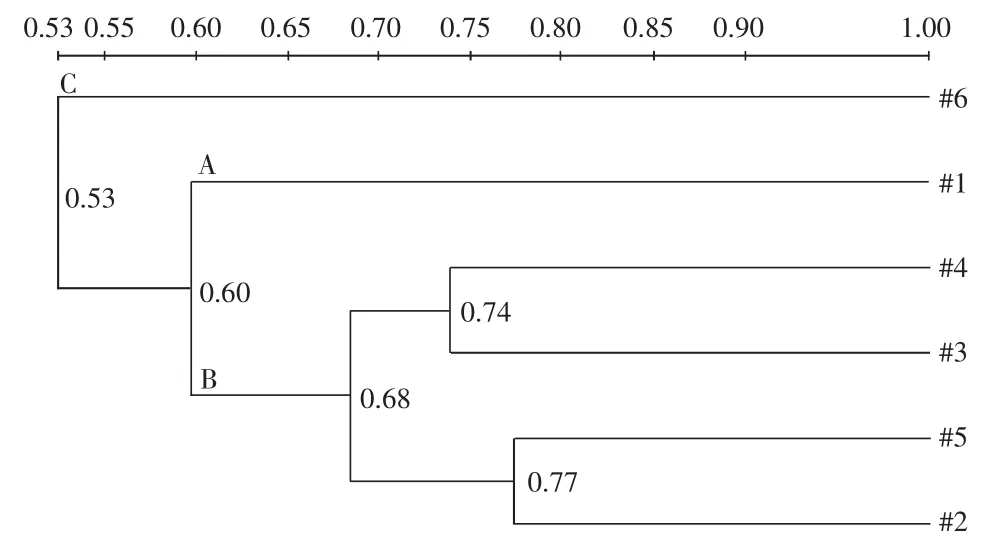
图3 基于细菌DGGE图谱的UPMGA聚类分析Fig.3 Cluster analysis of bacterial community based on DGGE profiles
由图3可知,随着豆瓣辣酱发酵的进行,豆瓣辣酱发酵细菌群落相似度分为豆瓣辣酱发酵7天(#1),豆瓣辣酱发酵90,180,270,390天(#2,#3,#4,#5),豆瓣辣酱发酵720天(#6)三类。豆瓣辣酱发酵720天(#6)和其他发酵阶段的样品相似性为0.53,说明豆瓣辣酱发酵720天微生物组成与其他阶段差异较大。随着发酵的进行,营养物质被微生物大量利用,同时豆瓣辣酱样品中水分含量低、食盐含量高,使得大部分微生物不能在此环境生长。豆瓣辣酱发酵中期样品相似性较高,表明样品之间的微生物群落结构相似。
2.2.3 细菌群落多样性分析
结合DGGE图谱的数据,对宁夏豆瓣辣酱发酵过程中细菌群落多样性进行了分析,结果见图4。
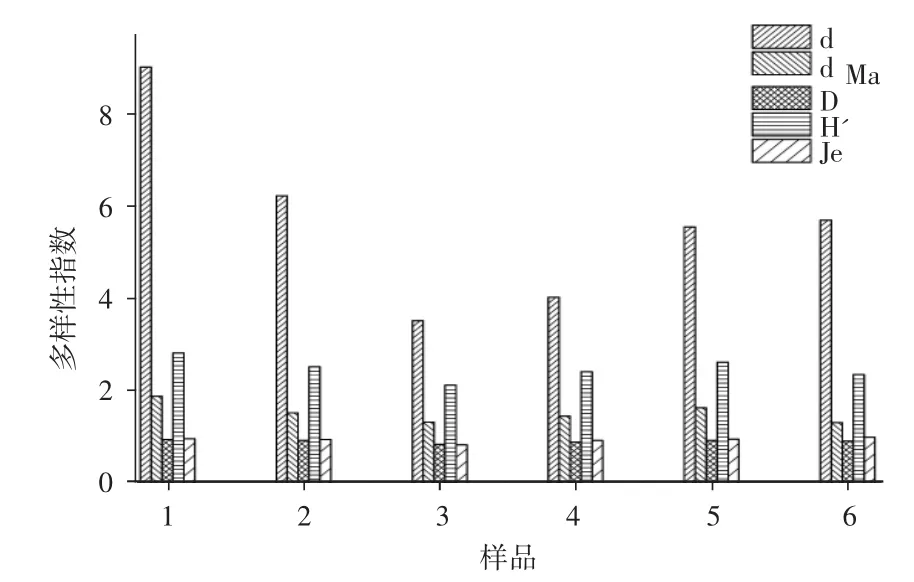
图4 细菌群落组成多样性分析Fig.4 Diversity analysis of bacterial community composition
由图4可知,豆瓣辣酱发酵初期(7,90天)的物种优势度指数(d)和物种丰富度指数(dMa)相比豆瓣辣酱发酵后期较高。分析表明:Shannon指数(H')和物种丰富度指数(dMa)变化趋势相同,豆瓣辣酱发酵过程主要为乳酸菌和芽孢杆菌属,其种类和数量先减少后增加,多样性指数(H')和丰富度指数(dMa)先降低后升高。物种均匀度指数(Je)在宁夏豆瓣辣酱发酵过程差异不大。
由于豆瓣辣酱发酵初期是甜瓣子发酵结束与辣椒胚发酵结束的样品混合后进行发酵,甜瓣子阶段和辣椒胚阶段的微生物被带进豆瓣辣酱发酵体系,因此发酵初期的微生物种类较为丰富。导致豆瓣辣椒酱发酵过程中微生物多样性发生变化的主要原因是豆瓣辣酱发酵过程中水分、食盐含量及营养物质的变化。发酵初期豆瓣辣酱中含有丰富的淀粉类等营养物质,且食盐含量较低,随着发酵的进行,营养物质逐渐被微生物利用,食盐含量逐渐升高,从而影响了微生物群落的组成及演替。
2.3 CCA对应分析微生物群落与主要参数之间的对应关系
豆瓣辣酱发酵过程中微生物的种类和数量在不断发生着变化,食盐、总酸和氨基态氮含量的变化影响着微生物的消长。以细菌群落组成作为物种数据,以发酵过程中主要参数数据作为环境变量,进行了CCA对应分析,从微生物生态学的角度,解析微生物群落与主要参数之间的对应关系。

表3 CCA分析信息Table 3 Analysis information of CCA
由表3可知,排序结果能够较好地反映微生物组成与主要参数的相互关系。
CCA对应分析微生物群落与主要参数的对应关系图谱见图5,微生物随豆瓣辣酱发酵的进行分为A,B,C,D 4个区域。A区域包括了豆瓣辣酱发酵7天(#1)的样品,该区域分布的细菌只出现在发酵初期(7天),且与各主要参数呈负相关关系,主要的细菌为Weissella confusa(b),Klebsiella oxytoca(c),Lactobacillus siliginis(j),Klebsiella quasipneumoniae(m),Bacillus atrophaeus(r),Anaerovibrio lipolyticus(s)。B区域只有豆瓣辣酱发酵90天(#2)的样品,分布的细菌为Staphylococcus equorum(i),Vagococcus fluvialis(k),Bacillus amyloliquefaciens(p),Streptococcus pasteurianus(u),Chroococcidiopsis thermalis(v),C区域包括了豆瓣辣酱发酵180天(#3)、270天(#4)的样品,分布的细菌为Leuconostoc mesenteroides(a),Lactobacillus plantarum(d),Weissella diestrammenae(f),Lactobacillus acidifarinae(g),Leuconostoc citreum(h),Rivicola pingtungensis(t),B和C区域分布的细菌是豆瓣辣酱发酵过程中的优势菌。
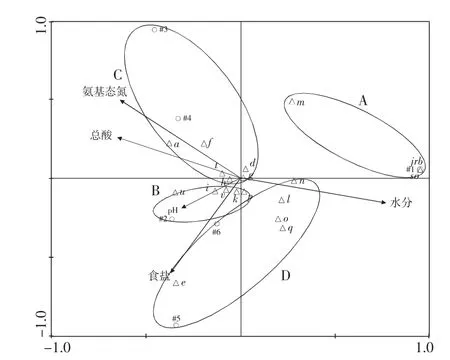
图5 CCA分析微生物群落与主要参数Fig.5 CCA analysis of bacterial community and main parameters
由图5可知,B和C区域的细菌对氨基态氮、总酸和pH贡献较大,且B区域的细菌对氨基态氮和总酸贡献较大,C区域的细菌对pH贡献较大。总酸和氨基态氮在一定程度上能够反映豆瓣辣酱的质量,在发酵过程中受到微生物影响较大。D区域分布的细菌与食盐和水分呈正相关关系,说明水分和食盐含量的变化对D区域分布的细菌影响较大。D区域的细菌包括豆瓣辣酱发酵390天(#5)和豆瓣辣酱发酵720天(#6)的样品,分布的细菌为Weissella viridescens(e),Tetragenococcus halophilus(l),Bacillus ginsengihumi(n),Proteus mirabilis(o),Lentibacillus salicamp(q)。
3 结论
采用PCR-DGGE方法分析了宁夏豆瓣辣酱在2年发酵期间微生物群落组成及主要参数的变化。在发酵过程中检测到22种细菌,乳酸菌是主要的优势菌,其相对丰度高达40.91%。随着发酵的进行,氨基酸态氮呈先增加后降低的趋势,CCA对应分析结果表明:发酵过程中对总酸和氨基酸态氮贡献较大的细菌依次为Leuconostoc mesenteroides,Weissella diestrammenae,Vagococcus fluvialis,Bacillus amyloliquefaciens,Lactobacillus plantarum,Leuconostoc citreum,Lactobacillus acidifarinae。食盐和水分与Weissella viridescens,Lentibacillus salicampi,Bacillus ginsengihumi,Tetragenococcus halophilus的浓度变化相关。
[1]韩永奇.关于提升郫县豆瓣品牌力的市场观察与思考[J].中国调味品,2009,34(6):115-117.
[2]Kim T W,Lee J H,Park M H,et al.Analysis of bacterial and fungal communities in Japanese and Chinese fermented soybean pastes using nested PCR-DGGE[J].Current Microbiology,2010,60(5):315-320.
[3]Wu J R,Zhang J C,Shi P,et al.Bacterial community involved in traditional fermented soybean paste Dajiang made in northeast China[J].Annals of Microbiology,2013,63(4):1-5.
[4]Zhao J,Dai X,Liu X,et al.Changes in microbial community during Chinese traditional soybean paste fermentation[J].International Journal of Food Science &Technology,2009,44(12):2526-2530.
[5]Nam Y D,Lee S Y,Lim S I.Microbial community analysis of Korean soybean pastes by next-generation sequencing[J].International Journal of Food Microbiology,2012,155(1-2):36-42.
[6]Park E J,Chun J,Cha C J,et al.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J].Food Microbiology,2012,30(1):197-204.
[7]Tanaka Y,Watanabe J,Mogi Y.Monitoring of the microbial communities involved in the soy sauce manufacturing process by PCR-denaturing gradient gel electrophoresis[J].Food Microbiology,2012,31(1):100-106.
[8]赵建新.传统豆酱发酵过程分析与控制发酵的研究[D].无锡:江南大学,2011.
[9]康明官.中外著名发酵食品生产工艺手册[M].北京:化学工业出版社,2001.
[10]杜宏福,聂志强,刘贤,等.山西老陈醋发酵过程中细菌群落组成与有机酸变化的关系研究[J].中国调味品,2015,40(7):26-31.
[11]邹艳玲.后熟期郫县豆瓣细菌多样性分析及产品护色研究[D].成都:西华大学,2013.
[12]Nie Z,Zheng Y,Wang M,et al.Exploring microbial succession and diversity During solid-state fermentation of Tianjin Duliu mature vinegar[J].Bioresource Technology,2013,148(8)325-333.
[13]Haruta S,Ueno S,Egawa I,et al.Succession of bacterial and fungal communities during a traditional pot fermentation of rice vinegar assessed by PCR-mediated denaturing gradient gel electrophoresis[J].Food Microbiol,2006,109(1-2):79-87.
[14]Shannon C E.A mathematical theory of communication[M].New York:McGraw-Hill,1974:53-55.
[15]孔凡洲,于仁成,徐子钧,等.应用Excel软件计算生物多样性指数[J].海洋科学,2012,36(4):57-62.
[16]刘永琪.豆瓣酱发酵的研究[D].广州:华南理工大学,2014.
[17]张忠刚.永丰辣酱自然发酵的菌相与成分分析及人工接种发酵工艺研究[D].长沙:湖南农业大学,2007.
[18]Jiang J J,Zeng Q X,Zhu Z W,et al.Chemical and sensory changes associated Yu-lu fermentation process-a traditional Chinese fish sauce[J].Food Chemistry,2007,104(4):1629-1634.
[19]Hjalmarsson G H,Park J W,Kristbergsson K.Seasonal effects on the physicochemical characteristics of fish sauce made from capelin(Mallotus villosus)[J].Food Chemistry,2007,103(2):495-504.
Analysis of the Relationship between Bacterial Community Succession and Fermentation Process of Chinese Traditional Spicy Bean Paste
YU Song-feng,ZHENG Yu,YANG Shuai,XIE Xiao-Lin,WANG Min*
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
Chinese traditional spicy bean paste is produced by traditional spontaneous fermentation technology.The complex micro-organism community completes the degradation of protein,carbohydrate,fat and other substances and produces the unique taste of spicy bean psate.In this research,the relationship between the composition and succession of bacterial community and the parameters during fermentation process of spicy bean paste are analyzed by canonical correspondence analysis(CCA).22species of bacteria,containing 3 Lactobacillus,2 Leuconostoc,3 Weissella,3 Bacillus,2 Klebsiella,etc.are detected by using the method PCR-DGGE(deformation gradient gel electrophoresis).The bacterial diversity decreases at the early stage of fermentation,and then increases.
spicy bean paste;traditional fermented food;denaturing gradient gel electrophoresis;microbial community;canonical correspondence analysis
TS201.5
A
10.3969/j.issn.1000-9973.2017.04.012
1000-9973(2017)04-0053-06
2016-10-20 *通讯作者
国家高技术研究发展计划(863计划)课题(2013AA102106);国家重点研发计划(2016YFD0400505)
于松峰(1990-),男,硕士,研究方向:传统发酵食品发酵技术;王敏(1971-),女,教授,博士生导师,研究方向:食品发酵微生物功能分析与发酵技术。
