水通道蛋白在小鼠小肠中的表达和定位
2017-04-20张凯琦苏维恒曲桂娟马红霞
张 迪 , 张凯琦 , 苏维恒 , 赵 元 , 马 馨 , 龚 倩 , 曲桂娟 , 马红霞
(1.吉林农业大学动物科学技术学院,吉林长春130118; 2.吉林大学生命科学学院,吉林长春130012)
水通道蛋白在小鼠小肠中的表达和定位
张 迪1, 张凯琦1, 苏维恒2, 赵 元1, 马 馨1, 龚 倩1, 曲桂娟1, 马红霞1
(1.吉林农业大学动物科学技术学院,吉林长春130118; 2.吉林大学生命科学学院,吉林长春130012)
探明水通道蛋白在小鼠小肠中的表达及定位,为研究小肠水转运过程中的细胞和分子机制奠定理论基础。本文运用RT-PCR和免疫印迹技术检测小鼠十二指肠、空肠和回肠中水通道蛋白的表达情况,结果显示,AQP3在小鼠空肠中存在基因和蛋白表达,AQP4在小鼠回肠中存在基因和蛋白表达。为进一步明确这两种水通道蛋白在小肠中的表达位置,通过免疫组织化学的方法进一步证实AQP3主要表达在小鼠空肠黏膜上皮细胞,而AQP4主要表达在小鼠回肠隐窝细胞基底膜。
水通道蛋白 ; 小肠 ; 小鼠 ; 水转运
肠道是机体重要的水盐代谢器官,人体每天大约有9 L液体进入到消化道中,其中2 L来自日常饮食,另外7 L则来自于唾液腺、胃腺、胰腺、小肠腺以及肝细胞分泌的胆汁等消化液。这9 L液体84%被小肠吸收,16%被结肠吸收,仅有100~200 mL的水随着粪便排出体外[1]。由此可见,小肠对水的转运在维持机体水盐平衡中发挥着重要作用。而水通道蛋白(Aquaporin,AQP)是广泛存在于原核和真核细胞膜上快速转运水分子的特异性孔道蛋白,在机体许多器官的体液转运过程中发挥重要作用[2]。以往对肠道中水通道蛋白的研究主要集中在人和大鼠的结肠[3-4],而对小鼠小肠中水通道的表达和功能研究却确鲜有报道。本文通过RT-PCR、免疫印迹和免疫组织化学等方法,明确了小鼠小肠水通道蛋白的表达类型及表达位置,为进一步揭示水通道蛋白在小肠水转运过程中的作用提供了理论依据。
1 材料与方法
1.1 动物与试剂 成年雄性昆明系小鼠,平均体重20g±3g,由吉林大学白求恩医学院实验动物中心提供(动物许可证编号:SCXK2007-0003)。总RNA提取试剂盒,购自于TaKaRa公司;SuperScriptTMII逆转录试剂盒及Taq酶,购自Invitrogen公司;兔抗小鼠AQP3和AQP4抗体及辣根过氧化物酶标记的羊抗兔抗体(HRP-Goat Anti-rabbit IgG),购自Sigma公司;免疫组化试剂盒,购自北京中杉金桥生物技术有限公司;引物由上海生工生物工程技术服务有限公司合成。
1.2 试验方法
1.2.1 总RNA的提取及cDNA的合成 分别取小鼠十二指肠、空肠、回肠各段组织,用高速匀浆器进行匀浆,按照TaKaRa公司Total RNA提取试剂盒提取总RNA。1%非变性琼脂糖凝胶电泳后,经溴化乙锭染色,凝胶成相仪扫描后观察结果,根据28S rRNA、18S rRNA、5S rRNA的亮度评价RNA是否有降解。测量其OD值并记录RNA浓度。用Invitrogen的SuperScriptTMII逆转录试剂盒合成cDNA。
1.2.2 RT-PCR 根据GenBank中公布的小鼠AQPs基因序列,选择其保守区利用Peimer5.0软件进行引物设计。其特异性引物用Invitrogen的SuperScriptTMII试剂盒,按说明书提供的方法进行总RNA的逆转录反应合成cDNA。以此cDNA为模板,用小鼠AQPs特异性引物对cDNA进行PCR扩增,扩增产物约为300 bp~500 bp大小的片段。反应体系均为25 μL,PCR 扩增条件如下:94 ℃ 预变性5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃延伸50 s,35个循环。循环结束后在72 ℃反应10 min,RT-PCR产物通过琼脂糖凝胶电泳分离检验。
1.2.3 Western Blot 分别取小鼠十二指肠、空肠、回肠组织放入匀浆器中,加入1.5 mL蛋白裂解液,置冰上玻璃匀浆10 min,12 000 r/min(4 ℃)离心10 min,取上清,超声6次(5 s/次,间隔冷却10 s),再以12 000 r/min(4 ℃)离心10 min,取上清冻存于-80 ℃备用。12%聚丙烯酰胺凝胶电泳分离蛋白。湿转法将蛋白转到PVDF膜上,用含5%脱脂奶粉的TTBS (20 mmol/L Tirs, pH值7.6,0.2 mol/L NaCl,0.1% Tween-20)50 mL室温封闭膜1 h,再用TTBS洗膜3次,每次10 min。然后加入一抗(分别为兔抗鼠AQP3抗体1∶1 000,兔抗鼠AQP4抗体1∶1 000,兔抗鼠β-actin 抗体1∶500),4 ℃下孵育过夜。用TTBS缓冲液洗膜3次,每次10 min。以HRP标记二抗(羊抗兔1∶5 000)室温下孵育1 h,洗涤条件同上。杂交膜用ECL化学发光试剂于暗室中显影并感光胶片。
1.2.4 免疫组织化学 4%多聚甲醛灌注小鼠,取小鼠空肠和回肠各约2 cm,继续用4%多聚甲醛固定标本24 h,石蜡包埋,6 μm连续切片。经二甲苯脱蜡、梯度乙醇再水化后,置入10 mmol/L 柠檬酸缓冲液(pH值6.0)微波修复抗原5 min,室温冷却,PBS漂洗。10%非免疫羊血清封闭2 h,分别用兔抗小鼠AQP3(1∶500稀释)、AQP4抗体(1∶500稀释)置于湿盒内4 ℃孵育过夜。多次冲洗后,加入辣根过氧化物酶标记羊抗兔IgG室温孵育15 min,PBS漂洗3次,DAB显色,光学显微镜下观察并拍照,棕黄色颗粒为阳性结果。
2 试验结果
2.1 总RNA质量分析 如图1所示,分别从小鼠十二指肠、空肠和回肠组织中提取总RNA,用1%非变性琼脂糖凝胶电泳进行检测。电泳结果显示,28S、18S和5S三条泳带均清晰、完整,且其亮度比基本符合2∶1,表明所提取的RNA未降解。测定并计算260 nm和280 nm紫外光吸收值OD260/OD280=1.9,表明提取的RNA纯度较高,质量可靠,可用于进行RT-PCR试验。

图1 总RNA凝胶电泳图
a:十二指肠; b:空肠; c:回肠
2.2 RT-PCR 检测小鼠小肠各段AQPs基因的表达
应用小鼠AQPs特异性引物对十二指肠、空肠和回肠组织进行 RT-PCR分析,以β-actin为内参,结果如图2所示,小鼠的空肠段存在AQP3基因表达,小鼠的回肠段存在AQP4基因表达。而小鼠的十二指肠段,没有检测到水通道蛋白基因的表达。
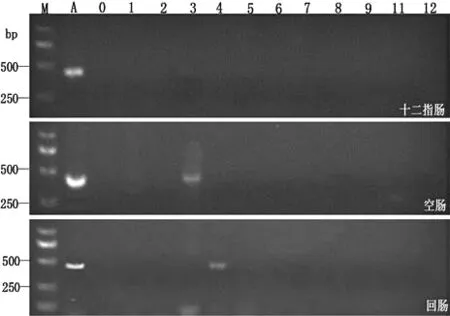
图2 RT-PCR检测 AQPs基因在小鼠十二指肠、空肠、回肠中的表达
M:DL-2 000 Marker; A:β-actin为内参;O:AQPO; 1:AQP1; 2:AQP2; 3:AQP3; 4:AQP4; 5:AQP5; 6:AQP6; 7:AQP7; 8:AQP8; 9:AQP9; 10:AQP10; 11:AQP11; 12:AQP12
2.3 Western Blot检测水通道蛋白AQP3和AQP4的表达 RT-PCR检测的结果表明,AQP3和AQP4基因分别在小鼠空肠和回肠中表达。为进一步明确这AQP3和AQP4在蛋白水平的表达情况,我们应用Western Blot方法分别检测了AQP3和AQP4在十二指肠、空肠和回肠中的表达情况。结果如图3所示,空肠中存在AQP3的蛋白表达,而回肠中存在AQP4的蛋白表达,这与之前RT-PCR的结果一致。

图3 Western Blot 检测AQP3和AQP4蛋白在小鼠十二指肠、空肠、回肠中的表达
2.4 AQP3和AQP4在小鼠小肠中的定位 通过Western Blot检测已知,AQP3在小鼠空肠中存在蛋白表达,AQP4在小鼠回肠中存在蛋白表达。为进一步确定其表达的位置,我们进行了免疫组织化学分析。结果如图4所示,AQP3蛋白主要表达于小鼠空肠黏膜上皮细胞(图4.A),而AQP4蛋白主要表达于小鼠回肠隐窝细胞基底膜(图4.B)。
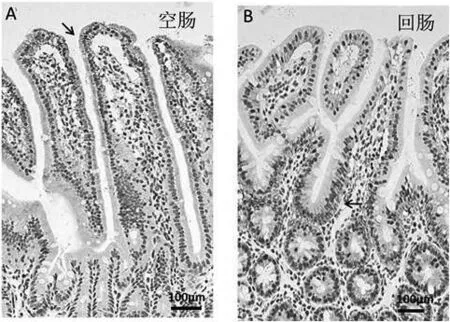
图4 免疫组织化学检测水通道蛋白在小鼠小肠的表达分布(100x)
3 讨论
小肠对水的转运主要通过两种途径:第一种为旁细胞途径,即水是通过细胞的紧密连接,进入细胞间隙,然后再转入血液;另外一种为跨细胞途径,即水通过绒毛柱状上皮细胞的腔膜面进入细胞内,再通过细胞基底膜或侧面膜进入血液[5-6]。这两种途径不是完全孤立的,是相互联系、互为补充的。传统观点认为,消化道对水的转运主要是通过旁细胞途径完成的,即使是通过旁细胞途径进行转运,水也必须通过小肠上皮细胞的基底膜和毛细血管膜才能进入到血液中[7-8]。因此,水的跨细胞膜转运是影响小肠水转运功能的关键,而水通道蛋白在水的跨细胞膜转运过程中发挥着重要作用。
以往对于水通道蛋白在小肠上的表达及功能研究主要集中在人和大鼠,而对其在小鼠小肠中的表达和功能研究却鲜有研究。我们的试验结果表明,AQP3主要表达于小鼠空肠黏膜上皮细胞,而黏膜上皮细胞的主要功能是吸收被分解的营养物质(包括水的吸收),也称吸收细胞。2003年Tomoyuki 等人将大鼠的大部分小肠切除,仅保留部分空肠和结肠,手术7 d后检测剩余部分小肠水通道的表达量,结果发现AQP3的表达量明显升高[9]。2011年Nobutomo等人报道,在MgSO4引起的渗透性腹泻大鼠模型肠道上皮细胞中,AQP3的表达量显著增加。其原因主要是因为当肠道内容物渗透压升高时,降低肠道上皮细胞对水的吸收量,机体会代偿性的引起水通道表达的增加,以增强机体对水的吸收功能[10]。2013年Zhao等人证实,三硝基苯磺酸(TNBS)诱导机体产生的炎症因子使得小肠上皮细胞AQP3的表达量下降,从而降低了小肠对水的吸收能力,引起腹泻[11]。由此可见,AQP3表达在小鼠空肠黏膜上皮细胞中,可能主要与空肠对水的吸收有关。
2002年Hamabata等人用人小肠 AQP4 转染非洲爪蟾卵母细胞,然后用霍乱毒素(CT)处理这些细胞,发现其 AQP4表达明显上调,对水的通透性增加了85 %左右,这说明 AQP4 可能是CT引起分泌性腹泻时作用的靶蛋白[12]。2014年Jiang等人在豚鼠胃壁细胞中发现了AQP4的表达,而壁细胞的主要功能就是分泌胃酸,因此他们推测AQP4的表达可能与壁细胞的分泌功能有关[13]。我们的试验结果也证实,AQP4主要表达在小鼠回肠隐窝细胞中,而隐窝细胞主要是执行腺体的分泌功能,又称分泌细胞。由此我们推测,AQP4在回肠中的表达可能与小肠隐窝的分泌功能有关,但其具体功能还有待进一步研究证实。
总之,小肠是机体中仅次于肾脏的第二大液体转运器官,在维持机体水盐平衡中发挥着重要作用,而水通道蛋白在机体的液体转运过程中发挥着不可替代的作用。我们的研究进一步明确了小鼠小肠各段水通道蛋白的表达及分布情况,为揭示小肠水转运的机制提供理论基础,也为小肠水转运障碍相关疾病(如腹泻等)的治疗提供了新的药物靶点。
[1] Umberto Laforenza. Water channel proteins in the gastrointestinal tract[J].Mol Aspets Med,2012,33: 642-650.
[2] Kuniaki T, Toshiyuki M, Yuki T. Aquaporins: water channel proteins of the cell membrane[J].Prog Histochem Cyto,2004,39: (1-83.)
[3] Cui Z, Zhuang C, Zongyong J. Expression, Distribution and Role of Aquaporin Water Channels in Human and Animal Stomach and Intestines [J].Int J Mol Sci, 2016,17: 1399-1407.
[4] Tonghui Ma,Verkman A S. Aquaporin Water Channels in Gastrointestinal Physiology [J].J Physic,1999,517:317-326.
[5] Field M. Intestinal ion transport and the pathophysiology of diarrhea[J].J Clin Invest,2003,111:931-943.
[6] Barrett K. New ways of thinking about (and teaching about) intestinal epithelial function[J]. Adv Physiol Educ,2008,32: (25-34.)
[7] Rosenthal R, Milatz S, Krug S M,etal. Claudin-2,a component of the tight junction, forms a paracellular water channel[J].J Cell Sci,2010,123:1913-1921.
[8] Fischbarg J. Fluid transport across leaky epithelia: central role of the tight junction and supporting role of aquaporins [J].Physiol Rev,2010,90:1271-1290.
[9] Tomoyuki T, Akihikoitoh, Tetsuya,etal. Alteration of aquaporin mRNA expression after small bowel resection in the rat residual ileum and colon[J].J Gastroen Hepatol,2003,18:803-808.
[10] Ikarashi N, Ushiki T, Mochizuki T,etal. Effects of Magnesium Sulphate Administration on Aquaporin 3 in Rat Gastrointestinal Tract[J].Biol Pharm Bull,2011,34:238-242.
[11] Guangxi Zhao, Jing Li,Yao Wang,etal. Aquaporin 3 and 8 are down-regulated in TNBS-induced rat colitis[J].Biochem Bioph Res C,2014,443:161-166.
[12] Hamabata T ,Liu C ,Takeda Y. Positive and negative regulation of water channel aquaporins in human small intestine by cholera toxin[J].Microb Pathog,2002,32: 273-277.
[13] Jiang L, Li J, Liu X,etal. Expression of aquaporin-4 water channels in the digestive tract of the guinea pig[J]. J Mol Histol,2014,45:229-241.
Expression and Localization ofAquaporins in small intestine of mice
ZHANG Di1, ZHANG Kai-qi1, SU Wei-heng2, ZHAO Yuan1, MA Xin1, GONG Qian1, QU Gui-juan1, MA Hong-xia1
(1.College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118,China; 2.School of Life Science, Jilin University, Changchun 130012,China)
The aim of this study is to ascertain the expression and localization of Aquaporins(AQPs) in small intestine of mice, and provide information for the functional studies of water transport in small intestine. The expression of AQP3 and AQP4 was detected by reverse transcription PCR(RT-PCR) and Western Blot analysis. The results indicated that the expression of AQP3 was detected in jejunum, and the expression of AQP4 was detected in ileum. The expression of AQP3 was located in intestinal epithelial cells, and AQP4 was located in intestinal crypt cells by immunohistochemistry.
Aquaporin (AQP); Small intestine; Mice; Water transport Corresponding author:MA Hong-xia
2016-08-01
国家自然科学基金青年科学基金项目(31402205)
张迪 (1980-),男,讲师,博士,从事细胞膜的结构与功能方面的研究,E-mail:zhangdi@jlau.edu.cn
马红霞,E-mail:hongxia0731001@163.com
S852
A
0529-6005(2017)03-0105-03
