1株鲫源维氏气单胞菌的分离鉴定
2017-04-20冷东泽张培军巴翠玉李月红
冷东泽 , 张培军 , 焦 雪 , 巴翠玉 , 李月红
(1.吉林农业大学动物科学技术学院, 长春130118 ; 2.吉林省卫生监测检验中心, 吉林长春1300001)
1株鲫源维氏气单胞菌的分离鉴定
冷东泽1, 张培军2, 焦 雪1, 巴翠玉1, 李月红1
(1.吉林农业大学动物科学技术学院, 长春130118 ; 2.吉林省卫生监测检验中心, 吉林长春1300001)
为快速分离鉴定鲫鱼出血性败血症致病因子,从病死鲫鱼肝脏分离细菌,经LB固体培养基划线分离,28 ℃,24 h培养后,见圆润光滑、表面微凸的菌株呈优势生长,挑取单菌落命名为AX002。观察该菌在RYAN培养基28 ℃,24 h后生长成深绿色有深核菌落,同条件在RS培养基培养,24 h后长成黄色菌落,后逐步由内向外变为绿色菌落,通过全自动细菌鉴定系统,检测AX002对蔗糖等23种指标呈阳性反应,对山梨醇等22种指标呈阴性反应。设计引物扩增16S rDNA和促旋酶亚基(gyrB)基因并测序。测序结果与NCBI中其他菌株序列进行比对,建立系统发育树,确定AX002为维氏气单胞菌。同时该系统显示该菌对阿米卡星、头孢唑啉、复方新诺明、环丙沙星等15种抗生素敏感。该菌对头孢唑啉、氨苄西林和氨苄西林舒巴坦钠三中抗生素药物最低抑菌浓度>16 μg/mL,对四环素最低抑菌浓度>8 μg/mL,结果判定AX002对头孢唑啉、氨苄西林、氨苄西林舒巴坦钠和四环素具有耐药性。该菌对体长5~15 cm,体重30~50 g鲫鱼腹腔注射,测定半致死浓度(LD50)为2.38×107CFU/mL。本研究有利于进一步研究维氏气单胞菌。
鲫鱼; 分离鉴定; 维氏气单胞菌
维氏气单胞菌(Aeromonasveronii),又称维隆气单胞菌、维罗纳气单胞菌和凡隆气单胞菌,是广泛存在江河、湖泊、淤泥等自然环境中的革兰阴性菌。该菌较嗜水气单胞菌(Aeromonashydrophila),温和气单胞菌(Aeromonassobria)等气单胞菌间检出概率最高,可达到70%以上[1],其为动物体内正常微生态细菌,当环境改变或者动物机体免疫力下降时,可变成致病性细菌[2]。维氏气单胞菌是对人-兽-鱼的条件性致病菌。近年有文献报道,该菌对锦鲤、斑点叉尾鮰、西伯利亚鲟和泥鳅等水产鱼类具有致病性[3-6]。国内报道中,维氏气单胞菌对多种水产鱼类具有感染致病性,如白缘、团头鲂、黄颡等[7-10]。该菌一旦暴发,可引起水产动物出血性败血症而大量死亡。本研究通过生化和分子鉴定方法,确定分离株为维氏气单胞菌。
1 试验材料
1.1 样品来源 患出血性败血疾病病鱼体长5~15 cm,体重30~50 g,病鱼样品主要表现为腹部充血、渗血,部分泄殖腔、眼底充血。
1.2 试验动物 鲫鱼140尾,体长5~15 cm,体重30~50 g,体表健康,连续饲养两周确定生命状态稳定无发病死亡。
1.3 主要试剂 RYAN和RS培养基基础和微生物培养基添加剂,购自海博生物技术有限公司;细菌基因组DNA提取试剂盒,购自北京索莱宝科技有限公司;DL-2 000 Marker、TaqDNA聚合酶,购自Invitrogen公司;其他试剂均为分析纯。
2 方法
2.1 细菌的分离 取病鱼肝脏磨碎,生理盐水稀释后,28 ℃ 经LB培养基划线培养24 h后,挑取单菌落移接到LB液体培养基中,28 ℃培养12 h,制成菌悬液,命名AX002。
2.2 细菌的鉴定
2.2.1 鉴别培养基鉴定 参照说明书配置RYAN和RS培养基。
2.2.2 生化鉴定 使用凤凰全自动细菌鉴定生化试验检测系统,革兰阴性菌鉴定板51孔槽,15 h后观察生化试验结果及其分析。并与维氏气单胞菌生化试验对比。
2.2.3 分子鉴定 (1)16S rDNA PCR鉴定:根据气单胞菌特异基因16S rDNA保守片段(模板X74677),利用Primier 5.0软件设计一对16S rDNA特异性引物并分析特异性,由上海生工生物工程技术服务有限公司合成。使用蒸馏水将引物稀释至10 μmol/L,分装-20 ℃保存。引物分别是16sw 5′-CTAATACCGCATACGCCCTAC-3′、16sx 5′-TAGCGATTCCGACTTCACG-3′,目的长度1 179 bp,反应参数为94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。取2 μL PCR产物1.5%琼脂糖胶电泳20 min,胶电泳图像分析系统观察结果并保存,将检出目标长度1 179 bp的PCR产物未纯化状态送至博仕生物公司测序;(2)gyrB PCR鉴定:保守基因序列促旋酶亚基(gyrB)引物来源于Yanez,M[11]等人设计,由上海生工生物工程技术服务有限公司合成,使用蒸馏水将引物稀释至10 μmol/L,分装-20 ℃保存。引物名称分别是gyrBw 5'-TCCGGCGGTCTGCACGGCGT-3′、gyrBx 5'-TTGTCCGGGTTGTACTCGTC-3',目标长度1 100 bp,反应参数为 94 ℃预变性3 min;94 ℃变性1 min,59 ℃退火1 min,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。取2 μL PCR产物1.5%琼脂糖胶电泳20 min,胶电泳图像分析系统观察结果并保存。将PCR产物未纯化状态送至博仕生物公司测序;(3)序列分析:利用Chromas软件翻译测序后的碱基序列,将得到的16S rDNA和gyrB序列同NCBI已被上传的基因序列比对,得出检测结果。MEGA6软件根据近邻结合法建立基因系统发育树,为进一步确定AX002发育渊源。
2.3 药物敏感性 根据凤凰全自动细菌鉴定药敏检测系统,药敏试验鉴定板为革兰阴性菌药敏板85孔槽,15 h候观察结果及分析。
2.4 动物回归感染试验 (1)活菌计数:摇菌12 h后的菌悬液按10倍梯度稀释,第4次、第5次、第6次10倍稀释后的悬液各3组,取1 mL稀释悬液均匀涂布在LB琼脂培养基上,待长出单个菌落后,计算悬液中菌株存在数量;(2)动物回归感染:7组健康鲫鱼共140尾,每尾腹腔注射0.3 mL各菌株浓度为1×103CFU/mL、1×104CFU/mL、1×105CFU/mL、1×106CFU/mL、1×107CFU/mL、1×108CFU/mL剂量的菌悬液,组7为生理盐水对照组。攻毒后截止72 h统计各组死亡鱼数量,并做记录。根据寇氏法[12]计算半致死浓度。
3 结果
3.1 分离结果 从病死鱼肝胰脏部位分离得到的优势生长的圆润、光滑、黄色细菌菌株。
3.1.1 鉴别培养基结果 AX002在RYAN固体培养基28 ℃培养24 h后,生长呈深绿色有深核圆润微凸光滑菌落,与张碧波[13]等研究报道的气单胞菌在RYAN生长状态相符。在RS培养基28 ℃培养24 h后生长呈黄色菌落,之后逐渐由内向外变色,直至全部变为绿色,即同培养基相同颜色。根据以上试验结果观察,初步确定AX002为气单胞菌。
3.1.2 生化鉴定结果 如表1所示,维氏气单胞菌AX002与葡萄糖、蔗糖、核糖醇、4MU-N-乙酰-BD-氨基葡萄苷等呈阳性反应,表明该菌能够发酵或利用以上物质,而与山梨醇、L - 阿拉伯糖、麦芽酮糖、鸟氨酸等物质呈阴性反应。参照Nicky B.Buller[14]所著,徐高蓉等人所译的《鱼类及其他水生动物细菌使用鉴定指南》得出该生化试验结果与维氏气单胞菌温和亚种(A.veroniispp.spnroa)生化反应结果[15-19]最为相近。
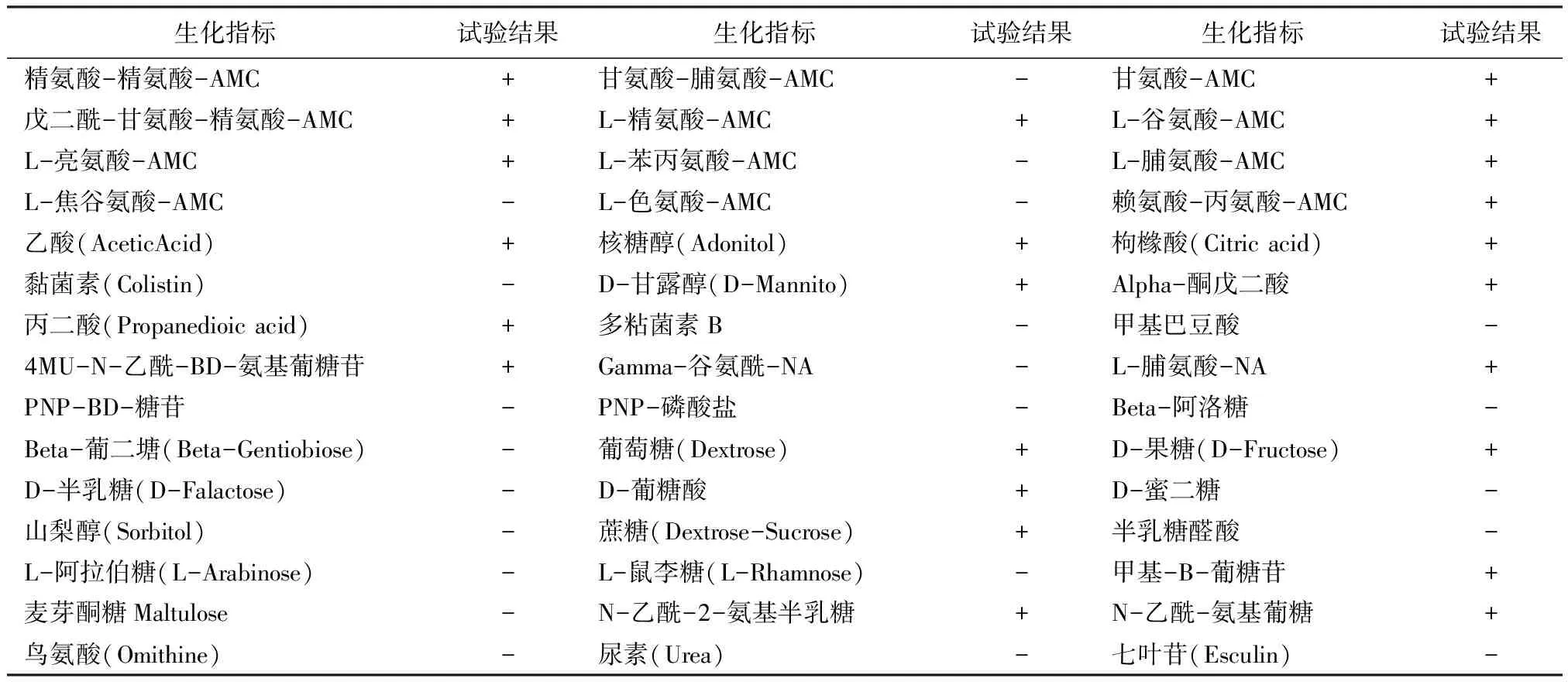
表1 AX002生化试验结果
+:生化反应阳性;-:生化反应阴性
3.1.3 分子鉴定结果 经细菌DNA模板提取,16S rDNA与gyrB在PCR反应后分别得出1 179 bp和 1 100 bp 目的基因条带(图1),将PCR未纯化产物送至博仕生物公司测序后得到两段目的基因序列结果,将两段基因的测序结果与GANBANK已上传了的序列相比对,其中16S rDNA比对结果显示,AX002与维氏气单胞菌WX153415(KT964297.1)100%高度同源,gyrB比对结果显示与维氏气单胞菌XX-60(JX025938.1)99%高度同源。从16S rDNA所建立的基因系统发育树上(图2)观察可见,AX002与维氏气单胞菌菌株WX153415、G18、x-n-602聚为一支,而与其他气单胞菌不能聚类。gyrB系统发育树上(图3)可见,与维氏气单胞菌菌株XX-60聚为一支,而与其他气单胞菌不能聚类。由此可鉴定AX002为维氏气单胞菌。通过系统发育树还可以观察到维氏气单胞菌与温和气单胞菌具有一定近缘关系。如温和气单胞菌菌株14H11和温和气单胞菌菌株S8。
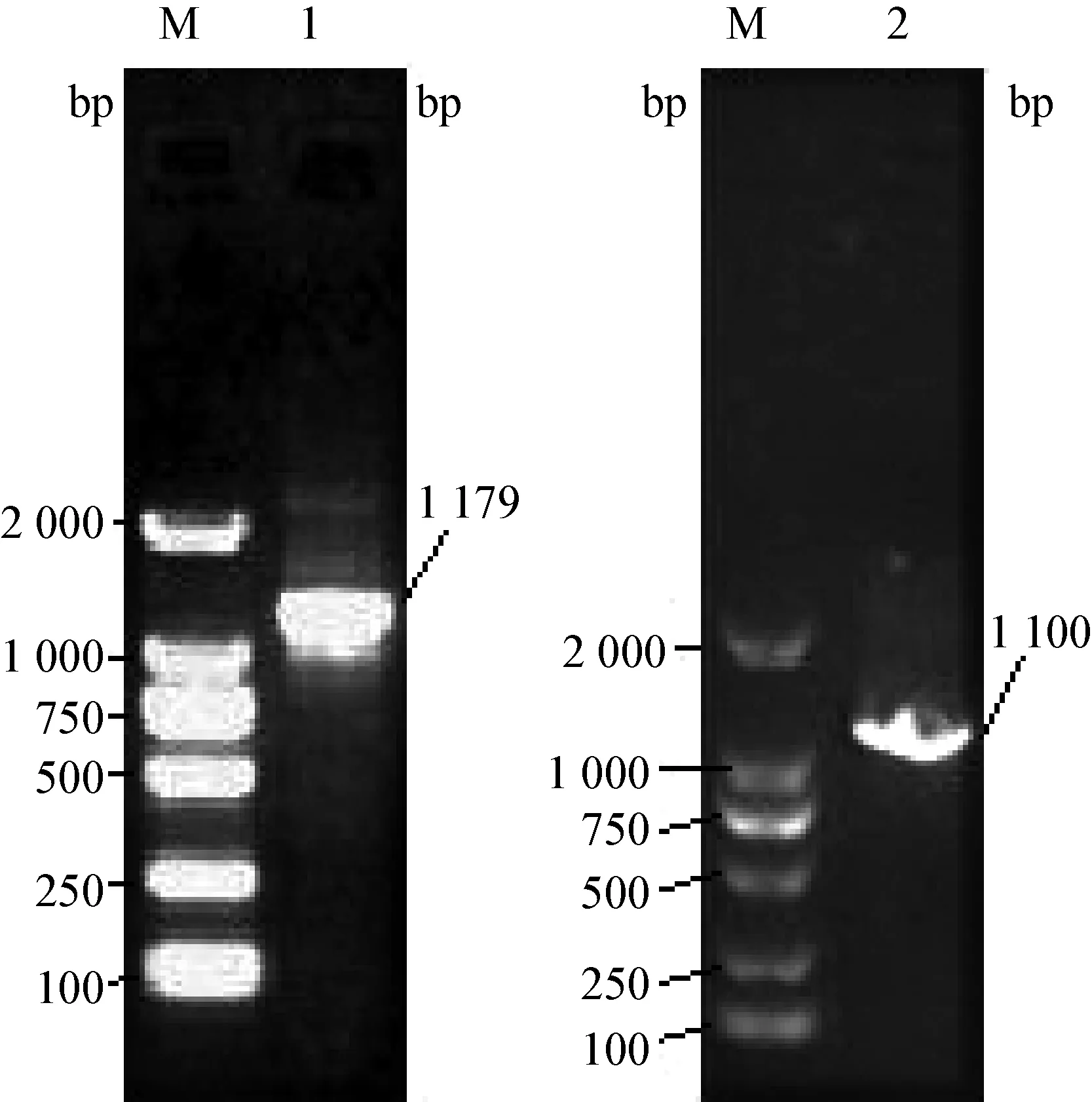
图1 16S rDNA和gyrB PCR结果
M:DL-2 000,1:16S rDNA PCR结果,2:gyrB PCR结果

图2 16S rDNA系统发育树

图3 gyrB系统发育树
3.2 药敏结果 根据19种抗生素对维氏气单胞菌AX002进行耐药性试验结果显示,该菌对阿米卡星、头孢唑啉、复方新诺明、环丙沙星等15种抗生素敏感;对头孢唑啉、氨苄西林、氨苄西林舒巴坦钠、四环素4种抗生素表现出具有耐药性(具体见表1~2)。
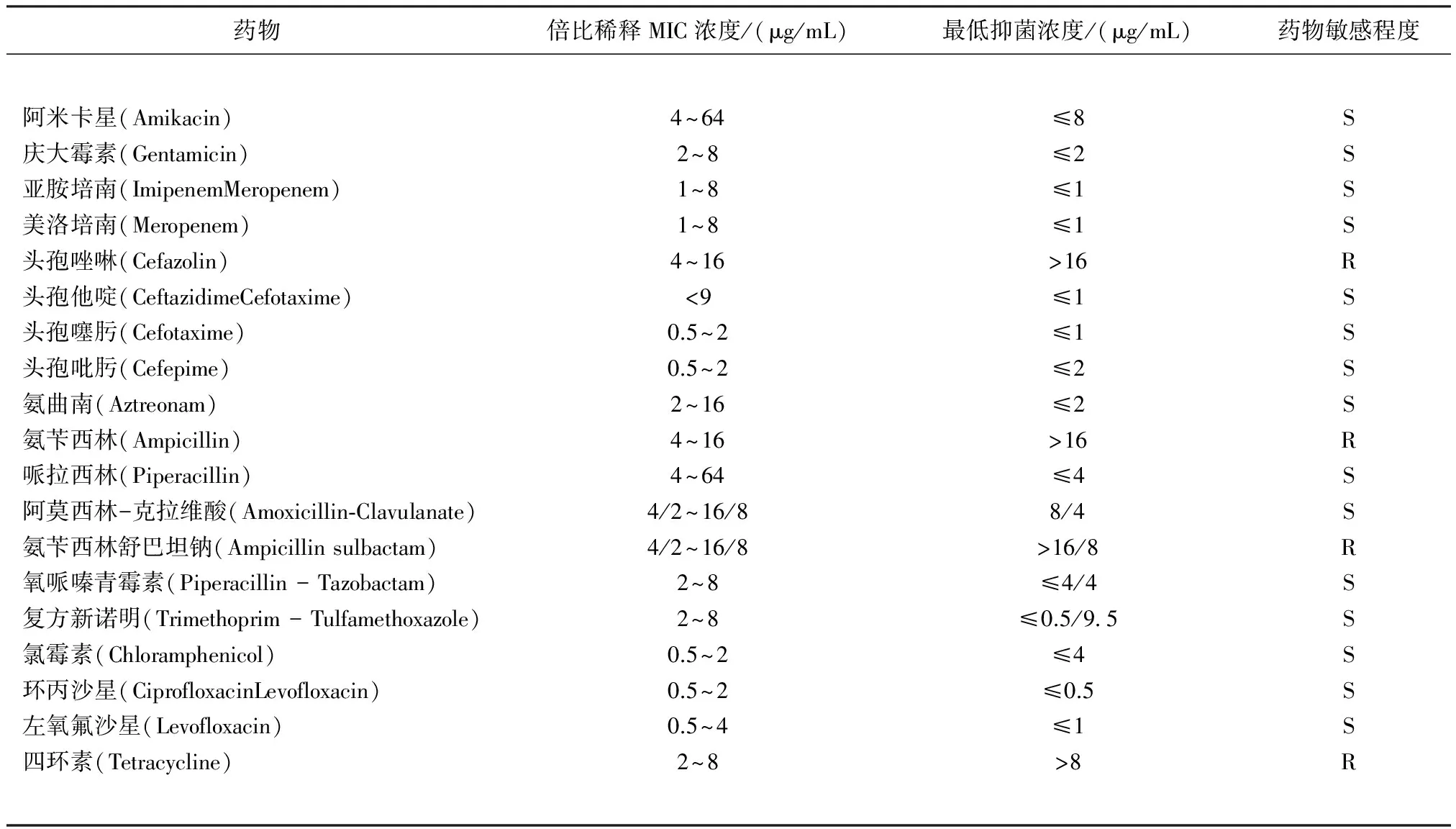
表2 药敏结果
注:“S”表示敏感;“R”表示耐药(判定标准为:2012 CLSI M100-S22 Performance Standards for Antimicrobial Susceptibility Testing;TwentySecond Informational Supplement)
3.3 动物回归感染试验结果 将菌悬液分组注射到健康鲫鱼腹腔,观察发病死亡情况(表2),腹腔注射菌悬液后,鱼开始停止摄食,24 h开始大批发病并且出现个别死亡现象,发病鱼游动缓慢,神经麻痹,几乎对外界的刺激没有反应,腹部表面严重充血,泄殖腔红肿、充血,腹部肿大。48 h后死亡鱼条数开始增多,72 h后开始大批死亡达到高峰,继而停止死亡,而对照组无发病和死亡现象。根据寇氏法得出菌AX002对体长5~15 cm,体重30~50 g鲫鱼半致死浓度(LD50)为2.38×107CFU/mL。

表3 动物回归感染试验结果
注:组1细菌剂量为3×103CFU、组2细菌剂量为3×104CFU、组3细菌剂量为3×105CFU、组4细菌剂量为3×106CFU、组5细菌剂量为3×107CFU、组6细菌剂量为3×108CFU、组7为生理盐水对照组
4 讨论
气单胞菌广泛存在在水自然环境,同时也是人和动物、鱼肠道内正常存在的菌群,而如嗜水气单胞菌、温和气单胞菌、维氏气单胞菌、豚鼠气单胞菌等也是多种水产动物的条件致病菌[20],常给水产养殖业带了较大的经济损失。
AX002的16S rDNA测序结果在NCBI BLAST过程中,同温和气单胞菌、嗜水气单胞菌等气单胞菌种,该段基因同样具有高度相似性,难以具体区分,相比之下gyrB的BLAST便可一目了然确定同维氏气单胞菌最高相似。但是在做出系统进化树结果后不难发现,16S rDNA测序方法同样可以鉴定维氏气单胞菌,具体结果可以看出,该菌和维氏气单胞菌聚为一支,与温和气单胞菌虽然发育较近却不在同一分支上,所以16S rDNA和gyrB两段保守基因都可以鉴定气单胞菌。由于气单胞菌是在近年被独立确定到气单胞菌科中,本试验通过两段保守基因序列建立系统发育树,可进一步确定维氏气单胞菌的发育地位。
细菌生化鉴定这种方法能够较为准确的鉴别气单胞菌,但是有时结果可能会出现偏差[1],常常错误鉴定为弧菌。仅可作为气单胞菌分离鉴定中的初筛选,目前通过生化试验鉴定气单胞菌种属研究尚无明确结论。凌红丽[20]创建RS和AHM鉴别培养基的组合应用,该应用成功区分气单胞菌与其他菌种,但是该组合还是不能完成气单胞菌间的鉴别。如温和气单胞菌、维氏气单胞菌、中间气单胞菌在该组合中均呈阳性反应,即24 h内菌落呈黄色,继而变色为培养基同种颜绿色。近年来16S rDNA基因测序鉴定气单胞菌成为热门,该段基因是气单胞菌的看家基因,被称为细菌的活化石,具有非常高的保守性。气单胞菌的另一段看家基因促旋酶亚基(gyrB),该段基因碱基的替换率为每百万年出现0.7%~0.8%变异率,相对16S rDNA在每千万年进化1%要快出来许多,可弥补16S rDNA无法区分的细菌近亲近缘种属。促旋酶亚基在维持DNA的超螺旋结构中起到关键作用。在促旋酶亚基上设计一段引物,经过PCR基因测序后,在NCBI上BLAST,根据已公布的该基因片段比对,同源性一致的可做气单胞菌种属鉴定。由于该基因不发生水平转移,可以作为系统发育分析的靶基因,同时16S rDNA和gyrB两段基因互补分析,能够更好的鉴别气单胞菌并建立复杂的系统发育基因树[21],目前气单胞菌的这两段基因在NCBI上已被大量上传,为该菌的进一步研究提供有力基础。维氏气单胞菌在进化树上可见与温和气单胞菌相近,却不同分枝上,这两种菌具体区别与比较还有待更多的研究与发现。
动物回归感染试验测定该菌对鲫鱼具有一定弱毒性,并且攻毒后72 h出现病死高峰,可见维氏气单胞菌致鲫鱼出血性败血症发病之急,应予以重视。
[1] 胡萌.江苏地区气单胞菌分离鉴定及强毒株生物学特性分析[D].南京:南京农业大学,2012.
[2] Fraisse T,Lechiche C,Sotto A,etal.Aeromonasspp.Infections:retrospective study in Nmes University Hospital,1997-2004[J].PathologieBiologie,2008,56:70-76.
[3] 潘晓艺,沈锦玉,李建应,等.青虾“软壳综合症”病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[4] 秦蕾,徐静,张晓君.泥鳅的凡隆气单胞菌感染[J].中国人兽共患病杂志,2008,24(12):1100-1102.
[5] 马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenserbaerii)致病性维氏气单胞菌的分离鉴定[J].微生物学报,2009,49(1):1289-1294.
[6] Gonzalez-Serrano C J,Santos J A,Garcia-Lopez M L,etal.Virulence markers inAeromonashydrophilaandAeromonasveroniibiovar sobria isolates from freshwater fish and from a diarrhoea case[J].Journal of Applied Microbiology,2002,93(3):414-419.
[7] 马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenserbaerii)致病性维氏气单胞菌的分离鉴定[J].微生物学报,2009,49(10):1289-1294.
[8] 杨泽晓,周亚,任冉阳,等.白缘(鱼央)维氏气单胞菌的分离鉴定与药敏试验[J].中国畜牧兽医,2012,39(2):92-95.
[9] 周光.团头鲂池塘维氏气单胞菌的致病性、耐药性、基因分型及其分布研究[D].上海:上海海洋大学,2012.
[10] 朱成科,向桢,叶华,等.黄颡鱼致病性维氏气单胞菌的分离鉴定[J].西南大学学报(自然科学版),2013,35(5):37-41.
[11] Yanez M A,Catalan V,Apraiz D,etal.Phylogenetic analysis of members of the genusAeromonasbased ongyrBgene sequences[J].Int J Syst EvolMicrobiol,2003,53:875-883.
[12] 谭苹.应用Excel软件计算半数致死量[J].山西医科大学学报,2010,41(10):914-916.
[13] 张碧波,张立怀,秦贞奎,等.运动性气单胞菌分离和鉴定方法的研究[J].天津轻工业学院学报,2000,4:40-44.
[14] Nicky B.Buller,徐高蓉,常亚青,等.鱼类及其他水生动物细菌实用鉴定指南[M].北京:海军出版社,2013.
[15] Altwegg M,Steigerwalt A.G,Altwegg bissig,etal.Biochemical identification ofAeromonasgenospecies isolated from humans[J].Journal of Clinical Microbiology,1990,28:258-264.
[16] Carnahan A.Chakraborty T.Fanning G,atal.Aeromonastrotasp.nov.an ampicillinsusceptible species isolatedfromclinical specimens[J].Journal of Clinical Microbiology,1991,29:1206-1210.
[17] Kaznowski A.Identification ofAeromonasstrains of different origin to the genomic species level[J].Journal of Applied Microbiology,1998,84:423-430.
[18] Kuijper E J,Steigerwalt A G,Schoenmakers B S C I M,etal.Phenotypiccharacterization and DNA relatedness in human fecal isolates of Aeromonas spp[J].Journal of Clinical Microbiology,1989,27:132-138.
[19] 黎炯,叶星,卢迈新,等.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3):132-136.
[20] 凌红丽,陆承平,陈怀青,等.嗜水气单胞菌选择培养基鉴别效果的比较[J].中国兽药杂志,1998,32(4):6-9.
[21] Mara kupfer,Peter Kuhnert,Bozena M.Genetic relationships ofAeromonasstrainsidferred from 16S-rRNA gyrB and rpoB gene sequences[J].Interational journal of systematic and evolutionary microbiology,2006,56:2743-2751.
2016-04-13
国家自然科学基金(30972191);吉林省留学人员创新创业项目(201523);长春市农业先进实用技术的示范推广项目(20130215)
冷东泽(1988- ),男,硕士生,研究方向为动物疾病与免疫,E-mail:174542602@qq.com
李月红,E-mail:liyhong@sina.com
S855.1+2
B
0529-6005(2017)03-0091-05
