小反刍兽疫实验室诊断
2017-04-20程振涛
王 琦 , 吴 燕 , 程振涛 , 李 涛
(1.贵州大学动物科学学院 , 贵州贵阳550025 ; 2.贵州省动物疫病预防控制中心 , 贵州贵阳550008)
小反刍兽疫实验室诊断
王 琦1, 吴 燕1, 程振涛1, 李 涛2
(1.贵州大学动物科学学院 , 贵州贵阳550025 ; 2.贵州省动物疫病预防控制中心 , 贵州贵阳550008)
为了对小反刍兽疫疑似病例进行实验室确诊,采集疑似小反刍兽疫病羊材料,用实时荧光定量RT-PCR检测方法以及一步法RT-PCR检测方法进行检测,并针对小反刍兽疫N基因序列设计引物扩增N基因并进行克隆测序及序列分析。试验结果可见,疑似小反刍兽疫病羊临床剖检表现为胃肠道及肺部出现坏死,肠道出现线状出血。实时荧光定量RT-PCR和一步法RT-PCR方法检测结果显示均为小反刍兽疫病毒(PPRV)核酸阳性。N基因测序结果China-GZ株与小反刍兽疫4个支系毒株序列比对显示,核苷酸同源性为89.0%~97.3%。本试验通过临床症状表现和实验室分子生物学诊断确诊该病例为小反刍兽疫病毒感染所致。
小反刍兽疫 ; 剖检病变 ; RT-PCR ;N基因
小反刍兽疫(PPR)是由小反刍兽疫病毒引起的一种急性、烈性传染病。该病自1942年首次在西非象牙海岸的科特迪瓦发现后,一直呈扩散趋势,目前全球有40多个国家已报告发生该疫情[1]。该病主要以高稽留热、眼鼻分泌物增多、坏死性口炎、肺炎、腹泻为主要特征[2]。主要感染山羊与绵羊,其中山羊比绵羊更易感。2007年,我国西藏首次暴发小反刍兽疫疫情[3]。自2013年11月份起,我国多省陆续暴发小反刍兽疫疫情,贵州省小反刍兽疫疫情也十分严峻。目前针对本病现在尚无有效的治疗方法。对本病综合防控依赖于临床病例的快速诊断、果断处置,同时亦应及时明确各地小反刍兽疫流行毒株分子特征,为疫苗防控奠定基础。本试验通过对临床疑似小反刍兽疫山羊病例进行剖检病变观察及样本采集,并利用实时荧光定量RT-PCR检测方法和本实验室建立一步法RT-PCR检测方法对该病例进行确诊。并对小反刍兽疫病毒本地流行株保守基因N基因进行克隆、测序及序列分析,为贵州省小反刍兽疫病例快速处置及综合防控奠定基础。
1 材料与方法
1.1 病料 疑似病羊材料采集自贵州省六盘水市某养羊场。
1.2 载体与试剂 pMD-19T载体,购自宝生物工程(大连)有限公司;小反刍兽疫实时荧光定量RT-PCR检测试剂盒,购自北京世纪元亨动物防疫技术有限公司;RNA提取试剂盒、E.Z.N.A.TMGel Extraction Kit 胶回收、E.Z.N.A.TMPlasmid Kit 质粒提取试剂盒,购自Omega公司;DNA限制性内切酶SalⅠ和KpnⅠ,均购自Thermo公司;DNA Marker DL-2 000,购自宝生物工程(大连)有限公司;其他试剂均为国产分析纯。1.3 方法
1.3.1 临床病例观察与样本采集 按照重大疫病样本采集与病例处置要求,对临床病例进行流行病学调查与剖检病变观察,并采集肺、粪便等样本,以备实验室检验。
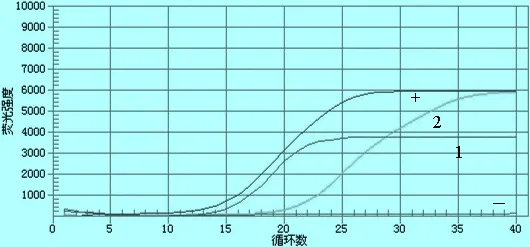
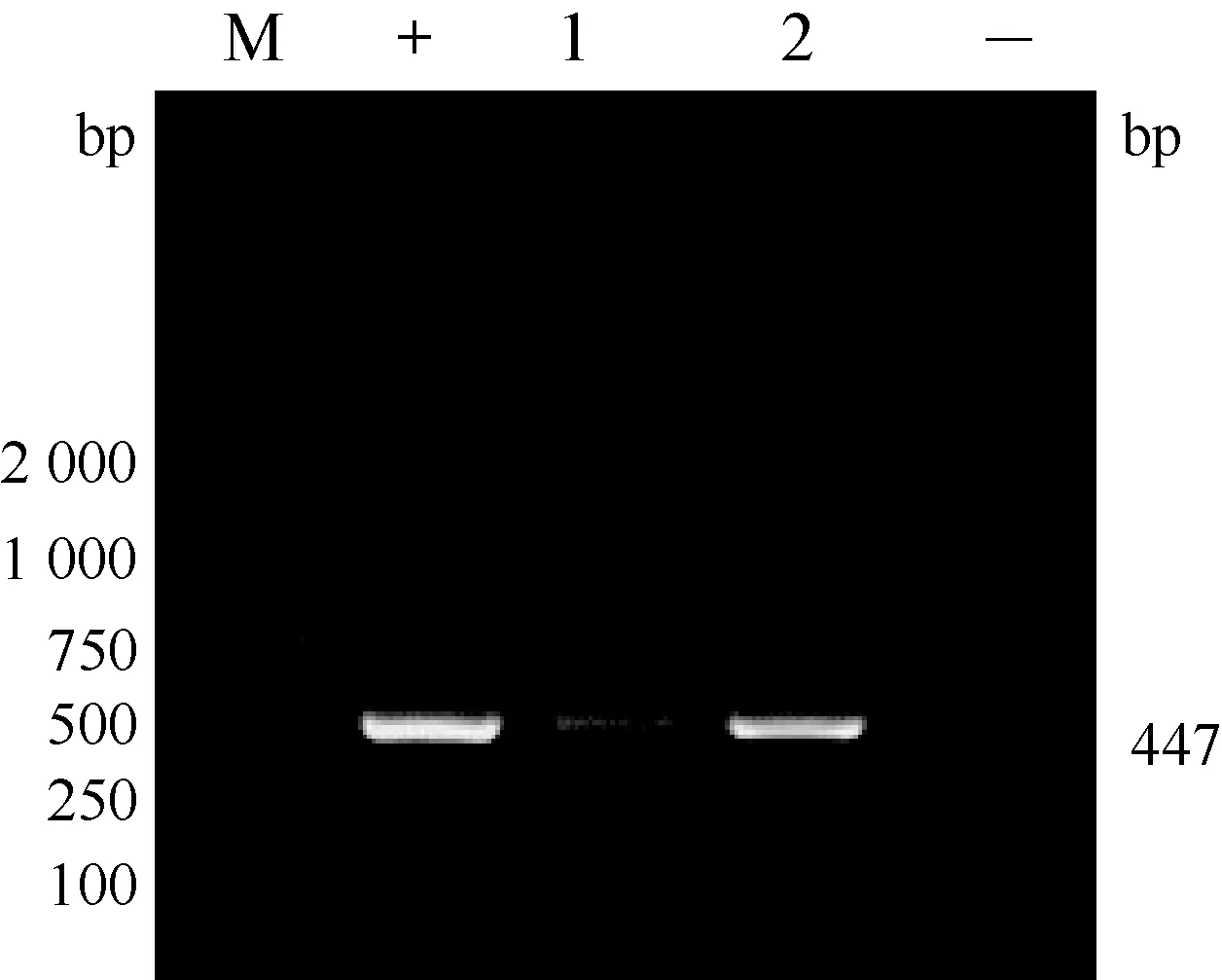
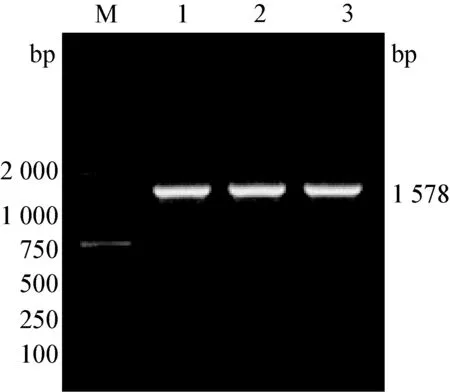
1.3.2 实时荧光定量RT-PCR方法检测 提取疑似病例样本总RNA为模板,用北京世纪元亨动物防疫技术有限公司小反刍兽疫实时荧光定量RT-PCR检测试剂盒进行检测(批号:PPR20150404P)。试验结果阳性对照Ct值≤30并出现特定的扩增曲线,阴性对照无Ct值并且无特定扩增曲线,试验结果成立;被检样品Ct值≤30并出现特定的扩增曲线为小反刍兽疫病毒阳性;被检样品30 1.3.4 N基因的克隆与序列分析 1.3.4.1 引物的设计 根据GenBank所登录的小反刍兽疫病毒N基因序列,设计合成一对引物,PPRV-N-F:5′-ATGGCGACTCTTCTTAAAAG-3′,PPRV-N-R:5′-CTAGCCGAGGAGATCCTTGT-3′,预期扩增片段大小为1 578 bp,送至上海生工生物工程技术服务有限公司合成,稀释引物至20 pmol/μL,-20 ℃保存备用。 1.3.4.2 目的片段的扩增 提取临床疑似病例组织样本总RNA为模板,用引物PPRV-N-F/ PPRV-N-R进行目的基因扩增。采用50 μL反应体系: RNA模板1 μL,PrimeScript 1 step Enzyme Mix 2 μL,2×1 step Buffer 25 μL,上下游引物各1 μL,RNase Free dH2O 20 μL。反应条件:50 ℃ 30 min;94 ℃ 2 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min 30 s,共35个循环。RT-PCR产物经15 g/L琼脂糖凝胶电泳,于凝胶成像仪中观察结果。 1.3.4.3 目的片段的克隆 用胶回收试剂盒纯化RT-PCR产物,按照pMD19-T载体试剂盒说明书将回收目的基因片段与pMD19-T载体连接,转化感受态细胞DH5α,应用PCR及SalⅠ/KpnⅠ双酶切(酶切体系:质粒DNA 9 μL,SalⅠ 4μL,KpnⅠ 2 μL,Buffer Tango 7 μL,灭菌双蒸水补足至30 μL)技术筛选阳性重组质粒。 1.3.4.4 测序、序列分析 将阳性重组质粒送至上海英潍捷基生物技术有限公司测序。将测序结果与GenBank上PPRV 4个支系毒株N基因序列进行比对分析。 表1 参考毒株信息 2.1 疑似病例临床表现观察 送检病羊出现口鼻分泌液增加、牙龈充血、口腔糜烂、咳嗽、腹泻等症状,临床诊断疑似小反刍兽疫。剖检后发现病羊胸腔有炎性渗出液蓄积及肺部出现不同程度的坏死,其他主要表现为肝脏及脾脏、淋巴结肿大,肠道出现线状出血。 2.2 疑似病例FQ RT-PCR检测结果 疑似病例组织样本总RNA进行实时荧光定量RT-PCR,结果见图2。根据判定标准对检测结果进行判定,由图1可见,阳性对照Ct值为17.40<30.00并出现特定的扩增曲线,阴性对照无Ct值并且无特定扩增曲线,试验结果成立。临床样本1和2Ct值分别为18.09和23.94,均小于30并出现特定的扩增曲线,故判定为小反刍兽疫病毒核酸阳性。 图1 小反刍兽疫病毒RNA的扩增曲线 +:阳性对照; 1-2:临床样本; -:阴性对照 2.3 疑似病例普通RT-PCR扩增结果 为进一步确诊,对疑似病例材料总RNA进行一步法RT-PCR扩增,RT-PCR产物凝胶电泳结果见图2。由图2可见,临床疑似样本扩增出大小约447 bp的核酸条带,与阳性对照大小相同,判断为疑似病例小反刍兽疫病毒核酸阳性。 图2 临床样本检测结果 M:DL2000 DNA Marker;+:阳性对照;1-2:临床样本;-:阴性对照 2.4N基因克隆 应用所设计N基因引物对其中1份疑似病例样本总RNA进行目的基因扩增,样本中扩增出大小约1 578 bp目的条带,与预期扩增大小相符。将胶回收纯化后的目的片段连接至pMD19-T载体并转化感受态细胞DH5α,提取重组质粒进行PCR和SalⅠ/KpnⅠ双酶切鉴定,结果见图3和图4。由图3可见,重组质粒中PCR扩增出约1 578 bp的目的条带;由图5可见重组质粒经SalⅠ/KpnⅠ双酶切可获得与目的条带大小相同的目的片段,证明目的基因片段成功克隆到pMD19-T载体。 图3 重组质粒PCR鉴定 M: DL-2 000 DNA Marker; 1~3: 重组质粒PCR产物 图4 重组质粒酶切鉴定 M: DL-2 000 DNA Marker; 1~3: 阳性重组质粒双酶切产物; 4: 重组质粒对照 2.5N基因测序结果 将鉴定为阳性的重组质粒送至上海英潍捷基生物技术有限公司测序,测序结果得到大小为1 578 bp的目的基因序列,暂命名为China-GZ株。 2.6N基因与PPR不同支系核苷酸比对分析 将China-GZ株序列与小反刍兽疫4个支系毒株序列进行对比显示(图5):China-GZ株与4个支系毒株核苷酸同源性分别为93.2%,92.7%,89.0%和97.3%,初步断定本次病例流行毒株小反刍兽疫病毒Ⅳ系。 图5 核苷酸同源性比对分析 2013年以来,我国多个省份均出现小反刍兽疫疫情,小反刍兽疫的防控迫在眉睫。对临床病例的快速诊断是防控小反刍兽疫的关键技术之一,针对小反刍兽疫病原的诊断方法包括免疫学检测方法和分子生物学检测方法。免疫学检测方法包括琼脂凝胶免疫扩散试验(AGID)、琼脂凝胶沉淀试验(AGPT)、对流免疫电泳试验(CIE)及酶联免疫吸附试验(ELISA)等[4],但相对于这些检测方法,分子诊断技术中的PCR方法更加灵敏[5]。目前针对PPRV诊断技术建立可见基于PPRVN、F、M基因设计引物[6-8]。方法可分为普通RT-PCR方法和实时荧光定量PCR方法,其中实时荧光定量PCR方法更敏感,而普通RT-PCR检测结果更直观。本试验根据病羊临床表现为口鼻分泌液增加、口腔糜烂、咳嗽、腹泻等症状,剖检病羊胸腔存在炎性渗出液蓄积,胃肠道及肺部出现不同程度的坏死,肝脏及脾脏、淋巴结肿大,肠道出现线状出血,与王光祥等[9]观察到的小反刍兽疫病变相似,初步怀疑为小反刍兽病毒感染。为做出确切性诊断,分别采用实时荧光定量RT-PCR技术和普通一步法RT-PCR技术对上述疑似病例进行分子生物学诊断,两种方法均显示临床疑似小反刍兽疫病例组织样本中存在PPRV核酸。可初步判定病例存在小反刍兽疫病毒感染。 小反刍兽疫防控采取净化与疫苗免疫相结合的方式进行[10],随着山羊交易与引种的频繁发生,疫苗免疫仍是健康羊群的有效保护手段。疫苗免疫对疫病防控能否成功建立在病原种类、分子特征是否一致的基础之上。小反刍兽疫基因组包括N基因、P基因、M基因、F基因、H基因和L基因,其中编码核蛋白的N基因在麻疹病毒属的基因组中是非常保守的,目前小反刍兽疫的ELISA、PCR等检测方法多数都是以N基因为基础建立的[11]。N基因所编码的N蛋白是PPRV中最丰富且免疫原性最强的蛋白[12],动物机体感染以后能够引起其机体产生高滴度抗体,此类抗体虽然不能中和病毒,但是具有重要的诊断意义[13]。为进一步确诊本次临床病例和了解PPRV本地流行株分子特征,本试验选取PPRVN基因进行克隆及测序,并将测序结果与小反刍兽疫四个支系毒株进行比对分析。结果可见,PPRV本地流行株与4个支系毒株核苷酸同源性高达89.0%~97.3%,证明扩增出的基因为PPRVN基因。同时分析结果显示,China-GZ株与疫苗株Nigeria 75-1株核苷酸同源性为93.2%,而与第四支系毒株India株同源性高达97.3%,提示本地流行株可能与India株同属小反刍兽疫第四支系,与疫苗株属于不同支系。研究结果为贵州省小反刍兽疫综合防控奠定基础。 [1] 刘永宏,曹胜波,赵丽,等.中国小反刍兽疫疫情分析[J].西北农业学报,2014,23(9): 19-26. [2] Kerur N,Jhala M K,Joshi.Genetic characterization of Indian peste des petits ruminants virus (PPRV) by sequencing and phylogenetic analysis of fusion protein and nucleoprotein gene segments[J].Res Vet Sci,2007,85(1):176-183. [3] 王乐元,次真,吴国珍,等.中国西藏小反刍兽疫的发生状况与防控[J].畜牧兽医学报,2011,42(5):717-720. [4] 姚伟.国外小反刍兽疫实验室诊断技术研究进展[J].中国兽医杂志,2015,51(6):79-81. [5] 袁向芬,吴绍强,林祥梅.小反刍兽疫诊断及其免疫防制的研究进展[J].中国畜牧兽医,2012,39(12):195-198. [6] Carrie A B,Ashley C B,Donald P K,etal.A real time RT-PCR assay for the specific detection of Peste des petits ruminants virus[J].J Virol Methods,2011,171(2):401-404. [7] Albayrak H,Alkan F.PPR virus infection on sheep in blacksea region of Turkey: Epidemiology and diagnosis by RT-PCR and virus isolation[J].Vet Res Commun,2009,33(3):241-249. [8] Balamurugan V,Sen A,Venkatesan G,etal.A rapid and sensitive one step-SYBR green based semi quantitative real time RT-PCR for the detection of peste des petits ruminants virus in the clinical samples[J].Virol Sin,2012,27(1):1-9. [9] 王光祥,贾宁,方梅,等.绵羊小反刍兽疫临床病例的病例学观察[J].畜牧兽医学报,2015,46(6):1011-1017. [10] 陈未,陈飞,周伟伟.小反刍兽疫研究进展[J].中国兽医杂志,2014,50(7):59-60. [11] 艾军,杨建明,叶玲玲,等.小反刍兽疫病毒N基因的克隆及原核表达[J].动物医学进展,2008,29(5):1-3. [12] Yadav V,Balamurugan V,Bhanuprakash V,etal.Expression of Peste des petits ruminants virus nucleocapsid protein in prokaryotic system and its potential use as a diagnostic antigen or immunogen[J].J Virol Methods,2009,162(1):56-63. [13] Balamurugan V,Sen A,Saravanan P,etal.One-step multiplex RT-PCR assay for the detection of peste des petits ruminants virus in clinical samples[J].Vet Res Commun,2006,30(6):655-666. 2015-10-15 贵州省科技合作项目(黔科合LH字[2015]7674号);省州科技合作专项项目 (黔西南科合[2012]5号);贵州省科技创新人才团队项目(黔科合人才团队[2015]4016号 王琦(1991-),女,硕士,主要从事预防兽医学研究,E-mail:862708743@qq.com 程振涛, E-mail: chengzhentao@sohu.com;李涛, E-mail: 727670509@qq.com 2.65 A 0529-6005(2017)03-0035-04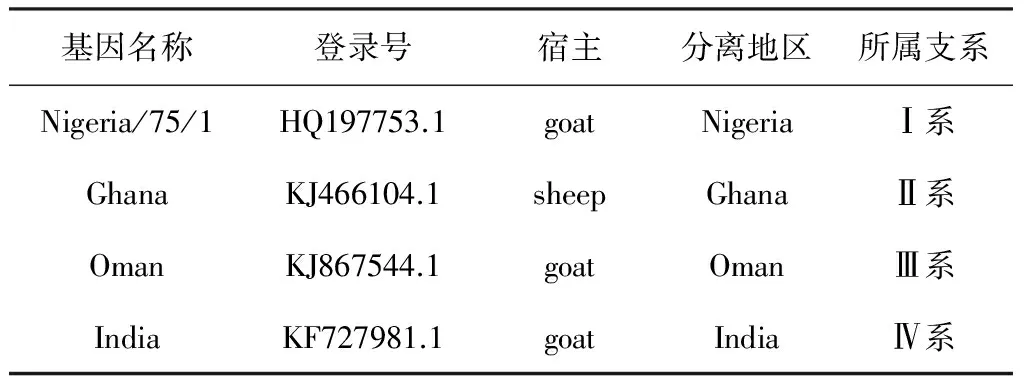
2 结果


3 讨论
