维生素K代谢相关基因CYP4F2参与凝血因子FⅨ活化的研究
2017-04-20秦留安席少枝王绪云李晓琪
刘 佳,秦留安,席少枝,刘 军,王绪云,李晓琪,杨 洁,尹 彤
(解放军总医院心内科,北京 100853)
维生素K循环是机体内维生素K依赖性凝血因子(Ⅱ、Ⅶ、Ⅸ、Ⅹ)活化的重要通路,环氧型维生素K经维生素K环氧化物还原酶(vitamin K epoxide reductase,VKOR,编码基因VKORC1)转变为维生素K,然后在VKOR的作用下,转化为还原型维生素K,参与维生素K依赖性凝血因子的羧化反应[1]。由于维生素K循环是通过少量维生素K的反复利用,实现维生素K的氧化还原和γ羧化,因此,肝脏维生素K循环中的维生素K含量的稳态对凝血因子活化反应的影响更直接和显著。近年研究表明,在维生素K循环中,细胞色素P450家族的成员CYP4F2具有氧化水解维生素K的功能[1],因此,CYP4F2有可能通过改变维生素K循环中维生素K含量的稳态影响凝血因子的活化,从而发挥其对凝血功能的影响。我们前期针对维生素K拮抗剂华法林的药物基因组学研究发现,在维生素K代谢和循环通路上的候选基因(VKORC1、GGCX、CYP4F2、EPHX1、APOE、NQO1、CALU)中,只有CYP4F2基因变异型与华法林出血并发症相关。经校正维生素K摄取等临床环境因素和已知相关基因变异因素(CYP2C9*3)后[2,3],其中携带CYP4F2rs3093168 CC基因型患者发生严重出血并发症的风险是非携带者的7.61倍[4],提示CYP4F2基因是影响华法林出血并发症的重要相关基因,其作用机制可能与CYP4F2参与影响凝血因子的活化密切相关。尽管如此,目前尚未见CYP4F2对维生素K依赖性凝血因子活性影响的相关文献报道。鉴于此,本研究以维生素依赖性凝血因子FⅨ活性的改变为例,通过在人肝细胞系LO2细胞中过表达CYP4F2和凝血因子FⅨ,探讨CYP4F2对维生素K依赖性凝血因子活化的影响,以期为基于药物基因组学的维生素K拮抗剂个体化抗凝治疗提供新的生物功能依据。
1 材料与方法
1.1 材料与试剂
携带人CYP4F2-cDNA的pCR4Zero质粒[5]和携带人凝血因子FⅨ-cDNA的pIRES质粒[6]分别由美国密西西比大学医学中心Stec教授和德国乌尔茨堡大学人遗传学研究所Czogalla教授惠赠。人正常肝脏细胞系LO2细胞购自军事医学科学院细胞库。质粒提取试剂盒、DNA凝胶回收试剂盒、1640细胞培养基、胎牛血清及Lipofectamine 2000 转染试剂为 Invitrogen 公司产品。XbaⅠ与SalⅠ核酸限制性内切酶购自TAKARA公司。FⅨ抗体、CYP4F2抗体及FⅨa活性检测试剂盒购自ABCAM公司。
1.2 质粒构建
通过携带人CYP4F2-cDNA的pCR4Zero质粒和携带人凝血因子FⅨ-cDNA的pIRES质粒,构建同时含有CYP4F2-cDNA片段与FⅨ-cDNA片段的pIRES质粒。步骤如下:根据NCBI的CYP4F2基因CDS序列设计扩增引物。上游引物 5’-tctagaatgtcccagctgagcctgtc-3’,下游引物5’-gtcgactcagctcaggggctccaccc-3’。以pCR4Zero-CYP4F2质粒作为模板,PCR 扩增CYP4F2基因 CDS 片段。反应体系:DNA模板1.5 μl、taq Master Mix 12.5 μl、上下游引物各0.8 μl、ddH2O 9.4 μl。用2.0% 琼脂糖凝胶电泳分离并回收PCR产物,扩增后的CYP4F2-cDNA片段连接到T载体。取连接产物转化TOP10感受态细胞,将转化菌液涂布于含氨苄青霉素(100 mg/ml) 的LB固体培养基上,37℃培养过夜。挑取生长状态良好的菌落培养,提取质粒后使用XbaⅠ与SalⅠ核酸限制性内切酶分别双酶切pIRES-FⅨ-cDNA质粒和连接CYP4F2-cDNA片段的T载体。使用T4连接酶16℃条件下将CYP4F2-cDNA片段连接到pIRES质粒的MCS B区域 (此前pIRES质粒的MCS A区域已经包含FⅨ-cDNA片段),构建pIRES-FⅨ-cDNA质粒。取连接产物转化TOP10感受态细胞,将转化菌液涂布于含氨苄青霉素(100 mg/ml) 的LB固体培养基上,37℃培养过夜。挑取生长状态良好的菌落培养,提取质粒进行双酶切并测序鉴定。
1.3 细胞培养及转染
使用含10%胎牛血清及5%双抗的1640培养基培养LO2细胞,常规换液、传代。取生长状态好的LO2细胞使用胰蛋白酶消化计数,将6×105细胞种植于直径为6 cm的平皿中。用含10%胎牛血清及3 nmol/L维生素K1(维生素K1使用10倍DMSO稀释后加入培养基)的1640培养基在37℃,5%CO2的孵箱内培养过夜。待细胞融合面积达70%~80%后,更换无血清无双抗的1640培养基。将8 μg pIRES-FⅨ质粒溶于500 μl Opti-mem无血清培养基中(A管)。另将20 μl Lipofectamine 2000 转染试剂溶于500 μl Opti-mem无血清培养基中(B管),室温静置 5 min 后将两管混合摇匀,室温孵育20 min后将混合液缓慢加入LO2细胞中,混匀后置于37℃,5%CO2培养箱中培养。同样方法转染pIRES-FⅨ-CYP4F2 质粒以及pIRES空白对照质粒。每组质粒做复孔同步转染。5 h后更换新的含10%胎牛血清及3 nmol/L维生素K1的1640培养基。48 h后收集培养上清于-80℃保存。
1.4 蛋白免疫印迹
质粒转染48 h后,分别刮取各组细胞,加入RIPA高效细胞裂解液。小心吸取上清提取细胞总蛋白,用BCA试剂盒 (Solarbio, 中国) 进行蛋白定量。分别将各组蛋白加入1/4体积的蛋白上样缓冲液后置于沸水中煮5 min加样,每组蛋白上样30 μg。SDS-PAGE 凝胶电泳 100 V、 1.5 h、半干转法将凝胶蛋白转至PVDF膜。转膜条件:恒流300 mA,2 h。使用5% 脱脂奶粉37℃封闭1 h。将目的蛋白条带和内参条带剪开,两张含有目的蛋白的膜分别加入1∶1000稀释的FⅨ 抗体以及1∶1000稀释的CYP4F2 抗体,含有内参蛋白的膜加入1∶1000稀释的GAPDH内参抗体(Solarbio,中国),置于4℃冰箱过夜。TBST 洗膜10 min,共3次。然后分别加入1∶5000稀释的辣根过氧化物酶标记的羊抗兔IgG抗体 (Solarbio,中国),37℃孵育1 h。再次 TBST 洗膜10 min,共3次。用ECL化学发光检测试剂 (Solarbio, 中国) 放射自显影检测FⅨ和CYP4F2蛋白表达。
1.5 凝血因子活性检测
根据FⅨa Assay检测试剂盒说明书,将每组蛋白裂解液各取10 μg 分别加入96孔板中,然后分别加入10 μl 配制好的master mix溶液,加入FⅨa Assay Buffer 溶液至98 μl,混匀后37℃孵育15 min。每个孔中加入2 μl FⅨa substrate-AMC 溶液,混匀。避光37℃孵育30 min后放入荧光酶标仪(Ex/Em=360/450 nm)。将每组细胞培养上清各取10 μl加入96孔板中,同样的方法对细胞培养上清中FⅨa活性进行检测。以上检测各组样本均做复孔重复3次,结果取均值。
1.6 统计学处理

2 结 果
2.1 PCR 扩增目的基因和构建质粒
PCR扩增产物在2%琼脂糖凝胶电泳30 min后可得到一条大小约1700 bp的扩增条带(图1A),与 NCBI 中CYP4F2基因 CDS 大小一致,提示成功克隆CYP4F2基因。pIRES-FⅨ-CYP4F2质粒经XbaⅠ与SalⅠ核酸限制性内切酶双酶切后琼脂糖凝胶电泳50 min后可获得1条大约1700 bp条带(图1B),与NCBI中CYP4F2基因CDS大小一致,测序后证实含有CYP4F2-cDNA片段,提示质粒构建成功。
2.2 转染后蛋白表达
转染pIRES-FⅨ质粒以及pIRES-FⅨ-CYP4F2质粒后,FⅨ和CYP4F2的表达显著增加 (P<0.05;图2),提示质粒转染成功并正常表达。
2.3 凝血因子活性检测
使用FⅨa活性检测试剂盒以及荧光酶标仪对各组细胞裂解液及培养上清FⅨa进行定量分析。发现过表达FⅨ后LO2细胞FⅨa的活性较正常对照组明显升高[培养上清:(2268.67±114.15)vs(1614.00±69.67),P=0.038;细胞裂解液:(1097.33±55.52)vs(778.67±36.01),P=0.041]。提示细胞中FⅨa的活性与FⅨ表达呈正相关。而同时过表达CYP4F2和FⅨ后LO2细胞FⅨa的活性较过表达FⅨ组明显降低[培养上清:(1540.00±72.64)vs(2268.67±114.15),P=0.032;细胞裂解液:(1805.33±10.50)vs(1097.33±55.52),P=0.036]。提示维生素K代谢相关基因CYP4F2过表达对凝血因子的活化具有抑制作用,进一步对凝血产生影响。具体结果见图3。

图1 CYP4F2基因PCR扩增产物和pIRES-FⅨ-CYP4F2重组质粒酶切
Figure 1 Electrophoresis of CYP4F2 PCR product and enzyme cleave identification of recombinant plasmid
M1: D2000 DNA marker; 1: PCR product; M2: 1kb plus DNA marker; 2: pIRES-FⅨ-CYP4F2 plasmid cleaved byXbaⅠ/SalⅠ; 3: pIRES-FⅨ-CYP4F2 plasmid

图2 各组LO2细胞FⅨ及CYP4F2蛋白表达Figure 2 FⅨ and CYP4F2 protein expression of different LO2 cells Control: empty plasmid (pIRES); FⅨ: recombinant plasmid (pIRES- FⅨ); CYP4F2+FⅨ: recombinant plasmid (pIRES-FⅨ-CYP4F2). Compared with control group, *P<0.05
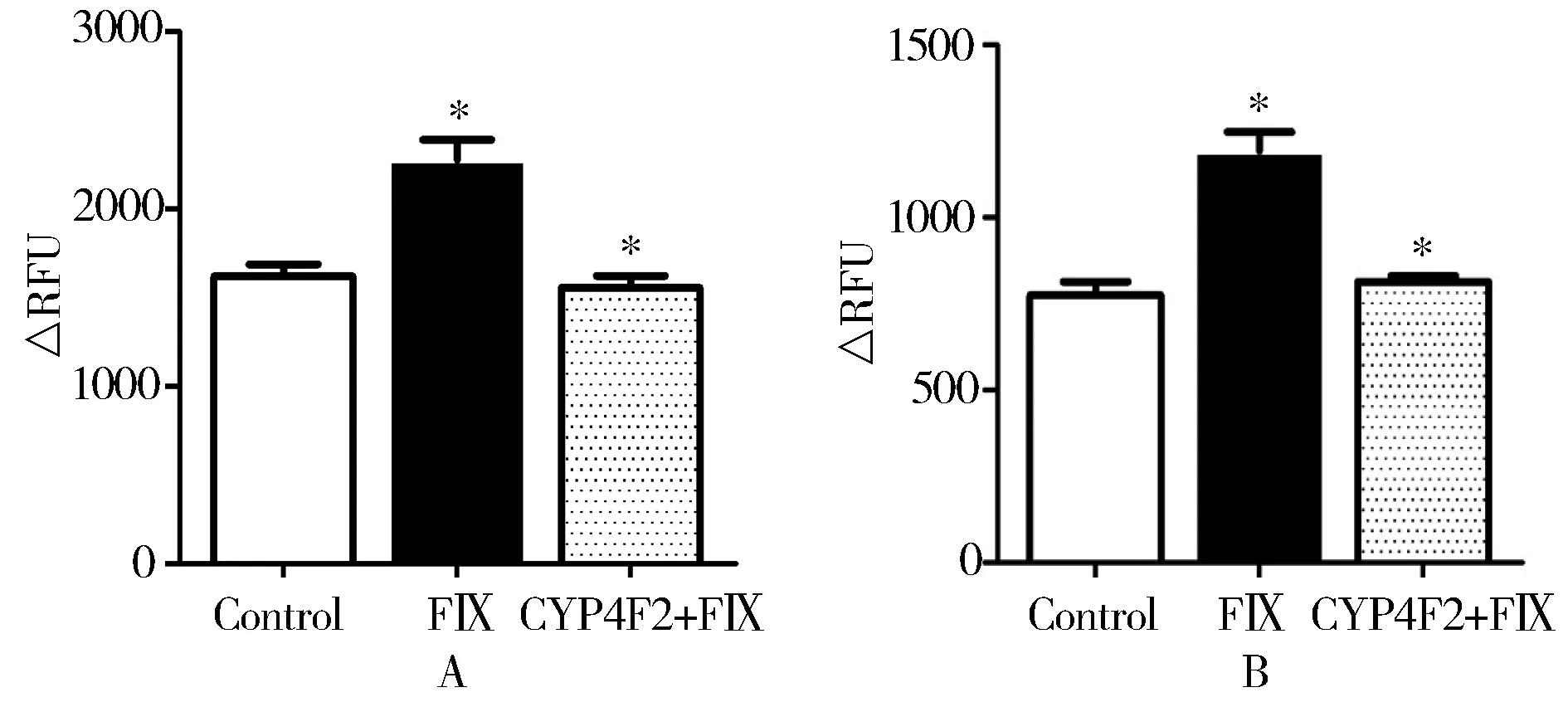
图3 各组LO2细胞裂解液和培养上清液中FⅨa定量分析Figure 3 Quantitative analysis of FⅨa in cell culture supernatant and lysis solution from different plasmids
A: cell supernatant; B: cell lysates. Control: empty plasmid (pIRES); FⅨ: recombinant plasmid (pIRES-FⅨ); CYP4F2+FⅨ: recombinant plasmid (pIRES-FⅨ-CYP4F2); RFU: relative fluorescence units. Compared with control group,*P<0.05
3 讨 论
CYP4F2基因是CYP450超家族的成员之一,位于19号染色体短臂,全长约20 kb,由13个外显子和12个内含子组成[7]。CYP4F2编码的蛋白具有氧化水解维生素K的功能,通过羟基化维生素K苯基侧链导致维生素K循环中还原型维生素K水平下降[1]。CYP4F2基因突变后对维生素K的代谢能力改变,造成维生素K蓄积或减少。多个研究表明CYP4F2*3基因型与华法林高剂量有关[8,9]。但CYP4F2与出血并发症的相关性及作用机制研究相对较少。本研究通过在人肝细胞中过表达CYP4F2和FⅨ后发现,CYP4F2对维生素K依赖性凝血因子的活化具有抑制作用。该研究表明,CYP4F2的过表达可能增强了对维生素K循环中维生素K的氧化水解,导致还原型维生素K含量降低,进而导致凝血因子γ羧化反应减弱,凝血因子活性降低。由于经肝脏维生素K循环进行的凝血因子γ羧化反应的变化与维生素K拮抗剂华法林出血并发症的发生直接相关,因此,本研究为前期发现的CYP4F2基因变异型与华法林出血并发症的关联性提供了生物功能依据[4,10]。
本研究通过补充外源性维生素K1使细胞培养液中维生素K1浓度达到3 nmol/L,该浓度与人血浆中维生素K浓度接近[11,12],因此,既能保证细胞完成正常的维生素K循环,又能避免外源性维生素对实验造成的干扰。由于FⅨ是分泌蛋白,因此本研究分别采用细胞裂解液和细胞培养上清液作为样本检测FⅨa的活性。结果显示,无论是在细胞裂解液还是细胞培养上清液中,过表达CYP4F2后,FⅨa的活性均降低。另外,在肝细胞的维生素K循环中VKOR为关键酶[5],在维生素K的氧化还原过程中发挥重要作用。本研究在细胞培养过程中未额外转染外源性VKOR,而是依靠细胞内源性VKOR完成维生素K循环及凝血因子羧化反应。这样可能存在因细胞内源性VKOR活性不足而影响结果,但是通过对维生素K依赖性凝血因子活性的检测发现,依靠肝细胞内源性VKOR能够实现维生素K循环催化的凝血因子羧化反应。
综上所述,本研究证实在肝细胞中过表达CYP4F2可导致维生素K依赖性FⅨa的活性降低。该结果将有助于进一步揭示CYP4F2基因与维生素K拮抗剂华法林出血关联性的相关功能机制。
【参考文献】
[1] Stafford DW. The vitamin K cycle[J]. J Thromb Haemost, 2005, 3(8): 1873-1878.
[2] Lewis BC, Nair PC, Heran SS,etal. Warfarin resistance associated with genetic polymorphism of VKORC1: linking clinical response to molecular mechanism using computational modeling[J]. Pharmacogenet Genomics, 2016, 26(1): 44-50. DOI: 10.1097/FPC.0000000000000184.
[3] Yin T, Miyata T. Warfarin dose and the pharmacogenomics of CYP2C9 and VKORC1 — rationale and perspectives[J].Thromb Res, 2007, 120(1) :1-10. DOI: 10.1016/j.thromres.2006.10.021.
[4] Wang HJ, Ma C, Yang J,etal. CYP4F2 polymorphism as a genetic risk factor for major hemorrhagic complications in Chinese patients on warfarin therapy[J]. J Geriatr Cardiol, 2012, 9(2): 209-210. DOI: 10.3724/SP.J.1263.2012.04162.
[5] Stec DE, Roman RJ, Flasch A,etal. Functional polymorphism in human CYP4F2 decreases 20-HETE production[J]. Physiol Genomics, 2007, 30(1): 74-81. DOI: 10.1152/physiolgenomics.00003.2007.
[6] Fregin A, Czogalla KJ, Gansler J,etal. A new cell culture-based assay quantifies vitamin K 2,3-epoxide reductase complex subunit 1 function and reveals warfarin resistance phenotypes not shown by the dithiothreitol-driven VKOR assay[J]. J Thromb Haemost, 2013, 11(5): 872-880. DOI: 10.1111/jth.12185.
[7] Bylund J, Finnstrom N, Oliw EH. Gene expression of a novel cytochrome P450 of the CYP4F subfamily in human seminal vesicles[J]. Biochem Biophys Res Commun, 1999, 261(1): 169-174. DOI: 10.1006/bbrc.1999.1011.
[8] Caldwell MD, Awad T, Johnson JA,etal. CYP4F2 genetic variant alters required warfarin dose[J]. Blood, 2008, 111(8): 4106-4112. DOI: 10.1182/blood-2007-11-122010.
[9] McDonald MG, Rieder MJ, Nakano M,etal.CYP4F2 is a vitamin K1 oxidase: an explanation for altered warfarin dose in carriers of the V433M variant[J]. Mol Pharmacol, 2009, 75(6): 1337-1346. DOI: 10.1124/mol.109.054833.
[10] Roth JA, Boudreau D, Fujii MM,etal. Genetic risk factors for major bleeding in patients treated with warfarin in a community setting[J]. Clin Pharmacol Ther,2014,95(6): 636-643. DOI: 10.1038/clpt.2014.26.
[11] Shea MK, O’Donnell CJ, Vermeer C,etal. Circulating uncarboxylated matrix gla protein is associated with vitamin K nutritional status, but not coronary artery calcium, in older adults[J]. J Nutr, 2011, 141(8): 1529-1534. DOI: 10.3945/jn.111.139634.
[12] Kamao M, Suhara Y, Tsugawa N,etal. Determination of plasma vitamin K by high-performance liquid chromatography with fluorescence detection using vitamin K analogs as internal standards[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2005, 816(1-2): 41-48. DOI: 10.1016/j.jchromb.2004.11.003.
