姜黄素在内脂素诱导内皮细胞炎症损伤中的作用机制
2017-04-20何晓乐王晓明
何晓乐,王晓明,葛 伟,李 榕,王 琳,王 宁,许 荣,贾 新,刘 军,2*
(1第四军医大学西京医院老年病科,西安 710032;2兰州军区总兰州医院全军骨科研究所,兰州 730000)
内质网应激(endoplasmic reticulum stress,ERS)是细胞为了维持内环境稳定而对未折叠或错误折叠蛋白和其他损伤内质网功能的一种自我保护反应[1]。ERS发生后,未折叠蛋白反应可引起一系列的细胞反应,持续或者急性ERS可导致细胞周期阻滞或细胞凋亡[2]。人类多种疾病的发生,如代谢紊乱疾病、神经变性疾病、炎性疾病和癌症等,都与ERS信号传导失调相关。研究表明,ERS参与多种细胞调节过程,如氧化应激、钙稳态失衡、自身免疫等。Fu等[3]的研究表明,金属硫蛋白可通过调节ERS来降低心肌细胞对阿霉素敏感性及乳酸脱氢酶(lactate dehydrogenase,LDH)的释放,从而抑制阿霉素对心肌的损伤作用。Ceylan-lsik等[4]通过老年C57BL小鼠试验发现,内皮素-1通过ERS可上调锌指转录因子(GATA binding factor-4,GATA-4)、心房钠尿肽(atrial natriuretic peptide,ANP)、自噬体蛋白P62,下调细胞内Ca2+及自噬标志物胰岛β细胞自噬相关基因1(islet β cell autophagy related gene 1,Beclin-1)、自噬相关基因5(autophagy related gene 5,ATG5)、ATG7等,诱导心肌细胞肥大和心脏间质纤维化。内脂素(visfatin)是Fukuhara等[5]发现的由一种脂肪细胞分泌的细胞因子,已证实重组内脂素可以剂量依赖形式产生炎症因子如肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin1β)、IL-6、IL-10等,也可成为CD14+单核细胞和CD19+B淋巴细胞的潜在趋化因子。研究发现,visfatin浓度为1×10-5mol/L时对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的影响最为明显[6]。本研究采用姜黄素(curcumin,Cur)干预visfatin诱导的 HUVECs损伤,探讨Cur改善内皮细胞炎症损伤的分子机制。
1 材料与方法
1.1 药物和试剂
HUVECs细胞株及MTT酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(第四军医大学免疫教研室),细胞黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、需肌醇激酶/核酸内切酶1(inositol-requiring transmembrane kinase/endonuclease-1,IRE1)、葡萄糖调节蛋白78(glucose-regulated protein78,GRP78)一抗(江苏:碧云天生物技术研究所);HRP羊抗鼠IgG二抗、siRNA、IRE1ɑ siRNA、二甲基亚砜 (dimethyl sulfoxide,DMSO)、胰蛋白酶、visfatin及Cur(Sigma公司,美国);低糖DMEM(dulbecco modified eagle medium)细胞培养基(HycLone公司,美国);小牛血清(四季青公司,杭州);RPMI-1640(roswell park memorial institute-1640)培养基(GIBCO公司,美国);细胞裂解液(碧云天公司,上海)。
1.2 HUVECs的培养
用含10%小牛血清的DMEM细胞培养基,在37℃、含5%CO2的培养箱内培养2~3 d,之后用0.25%胰蛋白酶进行消化。镜下观察到细胞收缩变圆时弃去消化液,加入培养液以终止胰蛋白酶的作用。用滴管吹打壁上的细胞,使其完全脱落并分离,根据实验需要按不同浓度接种于培养板或培养瓶中。
1.3 细胞分组及MTT法检测HUVECs活力
取对数生长期细胞,以2×105mol/ml浓度接种于多聚赖氨酸包被的96孔培养板中,于37℃、5%CO2培养箱中孵育,24 h内细胞达80%~90%融合,用含0.01%磷酸盐缓冲液(phosphate buffer saline,FBS)的DMEM培养液孵育细胞24 h,使细胞同步化。接种时分为4组: (1)正常对照组HUVECs在培养液中孵育 24 h;(2)visfatin组HUVECs在加入1×10-5mol/L visfatin的培养液中以2×105mol/ml浓度孵育24 h;(3)HUVECs在加入1×10-5mol/Lvisfatin和10 μmol/L Cur的培养液中孵育24 h;(4)HUVECs在加入1×10-5mol/L visfatin和 20 μmol/L Cur的培养中孵育24 h。每组按实验要求分别重复8孔。各组细胞孵育8 h后,弃去培养液,加入100 μl DMEM培养液和含0.5%的10 μl培养液,37℃、5%CO2的培养箱内孵育4 h后,弃培养液,加入100 μl DMSO原液,振荡10 min,待结晶完全溶解后拍照,酶标仪检测吸光度A值(λ=492 nm),记录结果,实验重复3次。
1.4 ELISA 法检测单核细胞趋化因子和E-选择素
HUVECs 以2×105mol/ml浓度接种于24孔培养板中,实验分组同上,将稀释好的包被抗体加入ELISA板,100 μl/孔,4℃放置48 h。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3 min。各组分别加待检样品100 μl/孔,置37℃、5%CO2培养箱中孵育1 h,然后洗涤。于各反应孔中,加入新鲜稀释的HRP羊抗鼠IgG二抗(经滴定后的稀释度)100 μl/孔,37℃、5%CO2培养箱中孵育0.5~1 h,洗涤。于各反应孔中加入临时配制的3’, 3’, 5’, 5’, -四甲基联苯胺(tetramethyl benzidine,TMB)底物溶液100 μl/孔,37℃下处理10~30 min。 在ELISA检测仪上,调至45 0nm处,以空白对照孔调零后测各孔OD值,并绘制标准曲线,计算单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)及E-选择素(E-selectin)的含量。
1.5 Western blotting测定IRE1、GRP78和ICAM-1蛋白表达
弃去培养液,使用预冷PBS轻轻漂洗一遍,随即加入细胞裂解液和蛋白酶抑制剂以裂解细胞。收集各组细胞加入细胞裂解液提取总蛋白,并用Bradford法测定蛋白质浓度,补上样缓冲液使总体积为80 μl,再加100 μl溴酚蓝染液煮沸4 min。然后各取10 μl样品,通过聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamid gel electrophresis,SDS-PAGE)进行分离,半干法将蛋白转移至硝酸纤维素膜,封闭,洗膜,加入1∶600稀释的抗ICAM-1、IRE1及GRP78的抗体,4℃过夜,用洗膜液漂洗后加入1∶5000稀释的二抗,摇床1 h,TBST(Tris-Buffer Solution Tween)冲洗3遍,每次5 min,加ECL荧光液显色,上机检测。用目标条带与内参条带(β-actin)积分吸光度值(integrated absorbance,IA)比值的百分率表示所检测蛋白的表达水平。
1.6 统计学处理
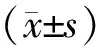
2 结 果
2.1 MTT法检测HUVECs 活力结果
MTT检测结果表明,与正常组相比,HUVECs单纯给予1×10-5mol/L visfatin或给予1×10-5mol/Lvisfatin与不同浓度的Cur联合处理24 h后,细胞活力没有明显变化。相比对照组和visfatin组,不同浓度Cur组(10、20 μmol/L)的HUVECs 细胞活力未降低,差异无统计学意义(P>0.05)。
2.2 Cur对visfatin诱导的HUVECs MCP-1和E-selectin含量的影响
与正常对照组相比,HUVECs给予1×10-5mol/Lvisfatin处理24 h后,HUVECs的MCP-1和E-selectin含量升高;而当给予10 μmol/L Cur和20 μmol/L Cur处理后,可显著降低HUVECs 的MCP-1和E-selectin含量,差异有统计学意义(P<0.05;图1),提示Cur可抑制visfatin诱导的HUVECs 的MCP-1和E-selectin含量的增加(图1)。
2.3 Cur对visfatin诱导的HUVECs ICAM-1、IRE1和GRP78表达的影响
与正常对照组相比,HUVECs给予visfatin处理24 h后,ICAM-1、IRE1和GRP78表达增加。而给予10 μmol/L和20 μmol/L Cur处理后,显著降低ICAM-1、IRE1和GRP78表达。提示Cur可通过减少ICAM-1、IRE1和GRP78的表达从而减轻visfatin诱导的HUVECs损伤(图2)。

图1 Cur对visfatin诱导的HUVECs MCP-1和E-selectin含量的影响Figure 1 Effect of Cur on MCP-1 and E-selectin production of the HUVECs induced by visfatin 1: Control group; 2: visfatin 1×10-5mol/L group; 3: visfatin 1×10-5mol/L+Cur 10 μmol/ml group; 4: visfatin 1×10-5mol/L+ Cur 20 μmol/ml group; HUVECs: human umbilical vein endothelial cells; MCP-1: monocyte chemoattractant protein-1. Compared with control group,*P<0.05; compared with visfatin group,#P<0.05; compared with Cur group,△P<0.05
3 讨 论
ERS及相应的未折叠蛋白反应(unfolded protein response,UPR)贯穿整个细胞周期。UPR主要通过以下3 种感受蛋白发挥作用:蛋白激酶R样内质网激酶、活化转录因子-6和IRE1。UPR发生时,IREl腔内结构域与GRP78解离,IRE1寡聚化引起自身磷酸化,从而激活许多与免疫、炎症和调亡相关的蛋白激酶。Hong等[7]发现IRE1ɑ/c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)途径参与氧化低密度脂蛋白及其脂质氧化产物7-酮基胆固醇和4-羟基壬烯醛诱导的人微血管内皮细胞凋亡和动脉粥样硬化(atherosclerosis,AS)形成。β受体阻滞剂体内和体外研究表明, 它可通过抑制ERS反应减轻细胞凋亡,并改善心肌肥大和心力衰竭问题[8]。体内外的研究发现,膜稳定剂(钠离子通道阻滞剂)亦能通过减轻ERS反应减少细胞凋亡,从而改善模型动物的心功能。Herzog等[9]发现,氧化低密度脂蛋白可通过修饰抑制蛋白二硫键异构酶,进而诱导ERS反应,引发血管内皮细胞凋亡。兔AS模型研究表明,高浓度同型半胱氨酸可诱导产生UPR,内皮细胞中C/EBP同源蛋白(C/EBP homologous protein)表达及内皮细胞凋亡与斑块大小呈正相关[10]。

图2 Cur对visfatin诱导的HUVECs ICAM-1、IRE1和GRP78表达的影响Figure 2 Effect of Cur on ICAM-1, IRE1 and GRP78 expression in the HUVECs induced by visfatin
1: control group; 2: visfatin 1×10-5mol/L group; 3: visfatin 1×10-5mol/L+Cur 10μmol/mL group; 4: visfatin 1×10-5mol/L+Cur 20 μmol/ml group. HUVECs: human umbilical vein endothelial cells; ICAM-1: intercellular adhesion molecule-1; IRE1: inositol-requiring transmembrane kinase/endonuclease-1; GRP78: glucose-regulated protein 78. Compared with control group,*P<0.05; compared with visfatin group,#P<0.05; compared with Cur group,△P<0.05
具有前炎症作用的visfatin能促进AS进程[11]。体外研究表明: visfatin通过增加细胞内的ICAM-1、血管黏附分子-1(vascular adhesion molecule,VCAM-1)、E-selectin及IL-6和IL-8的表达而诱使白细胞黏附于血管内皮细胞[12]。visfatin可促进机体内活性氧(reactive oxygen species,ROS)生成,活化多种因子如成纤维细胞生长因子-2、基质金属蛋白酶-2和9等[13]。Sahebkar等[14]报道,在AS及急性心肌梗死的活动斑块破裂处visfatin含量明显增高,提示其可导致斑块失稳。在临床研究中,冠状动脉硬化综合征患者血清visfatin含量明显增高。我们前期研究发现内皮细胞的炎症损伤和visfatin呈浓度依赖性,当visfatin 为1×10-5mol/L时,损伤程度最高。
Cur是从姜黄属中药块茎中提取出来的一种酚性色素,经济安全、副反应小且毒性低。目前已证实Cur具有如下功能:(1)具有酚及β-二酮的化学结构,其酚性羟基可结合或清除自由基,从而发挥抗氧化特性;(2)可在机体内增加载脂蛋白A含量,通过促进高密度脂蛋白胆固醇代谢和降低载脂蛋白B含量,降低低密度脂蛋白胆固醇-C的水平,从而达到降脂目的;(3)降低体内C反应蛋白、结合珠蛋白及IL-1β水平,提高一氧化氮水平,其可作为抑制剂拮抗花生四烯酸代谢中的环氧酶和脂氧酶,减少前列腺素D2、E2、F2a及白三烯等促炎症因子的释放;(4)通过下调核转录因子-κB活性,干扰蛋白激酶C信号传导,直接或间接抑制肿瘤细胞增殖。
本研究采用前期研究摸索出的visfatin的浓度作用于HUVECs,建立实验组后,加入不同浓度Cur,MTT法结果表明细胞活力未见明显变化,差异无统计学意义,表明Cur对HUVECs生长活性无抑制和毒性作用。后期实验结果表明,与visfatin组相比,HUVECs给予10 μmol/L和20 μmol/L Cur的处理后,MCP-1、E-selectin等炎症指标含量下降,同时Cur可下调ICAM-1、IRE1、GRP78的表达,且浓度为20 μmol/L时作用最显著。分析其机制,可能为:(1)Cur分子中的2个苯丙烯酰基骨架、苯环上的酚羟基和甲氧基及丙烯基与β-双酮/烯醇式结构的连接有助于其发挥抗氧化应激作用,其中甲氧基的存在进一步增加其抗氧化活性[15];(2)Cur通过直接抑制微粒体的前列腺素E2合酶-1阻断PGE2的生物合成,在转录或翻译水平调节液态氧和环氧化酶2[16];(3)Cur具有抑制MCP-1激活单核细胞和巨噬细胞、释放溶菌酶、上调单核细胞和巨噬细胞黏附分子和IL-1、IL-6水平的作用;(4)Cur可通过过氧化物酶产生苯氧基团,协同氧化细胞内谷胱苷肽或烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate,NADH),通过摄入O2形成ROS[17]。
综上所述,ERS可能参与visfatin诱导的HUVECs炎症损伤过程,Cur可抑制visfatin的作用,对内皮细胞具有保护功能,其机制可能与抑制ERS相关。本研究为我们将来更好地研究Cur的作用效果和ERS在血管内皮损伤中的机制提供初步依据,但它们之间是否涉及其他信号传导通路尚需进一步研究。
【参考文献】
[1] Marí M, Morales A, Colell A,etal. Mitochondrial cholesterol accumulation in alcoholic liver disease: role of ASMase and endoplasmic reticulum stress[J]. Redox Biol, 2014, 3: 100-108. DOI: 10.1016/j.redox.2014.09.005.
[2] Wang G, Liu K, Li Y,etal. Endoplasmic reticulum stress mediates the anti-inflammatory effect of ethyl pyruvate in endothelial cells[J].PLoS One, 2014, 9(12): e113983. DOI: 10.1371/journal.pone.0113983.
[3] Fu Z, Guo J, Jing L,etal. Enhanced toxicity and ROS generation by doxorubicin in primary cultures cardiomyocytes from neonatal metallothionein-Ⅰ/Ⅱ null mice[J].ToxicolinVitro, 2010, 24(6): 1584-1591. DOI: 10.1016/j.tiv.2010.06.009.
[4] Ceylan-lsik AF,Dong M,Zhang Y,etal. Cardiomyocyte-specific deletion of endothelin receptor A rescues aging-associated cardiac hypertrophy and contractile dysfunction: role of autophagy[J].Basic Res Cardiol, 2013, 108(2): 335. DOI: 10.1007/s00395-013-0335-3.
[5] Fukuhara A, Matsuda M, Nishizawa M,etal. visfatin: a protein secreted by visceral fat that mimics the effects of insulin[J]. Science, 2005, 307(5708): 426-430. DOI: 10.1126/science.1097243.
[6] 何晓乐, 刘 军, 张航向, 等. TLR4/NF-κB信号转导通路介导吡格列酮在内脂素诱导内皮细胞炎症损伤过程中作用机制的探讨[J].中华老年多器官疾病杂志, 2015, 14(4): 301-306. DOI: 10.i1915/j.issn.1671-5403.2015.04.06.
He XJ, Liu J, Zhang HX,etal.TLR4/NF-κB signal pathway mediates pioglitazone protecting human vascular endothelial cells against visfatin-induced injury[J]. Chin J Mult Organ Dis Elerly, 2015, 14(4):301-306. DOI: 10.i1915/j.issn.1671-5403.2015.04.06.
[7] Hong S, Gu Y, Gao Z,etal. EGFR inhibitor-driven endoplasmic reticulum stress-mediated injury on intestinal epithelial cells[J].Life Sci, 2014, 119(1-2): 28-33. DOI: 10.1016/j.lfs.2014.10.008.
[8] Breckwoldt MO, Chen JW, Stangenberg L,etal. Tracking the inflammatory response in strokeinvivoby sensing the enzyme myeloperoxidase[J]. Proc Natl Acad Sci USA, 2008, 105(47): 18584-18589. DOI: 10.1073/pnas.0803945105.
[9] Herzog DP, Dohle E, Bischoff I,etal. Cell communication in a coculture system consisting of outgrowth endothelial cells and primary osteoblasts[J].Biomed Res Int, 2014, 2014: 320123. DOI: 10.1155/2014/320123.
[10] Lu H, Lu L, Xu ZC,etal. Tauroursodeoxycholic acid and 4-phenyl butyric acid alleviate endoplasmic reticulum stress and improve prognosis of donation after cardiac death liver transplantation in rats[J]. Hepatobiliary Pancreat Dis Int, 2014, 13(6):586-593. DOI: 10.1016/S1499-3872(14)60269-1.
[12] Hognogi LD, Simiti LV.The cardiovascular impact of visfatin — an inflammation predictor biomarker in metabolic syndrome[J]. Clujul Med, 2016, 89(3): 322-326.DOI: 10.15386/cjmed-591.
[14] Sahebkar A, Giorgini P, Ludovici V,etal. Impact of statin therapy on plasma resistin and visfatin concentrations: a systematic review and meta-analysis of controlled clinical trials[J]. Pharmacol Res, 2016, 111: 827-837. DOI: 10.1016/j.phrs.2016.07.031.
[15] Lewis JD, Ferrara A, Peng T,etal. Risk of bladder cancer among diabetic patients treated with Cur: interim report of a longitudinal cohort study[J]. Diabetes Care, 2011, 34(4): 916-922. DOI: 10.2337/dc10-1068.
[16] Sato K, Awasaki Y, Kandori H,etal. Suppressive effects of acid-forming diet against the tumorigenic potential of Cur hydrochloride in the urinary bladder of male rats[J]. Toxicol Appl Pharmacol, 2011, 251(13): 234-244. DOI: 10.1016/j.taap.2011.01.006.
[17] Yang X, Chan JC. Comment: analyses using time-dependent pioglitazone usage in Cox models may lead to wrong conclusions about its association with cancer[J]. Diabetes Care, 2011, 34(8): 136-137. DOI: 10.2337/dc11-0627.
