轻度镇静对幕上占位病人神经功能的影响与头部磁共振表现的相关因素分析
2017-04-19周建新韩如泉
林 楠 周建新 韩如泉*
(1.首都医科大学附属北京天坛医院麻醉科,北京 100050; 2. 首都医科大学附属北京天坛医院重症监护室,北京 100050)
·临床研究 ·
轻度镇静对幕上占位病人神经功能的影响与头部磁共振表现的相关因素分析
林 楠1周建新2韩如泉1*
(1.首都医科大学附属北京天坛医院麻醉科,北京 100050; 2. 首都医科大学附属北京天坛医院重症监护室,北京 100050)
目的 本研究通过分析幕上占位病人头部磁共振表现,发现不同镇静药诱发神经缺陷的病人存在的危险因素。方法 该研究为前瞻性、随机、单盲对照研究。符合纳入标准的病人采用数字表法随机分配至异丙酚组、咪达唑仑组、芬太尼组或右美托咪啶组。每组病人均使用相应镇静药物滴定至清醒镇静评分(Observer’s Assessment of Alertness and Sedation, OAA/S)4分,给予镇静药物之前和之后进行美国国立卫生院卒中评分(National Institutes of Health Stroke Scale, NIHSS),并在评估过程结束后详细记录头部核磁结果。结果 本研究发现不同机制的镇静药物在轻度镇静的情况下对于幕上肿瘤的病人神经功能缺陷有着暴露或恶化的作用。病变位于运动区(P=0.000)、感觉区(P=0.004)、累及基底节(P=0.031)和发生中线移位(P=0.000)、脑室扩张或压缩(P=0.000)、瘤周水肿时(P=0.000)的肿瘤更容易引起镇静相关的神经功能缺陷。结论 头部磁共振显示为运动区和中线移位的病人神经功能改变对轻度镇静更敏感。但是对于镇静药物对脑功能影响的机制还有待于进一步探讨。
镇静;神经功能缺陷;颅内占位;磁共振
对于神经系统受到损伤的病人来说,神经功能的评估非常必要。无论是在手术室内还是病房或重症监护室,对于神经外科的病人在用药选择上都有着其特殊的考虑,目的是为了尽量避免对神经功能评估的影响[1]。特别是功能区或功能区附近占位的病人,详尽的神经功能评估则十分必要,如语言、运动功能,同时也通过反复的评估来监测病人的病情变化,以便指导治疗干预。
目前镇静所诱发的神经功能改变的发生率、危险因素以及与肿瘤位置的关系都缺乏有力的证据和相关的研究。因此,有必要结合头部核磁结果对颅内占位的病人在接受不同机制的镇静药后进行细致的神经功能的评估和观察,从而试图寻找最合理且对神经功能影响最小的镇静药物,为临床用药提供指导,同时也为解释一些非神经外科因素的神经功能缺陷提供参考。
1 对象与方法
1.1 研究对象
本研究为前瞻性、单中心、随机、单盲自身对照研究。研究人群为进行开颅肿瘤切除术之前的幕上肿瘤病人(“额叶”和/或“颞叶”和/或“顶叶”占位)。试验过程在首都医科大学附属北京天坛医院神经外科手术室中进行。纳入标准:连续纳入幕上占位行择期开颅手术的病人(额-颞-顶区域),年龄18~65岁,美国麻醉医师协会评分(American Society of Anesthesiologist, ASA)分级Ⅰ~Ⅱ级,入选者均签署知情同意书。有以下情况之一的病人被排除:(1)不能配合神经功能评估;(2)有精神疾患或症状;(3)24 h之内口服或静脉使用过镇静药物;(4)24 h之内口服或静脉使用过镇痛药物;(5)药物滥用和乙醇滥用;(6)孕产期和/或哺乳期的女性病人;(7)颅内复发肿瘤的病人。
共纳入病人143例,其中排除1例不能配合研究、1例合并小儿麻痹一次肢体偏瘫、6例复发胶质瘤或脑膜瘤,余135例病人纳入分组,经过随访和剔除,每组共纳入30例进行统计分析,总计120例。
本研究通过了首都医科大学附属北京天坛医院伦理委员会的审批(伦理审查批号为:kylw-2010-017-02)。并且通过了中国临床试验注册(注册号:ChiCTR-TRC-13003774 )。对符合纳入标准的病人在术前1d进行访视,详细向病人和家属解释试验过程,征求病人和家属的同意。
1.2 随机单盲和分组隐匿
研究对象被分为4个镇静药物组,即异丙酚组,咪达唑仑组,芬太尼组和右美托咪啶组。受试病人采用数字表法随机分组。由于4种药物的起效时间不同,2~10 min不等(比如异丙酚只需要1~2 min起效,而右美托咪啶则需7~10 min起效),起效后的临床表现也各有不同,且这些特性无法被掩盖,因此无法做到评估者盲,只能进行受试者单盲。研究者只有在评估结束后才可获取头部磁共振的详细描述和结果。受试病人只被随机分配1次,对研究者实行分配隐匿,即当天才告知试验药物组。
1.3 试验研究的干预方案
受试病人随机接受其中一种镇静药物滴定剂量至相同的镇静水平,通过清醒镇静评分(Observer’s Assessment of Alertness/Sedation, OAA/S)对病人的镇静深度进行评估,并且镇静药物滴定至4分,即轻声呼叫即可唤醒的轻度镇静状态。在OAA/S达到4分时对受试病人的各项神经功能进行美国国立卫生院卒中评分(National Institute of Health Stroke scale, NIHSS)。NIHSS可用于临床中评价神经中枢受损的病人其神经功能的变化,包括了意识水平、意识指令、感觉、运动、肢体共济、视野、面瘫、语言功能等的受损情况。如果NIHSS的分值没有变化,则追加一次镇静药物,并维持镇静深度仍在OAA/S=4分,随后进行第2次NIHSS。如果NIHSS与基础值相比改变大于等于2分,则在本研究中定义为神经功能的阳性改变;如果小于2分,则定义为阴性改变。
每次的给药剂量按照预定的方案进行,其给药方案见表1。
1.4 试验研究的持续时间和剔除标准
研究在手术室内进行,并且在给予术前药物之前进行。研究的发生以下任何一种情况是则需提前终止,受试病人被剔除:(1)给予镇静药物后收缩压<90 mmHg (1 mmHg=0.133 kPa)或 >180 mmHg;给予0.5 mg阿托品后心率仍<50次/min;血氧饱和度<90%;过度镇静,即OAA/S≥3分;在给予上述全量的镇静药物后仍然达不到预期的镇静深度(OAA/S=5分);出现严重的药物不良反应,如呼吸抑制、血流动力学不平稳、躁动等。
1.5 研究数据收集
术前访视时收集病人的一般信息、临床表现和既往史。给予镇静药物之前和之后详细记录病人的血压、心率、血氧饱和度和脑电双频谱指数(bispectral index,BIS)等生命体征,以及评估和记录 OAA/S 分值和 NIHSS分值。研究过程中其他必要药物的使用也进行了详细记录。评估后记录头部磁共振的结果,包括:肿瘤位置、肿瘤直径、中线移位情况、脑室扩张或受压情况、肿瘤周围水肿情况和肿瘤出血情况。
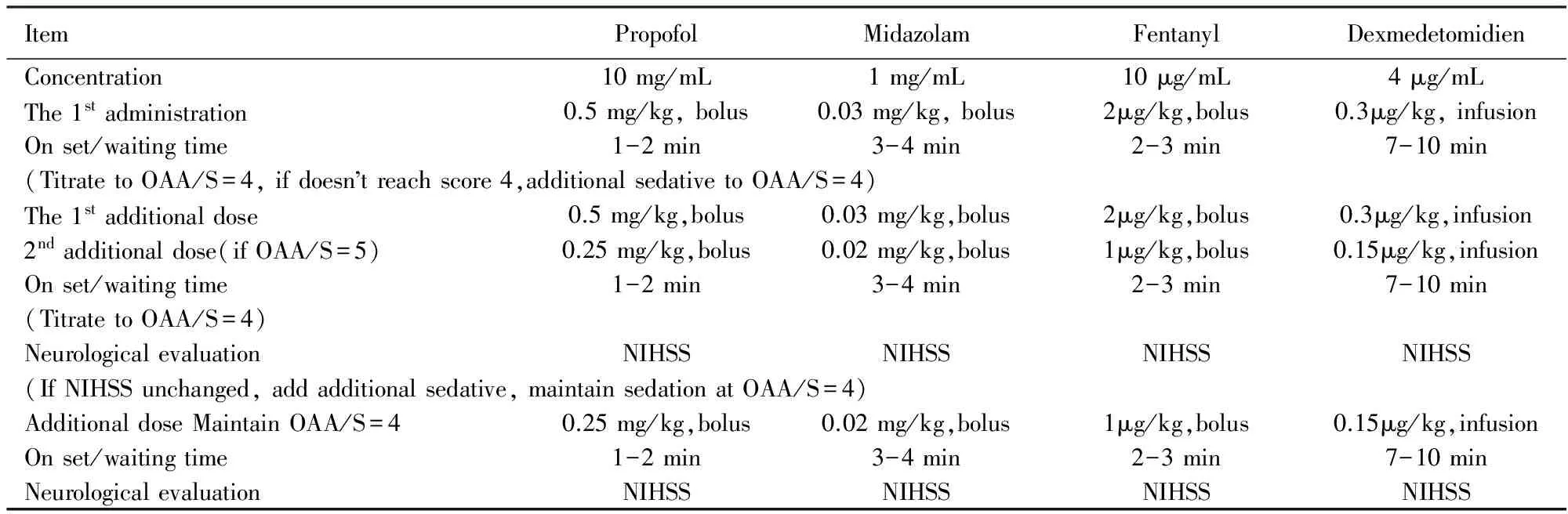
表1 研究给药方案和流程
OAA/S:Observer’s Assessment of Alertness and Sedation; NIHSS: National Institutes of Health Stroke Scale.
1.6 研究终点
主要研究终点:轻度镇静后NIHSS的变化值与头部磁共振结果之间的关系,包括肿瘤位置、中线移位情况、脑室扩张或压缩情况、瘤周水肿和出血情况等。
次要研究终点:镇静前后的生命体征(血压、心率、血氧饱和度)、BIS,受试者的神经疾病相关临床表现。
1.7 统计学方法
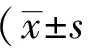
2 结果
2.1 轻度镇静后生理指标的变化
给予不同镇静药后,由于药物药理学特性的影响,病人的血压、心率、血氧饱和度和BIS值等生理指标发生了相应的变化,但均维持在纳入标准之内。各项指标均为正态分布,各药物组之间对生理学参数的影响详见表2。
给予不同镇静药后,平均动脉压(F=8.653,P=0.000)、心率(F=15.338,P=0.000)和BIS(F=3.637,P=0.016)的改变在各组间差异有统计学意义;由于病人持续性吸入100%(体积分数)纯氧,血氧饱和度在给药前后各组间差异无统计学意义(F=0.287,P=0.835)。LSD检验显示平均动脉压异丙酚与芬太尼(P=0.000)、异丙酚与右美托咪啶(P=0.002)、咪达唑仑与芬太尼(P=0.001)组间比较,差异有统计学意义(P<0.05)。咪达唑仑和右美托咪啶心率比较,差异有统计学意义(P=0.000)。芬太尼和右美托咪啶BIS值比较,差异有统计学意义(P=0.002)。
2.2 对镇静诱发NIHSS改变的影响
表3中汇总了本项研究中从磁共振成像(magnetic resonance imaging,MRI)结果中所判读出的不同影像学表现(由首都医科大学附属北京天坛医院神经影像科的专业医师提供),以及各项对于镇静诱发的NIHSS阳性改变的影响。其中病变位于运动区、感觉区、累及基底节和发生中线移位、脑室扩张或压缩、瘤周水肿时,镇静药诱发的NIHSS阳性改变差异有统计学意义(P<0.05)。上述影像学表现可能是单纯的脑区占位,也可能是同时累及多个区域。图1为代表性运动区病变和中线移位病变的头部MRI结果。
2.3 Logistic回归分析
基于影像学表现,结合所有4组病人的症状、病理类型,通过Logistic回归分析影响镇静诱发的NIHSS分值改变的因素,因变量为NIHSS分值,自变量包括肢体是否有运动感觉异常症状、是否有癫痫症状、世界卫生组织(World Health Organization, WHO)病理分级(低级别或高级别)、肿瘤是否位于功能区、中线是否有移位、脑室是否有扩张或压缩,进行二分类Logistic回归分析,评价这些因素对于镇静诱发的神经功能改变的影响。Logistic回归结果显示有影响的危险因素如表4所示。

表2 给予镇静药前后生理指标的变化
BP:blood pressure; HR:heart rate; SpO2:pulse oxygen saturation; BIS:bispectral index;95%CI:95% confidence interval;△1 mmHg=0.133 kPa.
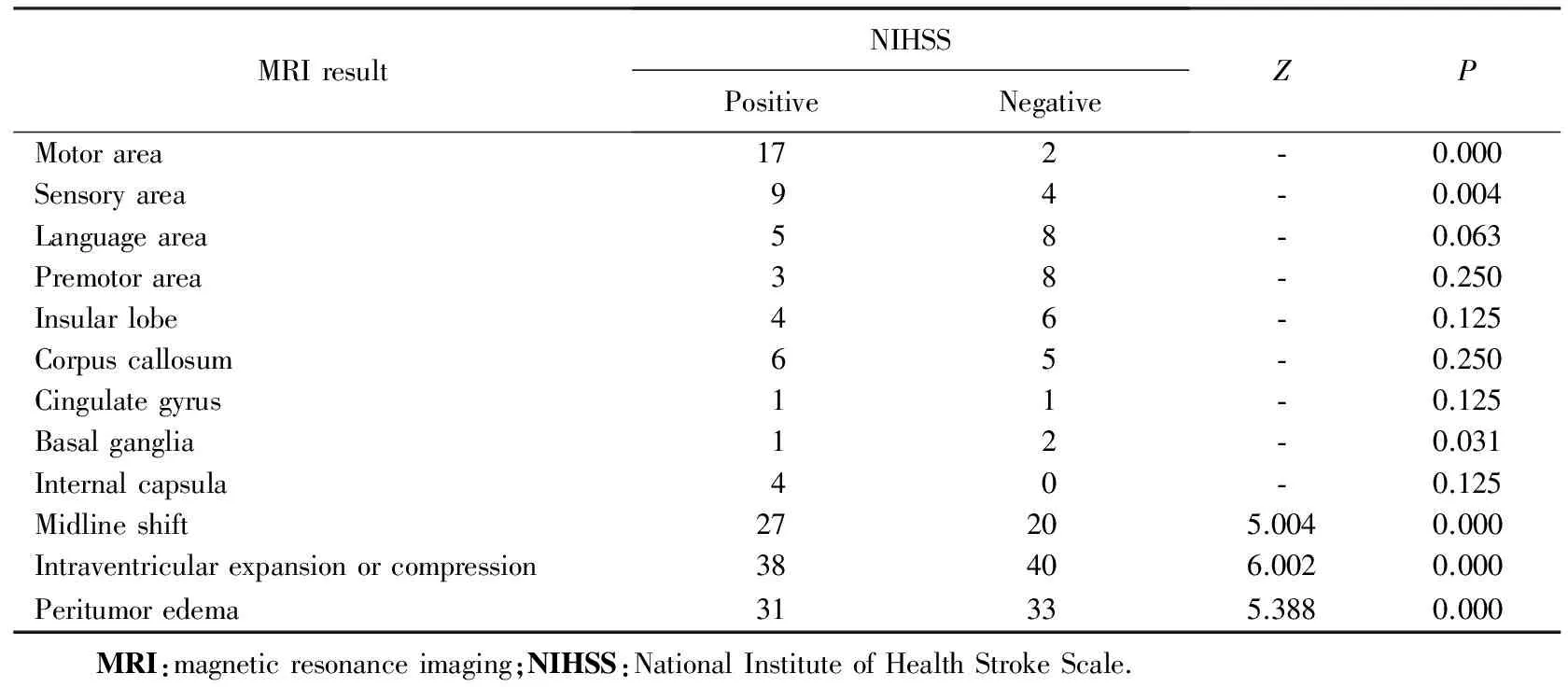
表3 头部MRI结果与镇静诱发的NIHSS阳性改变发生率的关系
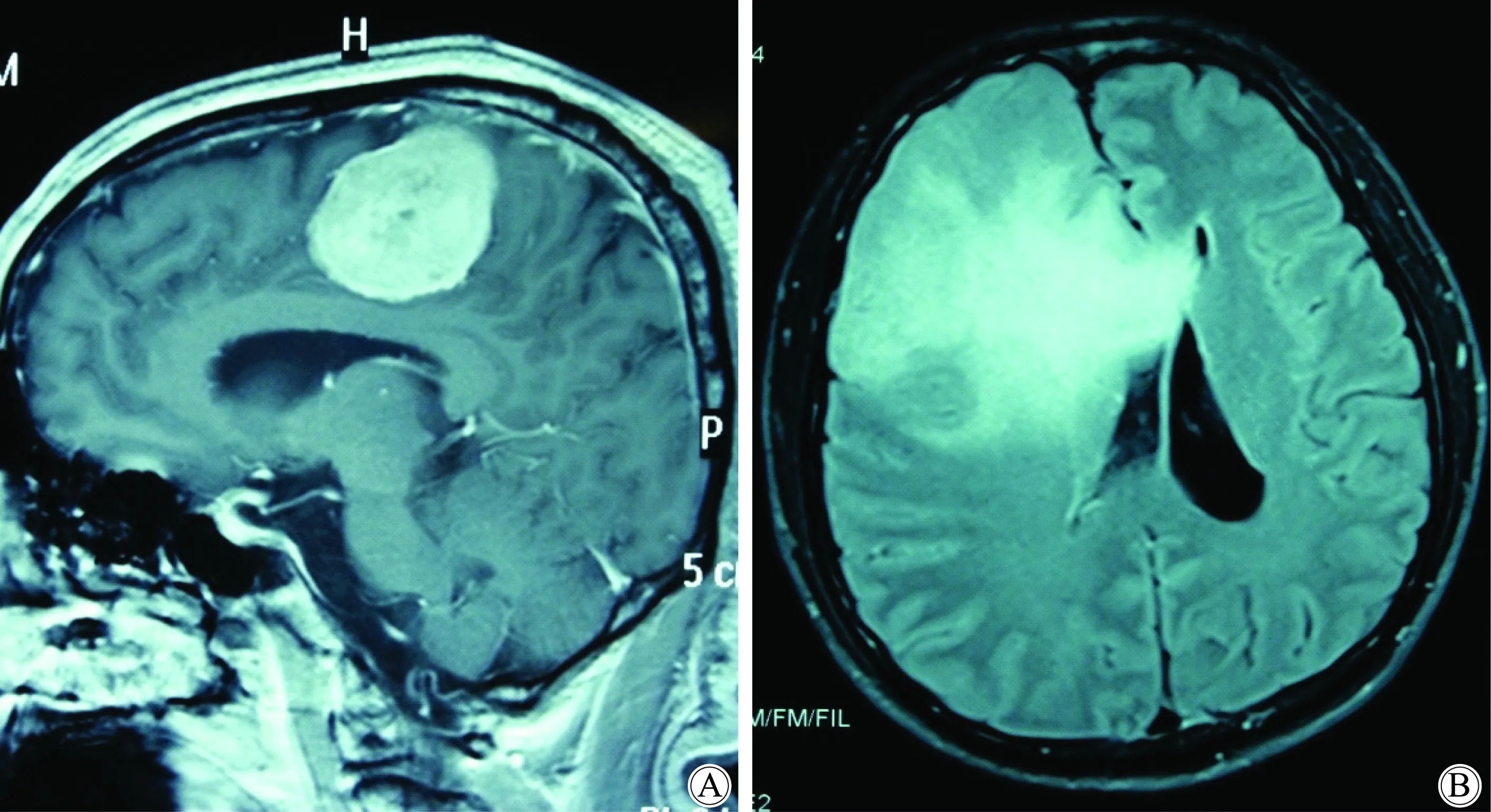
图1 头部MRI影像结果
A:tumor is located in motor area in sagittal view; B:midline shift in axial view. A and B are different patients; MRI:magnetic resonance imaging.
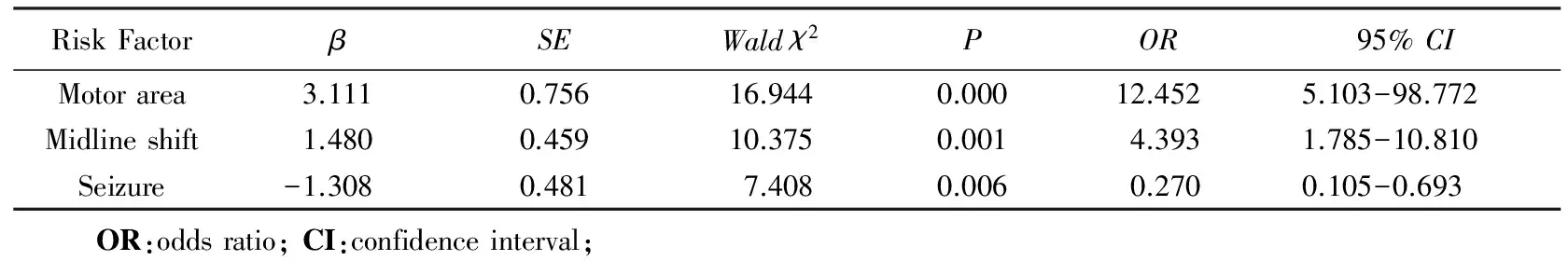
表4 Logistic回归分析镇静诱发神经功能改变的危险因素
通过Logistic回归分析,最终肿瘤位于运动区和MRI显示中线有移位的病人出现镇静诱发的神经功能改变的危险分别是无上述表现病人的12倍和4倍,有癫痫症状的病人不易引起镇静诱发的神经功能改变。
3 讨论
本研究发现镇静药在轻度镇静时对幕上肿瘤的病人神经功能缺陷有暴露或恶化的作用,位于运动区和引起中线移位的肿瘤更易引起镇静相关的神经功能缺陷。
3.1 镇静诱发的神经功能缺陷
镇静作用在神经外科手术中可能加重神经功能缺陷的作用早在1992年就被一名经验丰富神经外科麻醉医生所发现,主要变现为一些神经系统病变的病人在术后苏醒期出现一过性神经功能缺陷暴露或加重,并将之命名为“差异性苏醒”[2]。但后来被人们理解为泛化的麻醉苏醒期反应并忽略,而事实上,这种现象只存在与有中枢神经系统病变的一部分病人身上。随后又一些小样本的研究再度证实了有一些病人会出现神经外科术后的一过性神经缺陷[3]。多数情况下,神经外科医生会首先考虑神经外科因素,但很多病人的神经缺陷会在几个小时到几天之内缓解或消失,虽然目前已经证实脑内存在强大的损伤后代偿机制,但是代偿机制的功能发挥是需要时间的,因此我们目前考虑神经症状的加重可能与中枢存留的低剂量镇静药物有关。
3.2 神经功能评分
研究中对于神经功能的评分——NIHSS包括11项内容,涵盖了意识水平(第1项)、视觉功能(第2、3项)、面部功能(第4项)、运动功能(第5、6项)、共济功能(第7项)、感觉功能(第8项)、语言功能(第9、10项)和注意功能(第11项)[4]。所有的病人在给予低剂量镇静药达到轻微的镇静状态时,NIHSS的第一项意识水平必然得到1分,因此,除了意识水平外,其他项目出现分值的改变才被视作神经功能受到了药物的影响。当然,需要强调的是,评分在本研究中并非是诊断作用,而是评价镇静相关的神经功能可逆性改变。因此,即使镇静诱发了NIHSS分值变化,也不能诊断病人在清醒状态下具有这些神经功能障碍。
3.3 镇静与脑功能代偿重塑
与以往所认为的“静态”脑功能模式不同,脑功能的塑造可以自发的或受到外界因素影响,发生增强和代偿。低剂量镇静药的作用与脑功能、脑功能代偿之间存在联系,这可能与镇静药的作用机制和功能代偿的作用机制相重叠有关。众所周知,麻醉临床常用的有镇静作用的药物作用于中枢的一些重要受体如GABA受体、NMDA受体、中枢肾上腺素受体等从而产生镇静,而这些受体又恰恰是与神经功能形成和代偿有关的重要受体。相关的受体和通路广泛存在于大脑皮质,在有颅内病变的病人中,病变及其周围的受体也发生了受体分布和数量的变化[5]。Nudo[6]提出,大脑皮层损伤的运动功能重建过程中,GABA-A受体的下调和NMDA受体的上调不仅发生在损伤侧大脑运动区、感觉区和运动前区,同时还存在于对侧,并且两侧的重建代偿机制是相同的。目前所谓的“功能区”也只能称之为广义的已知的功能支配区域,事实上,大脑皮质和皮质下的神经神经网络结构和联接在更广泛的区域发挥着作用从而共同完成一个特定的功能,因此,即使有些病变在解剖学上累及了功能区,但却不表现出任何明显的理论上应该出现的神经功能损伤[7],进一步证明了损伤后大脑内广泛存在强大的代偿和功能重塑机制。本研究中出现的镇静药诱发的神经功能缺陷暴露可能是由于药物减弱或抑制了上述不稳定的神经功能代偿,使脑功能重塑机制受到干扰,从而暴露出病变本身所导致的神经功能损害。但无法确定究竟是通过哪一种机制来发挥作用的,或很可能是多种机制共同作用的结果。
对于颅内占位的病人来说,通过临床现象和功能磁共振推测,术前没有任何神经功能缺陷的病人可能存在以下4种功能代偿重建机制[8]:第一,生长缓慢的肿瘤内部本身就存在一定的功能[9];第二,肿瘤周围的功能区域代偿了损伤部位的功能[6],比如运动区损伤后感觉区和运动前区的参与,一个区域损伤可能通过增强另一个区域的功能来平衡整体功能;第三,远离损伤部位的区域在受损半球一侧通过联接机制发生代偿[6];第四,不仅受损半球侧存在代偿,大脑半球的对侧也会通过双侧的联接重塑脑功能[6, 10],这可能是通过直接激活对侧功能,也可能是通过解除损伤侧的抑制来加强对侧功能区的代偿活动[11]。这4种机制不一定单独存在,可能是一种由低到高的级别性结构调整,使不同的机制逐渐发挥作用,也可能是一种机制无法发挥作用后启动更高一层的机制。这些机制可能与病变发生发展的时间和病变的恶性程度均有关系[12]。
3.4 镇静诱发的神经功能缺陷病人的核磁特点分析
头部磁共振结果显示的中线移位的病人更容易出现镇静相关的神经功能改变。脑内的代偿可发生于病变侧或病变对侧,尤其对于颅内肿瘤的病人来说。动物的皮质下卒中模型也表明,胼胝体纤维对参与皮质运动感觉的代偿和重塑有重要作用[13]。很多研究[12-14]证实颅内肿瘤的病人受累肢体同侧的运动区可被激活,这可能通过连接两侧大脑半球的连合纤维发生。连合纤维穿胼胝体后呈扇形穿大脑半球,终止于每侧大脑半球内的同位皮质区,除了初级视觉皮质和手部足部的躯体感觉皮质外,其他同位皮质区多通过连合纤维联接。因此推测,中线移的时,连合纤维介导的代偿变得不稳定,在发生对侧代偿的病人中,镇静药对此发生了抑制作用。对于Logistic回归中癫痫是否对镇静诱发神经功能改变具有保护作用还值得进一步探讨和商榷,其原因在于病人由于癫痫症状所服用的不同类型的抗癫痫药与神经功能和镇静药物的相互作用还不清楚,另外癫痫的发作类型、发作频率和癫痫病程的长短也并未考虑,由于样本量的原因无法根据上述情况进一步做亚组分型,因此尚无定论。
本研究存在一定的局限性,首先,给药方式TCI的给药方式可能更适合在评估期间维持稳定的脑内血药浓度,但是本研究的4种药物并非都具有TCI模型,鉴于NIHSS评分过程十分短暂,因此笔者认为可以采取阶梯给药的方式以达到同样的镇静深度,但由于各种镇静药的起效时间不同,药物特性不同,因此研究很难做到双盲; 第二,NIHSS评分的敏感性较低,所以可能会出现一些假阴性的结果,对于更加细致的功能评估如深感觉等无法获得;第三,研究只进行了主观评分,对临床表现的变化进行了评估,并没有采取神经电生理等客观指标进行参照。
综上所述,颅内占位的神经外科病人使用小剂量镇静药物时,会暴露潜在的神经缺陷或使已表现出来的神经缺陷加重,颅内占位位于初级运动区、造成中线移位的病人更容易发生镇静诱导的神经功能缺陷。脑内的代偿机制及其稳定性、肿瘤和周围组织对镇静药的敏感程度可能与镇静诱发的神经功能缺陷有关。对于各种机制的探讨还有待证实。
[1] Fabregas N, Bruder N. Recovery and neurological evaluation[J]. Best Prac Res Clin Anaesthesiol,2007, 21(4):431-447.
[2] Thal G D, Szabo M D, Lopez-Bresnahan M, et al. Exacerbation or unmasking of focal neurologic deficits by sedatives[J]. Anesthesiology,1996, 85(1):21-25.
[3] Cucchiara R F. Differential awakening[J]. Anesth Analg, 1992, 75(3):467.
[4] Goldstein L B, Samsa G P. Reliability of the National Institutes of Health Stroke Scale: Extension to non-neurologists in the context of a clinical trial[J]. Stroke, 1997, 28(2):307-310.
[5] Redecker C, Luhmann H J, Hagemann G, et al. Differential downregulation of GABAA receptor subunits in widespread brain regions in the freeze-lesion model of focal cortical malformations[J]. J Neurosci,2000, 20(13):5045-5053.
[6] Nudo R J. Mechanisms for recovery of motor function following cortical damage[J]. Curr Opin Neurobiol, 2006, 16(6):638-644.
[7] Pallud J, Audureau E, Blonski M, et al. Epileptic seizures in diffuse low-grade gliomas in adults[J]. Brain, 2014, 137(Pt 2):449-462.
[8] Duffau H. The huge plastic potential of adult brain and the role of connectomics: New insights provided by serial mappings in glioma surgery[J]. Cortex, 2014, 58:325-337. [9] Hayashi Y, Nakada M, Kinoshita M, et al. Functional reorganization in the patient with progressing glioma of the pure primary motor cortex: A Case Report with special reference to the topographic central sulcus defined by somatosensory-evoked potential[J]. World Neurosurg, 2014,82(3-4):536.
[10]Tozakidou M, Wenz H, Reinhardt J, et al. Primary motor cortex activation and lateralization in patients with tumors of the central region[J]. Neuro Image Clin, 2013, 2:221-228.
[11]Darling W G, Pizzimenti M A, Hynes S M, et al. Volumetric effects of motor cortex injury on recovery of ipsilesional dexterous movements[J]. Exp Neurol, 2011, 231(1):56-71.
[12]Duffau H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumour and brain plasticity[J]. Lancet Neurol, 2005, 4(8):476-486.
[13]Wang L E, Tittgemeyer M, Imperati D, et al. Degeneration of corpus callosum and recovery of motor function after stroke: a multimodal magnetic resonance imaging study [J]. Human Brain Map, 2012, 33(12):2941-2956.
[14]周建新.重症脑损伤患者镇痛镇静治疗专家共识[J]. 中国脑血管病杂志,2014,11 (1) :48-55.
编辑 慕 萌
Effects of mild sedation on neurologic function in patients with supratentorial mass lesion and the associated factors in head magnetic resonance imaging
Lin Nan1, Zhou Jianxin2, Han Ruquan1*
(1.DepartmentofAnesthesiology,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China;2.DepartmentofIntensiveCareUnit,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective Sedation may induce or exacerbate neurologic function in some patients with supratentorial mass lesion. This trial aimed to investigate the risk factor of sedative associated neurologic deficits in that population through analyzing head magnetic resonance imaging (MRI). Methods The study was a prospective, randomized, single-blind, controlled trial. Patients were randomly assigned to one of the four study groups, including ‘Propofol group’, ‘Midazolam group’, ‘Fentanyl group’ or ‘Dexmedetomidine group’. In each group, patients were titrated to Observer’s Assessment of Alertness and Sedation (OAA/S) score 4 with a ladder-like administration of the assigned drug to target this same sedation level. National Institutes of Health Stroke Scale (NIHSS) was applied to evaluate before and after the sedation. Patients’ magnetic resonance imaging (MRI) findings were collected after the evaluation. Results This study showed that mild sedation unmasked or exacerbated neurologic deficits in patients with supratentorial brain tumors. Patients with brain tumors in the primary motor area(P=0.000),primary sensory area(P=0.004), basil ganglion(P=0.031), with brain midline shift(P=0.000), brain ventricular compression or expansion(P=0.000) as well as present peritumor edema(P<0.001)had a higher probability of sedative related neurologic deficits. Conclusion The neurologic function altering is more sensitive to sedation if MRI displays a primary motor area mass lesion and brain midline shift. However the potential mechanism of sedative related neurologic deficits is still in need of further investigation.
sedation;neurologic deficit; brain mass lesion; magnetic resonance imaging
北京市留学归国人员资助项目(0000130130610634)。This study was supported by Beijing Municipal Fund for Returning Scholars(0000130130610634).
时间:2017-04-13 19∶53
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1953.028.html
10.3969/j.issn.1006-7795.2017.02.029]
R445.2
2016-10-24)
*Corresponding author, E-mail:Hanrq666@aliyun.com
