依帕司他对2型糖尿病大鼠肝损伤的作用
2017-04-19赵月蓉侯碧玉柳晨歌王晓波杜冠华管淑玉
赵月蓉 侯碧玉 柳晨歌 王晓波 杜冠华 张 莉* 管淑玉
(1.广东药科大学中药学院,广州 510006;2.中国医学科学院药物研究所靶点研究与新药筛选北京市重点实验室,北京 100050)
·基础研究 ·
依帕司他对2型糖尿病大鼠肝损伤的作用
赵月蓉1,2侯碧玉2柳晨歌2王晓波1,2杜冠华2张 莉2*管淑玉1*
(1.广东药科大学中药学院,广州 510006;2.中国医学科学院药物研究所靶点研究与新药筛选北京市重点实验室,北京 100050)
目的 探讨依帕司他对2型糖尿病大鼠肝损伤的作用及机制。方法 SD大鼠经高糖高脂饮食喂养联合腹腔注射45 mg·kg-1链脲佐菌素(Streptozotocin,STZ)建立2型糖尿病大鼠模型,将造模成功的大鼠分为模型对照组,依帕司他组(100 mg·kg-1)。另取12只正常SD大鼠设为正常对照组。依帕司他组连续8周灌胃给药,模型对照组和正常对照组给予0.5%(质量分数)羧甲基纤维素钠。观察依帕司他对2型糖尿病大鼠体质量、进食饮水量、血糖、血脂、肝功能、肝脏组织学及氧化应激反应的影响,并采用免疫组织化学方法检测肝脏组织中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达。结果 与模型对照组比较,给药8周后,依帕司他组大鼠空腹血糖和血脂降低,氧化应激反应降低,肝功能明显改善。病理学检查结果表明伊帕司他组大鼠肝脏炎性反应和纤维化病变较模型对照组减轻。免疫组织化学结果可见依帕司他组大鼠肝组织α-SMA和TGF-β1表达显著低于模型对照组。结论 依帕司他能够提高机体抗氧化能力,改善2型糖尿病大鼠氧化应激肝损伤,并且能够通过抑制肝星状细胞(hepatic stellate cell,HSC)的激活改善糖尿病大鼠肝纤维化。
依帕司他;2型糖尿病;氧化应激;肝纤维化
糖尿病是目前严重危害人类健康的重大疾病之一,世界卫生组织最新研究报告[1]显示,截至2014年,全球糖尿病病人高达4.22亿。预测到2030年,糖尿病将成为第七大主要死亡原因。随着糖尿病发病率的迅速上升,糖尿病肝损伤病人如非酒精性脂肪肝、肝纤维化、肝癌的病死率也在逐年上升[2]。研究[3]显示,糖尿病病人中终末期肝病的病死率高于心血管疾病。目前临床上还没有专门针对糖尿病肝病的治疗药物,现在的治疗主要是基于糖尿病本身,采用改善胰岛素抵抗、氧化应激、糖脂代谢紊乱药物和肝脏保护药物等药物治疗,同时联合高纤维低糖低脂饮食、控制体质量等非药物治疗加以控制,但存在疗效不确切等问题。
依帕司他为醛糖还原酶抑制剂,临床上主要用于治疗糖尿病神经病变,可很好地控制糖尿病病人血糖[4]。近年来研究[5-6]表明依帕司他能有效治疗早期糖尿病肾病,而且早期应用依帕司他治疗能预防糖尿病视网膜病变的发生。研究[7]显示,治疗剂量的依帕司他能够促进细胞内的谷胱甘肽合成,改善氧化应激,阻止氧化应激引起的相关疾病的发展。此外依帕司他还能抑制高糖所致的冠状动脉平滑肌细胞的迁移和血管紧张素-Ⅱ(angiotensin, Ang-Ⅱ)刺激的系膜细胞细胞外基质的合成[8]。但依帕司他对糖尿病肝损伤的作用至今鲜见报道。因此,本研究就依帕司他对糖尿病肝损伤的作用及机制进行了初步探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级Sprague-Dawley(SD)雄性大鼠,160~190 g,由北京华阜康生物科技股份有限公司提供,清洁级,实验动物许可证号:SCKK(京)2014-0004。
1.1.2 药品与试剂
依帕司他胶囊(扬子江药业集团南京海陵药业有限公司);链脲佐菌素(Streptozocin,STZ,Sigma公司,美国);总胆固醇、三酰甘油、低密度脂蛋白胆固醇、丙氨酸氨基转移酶、门冬氨酸氨基转移酶测定试剂盒(中生北控生物科技股份有限公司);糖化血清蛋白、丙二醛、超氧化物歧化酶测定试剂盒(南京建成生物工程研究所);8-羟基脱氧鸟苷测定试剂盒(武汉华美生物工程有限公司);罗氏全活力型血糖仪、罗氏全活力型血糖试纸(德国罗氏诊断有限公司);兔抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体,兔抗大鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)多克隆抗体(武汉博士德生物工程有限公司)。
1.1.3 仪器
光学显微镜(日本Nikon公司),全自动生化分析仪(日本东芝公司)。
1.2 方法
1.2.1 动物模型
SD大鼠适应性喂养1周后,采用随机数字表法分为正常对照组(Control, 12只)和糖尿病造模组(38只)。造模方法参考文献[9-10],稍作调整。造模组大鼠经高糖高脂饲料[77.5%(质量分数)基础饲料,10%(质量分数)蔗糖,10%(质量分数)猪油,2.0%(质量分数)胆固醇,0.5%(质量分数)胆酸盐]喂养4周后,禁食12 h,一次性腹腔注射45 mg·kg-1STZ(以pH4.2的柠檬酸缓冲溶液配制),正常对照组注射柠檬酸缓冲液。注射72 h后,动物禁食4 h尾尖取血,测定空腹血糖值。7 d后再次测定,以空腹血糖值超过11.1 mmol·L-1的动物为2型糖尿病大鼠模型。
1.2.2 分组与给药
选取24只造模成功的糖尿病大鼠随机数字表法分为模型对照组(Model)和依帕司他组(100 mg·kg-1·d-1,Epal),每组12只。模型对照组与依帕司他组持续饲喂清高脂饲料[87.5%(质量分数)基础饲料,10%(质量分数)猪油,2.0%(质量分数)胆固醇,0.5%(质量分数)胆酸盐]。依帕司他组连续灌胃给药8周,正常对照组和模型对照组灌服等量0.5%(质量分数)羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na)。
1.3 样本收集及指标检测
1.3.1 一般指标
给药后每周监测动物体质量。给药第4周和第8周分别测定24 h进食饮水量,以动物初始食水量与24 h后剩余食水量之差为24 h进食饮水量。每2周禁食4 h后尾尖取血,采用罗氏血糖仪测定空腹血糖(fasting plasma glucose,FPG),测定当天早7∶00禁食,10∶00给药,11∶00检测。
1.3.2 样本收集
末次给药后,动物禁食过夜,自由饮水,处死取血,取肝组织称质量,计算肝脏系数(肝脏质量/体质量×100%),留样用于病理检测。
1.3.3 血清指标检测
全自动生化分析仪检测血清总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、三酰甘油(triglyceride,TG)。试剂盒检测糖化血清蛋白(glucosylated serum protein,GSP),超氧化物歧化酶(superoxide dismutase,SOD),丙二醛(malondialdehyde,MDA)以及8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHdG)。
1.3.4 肝组织检查
1)HE染色:大鼠肝组织用组织固定液固定,石蜡包埋后切片脱蜡水化,Harris苏木素染3~8 min,1%(体积分数)盐酸乙醇分化数秒,氨水返蓝,伊红染色3 min,二甲苯脱水至透明,晾干,中性树胶封片。400倍光学显微镜观察肝组织病理学变化。
2)Masson染色:大鼠肝组织石蜡包埋后切片脱蜡水化,Regaud苏木精染色液染核5~10 min,先水洗后蒸馏水洗。Masson丽春红酸性复红液染色5~10 min,2%(体积分数)冰醋酸浸洗数秒,1%(质量分数)磷钼酸分化5 min。苯胺蓝染色5 min,0.2%(体积分数)冰醋酸浸洗数秒。95%(体积分数)乙醇、无水乙醇、二甲苯逐级脱水至透明,晾干,中性树胶封固。400倍光学显微镜下观察,胶原纤维呈蓝色,肌纤维及红细胞呈红色。随机选取5个视野,用Image-ProPlus 6.0软件计算胶原纤维面积。
3)苦味酸-天狼星红染色:大鼠肝组织石蜡包埋后切片脱蜡水化,苦味酸-天狼星红染液染色8 min;无水乙醇分化,镜下控制显色;切片于60 ℃烘箱烤干,二甲苯5 min至透明,中性树胶封片,胶原纤维着色,其中Ⅰ型胶原纤维为黄色或红色,Ⅲ型胶原纤维为绿色。随机选取5个视野用偏振光显微镜拍照,对Ⅰ型、Ⅲ型胶原纤维束用Image-ProPlus 6.0软件分别分析吸光度。
4)免疫组织化学染色:大鼠肝组织石蜡包埋后切片脱蜡水化,室温条件下3%(体积分数)H2O2溶液避光孵育25 min;PBS冲洗3次,每次5 min;3%(质量分数)BSA室温封闭30 min;加兔抗大鼠α-SMA多克隆抗体(1∶1 000)或兔抗大鼠TGF-β1多克隆抗体(1∶200),4 ℃孵育过夜,PBS冲洗3次,每次5 min。加酶标羊抗兔二抗,室温孵育50 min,PBS冲洗,0.02%(体积分数)DAB显色10 min;自来水冲洗终止染色。Harris苏木素复染色3 min,自来水洗,1%(体积分数)盐酸乙醇分化数秒,氨水返蓝,流水冲洗。二甲苯脱水15 min至透明,晾干,中性树胶封片。每组随机选取5例,每例选取5个视野在400倍光学显微镜下拍照,并用Image-Pro Plus 6.0软件分析阳性区域吸光度。
1.4 统计学方法
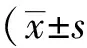
2 结果
2.1 依帕司他对糖尿病大鼠体质量、肝脏系数和24 h进食饮水量的影响
如表1所示,与正常对照组相比,2型糖尿病大鼠体质量明显减轻,肝脏系数显著增加(P<0.01),依帕司他连续给药8周对2型糖尿病大鼠体质量和肝脏系数没有显著影响。模型对照组大鼠进食进水量相较正常组明显增多(P<0.01)。依帕司他组大鼠进食量和进水量均有降低,其中进水量改善作用明显,与模型对照组相比差异具有统计学意义(P<0.05)。提示依帕司他能改善糖尿病大鼠多饮多食的症状。
表1 依帕司他对糖尿病大鼠体质量、肝脏指数、进食和饮水量的影响

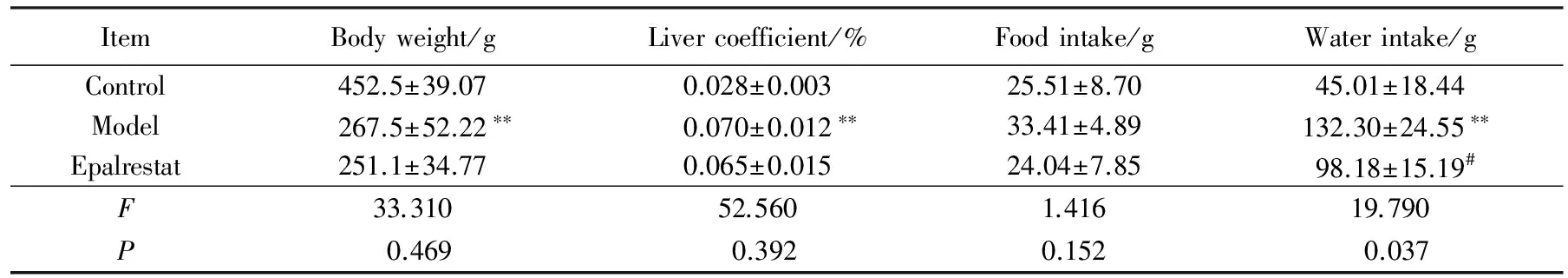
ItemBodyweight/gLivercoefficient/%Foodintake/gWaterintake/gControl452.5±39.070.028±0.00325.51±8.7045.01±18.44Model267.5±52.22∗∗0.070±0.012∗∗33.41±4.89132.30±24.55∗∗Epalrestat251.1±34.770.065±0.01524.04±7.8598.18±15.19#F33.31052.5601.41619.790P0.4690.3920.1520.037
**P<0.01vscontrol group;#P<0.05vsmodel group.
2.2 依帕司他对糖尿病大鼠空腹血糖、糖化血清蛋白及血脂的影响
与正常对照组比,2型糖尿病大鼠空腹血糖显著升高(P<0.01)。给药2周依帕司他开始出现降糖作用,空腹血糖较模型对照组降低(图1A),给药8周差异具有统计学意义(P<0.05)。如图1B所示,给药8周依帕司他组GSP的量较模型对照组明显降低(P<0.01),提示依帕司他可良好控制糖尿病大鼠血糖。
如图1C~1E所示,模型对照组TC、TG、LDL浓度与正常对照组相比明显升高(P<0.01),模型动物出现血脂代谢异常。依帕司他组上述指标较模型对照组显著降低(P<0.05),提示依帕司他能降低糖尿病大鼠血脂,改善脂代谢。
2.3 依帕司他对糖尿病大鼠氧化应激水平的影响
如图2所示,模型对照组动物SOD活力较正常对照组显著降低(P<0.01),MDA和8-OHdG的量明显升高(P<0.01)。依帕司他组SOD活力与模型对照组相比升高显著、MDA的量降低明显(P<0.01),8-OHdG的量有降低趋势,但较模型对照组差异无统计学意义。提示依帕司他可提高机体抗氧化能力,减轻糖尿病大鼠氧化应激损伤。
2.4 依帕司他对糖尿病大鼠肝功能的影响
如图3所示,与正常对照组相比,模型对照组血清ALT、AST浓度明显升高(P<0.05),说明动物肝脏受损。依帕司他给药8周,AST、ALT与模型对照组相比分别降低了15.47%和42.95%,差异具有统计学意义(P<0.05)。结果提示依帕司他能改善2型糖尿病大鼠肝功能。
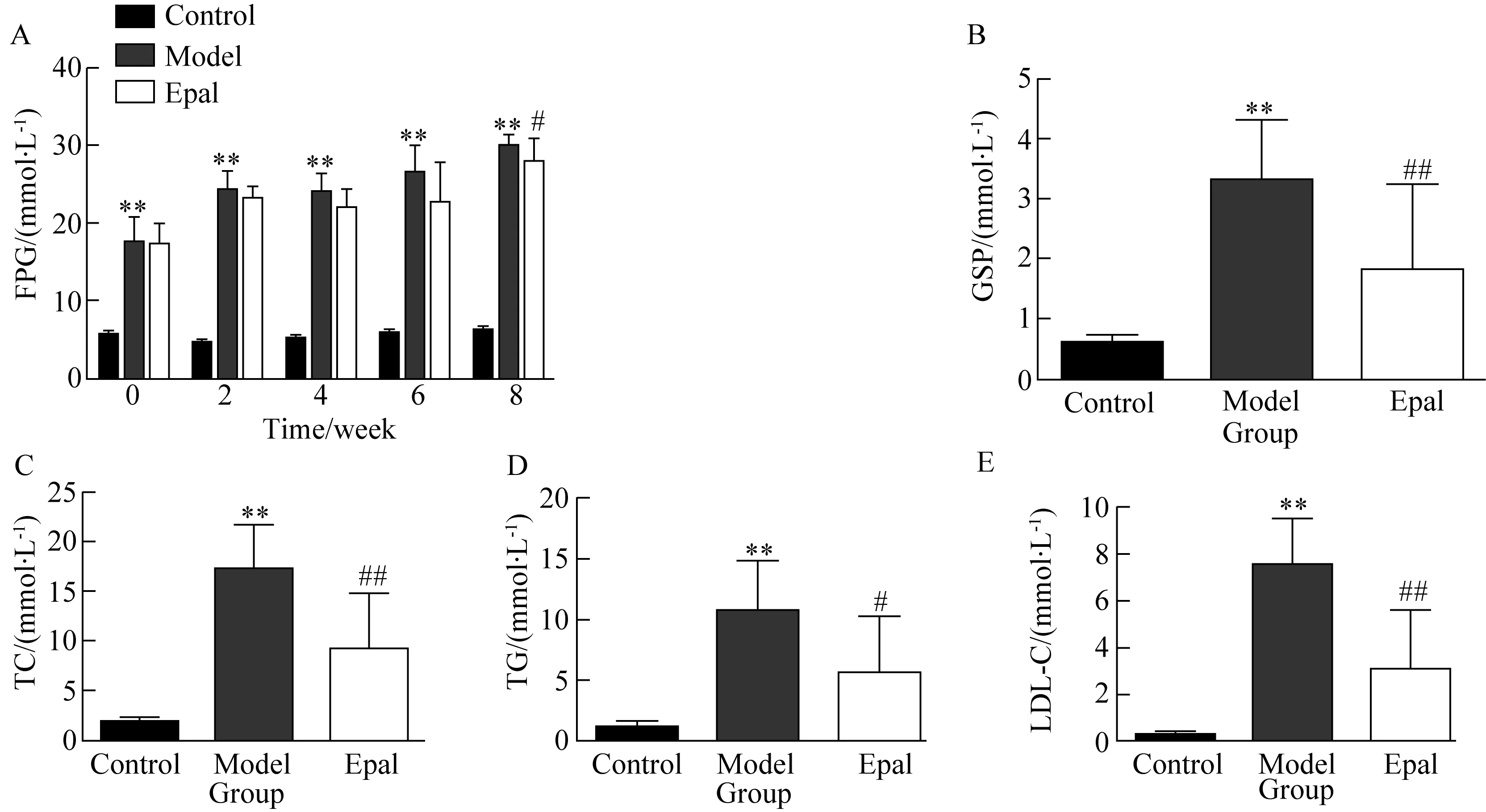
图1 依帕司他对糖尿病大鼠空腹血糖、糖化血清蛋白及血脂的影响

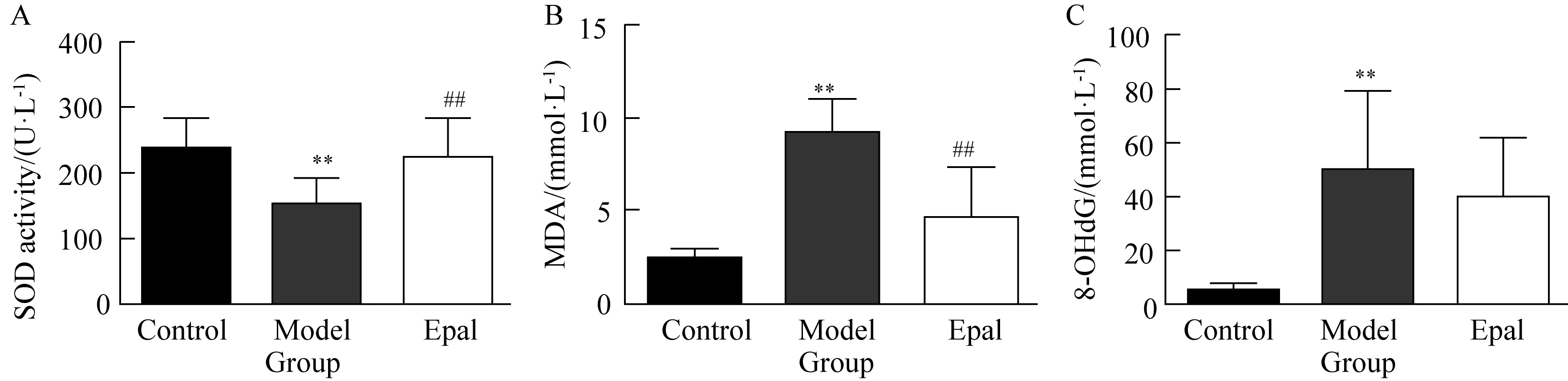
图2 依帕司他对糖尿病大鼠氧化应激的影响

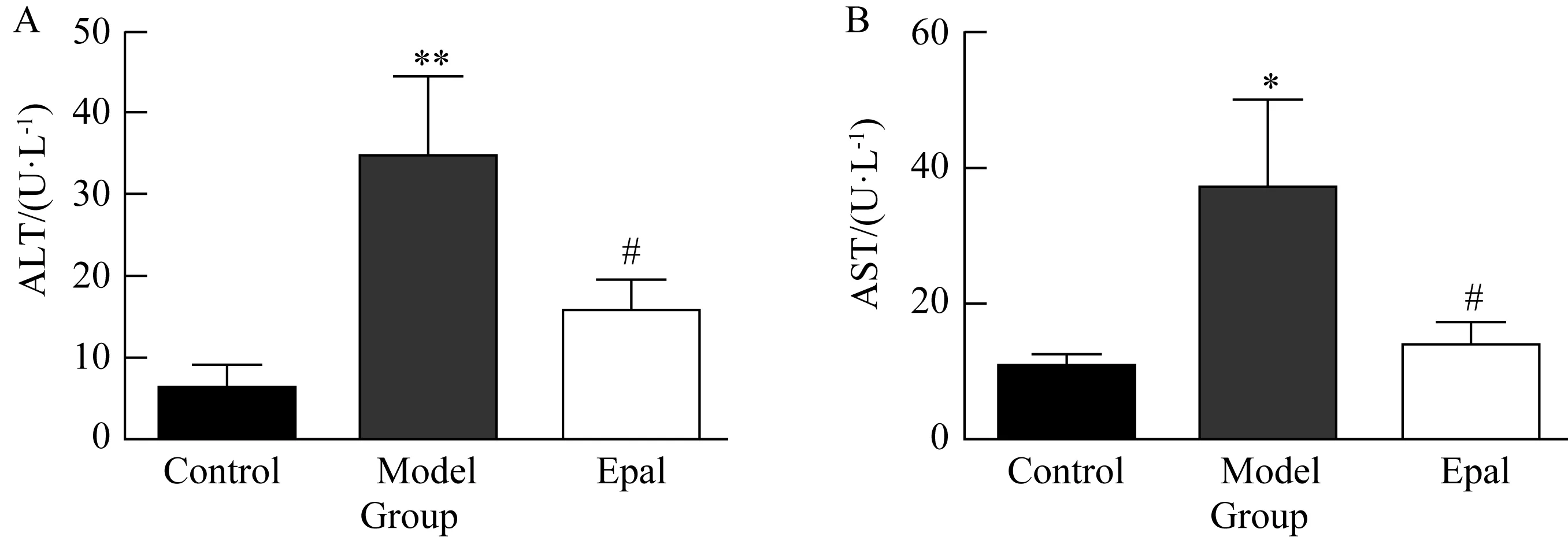
图3 依帕司他给药8周对糖尿病大鼠肝功能的影响
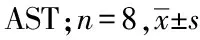
2.5 依帕司他对糖尿病大鼠肝组织病理学改变的影响
HE染色结果显示,正常对照组肝小叶结构正常,未出现炎性细胞浸润(图4A);模型对照组肝脏出现细胞肿胀,汇管周围出现大量炎性细胞浸润,纤维结缔组织明显增多(图4B);依帕司他组可见部分炎性细胞浸润,但较模型对照组少,纤维结缔组织有所减少(图4C)。
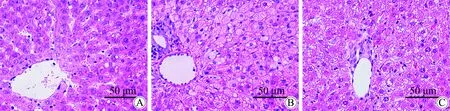
图4 依帕司他对糖尿病大鼠肝脏病理学改变的影响
2.6 依帕司他对糖尿病大鼠肝脏组织纤维化的影响
Masson染色结果(图5A)表明正常对照组肝小叶结构正常,基本没有发生纤维化改变。而模型对照组肝组织出现空泡,肝小叶结构破坏严重,汇管区有大面积纤维结缔组织增生和纤维胶原沉积,部分细胞明显变性或坏死,显示为早期纤维化。经苦味酸-天狼星红染色的肝组织可在偏振光显微镜下显示不同类型的嗜酸性胶原蛋白纤维束。其中I型胶原纤维为黄色或红色,排列紧密,折光性很强;Ⅲ型胶原纤维为绿色,呈疏松网状,折光性较弱。如图5B所示,正常对照组只有极少量胶原纤维,而模型对照组Ⅰ型和Ⅲ型胶原纤维明显增加。依帕司他组与模型对照组相比,Ⅲ型胶原纤维明显减少(P<0.05,图5C),Ⅰ型胶原纤维稍有减少,但差异无统计学意义(图5D)。结果表明依帕司他具有改善糖尿病大鼠肝纤维化的作用。
2.7 依帕司他对糖尿病大鼠肝脏组织TGF-β1表达的影响
免疫组织化学结果显示(图6A),正常对照组肝组织有极少量棕黄色TGF-β1在细胞质表达,着色较浅,仅见于汇管区周围。模型对照组TGF-β1表达明显增加,肝组织大面积深染,阳性细胞数增加明显。依帕司他组肝脏组织阳性细胞数减少,TGF-β1表达明显降低,与模型对照组相比具有差异有统计学意义(P<0.01,图6B)。
2.8 依帕司他对糖尿病大鼠肝脏组织α-SMA表达的影响
α-SMA是肝星状细胞活化的标志。免疫组织化学结果显示(图7A),正常对照组肝组织仅有极少量α-SMA表达。模型对照组α-SMA表达显著增加,呈棕黄色,着色较深,以汇管区和纤维间隔较为突出,阳性细胞数有所增加,说明肝星状细胞被激活。依帕司他组α-SMA表达量和阳性细胞数明显减少,与模型对照组比较差异具有统计学意义(P<0.01,图7B)。提示依帕司他可能是通过抑制肝星状细胞(hepatic stellate cell,HSC)的激活,从而降低α-SMA表达,改善糖尿病大鼠肝纤维化。

图5 依帕司他对糖尿病大鼠肝组织纤维化的影响
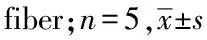

图6 依帕司他对糖尿病大鼠肝组织TGF-β1表达的影响

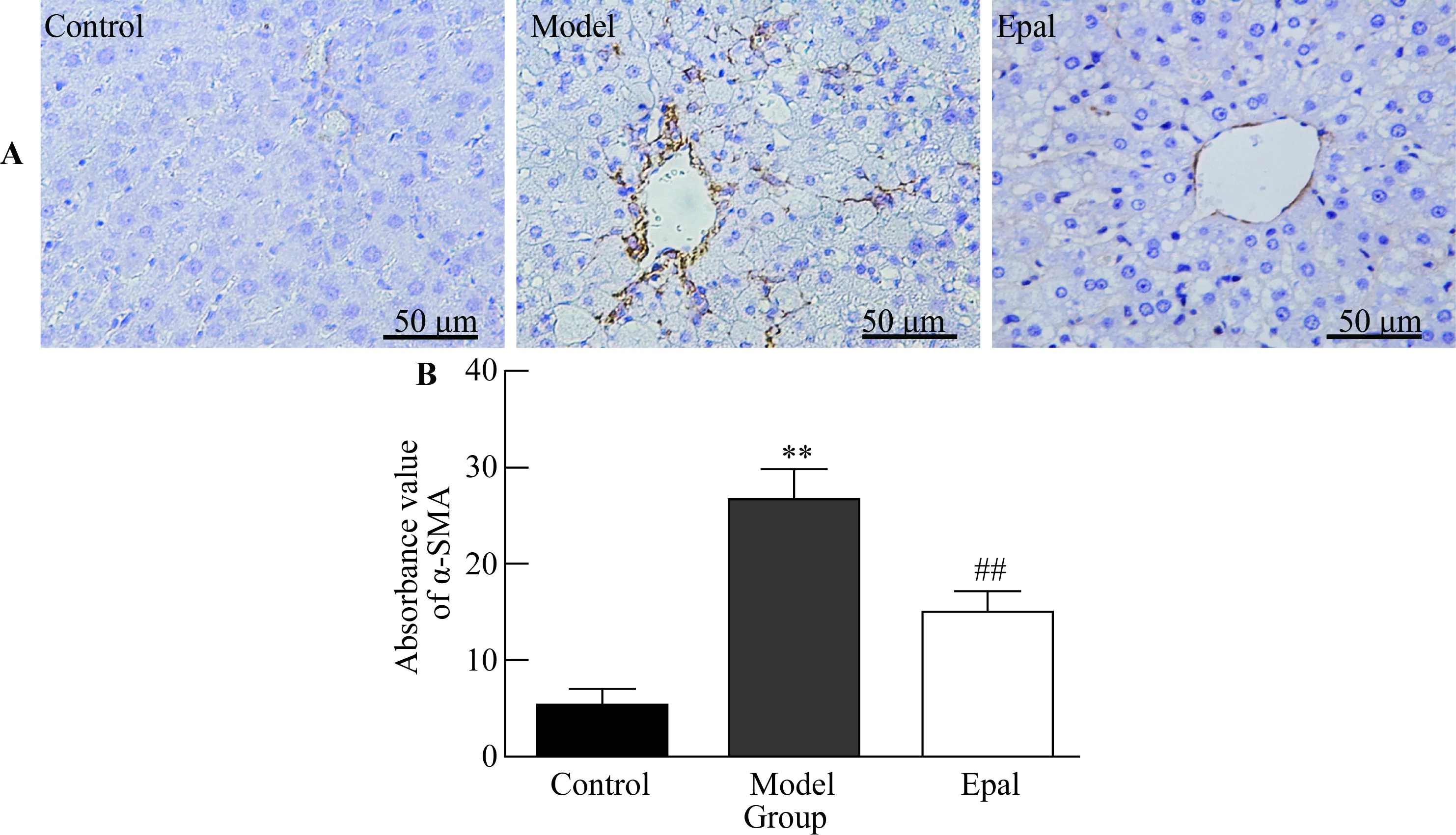
图7 依帕司他对糖尿病大鼠肝组织α-SMA表达的影响

3 讨论
胰岛素抵抗和由此所致的糖脂代谢异常是2型糖尿病的重要病理特征,可引起肝脏多方面的损伤,包括脂肪肝、脂肪性肝炎、肝硬化和肝癌等。其确切发病机制目前并未完全阐明,但脂代谢紊乱被认为是诱发脂肪肝的重要机制之一。本研究采用高糖高脂饮食联合腹腔注射小剂量STZ诱导建立2型糖尿病大鼠模型,肝功能检查及肝脏病理结果显示糖尿病大鼠肝脏出现炎性反应及纤维化损伤。依帕司他治疗8周能够改善糖尿病大鼠多食多饮症状,降低糖尿病大鼠空腹血糖及血脂浓度,改善糖脂代谢紊乱。
糖尿病病人的持续高血糖状态可引起机体产生糖化氧化或自氧化作用从而导致糖尿病病人体内产生过量的活性氧,引发机体氧化应激[11]。氧化应激被认为是影响糖尿病合并症发展的重要因素之一。研究[12-13]表明,氧化应激与脂质过氧化在肝细胞损伤中发挥重要作用。游离胆固醇的增加会上调引起活性氧(reactive oxygen species,ROS)产生的相关酶的活性,下调抗氧化酶活性,从而使氧化应激加剧[14],促进肝纤维化小鼠病情的发展。MDA的量升高是机体细胞受自由基损伤的表现,而SOD活力则是机体抗氧化能力的指标[15]。已有研究[16]表明,依帕司他能够减少2型糖尿病病人红细胞中脂质过氧化物的量,增强糖尿病大鼠抗氧化酶SOD活力,减轻氧化应激对其造成的组织损伤[17]。本研究显示,糖尿病大鼠血脂升高,机体脂代谢严重紊乱,进而导致体内脂质过氧化物MDA大量积累,抗氧化酶SOD活性降低,机体产生氧化应激,氧化应激标志物8-OHdG释放增加,加重肝损伤。依帕司他治疗8周,糖尿病大鼠血脂浓度和脂质过氧化物的量显著降低,抗氧化酶活性升高,氧化应激得到明显改善,肝功能指标ALT和AST降低,肝组织病理学检查显示肝脏炎性病变有所缓解,表明依帕司他可通过改善脂代谢紊乱,减少脂质过氧化物的积累,提高机体抗氧化应激能力从而减轻糖尿病大鼠肝损伤。
肝纤维化是肝硬化的前期阶段,也是各种慢性肝病向肝硬化发展的必经途径,其病理改变可以逆转。但如若治疗不及时,严重者可能会发展成肝硬化甚至肝癌[18-19]。本研究中Masson染色和天狼星红染色显示糖尿病大鼠肝脏出现大面积胶原纤维沉积和嗜酸性胶原纤维束积累,表现为早期肝纤维化病变。TGF-β1是重要的致纤维化因子,当肝实质受损后,肝细胞释放大量TGF-β1。TGF-β1可以促进各种胶原成分和细胞外基质(extracellular matrix,ECM)的积累,进而导致HSC的活化和增生,引起肝纤维化的发生[20]。同时活化的HSC又能自分泌TGF-β1,自分泌的TGF-β1又作用于HSC,形成恶性循环,并导致ECM不断产生和沉积,进一步促进肝纤维化的发展[21]。肝纤维化模型研究[22]证实, 通过阻断TGF-β相关信号通路或RNA干涉等技术抑制TGF-β的表达可阻止肝纤维化。本研究显示依帕司他治疗8周可明显改善糖尿病大鼠肝组织结构病变程度,减轻肝脏胶原组织增生,降低肝组织TGF-β1表达,说明依帕司他可能通过抑制HSC的激活,减轻糖尿病大鼠肝纤维化病变。另有研究[23]表明,依帕司他能够降低TGF-β1所致的肺纤维母细胞中醛糖还原酶的表达,通过抑制醛糖还原酶的活性改善博莱霉素引起的大鼠肺纤维化;而且能够减少大鼠肾小球系膜细胞的胶原沉积[24]。关于本研究中依帕司他是否能通过抑制醛糖还原酶的活性反馈抑制TGF-β1的增加从而对肝纤维化大鼠发挥作用尚需研究证实。
α-SMA作为肝星状细胞激活的标志,在HSC活化程度和肝纤维化进展中发挥重要作用。被激活的HSC发生表型转化成为肌成纤维细胞,并导致α-SMA表达增加,从而大量合成ECM,使活化得以持续,促进肝纤维化的发展[25-26]。据报道[27]肝纤维化大鼠α-SMA的蛋白表达明显增加,且与肝纤维化程度呈正相关。本研究显示,糖尿病大鼠肝脏纤维化病变明显,Ⅰ型及Ⅲ型胶原纤维以及肝组织α-SMA表达显著增加。依帕司他治疗8周能够减少糖尿病大鼠肝脏胶原纤维的产生,下调肝组织α-SMA的表达,提示依帕司他可能是抑制了HSC的激活,从而减少了ECM的合成和分泌,改善肝纤维化。
糖尿病肝损伤的早期症状并不明显,病人往往是在肝脏受损比较严重的时候才被发现,因此导致治疗难度增加。而且由于国内临床上对糖尿病与肝损伤的关系重视度不够,使得现在对于糖尿病肝损伤病人仍然没有确切的治疗药物。本研究发现依帕司他能够改善糖尿病大鼠糖脂代谢紊乱,提高机体抗氧化能力,减轻糖尿病大鼠氧化应激和肝脏炎性反应。依帕司他能够下调糖尿病大鼠肝组织TGF-β1和α-SMA的表达,缓解糖尿病大鼠肝纤维化的发展,其作用机制可能和抑制HSC的激活有关,但其确切的作用机制还有待进一步深入研究。
[1] World Health Organization Global report on diabetes[R]. Geneva:World Health Organization,2016.
[2] Bhatt H B, Smith R J. Fatty liver disease in diabetes mellitus[J]. Hepatobiliary Surg Nutr, 2015, 4(2):101-108.
[3] Davis T M, Peters K E, Bruce D G, et al. Prevalence, incidence, and prognosis of hepatobiliary disease in community-based patients with type 2 diabetes: the Fremantle Diabetes Study[J].J Clin Endocrinol Metab, 2012, 97(5):1581-1588.
[4] 周玉, 张明. 依帕司他治疗糖尿病周围神经病变的效果分析[J]. 糖尿病新世界, 2016, 19(18):33-34.
[5] 马开颜,李娜.依帕司他片治疗糖尿病肾病43例疗效观察[J].陕西医学杂志,2016, 6(3):380.
[6] Hotta N, Kawamori R, Fukuda M, et al. Long-term clinical effects of epalrestat, an aldose reductase inhibitor, on progression of diabetic neuropathy and other microvascular complications: multivariate epidemiological analysis based on patient background factors and severity of diabetic neuropathy[J]. Diabet Med, 2012, 29(12):1529-1533.
[7] Sato K, Yama K, Yu M, et al. Epalrestat increases intracellular glutathione levels in Schwann cells through transcription regulation[J]. Redox Biol, 2013, 2:15-21.
[8] Li Z Y, Deng X L, Huang W H, et al. Lignans from the bark of Eucommia ulmoides inhibited Ang-IIstimulated extracellular matrix biosynthesis in mesangial cells[J]. Chin Med, 2014, 9(1):8.
[9] 强桂芬,张莉,宣琪,等.二甲双胍对2型糖尿病大鼠肝纤维化形成的影响[J].药学学报,2010,45(6):801-806.
[10]赵世印,邱华,贺琴,等.绞股蓝皂苷对2型糖尿病合并非酒精性脂肪性肝病模型大鼠肝纤维化影响[J].医药导报,2014,33(2):156-159.
[11]郭翼华, 项嘉亮, 黄碧云. 氧化应激与糖尿病并发症发生的相关性研究[J]. 中国基层医药, 2010, 17(17):2352-2353.
[12]Ashraf H, Zare S. Preventive effects of aqueous extract of berberis integerrima bge. root on liver injury induced by diabetes mellitus (Type 1) in rats[J].Iran J Pharm Res, 2015, 14(1):335-343.
[13]Lee K S, Lee S J, Park H J, et al.Oxidative stress effect on the activation of hepatic stellate cells[J].Yonsei Med J,2001,42(1):1-8.
[14]Babalola O, Mamalis A, Lev-Tov H, et al. NADPH oxidase enzymes in skin fibrosis:molecular targets and therapeutic agents[J].Arch Dermatol Res,2014,306(4):313-330.
[15]Kang Y S, Song H K, Lee M H, et al. Visfatin is unregulated in type 2 diabetic rats and targets renal ceus[J].Kidney Int,2010,78(2):170-181.
[16]Ohmura C, Watada H, Azuma K, et al. Aldose reductase inhibitor, epalrestat, reduces lipid hydroperoxides in type 2 diabetes[J]. Endocr J, 2009, 56(1):149-156.
[17]Li Q R, Wang Z, Zhou W, et al. Epalrestat protects against diabetic peripheral neuropathy by alleviating oxidative stress and inhibiting polyol pathway[J]. Neural Regen Res, 2016, 11(2):345-351.
[18]夏海珊, 陈少茹, 钟月春,等. 肝纤维化的发病机制和药物治疗现况[J]. 中国医药导报, 2014, 11(18):162-165.
[19]王静, 何方平, 娜丽玛,等. 2型糖尿病发生肝纤维化的相关危险因素分析[J]. 中华糖尿病杂志, 2015,7(3):156-160.
[20]Hernandez-Gea V, Friedman S L. Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011,6:425-456.
[21]Pinzani M, Maciasbarragan J. Update on the pathophysiology of liver fibrosis[J]. Expert Rev Gastroenterol Hepatol, 2010, 4(4):459-472.
[22]Chen H N, Fan S, Weng C F. Down-regulation of TGF-beta1 and leptin ameliorates thioacetamide-induced liver injury in lipopolysaccharide-primed rats[J]. J Endotoxin Res, 2007, 13(3):176-188.
[23]Li X, Shen Y, Lu Y, et al. Amelioration of bleomycin-induced pulmonary fibrosis of rats by an aldose reductase inhibitor, epalrestat[J]. Korean J Physiol Pharmacol,2015,19(5):401-411.
[24]Jiang T, Che Q I, Lin Y, et al. Aldose reductase regulates TGF-β1-induced production of fibronectin and type IV collagen in cultured rat mesangial cells[J]. Nephrology, 2006, 11(2):105-112.
[25]张玉姣.肝星状细胞和枯否细胞在肝纤维化过程中的相互作用[D]. 长春: 吉林大学, 2015.
[26]Ji H Y, Sang C K, Kim K M, et al. Isorhamnetin attenuates liver fibrosis by inhibiting TGF-β/Smad signaling and relieving oxidative stress[J]. Eur J Pharmacol, 2016, 783(15):92-102.
[27]邵佳亮,胡国信,郑洁,等. 羟基喜树碱对肝纤维化大鼠肝组织Bax、Bcl-2基因和α-SMA蛋白表达及肝纤维化的影响[J]. 第二军医大学学报, 2014, 35(4):399-405.
编辑 孙超渊
Effect of epalrestat on liver injury in type 2 diabetic rats
Zhao Yuerong1,2,Hou Biyu2,Liu Chenge2, Wang Xiaobo1,2, Du Guanhua2, Zhang Li2*, Guan Shuyu1*
(1.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.BeijingKeyLaboratoryofDrugTargetResearchandDrugScreening,InstituteofMateriaMedica,ChineseAcademyofMedicalSciences,Beijing100050,China)
Objective This study investigated the effect of epalrestat on liver injury in rats with type 2 diabetic mellitus (T2DM). Methods SD rats were fed with high-fat and high-sucrose diet for four weeks, then 45 mg·kg-1Streptozotocin (STZ) was injected intraperitoneally to make the animal model of type 2 diabetes. Diabetic rats were divided into two groups as the model group and the epalrestat group (100 mg·kg-1), another 12 normal SD rats were served as the control group. The diabetic rats were treated with or without epalrestat by gavaging for 8 weeks. Body weight, food and water intake, blood glucose level, blood lipids were measured; liver function, liver pathological changes and oxidative stress were examined. Immunohistochemistry of α-smooth muscle actin (α-SMA)and transforming growth factor-β1 (TGF-β1) were conducted. Results Compared with the model group, epalrestat could reduce the concentration of fasting plasma glucose and blood lipids. The index for liver condition and oxidative stress were down regulated. Pathological examination showed that lesions of hepatic inflammation and fibrosis were significantly alleviated. The expressions of α-SMA and TGF-β1 were markedly reduced in liver tissues of type 2 diabetic rats with the treatment of epalrestat. Conclusion Epalrestat could alleviate liver inflammation and hepatic fibrosis of rats with T2DM via anti-oxidative stress and inhibiting the activation of hepatic stellate cell.
epalrestat;type 2 diabetic mellitus;oxidative stress;hepatic fibrosis
“重大新药创制”科技重大专项(2013ZX09508104)。This study was supported by National Science and Technology Major Projects for “Major New Drugs Innovation and Development” (2013ZX09508104).
时间:2017-04-13 19∶39
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1939.014.html
10.3969/j.issn.1006-7795.2017.02.021]
R96
2016-12-15)
*Corresponding authors, E-mail:guanshy3@163.com; zhangli@imm.ac.cn
