树突状细胞在咪喹莫特诱导的银屑病样小鼠模型中的表达及凉血解毒方的干预作用
2017-04-19王明星赵京霞底婷婷阮智通蒙玉娇谢湘江张璐林
王明星 王 燕 赵京霞 底婷婷 阮智通 蒙玉娇 谢湘江张 璐林 燕 王 宁 李 萍*
(1.首都医科大学附属北京中医医院,北京 100010;2.银屑病中医临床基础研究北京市重点实验室,北京市中医研究所,北京 100010;3.北京中医药大学,北京 100027)
·基础研究 ·
树突状细胞在咪喹莫特诱导的银屑病样小鼠模型中的表达及凉血解毒方的干预作用
王明星1,2王 燕2,3赵京霞1,2底婷婷2,3阮智通1,2蒙玉娇1,2谢湘江2,3张 璐2林 燕2王 宁2李 萍2*
(1.首都医科大学附属北京中医医院,北京 100010;2.银屑病中医临床基础研究北京市重点实验室,北京市中医研究所,北京 100010;3.北京中医药大学,北京 100027)
目的 观察凉血解毒方对咪喹莫特(imiquimod, IMQ)诱导的银屑病样小鼠模型中活化的树突状细胞(dendritic cells, DCs)的干预作用。方法 将小鼠采用数字表法随机分为正常对照组,模型组,凉血解毒方高(Liangxue Jiedu groups with high, LXJD-H)、中(medium, LXJD-M)、低(low, LXJD-L)剂量组和甲氨蝶呤(methotrexate, MTX)组,观察小鼠背部皮损变化。采用银屑病皮损面积和疾病严重程度评分(psoriasis area and severity index,PASI)标准进行评分,光镜下观察皮肤组织形态学变化,测量表皮厚度;免疫荧光及组织化学法检测皮损中Ki67、CD3、CD11c的表达情况;流式细胞术检测脾脏中DCs数量;酶联免疫法(enzyme linked immunosorbent assay,ELISA)检测细胞上清液中细胞因子的量;采用RT-PCR法检测皮损组织中DCs相关受体基因水平;Western blotting法检测小鼠皮损中TLR7/TLR8通路相关蛋白表达。结果 凉血解毒方明显降低皮损PASI评分及表皮厚度、减少炎性反应细胞的浸润;抑制皮损中TLR7通路相关蛋白的表达;体内外降低白细胞介素-23(interleukin-23,IL-23)、Toll样受体(Toll-like receptors, TLR7)、TLR8 及IL-12p40 mRNA表达及下调IL-23、IL-1β细胞因子分泌水平。结论 凉血解毒方可以改善IMQ诱导的银屑病样小鼠皮损,且可以改善皮损中T淋巴细胞及DCs的浸润,同时抑制DCs的活化。
银屑病;咪喹莫特;树突状细胞;凉血解毒方
银屑病,中医称之为“白疕”,是临床上常见的以鳞屑、浸润、红斑为主要症状的皮肤病,近20年,我国的患病率由0.123%升至0.47%[1]。该病是由遗传与环境等多个因素相互作用导致的慢性复发性的自身免疫性疾病,其主要病理特征表现为表皮角质形成细胞的过度增生和以T淋巴细胞为主的免疫系统的异常活化[2]。近 10 年的研究[3]显示,DCs的异常活化是银屑病发病的上游环节:在银屑病的皮损中,DCs的数量增多、活性增强,它们分泌大量的炎性细胞因子,可促使 T 淋巴细胞的激活,引发免疫反应。此外,以DCs分泌的炎性反应因子为靶点的特异性疗法逐渐被用于临床,与传统的疗法相比,具有更好的疗效,这些研究结果和临床疗效都强调了DCs在银屑病发病环节中的重要作用[4]。
中医认为临床进行期的银屑病病人多属血热证,治疗以清热凉血解毒为主,代表方为凉血解毒方。随机、双盲、安慰剂对照的临床研究[5]显示,临床愈显率70.97%,明显高于对照组。而目前对中医药治疗银屑病的机制研究多集中在调控 T 淋巴细胞的活化及角质形成细胞的增生和凋亡等方面,对其上游的DCs研究较少。
因此,本实验通过咪喹莫特诱导银屑病样小鼠皮损模型,观察中药凉血解毒方是否可以通过抑制DCs的活化,下调细胞因子分泌水平,从而起到治疗银屑病的作用。
1 材料与方法
1.1 动物
BALB/c 雌性小鼠36只,由中国食品药品检定研究院提供,实验动物许可证编号:SCXK(京)2014-0013,体质量18~20 g。
1.2 细胞
DC2.4细胞株(上海赛百慷生物技术股份有限公司)。
1.3 试剂和药物
凉血解毒方来自于首都医科大学附属北京中医医院协定处方(土茯苓30g,生槐花15 g,生地黄15 g,紫草10 g,赤芍10 g, 白茅根30 g, 苦参10 g, 金银花15 g,草河车9 g,白鲜皮10 g),组方按照成人(60 kg)的剂量,根据人与动物间药物剂量换算比例换算成小鼠灌胃用量。中药材统一由首都医科大学附属北京中医医院中药房提供,以中药常规煎服法制备中药水煎剂;咪喹莫特乳膏(四川明欣药业有限责任公司产品,批号:15020139);甲氨蝶呤片(上海信谊药厂有限公司,批号:国药准字H31020644);凡士林(河北兰炼飞天石化有限公司产品);3%(质量分数)H2O2去离子水、DAB显色液(中杉金桥生物技术有限公司);CD3单克隆抗体、增生细胞核抗原Ki67抗体、CD11c单克隆抗体(Abcam 公司,英国)、CD11c-PE单克隆抗体(eBioscience公司,中国,上海);抗鼠白细胞介素-23(interleukin-23,IL-23)一抗(Santa Cruz公司,美国),二抗购自中杉金桥生物技术公司;PCR试剂盒;Western blotting的抗体;CCK-8 试剂盒购自日本同仁化学。
1.4 主要仪器
超低温冰箱、脱水机、包埋机、石蜡切片机、图像分析系统、流式细胞仪、PCR仪、紫外分光光度计、凝胶电泳成像系统、高速冷冻离心机等设备。
1.5 造模制备及分组给药
1.5.1 动物实验
参考van der Fits等[6]银屑病样小鼠模型制备方法。实验前腹腔注射戊巴比妥钠麻醉(80 mg/kg)小鼠,背部去除面积约2 cm×2 cm的毛发,备皮后单笼饲养。采用数字表法,将备好皮的小鼠随机分为正常对照组(control),模型组(model),凉血解毒方(Liangxue Jiedu,LXJD)高、中、低剂量组和甲氨蝶呤(MTX)阳性药物对照组,每组6只。正常对照组小鼠背部每日涂抹适量凡士林,其余各组小鼠背部每日涂抹4%(质量分数)咪喹莫特乳膏420 ng;造模同时灌胃给药,每天1次,每次0.2 mL,连续7 d,正常对照组与模型组给予0.2 mL 0.9%(质量分数)氯化钠注射液,凉血解毒方高、中、低剂量组分别给予等量的凉血解毒方溶液,浓度分别为2、1、0.5 mg·kg-1·d-1(按成人剂量换算为小鼠用量制备的水煎剂为凉血解毒方中剂量 1 mg·kg-1·d-1,中剂量的1/2为低剂量,中剂量的2倍为高剂量);MTX组给予1 mg·kg-1·d-1甲氨蝶呤片溶液。
1.5.2 细胞实验
DC2.4细胞的培养:DC2.4细胞应用含有10%(体积分数)胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养液,置于37 ℃,5%(体积分数) CO2恒温培养箱中培养。定期换液及观察细胞形态,传代2~3次,选取处于旺盛生长期、状态良好的细胞备用。
喷雾干燥法制备凉血解毒方水煎剂粉末:喷雾干燥技术是应用高压泵将药液从雾化器喷出,形成雾状微粒,该雾状微粒与热空气直接接触后,绝大部分水瞬时蒸发,水蒸气随即被抽气装置抽走,干燥的提取物粉末被收集在收集管内。该方法样品与热空气接触时间极短,最大限度保留了热敏感成分。同时所得样品为较均匀的粉末,省去一般干燥法中粉碎过程。
凉血解毒方药物浓度筛选:用CCK-8法(CCK-8 试剂盒购自日本同仁化学)筛选出凉血解毒方对细胞没有毒性作用的浓度:采用常规细胞培养的DC2.4细胞株,加入 96 孔板中,加入不同浓度的中药,37 ℃、5% (体积分数)CO2条件下培养 24、48、72 h。检测前3 h,每孔加入 10μL CCK-8,酶标仪450 nm处检测吸光度值。以筛选出的药物浓度分为高、中、低3个剂量进行后续细胞实验。
按照筛选出的药物浓度分为:① 空白对照组:不用中药干预也不用R848进行刺激;② 模型组:用TLR7/8的激动剂R848刺激细胞24 h;③ 中药高浓度+R848刺激组:高浓度中药预先作用细胞24 h,再以R848刺激24 h;④ 中药中浓度+R848刺激组:中浓度中药预先作用细胞24 h,再以R848刺激24 h;⑤ 中药低浓度+R848刺激组:低浓度中药预先作用细胞24 h,再以R848刺激24 h。
1.6 检测指标与方法
1.6.1 动物实验
1)小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分:每天采用数码相机拍照的方法记录皮损变化情况,并依据PASI评分标准:0(无):表面无红斑鳞屑可见、皮损与正常皮肤平齐;1(轻度):部分皮损表面上覆有鳞屑,以细碎鳞屑为主、皮损轻微高于正常皮肤表面、呈淡红色;2(中等度):大多数皮损表面完全或不完全覆有鳞屑,鳞屑呈片状、中等度隆起,斑块的边缘为圆或斜坡形、红色;3(重度):几乎全部皮损表面覆有鳞屑,鳞屑较厚呈层、皮损肥厚,隆起明显、深红色;4(极重度):全部皮损。对各组小鼠皮损进行鳞屑、浸润及红斑严重程度的评分,将三者积分相加得到总积分,取各组积分平均值后绘制皮损积分趋势线,观察小鼠皮损的变化情况。
2)小鼠皮损组织形态学观察:于造模给药后第7天,取小鼠背部皮损组织,用10%(体积分数)甲醛固定,石蜡包埋、切片后经苏木精-伊红(hematoxylin eosin,HE)染色,在光镜下观察小鼠皮损的病理学变化。采用IPP 6.0图像分析软件,每组选用4个标本切片进行观察并照相,并在每张切片中随机测量5处表皮厚度,并利用GraphPad Prism 6统计软件绘制表示皮损增厚程度的柱状图观察。
3)小鼠皮损表皮层异常增生分化的检测:利用免疫荧光法(immunofluorescence,IF)对小鼠皮损组织石蜡切片进行Ki67染色,并且观察各组小鼠皮损处Ki67的表达情况。
4)小鼠皮损中T淋巴细胞及树突状细胞浸润的检测:利用免疫组织化学法(immunohistochemistry,IHC)对小鼠皮损组织石蜡切片进行CD3染色,观察各组小鼠皮损中CD3表达情况;小鼠皮损经 OCT (opti-mum cutting temperature compound) 包埋做冰冻切片,预冷的丙酮固定CD11c、抗体孵育、 DAB 显色。切片采用Image-Pro Plus 6.0图像分析系统对阳性细胞计数分析,观察各组小鼠皮损中CD11c的表达情况。
5)小鼠皮损中白细胞介素-23(interleukin-23, IL-23)、IL-12p40法:按TRIzol试剂说明书提取组织mRNA,采用实时荧光定量PCR(real-time polymerase chain reaction)法检测。
6)小鼠脾脏细胞中CD11c+细胞数量检测:常规分离各组小鼠脾脏细胞,获得脾细胞悬液加入CD11c-PE单克隆抗体,室温下避光放置30 min,离心洗涤重悬,进行流式细胞术检测分析。
7)小鼠皮损中TLR7通路相关蛋白TLR7表达的检测:Western blotting法,裂解提取总蛋白,BCA法蛋白定量。将聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上,利用特异性的抗体和荧光二抗检测,反应信号经Odssey远红外成像仪检测。
1.6.2 体外细胞实验
1)树突状细胞分泌的细胞因子IL-23、IL-1β检测:收集各组细胞上清液,按照酶联免疫法(enzyme linked immunosorbent assay,ELISA)试剂盒方法检测。
2)树突状细胞表面IL-23、IL-1β、IL-12p40 mRNA表达检测:收集各组细胞,按TRIzol试剂说明书提取细胞mRNA,采用RT-PCR法检测。
1.7 统计学方法

2 结果
2.1 凉血解毒方对IMQ诱导的银屑病样小鼠皮损鳞屑、浸润、红斑及皮损总积分的影响
小鼠背部涂抹IMQ 7 d,观察各组小鼠皮损变化。正常对照组小鼠背部皮肤粉嫩、光滑,皮肤薄(图1A);模型组小鼠背部皮损增厚、浸润,出现皱褶,并附有一层片状鳞屑,易脱落,脱落后可见针状出血点,部分皮肤红斑突起,甚至肥厚融合成斑块(图1B);MTX组小鼠与模型组对比,皮损症状明显改善:皮肤增厚减轻,鳞屑较少明显,红斑面积减小、颜色变浅(图1C);LXJD-H、M、L组与模型组小鼠相比,皮损症状均明显减轻,鳞屑减少,红斑面积较小,颜色较淡,浸润肥厚减轻(图1D-F);肉眼观察发现LXJD-L组与MTX组小鼠背部皮损症状相似。

图1 凉血解毒方治疗7 d对IMQ诱导的银屑病样小鼠皮损的影响
A:control;B:model; C:MTX:methotrexate; D: LXJD-H:Liangxue Jiedu-high; E: LXJD-M: Liangxue Jiedu-medium; F: LXJD-L: Liangxue Jiedu-low;IMQ: imiquimod.
依据PASI评分标准,并采用重复测量数据方差分析进行统计分析并绘制趋势线,见图2。实验过程中,空白对照组小鼠背部皮肤均无鳞屑、浸润及红斑的改变;模型组小鼠在IMQ涂抹2 d后皮肤即出现微小的红斑,3 d后出现细小鳞屑,皮肤出现增厚。随着IMQ药物作用时间的延长,模型组小鼠皮损加重,出现片状鳞屑,皮肤增厚隆起明显,并且出现大面积深红色红斑,出现类似银屑病样皮损,评分于6~7 d达到高峰;MTX组小鼠皮肤各项积分都明显低于同期模型组,尤其浸润、红斑积分明显下降(分别P<0.05);IMQ涂抹3 d后发现,与模型组相比,MTX组及LXJD-M、L组小鼠皮损的鳞屑(F=10.414,P<0.05)、浸润(F=9.981,P<0.05)、红斑(F=9.842,P<0.05)及总积分(F=14.462,P<0.05)均明显降低(P<0.05),趋势图中可以看出MTX组及LXJD-L组降低皮损积分的作用更为显著(P<0.05)。与MTX组对比,LXJD-L组降低小鼠皮损各项积分的作用与MTX组类似,差异无统计学意义(P>0.05)。
2.2 凉血解毒方对IMQ诱导小鼠银屑病样皮损动物模型组织学病理变化的影响
HE 染色结果显示:治疗7 d 时,空白对照组小鼠皮肤表皮层较薄,仅2 ~3 层(图3A)。模型组可见细胞成熟增多,达7~8层,伴角化不全,表皮棘细胞层的增厚,同时基底细胞核分裂像较多(图3B)。对比模型组,MTX组与LXJD各浓度组小鼠皮损表皮层厚度明显减少,核分裂像局限基底,角化不全减少,血管增生及炎性细胞浸润均明显减少,但各组间无明显剂量依赖关系,且皮损表现与MTX组接近(图 3C-F)。
通过IPP测量各组小鼠表皮层的垂直厚度发现:空白对照组小鼠表皮厚度为(11.83±2.42)μm,,模型组小鼠表皮厚度为(73.92±23.74)μm,与空白对照组对比,模型组表皮层明显增厚(P<0.001),约为正常对照组小鼠表皮厚度的7倍;治疗后发现,与模型组相比,MTX组及LXJD各组小鼠表皮厚度均明显降低(F=398.2,P<0.0001);与MTX组对比,LXJD-M、L组降低小鼠表皮厚度作用均明显优于MTX组(P<0.05),LXJD-H作用不及MTX组(P>0.05)。进一步对比LXJD各浓度组的作用发现,LXJD-L组优于LXJD-M组,差异具有统计学意义(P<0.05);故提示LXJD-L组抑制小鼠表皮增厚的作用最为明显。详见表1。
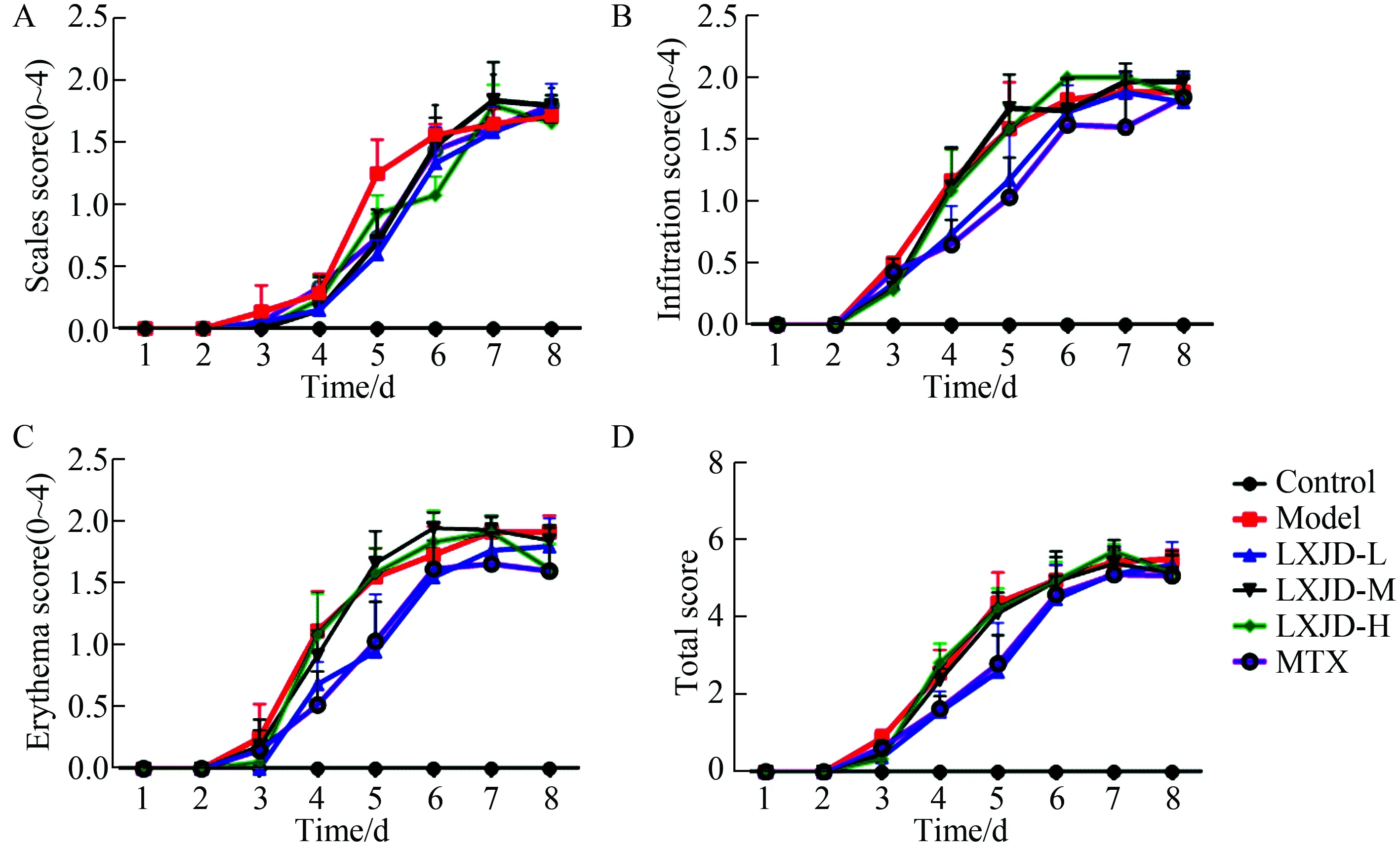
图2 凉血解毒方对IMQ诱导的银屑病样小鼠皮损PASI评分的影响

A:scales; B:infiltration;C:erythema; D:total scores; IMQ:imiquimod;PASI:psoriasis area and severity index.

图3 凉血解毒方治疗7 d后各组IMQ(Imiquimod)诱导的银屑病样小鼠皮损组织学改变
A:control;B:model;C:MTX (methotrexate); D: LXJD-H:Liangxue Jiedu-high; E: LXJD-M:Liangxue Jiedu-medium; F: LXJD-L:Liangxue Jiedu-low; IMQ:imiquimod.
2.3 凉血解毒方对IMQ诱导的银屑病样小鼠皮损中 Ki67表达的影响
Ki67是一种增生细胞相关的核抗原,其功能与有丝分裂密切相关,阳性细胞胞核呈绿色荧光。空白对照组小鼠皮肤仅基底层细胞表达,呈线状排列(图4A)。模型组表皮细胞在基底层、颗粒层均有表达,阳性细胞数量明显增多,约为空白对照组的3倍(P<0.01)(图4B);各组治疗后显示,MTX组及LXJD-M、L组小鼠表皮层中Ki67阳性细胞个数均比MTX组明显减少(F=10.84,分别P<0.01);其中LXJD-M、L组的作用接近MTX组,差异无统计学意义(P>0.05)。详见图4C~F及表2。
表1 凉血解毒方治疗7 d后imiquimod 诱导的银屑病样小鼠皮损表皮层厚度比较
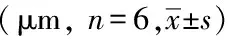

GroupEpidermisthicknessControl11.83±2.42∗∗∗Model73.92±23.74LXJD⁃L36.56±9.21∗∗∗##△△LXJD⁃M45.55±10.17∗∗∗##△LXJD⁃H54.79±11.48∗∗∗##△△△MTX41.31±11.79∗∗∗##
***P<0.001vsmodel;##P<0.01vscontrol;△P<0.05,△△P<0.01,△△△P<0.001vsMTX.LXJD-L:Liangxue Jiedu-low; LXJD-M:Liangxue Jiedu-medium; LXJD-H:Liangxue Jiedu-high; MTX:methotrexate.
2.4 凉血解毒方对IMQ诱导的银屑病样小鼠皮损中炎性细胞浸润的影响
1)小鼠皮损IHC染色观察:CD3阳性细胞浸润情况:与空白组相比,模型组小鼠真皮层褐色沉淀颗粒CD3明显增多(P<0.01);与模型组相比,各治疗组小鼠皮损真皮层中CD3阳性细胞的浸润数量均明显降低,差异具有统计学意义(F=47.07,分别P<0.01);与MTX组相比,LXJD方3个剂量组小鼠皮损中CD3阳性细胞数量接近,差异无统计学意义(P>0.05);说明LXJD与MTX组疗效相似。详见图5及表2。
CD11c+细胞浸润情况:与空白组相比,模型组小鼠皮损中CD11c+浸润明显增多(P<0.01);与模型组相比,各治疗组小鼠皮损中CD11c+细胞的浸润数量明显降低(F=26.43,P<0.05);与MTX组相比,LXJD-M、L组小鼠皮损中CD11c+细胞数量与MTX组相近,差异无统计学意义(P>0.05),而LXJD-H组与MTX组对比CD11c+细胞数量差异有统计学意义(P<0.05),根据数据说明LXJD-H组作用不及MTX组;LXJD方各浓度之间对比显示,LXJD-M、L组差异无统计学意义,作用相似(P>0.05),LXJD-H、L组对比差异有统计学意义,提示LXJD-L组降低小鼠真皮中CD11c+作用明显优于LXJD-H组,差异具有统计学意义(P<0.01)。详见图 6及表2。

图4 凉血解毒方治疗7d各组imiquimod诱导的银屑病样小鼠皮损Ki67表达情况
Blue:DAPI, Green: Alexa Fluor 488; A:control, B:model,C: MTX(methotrexate); D: LXJD-H(Liangxue Jiedu-high); E: LXJD-M(Liangxue Jiedu-medium); F: LXJD-L(Liangxue Jiedu-low).
表2 各组治疗7 d后小鼠皮损中Ki67、CD3+、CD11c+的表达


GroupKi67CD3+CD11c+Control11.50±3.1510.69±2.6914.69±2.30Model32.20±8.43∗∗∗40.44±8.13∗∗∗33.64±7.21∗∗∗LXJD-L22.17±3.37∗#18.53±5.32∗∗###20.53±4.63###LXJD-M23.50±3.25∗∗#23.79±3.89∗∗∗###24.62±4.57∗∗∗###LXJD-H25.50±7.87∗∗23.89±3.89∗∗∗###30.85±4.41∗∗∗△△MTX18.43±4.47###21.53±6.64∗∗∗###21.78±7.60∗∗###
*P<0.05,**P<0.01,***P<0.001vscontrol;###P<0.01vsmodel;△△P<0.01vsMTX. LXJD-L:Liangxue Jiedu-low; LXJD-M:Liangxue Jiedu-medium; LXJD-H:Liangxue Jiedu-high;MTX:methotrexate.
2)流式细胞术检测小鼠脾脏CD11c细胞数量:在前向角和侧向角散点图中,圈入排除碎片及粘连细胞的所有细胞,与空白对照组相比,模型组小鼠脾脏中CD11c+细胞个数明显增多(P<0.01);与模型组相比,MTX组及LXJD作用7 d后,各治疗组小鼠脾脏中CD11c+细胞数少于模型组,其中MTX组较模型组差异有统计学意义(P<0.01)(图7)。

图5 凉血解毒方治疗7d各组小鼠 imiquimod 诱导的银屑病样小鼠皮损真皮层CD3细胞表达情况
A:control; B:model; C:MTX (methotrexate); D: LXJD-H(Liangxue Jiedu-high); E: LXJD-M(Liangxue Jiedu-medium); F: LXJD-L(Liangxue Jiedu-low).
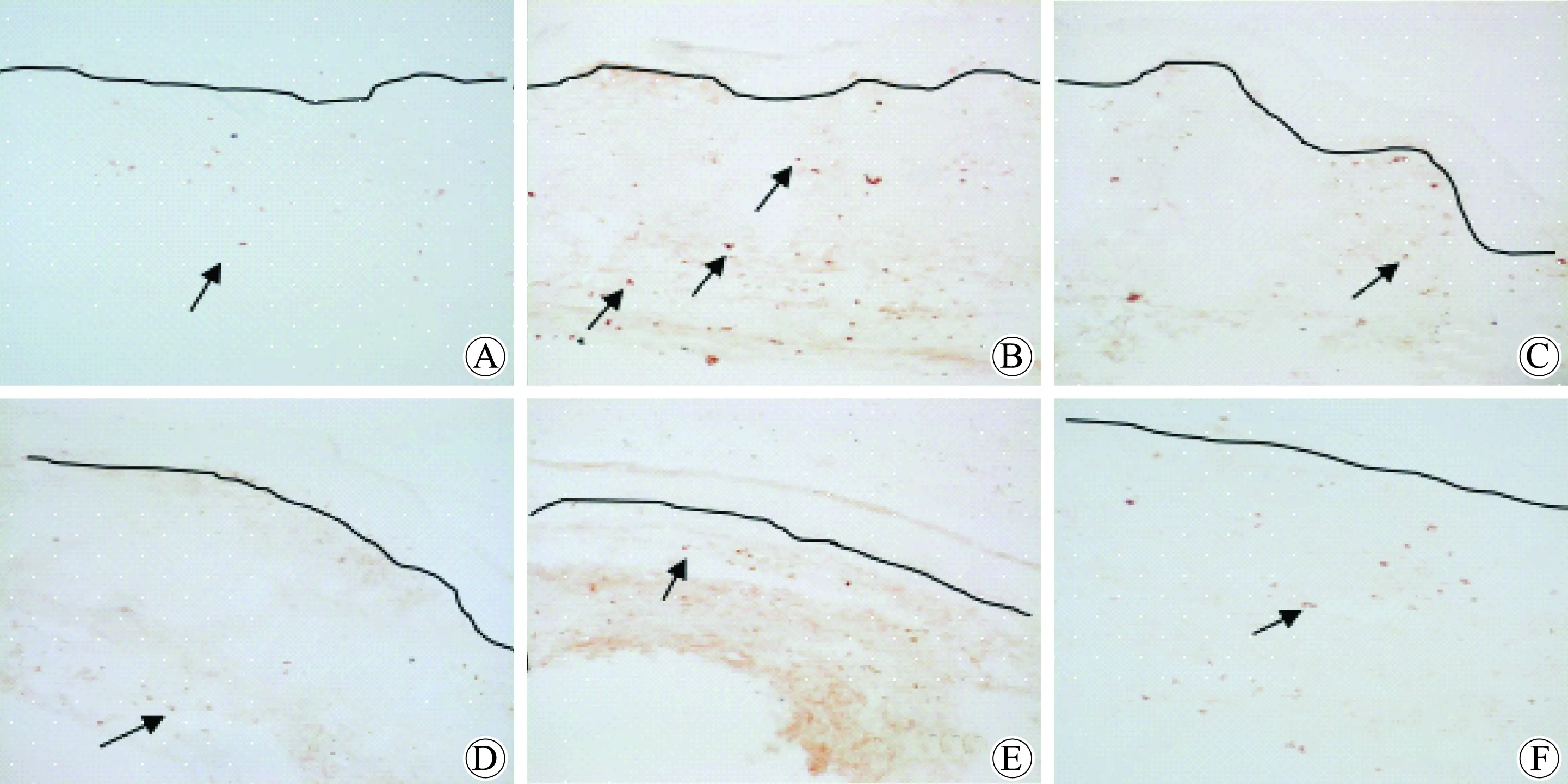
图6 凉血解毒方治疗 7 d各组小鼠 imiquimod诱导的银屑病样小鼠皮损真皮层CD11c+细胞表达情况
A:control; B:model; C: MTX(methotrexate); D: LXJD-H(Liangxue Jiedu-high); E: LXJD-M(Liangxue Jiedu-medium); F: LXJD-L(Liangxue Jiedu-low).

图7 凉血解毒方治疗7 d后各组imiquimod 诱导的银屑病样小鼠脾脏中CD11c+细胞数量
2.5 凉血解毒方对IMQ诱导的银屑病样小鼠皮损IL-23、IL-12p40、TLR7及TLR8 mRNA表达水平的影响
PCR法检测小鼠皮损中IL-23、IL-12p40、TLR7及TLR8 mRNA表达水平显示:与空白组相比,模型组小鼠的皮损中IL-23、IL-12p40、TLR7及TLR8 mRNA水平均明显增高(P<0.05),其中IL-23 mRNA表达水平约为空白组小鼠的2倍,TLR8 mRNA水平约为空白组小鼠的3倍,TLR7、IL-12p40 mRNA 表达水平约为空白组小鼠的4倍。与模型组相比,MTX组及LXJD组小鼠皮损中IL-23(F=6.61,P<0.05)、IL-12p40(F=19.00,P<0.05)、TLR7(F=11.67,P<0.05)及TLR8 mRNA(F=22.45,P<0.05)表达明显降低。MTX组在下调IL-12p40 mRNA表达水平方面作用优于LXJD-H、M组(分别P<0.05);在下调IL-23、TLR7及TLR8 mRNA表达水平方面,MTX组与LXJD各浓度组相似(P>0.05)。详见图8。

图8 凉血解毒方治疗7 d各组imiquimod 诱导的银屑病样小鼠皮损中相关受体基因水平的比较
A:the relative expression of IL-23 mRNA; B:the relative expression of TLR7; C:the relative expression of TLR8;D:the relative expression of IL-12p40 mRNA.*P<0.05,**P<0.01vsmodel group ;LXJD-L:Liangxue Jiedu-low; LXJD-M:Liangxue Jiedu-medium; LXJD-H:Liangxue Jiedu-high; MTX:methotrexate;IL-23:interleukin-23.
2.6 凉血解毒方对IMQ诱导的银屑病样小鼠皮损中TLR7通路相关蛋白表达的影响
模型组TLR7的表达量与正常对照组相比有所增高;与模型组相比,MTX组及LXJD组均可以降低TLR7蛋白的表达,两者间差异无统计学意义(P>0.05);MTX组与LXJD组降低TLR7蛋白表达作用相似,差异无统计学意义(F=0.3471,P>0.05)(图9)。
2.7 凉血解毒方体外对DC2.4分泌细胞因子IL-23、IL-1β的影响
与空白组相比,经R848刺激DC2.4细胞后,IL-23、IL-1β等细胞因子的分泌明显增多;与R848刺激DC2.4细胞组相比,加入中药凉血解毒方后IL-23、IL-1β分泌量明显减少,差异有统计学意义(F=199.3,P<0.01),且凉血解毒方各浓度间差异无统计学意义(P>0.05),说明凉血解毒方可以直接作用于DC2.4细胞并抑制其分泌IL-23、IL-1β等细胞因子(图10)。
2.8 凉血解毒方对DC2.4细胞IL-23、IL-12p40、IL-1β mRNA表达的影响
经R848刺激DC2.4细胞后,细胞表面IL-23(F=5.341,P<0.05)、IL-12p40(F=25.86,P<0.01)、IL-1βmRNA(F=40.38,P<0.01)表达明显增加;与R848组相比,中药LXJD方直接作用DC2.4细胞后,IL-23、IL-1β、IL-12p40 mRNA表达均明显降低(P<0.05);LXJD方各浓度间差异均无统计学意义(P>0.05),说明中药LXJD方可以作用于DC2.4细胞并抑制细胞表面IL-23、IL-12p40、IL-1βmRNA的表达(图11)。

图9 凉血解毒方治疗7 d后各组imiquimod诱导的银屑病样小鼠皮损中TLR7蛋白表达量

LXJD:Liangxue Jiedu;MTX:methotrexate.
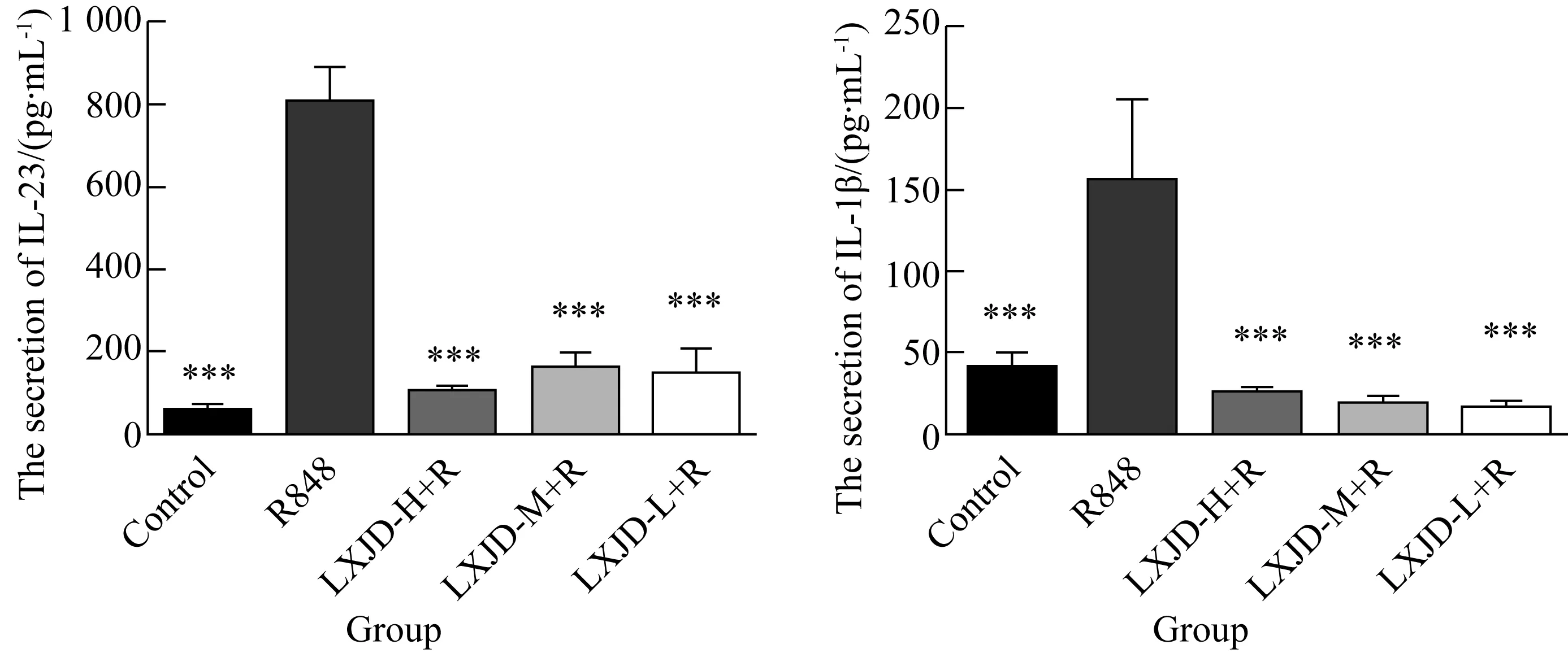
图10 凉血解毒方对DC2.4分泌的细胞因子的影响
Groups: 10 ng/mL R848, 10 ng/mL R848 + LXJD-H (Liangxue Jiedu-high) (2.5 μg/mL), 10 ng/mL R848 + LXJD-M (Liangxue Jiedu-medium) (1.25 μg/mL), 10 ng/mL R848 + LXJD-L (Liangxue Jiedu-low)(0.625μg/mL) for 24 h. A:The secretion of IL-23; B:The secretion of IL-1β.***P<0.001vsR848 group. LXJD-H+R:Liangxue Jiedu-high+R848; LXJD-M+R:Liangxue Jiedu-medium+R848;LXJD-L+R:Liangxue Jiedu-low+R848.
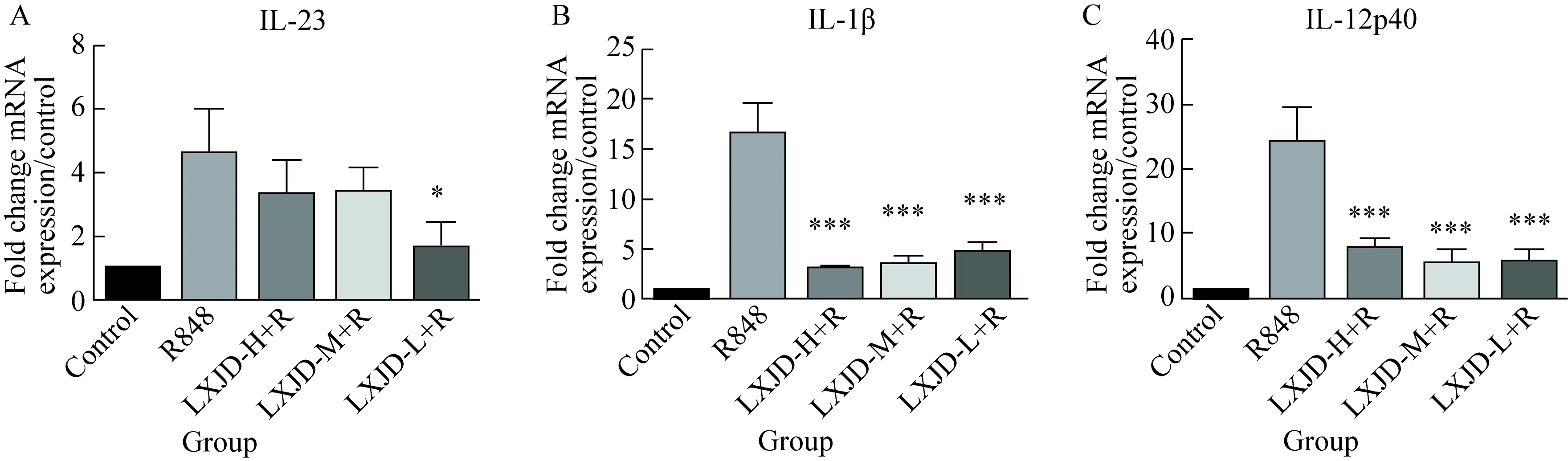
图11 凉血解毒方对DC2.4细胞IL-23、IL-1β、IL-12p40 mRNA表达的影响 分组
Groups:10 ng/mL R848, 10 ng/mL R848 + LXJD-H (Liangxue Jiedu-high) (2.5 μg/mL), 10 ng/mL R848 + LXJD-M (Liangxue Jiedu-medium) (1.25 μg/mL), 10 ng/mL R848 + LXJD-L (Liangxue Jiedu-low)(0.625 μg/mL) for 24 h. A:the fold change mRNA expression of IL-23 mRNA; B:the fold change mRNA expression of IL-1βmRNA; C:the fold change mRNA expression of IL-12p40 mRNA.*P<0.05,***P<0.001vsR848 group; IL:interleukin.
3 讨论
银屑病是一种常见的慢性炎性反应性皮肤病,它属于与多种基因相关的遗传性疾病,其主要病理变化为表皮角化过度及角化不全,角化不全区域内可见中性白细胞构成的小脓肿,称Munro氏小脓肿;颗粒层明显减少或消失;棘层增厚;表皮突延伸;乳头内毛细血管扩张充血[7]。目前有研究[8-9]表明,DCs的异常活化与银屑病的发生密切相关,DCs是目前已知的体内功能最强的抗原提呈细胞,通过分泌不同的细胞因子启动和调节固有和获得性免疫应答,它可以分泌多种细胞因子,如TNF-a、IFN-γ、IL-12、IL-23等。有研究[10-11]证实:DCs 通过分泌以IL-12 为主的细胞因子来诱导或促进初始T 细胞分化为Th1类细胞,从而增强细胞免疫应答[10];同时也可通过分泌以IL-1β为主的细胞因子,促进T、B 细胞的活化[11]。然而,在其分泌的众多细胞因子中,与银屑病发病关系最为密切的为IL-12和IL-23。IL-23是IL-12细胞因子家族的新成员,由p19和p40组成异源二聚体分子,是T辅助细胞的始动因素[12]。检测银屑病病人皮损区可发现IL-23 mRNA在角质形成细胞和真皮层有表达,其表达高于正常人皮肤及病人非皮损区的皮肤[13]。综上所述,银屑病的发病是由于DCs的异常活化,其所分泌的IL-12、IL-23进一步引发 T 淋巴细胞的活化,而活化的DCs及T细胞共同分泌众多细胞因子、化学增活素及生长因子,在局部构成 “细胞因子风暴”,一场恶性循环在附近的角质形成细胞、内皮细胞及中性粒细胞、免疫细胞中发生,最终共同导致银屑病皮损的形成[14-15]。
IMQ是TLR7、TLR8受体的激动剂,可以诱导小鼠体内DCs的成熟和分泌,进一步激活皮损周围T淋巴细胞的活化,从而导致自身性免疫反应,最终引起红斑、鳞屑及皮损浸润肥厚等病理改变,如表皮棘层细胞的大量增生、角化不全,并伴有微脓肿的形成、真皮层毛细血管增生、扩张以及大量淋巴细胞的浸润等类似银屑病的病理特征[16]。故选用此模型进行探索研究。
本研究结果显示,LXJD方可明显改善IMQ诱导的银屑病样小鼠皮损症状;HE的结果提示,凉血解毒方可以显著抑制表皮细胞的增生、角化不全及真皮浅层的毛细血管扩张;显著抑制异常活跃的角质形成细胞的增生;同时还可以降低小鼠脾脏中CD11c+及皮损中CD3和CD11c+的浸润。提示LXJD方通过抑制DCs的活化及T淋巴细胞的浸润,从而发挥改善银屑病样小鼠皮损的作用。
本实验进一步研究显示,LXJD方可以降低小鼠皮损中IL-23、IL-12p40、TLR7及TLR8 mRNA的表达,尤其是可显著抑制IL-23、IL-12p40 mRNA的表达。提示凉血解毒方具有抑制DCs的活化及其产生IL-23、IL-12等细胞因子的能力。那么凉血解毒方是否可以直接抑制DCs的活化?笔者通过体外实验直接观察了凉血解毒方对DC2.4细胞的干预作用,结果发现LXJD方可以降低细胞上清液中IL-23、IL-1β细胞因子,同时可以明显降低细胞中IL-23、IL-1β、IL-12p40 等mRNA表达。这些结果均证实LXJD方可以直接抑制DCs的活化。
然而在TLR7通路相关蛋白的检测结果显示,模型组小鼠与皮损中TLR7的表达量与正常对照组相比有所增高,MTX组小鼠与模型组相比,小鼠皮损中TLR7的表达较少,LXJD方组小鼠与模型组相比,小鼠皮损中TLR7的表达差异无统计学意义(P<0.05),推测LXJD方治疗银屑病可能不是通过抑制TLR7通路实现的,在后续实验中笔者会进一步对TLR8通路进行检测,以探讨药物作用的靶点。由此笔者推断LXJD方治疗银屑病的机制之一可能是抑制了DCs的活化。
LXJD方中主要成分是由生地黄、生槐花、紫草、赤芍、土茯苓、金银花等组成;以往的研究[17]显示,紫草的主要成分紫草素可以抑制人外周血单核细胞来源的DCs表型CD80及CD86的表达,同时抑制DCs促淋巴细胞增生的能力及LPS和INF-γ联合诱导的DCs对IL-23的分泌。同时研究[18]显示,凉血中药紫草的主要成分紫草素及阿卡宁通过抑制DCs的成熟,降低其细胞表面成熟分子标志的表达,抑制其分泌IL-6、IL-23,干预DCs的功能,从而改善TLR7、8激动剂IMQ诱导的银屑病样小鼠皮损,发挥治疗银屑病的作用。这些研究均提示LXJD方中的有效成分对DCs的异常活化有抑制作用。
综合以上实验结果,本实验可以得出如下结论:凉血解毒方可以改善IMQ诱导的银屑病样小鼠皮损,可以改善皮损中T淋巴细胞及DCs的浸润,同时抑制DCs的活化。
[1] 张建中.银屑病的流行病学与危险因素[J].实用医院临床杂志, 2013, 10(1):4-6.
[2] 卢传坚, 韩凌, 彭燕, 等.中医药治疗银屑病的相关分子机制研究进展[J].中华中医药杂志, 2012, 27(5):1364-1369.
[3] Nestle F O, Conrad C, Tun-Kyi A, et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-alpha production [J]. J Exp Med, 2005, 202(1):135-143.
[4] Pietrzak A T, Zalewska A, Chodorowska G, et al. Cytokines and anticytokines in psoriasis[J]. Clin Chim Acta, 2008, 394 (1-2):7-21.
[5] 周冬梅,王萍,姜春燕,等. 从血论治寻常型银屑病的临床疗效观察[J].北京中医药, 2009, 28(6):435-438.
[6] van der Fits L,Mourits S,Voerman J S,et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis [J]. J Immunol,2009,182(9):5836-5845.
[7] 唐冬梅, 周彪, 付丽新, 等. 银屑病样皮损的组织病理研究 [J]. 西南民族大学学报:自然科学版, 2015, 41(2): 156-159.
[8] Lynde C W, Poulin Y, Vender R, et al. Interleukin 17A: toward a new understanding of psoriasis pathogenesis [J]. J Am Acad Dermatol,2014,71(1):141-150.
[9] Michalak-Stoma A, Pietrzak A, Szepietowski J C, et al. Cytokine network in psoriasis revisited [J].Eur Cytokine Netw, 2011, 22(4):160-168.
[10]Arakawa A, Ruzicka T, Prinz J C. Therapeutic efficacy of interleukin 12/interleukin 23 blockade in generalized pustular psoriasis regardless of IL36RN mutation status [J]. JAMA Dermatol, 2016, 152(7): 825-828.
[11]Christiansen A J, Dieterich L C, Ohs I, et al. Lymphatic endothelial cells attenuate inflammation via suppression of dendritic cell maturation.[J]. Oncotarget, 2016, 7(26): 39421-39435.
[12]Zhang J, Li Z, Hu X, et al. Knockout of P2Y12 aggravates experimental autoimmune encephalomyelitis in mice via increasing of IL-23 production and Th17 cell differentiation by dendritic cells [J]. Brain Behav Immun, 2016, Dec 7, Pii: S0889-1591(16)30547-30555.
[13]Johnsson H J, McInnes I B. Interleukin-12 and interleukin-23 inhibition in psoriatic arthritis[J]. Clin Exp Rheumatol, 2015, 33(5 Suppl 93): S115-S118.
[14]Nograles K E, Davidovici B, Krueger J G, et al. New insights in the immunologic basis of psoriasis[J]. Semin Cutan Med Surg, 2010,29(1):3-9.
[15]Tisoncik J R, Korth M J, Simmons C P,et al. Into the eye of the cytokine storm[J].Microbiol Mol Biol Rev,2012,76(1):16-32.
[16]赵京霞, 底婷婷, 王燕, 等. 5 种常用药物对咪喹莫特诱导小鼠银屑病样皮损模型形成的影响 [J]. 中国皮肤性病学杂志, 2014,28 (3): 234-259.
[17]王燕,赵京霞,林燕,等. 紫草素对人外周血单核细胞来源的树突状细胞表型及功能的影响 [J]. 免疫学杂志, 2014,30(8):667-670.
[18]Wang Y, Zhao J, Zhang L, et al. Suppressive effect of β, β-dimethylacryloyl alkanninon on activated dendritic cells in an imiquimod-induced psoriasis mouse model[J]. Int J Clin Exp Pathol, 2015, 8 (6):6665-6673.
编辑 陈瑞芳
Dendritic cells on mice psoriasis-like lesions induced by imiquimod and the effects of Liangxue Jiedu decoction
Wang Mingxing1,2, Wang Yan2,3,Zhao Jingxia1,2, Di Tingting2,3, Ruan Zhitong1,2, Meng Yujiao1,2, Xie Xiangjiang2,3, Zhang Lu2, Lin Yan2, Wang Ning2, Li Ping2*
(1.BeijingHospitalofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100010,China; 2.BeijingKeyLaboratoryofClinicandBasicResearchwithTraditionalChineseMedicineonPsoriasis,BeijingInstituteofTraditionalChineseMedicine,Beijing100010,China; 3.BeijingUniversityofChineseMedicine,Beijing100027,China)
Objective To observe the effects of Liangxue Jiedu decoction(LXJD) on the abnormal activation of dendritic cells on mice psoriasis-like lesions induced by imiquimod. Methods Thirty-six BALB/c mice were randomly divided into six groups: control group, model group, Liangxue Jiedu groups with high(LXJD-H),medium(LXJD-M) or low(LXJD-L) doses, and Methotrexate (MTX) group. The lesions were evaluated according to the psoriasis area and severity index(PASI). The histology and epidermal thicknesses were observed under light microscope.The expression of Ki-67 protein was detected by influorescent antibody technique. Meanwhile, the positive expression of CD3, CD11c was counted by immunohistochemical staining.The expression of dendritic cells in mouse spleen cells and the content of IL-23, IL-12p40, IL-1β in DC2.4 by flow cytometry. The IL-23 mRNA, TLR7, TLR8 were detected by PCR. The expression of TLR7 protein was detected by Western blotting. Results Compared with model group, the cutaneous symptoms in LXJD capsules groups were alleviated, with PASI scores decreased, epidermal parakeratosis and epidermal over-proliferation, the numbers of dermal T lymphocytes, dendritic cells reduced significantly.Compared with model group, the number of Ki67, CD3 and CD11c+in LXJD group was reduced obviously. Meanwhile the expression of IL-23, TLR7, TLR8 and IL-12p40 were all decreased compared with model group. Then in the cell experiment the secretion of cytokines IL-23 and IL-1β were all decreased. Conclusion Liangxue Jiedu Decoction could improve IMQ-induced mouse psoriasis-like lesions and ameliorate the infiltration of T cells and DCs in psoriasis-like lesions, While inhibiting the activation of DCs.
psoriasis; imiquimod; dendritic cell; Liangxue Jiedu
国家自然科学基金青年科学基金(81403410),北京市科技计划课题“十病十药”研发 (Z141100002214015)。This study was supported by National Natural Science Foundation of China Youth Fund (81403410), Beijing Project of Science and Technology Plan (Z141100002214015).
时间:2017-04-13 20∶32
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2032.064.html
10.3969/j.issn.1006-7795.2017.02.019]
R289.5
2016-12-07)
*Corresponding author, E-mail:liping411@ 126.com
