PI3K/mTOR/自噬通路在间歇性低氧加重全脑缺血大鼠神经损伤中的作用
2017-04-18郭向飞赵雅宁李建民刘文倩陈长香
郭向飞,赵雅宁,李建民,刘文倩,陈长香
(华北理工大学1.护理与康复学院社区护理教研室;2.附属医院神经外科,河北唐山063000)
PI3K/mTOR/自噬通路在间歇性低氧加重全脑缺血大鼠神经损伤中的作用
郭向飞1,赵雅宁1,李建民2,刘文倩1,陈长香1
(华北理工大学1.护理与康复学院社区护理教研室;2.附属医院神经外科,河北唐山063000)
目的比较常态大鼠和间歇性低氧大鼠全脑缺血再灌注后磷脂酰肌醇3激酶(PI3⁃K)、雷帕霉素靶蛋白(mTOR)及Beclin⁃1表达变化,探讨PI3K/mTOR/自噬通路在间歇性低氧加重全脑缺血大鼠神经损伤中的作用。方法80只雄性Wistar大鼠采用数字随机法随机分成假手术组(SO组)、单纯脑缺血再灌注组(I/R组)、间歇性低氧7 d脑缺血再灌注组(IH7+I/R组)以及间歇性低氧21 d脑缺血再灌注组(IH21+I/R组),每组20只。造模前,IH7+I/R组、IH21+I/R组分别给予间歇性低氧7和21 d。采用改良的Pulsinelli四血管阻断法制备脑缺血再灌注模型,HE染色、电镜观察海马CA1区神经细胞形态变化;免疫组织化学法、实时定量PCR检测大鼠脑组织海马CA1区PI3⁃K、mTOR和Beclin⁃1表达情况;Morris水迷宫测试检测大鼠学习记忆功能。结果与SO组比较,I/R组大鼠在各时间点出现神经元结构损伤,存活神经细胞数量减少,大鼠的学习记忆功能下降;免疫组化示PI3⁃K、mTOR和Beclin⁃1免疫阳性细胞数增加(P<0.05);实时定量PCR示PI3⁃K、mTOR和Beclin⁃1表达增强(P<0.05)。与I/R组比较,IH7+I/R组和IH21+I/R组大鼠在各时间点神经元结构损伤加重,存活神经细胞数量减少,大鼠的学习记忆能力下降;免疫组化示PI3⁃K、mTOR和Beclin⁃1免疫阳性细胞数增加(P<0.05);实时定量PCR示PI3⁃K、mTOR和Beclin⁃1表达增强(P<0.05);上述变化在IH21+I/R组更为显著(P<0.05)。结论间歇性模式低氧可加重全脑缺血再灌注损伤后神经损伤,其机制与PI3K/mTOR/自噬通路活化有关。
间歇性低氧;脑缺血再灌注;磷脂酰肌醇3激酶;雷帕霉素靶蛋白;自噬
阻塞性睡眠呼吸暂停低通气综合征(obstruc⁃tive sleep apnea hypopnea syndrome,OSAHS)能够加重脑缺血后引起的神经损伤,是使缺血性卒中发病率和死亡率增加的独立危险因素[1-2]。研究[3]显示,脑缺血后认知功能障碍的关键与脑组织缺血缺氧后某些信号转导系统发生紊乱以及神经细胞死亡密切相关。自噬是真核细胞中产生的一种细胞防御机制,最终决定细胞的转归:修复、损伤、加重或死亡[4]。磷脂酰肌醇3激酶(phosphatidylinositol 3⁃kinase,PI3⁃K)/Akt/雷帕霉素靶蛋白(mammalian tar⁃get of rapamycin,mTOR)信号通路参与真核细胞的自噬、增殖和凋亡等多重过程,在中枢神经系统疾病中发挥重要作用[5⁃6]。因此,推测PI3K/mTOR/自噬通路在间歇性低氧加重脑缺血后神经损伤病理过程中具有重要作用。本研究采用间歇性低氧大鼠制作全脑缺血再灌注模型,观察大鼠海马区PI3K/ mTOR/自噬通路的表达及神经细胞丢失变化情况,探讨其在间歇性低氧加重脑缺血再灌注神经损伤中的作用,为临床OSAHS并发缺血性脑血管疾病的防治提供实验依据。
1 材料与方法
1.1 材料
Wistar雄性大鼠80只,由北京维通利华公司提供,实验动物合格证号SCXK(京)2012⁃013。低氧控制程序,购自清华大学科技研发中心;测氧仪,购自建德市梅城电化分析仪器厂;动物低氧舱,购自中国淮北正华科技有限公司;纯氮,购自唐山大众气体高科技有限公司;Morris水迷宫,购自中国医学科学研究院药物研究所。
1.2 动物分组和模型制备
大鼠采用随机数字表法分成假手术组(SO组)、单纯脑缺血再灌注组(I/R组)、间歇性低氧7 d脑缺血再灌注组(IH7+I/R组)、间歇性低氧21 d脑缺血再灌注组(IH21+I/R组),每组20只。
SO组分离并暴露血管,不电凝椎动脉、不夹闭颈总动脉;I/R组、IH7+I/R组、IH21+I/R组采用改良的Pulsinelli的四血管闭塞法制作大鼠全脑缺血模型。
IH7+I/R组、IH21+I/R组大鼠每日8:00~15:00置于低氧舱内,向舱内循环充入氮气、空气,每120 s为1个循环周期,连续给予氮气30 s,使舱内氧浓度维持在5%~21%。采用数字测氧仪监测低氧舱内氧浓度,分别持续7和21 d。
1.3 电镜观察
分别于缺血再灌注后6和24 h每组随机抽取5只大鼠,取大鼠大脑海马CA1区组织,切成1 mm3组织块,40 ml/L戊二醛固定,0.1 mol/L二甲砷酸缓冲液冲洗2次;10 g/L四氧化锇固定,缓冲液冲洗2次;4℃过夜。丙酮脱水,环氧树脂包埋,超薄切片,醋酸铀枸橼酸铅双重染色,透射电镜下观察。
1.4 HE染色
分别于缺血再灌注后6和24 h,每组随机抽取5只大鼠,4%多聚甲醛心脏灌注固定,断头取脑,截取视交叉平面至大脑横裂脑组织,脱水、石蜡包埋、切片、脱蜡、二甲苯透明及HE染色,光学显微镜(400倍)下观察。
1.5 免疫组化染色
标本采集同HE染色,切片脱蜡至水、0.3%H2O2封闭10 min、热修复抗原1.5 min,分别滴加PI3⁃K、mTOR及Beclin⁃1抗体,湿盒中37℃孵育30 min,然后滴加二抗,37℃恒温箱孵育40 min,DAB显色、脱水、透明、中性树胶封片,400倍光镜下观察。
1.6 实时定量PCR反应
分别于缺血再灌注后6和24 h,每组随机抽取5只大鼠,取大鼠海马CAl区组织50~100 mg,加入Trizol试剂1 mL后匀浆,提取总RNA。测量OD260值,根据OD260计算RNA浓度,-80℃保存。PI3⁃K引物序列:正义链5’⁃GAAACCCAGTCACCTAGGGC⁃3’,反义链5’⁃GGTGGGCAGTACGAACTCAA⁃3’。mTOR引物序列:正义链5’⁃GGTGGACGAGCTCTTT GTCA⁃3’;反义链5’⁃AGGAGCCCTAACACTCGGAT⁃3’。Beclin⁃1引物序列:正义链5’⁃CTCTCGTCAAG GCGTCACTTC⁃3’;反义链5’⁃CCTTAGACCCCTCCA TTCCTCA⁃3’。实时定量PCR反应:95℃预变性10 s;95℃变性15 s,56℃退火20 s,72℃延伸30 s,共45个循环;72℃延伸10 min,4℃终止反应。采用2-△△Ct计算目的基因mRNA相对表达水平。
1.7 水迷宫测试
实验大鼠于缺血再灌注后48 h进行测试,安全岛置于水迷宫第二象限。大鼠分别从4个象限固定位置投放,记录大鼠找到平台所需要的潜伏期。如果大鼠90 s内未能找到平台,潜伏期记为90 s。由摄像机及计算机拍摄并统计大鼠分别由4个象限入水后寻找到安全岛的潜伏值和穿台次数。
1.8 统计学分析
用Excel 2003将实验数据建立数据库,所有数据均用表示,用SPSS 17.0统计分析软件进行重复设计的单因素方差分析,组间两两比较采用SNK⁃q检验,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色
SO组大鼠海马CA1区神经细胞排列整齐、结构正常,细胞核清晰,核仁明显。I/R组大鼠可见较多肿胀的神经元,结构疏松,神经元出现核固缩、深染,部分神经元胞核完全消失,形成空泡状结构。IH7+I/R组、IH21+I/R组神经细胞结构形态破坏较严重,结构疏松,神经元出现核固缩、深染,部分神经元胞核完全消失,形成空泡状结构;其中IH21+I/R组神经细胞结构形态破坏更为严重。图像分析结果显示,与SO组比较,I/R组各时间点神经细胞存活率均下降(P<0.05);与I/R组比较,IH7+I/R组、IH21+I/R组各时间点神经细胞存活率均下降(P<0.05),上述变化在IH21+I/R组更为显著(P<0.05)。见表1、图1。
2.2 电镜观察
SO组大鼠海马神经元细胞核规则,核膜光滑,细胞核内染色质均匀散在,神经元胞质内细胞器数量丰富,结构正常。I/R组大鼠海马神经元核膜溶解,细胞核内染色质凝聚固缩,神经元胞质内细胞器数量减少,结构较完整。IH7+I/R组细胞核染色质边集,神经元胞质内细胞器消失。IH21+I/R组细胞核皱缩明显,细胞核内染色质溶解,神经元胞质内细胞器数量减少,结构模糊。见图2。
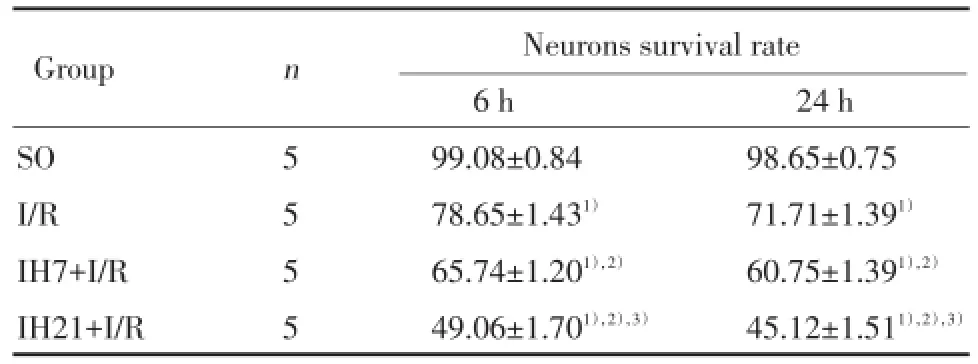
表1 各组大鼠海马CA1区神经元细胞存活率比较(%)Tab.1Comparison of neurons survival rate in hippocampal CA1 region of rats in each group(%)
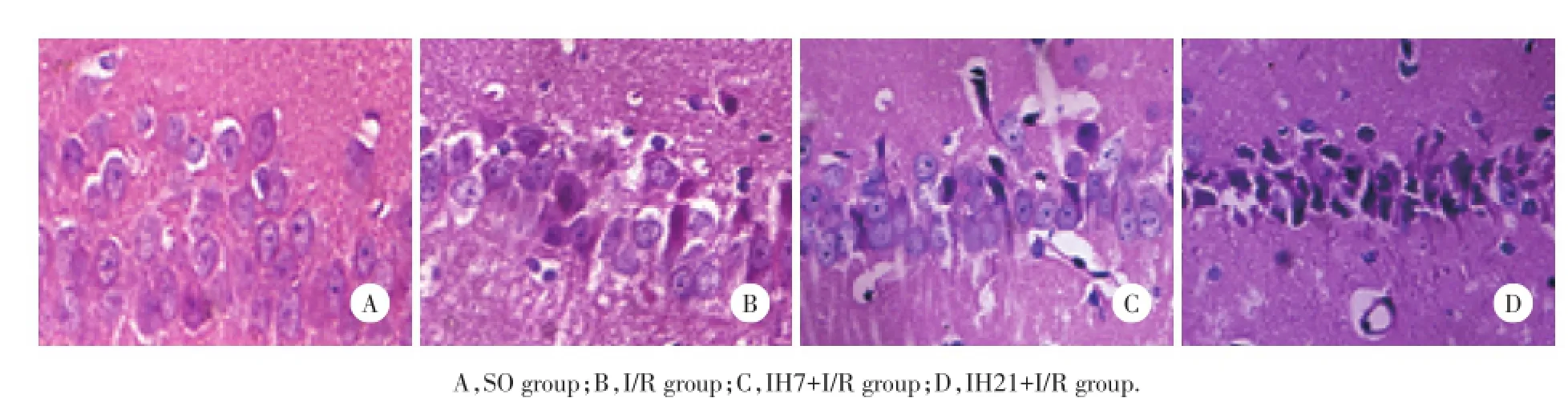
图1 各组大鼠缺血再灌注24 h后海马CA1区神经元HE染色×400Fig.1Neurons in hippocampal CA1 region of rats after I/R 24 h in each group HE×400
2.3 水迷宫测试
与SO组比较,I/R组大鼠水迷宫检测的逃避潜伏期时间延长、穿台次数减少(P<0.05);与I/R组比较,IH7+I/R组、IH21+I/R组大鼠的逃避潜伏期时间均延长、穿台次数均减少(P<0.05);与IH7+I/R组比较,IH21+I/R组大鼠的逃避潜伏期时间延长、穿台次数减少(P<0.05)。见表2。
2.4 免疫组化染色
PI3⁃K、mTOR和Beclin⁃1免疫组化染色呈棕黄色,定位于细胞质中,主要表达在神经元细胞中。SO组偶见PI3⁃K、mTOR和Beclin⁃1免疫阳性细胞;与SO组比较,I/R组大鼠PI3⁃K、mTOR和Beclin⁃1在各时间点(6和24 h)免疫阳性细胞数增加(P<0.05);与I/R组比较,IH7+I/R组、IH21+I/R组大鼠PI3⁃K、mTOR和Beclin⁃1在各时间点(6和24 h)免疫阳性细胞数均增加(P<0.05),上述变化在IH21+I/R组更为显著(P<0.05)。见表3,图3。
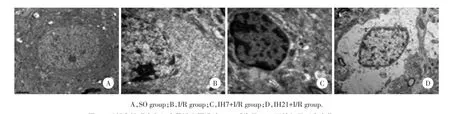
图2 透射电镜观察各组大鼠缺血再灌注24 h后海马CA1区神经元形态变化×20 000Fig.2Morphological changes of neurons in hippocampus of rats detected by electron microscope after I/R 24 h in each group×20 000

表2 各组大鼠水迷宫潜伏时间和穿台次数的比较Tab.2Comparison of escaping latency and frequency of crossing the platform in the water maze test in each group
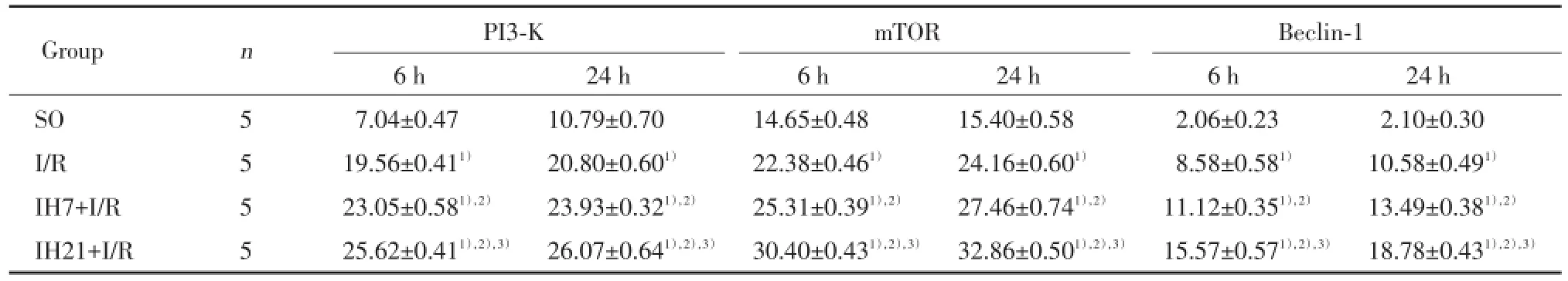
表3 各组大鼠海马区PI3⁃K、mTOR、Beclin⁃1免疫阳性细胞数比较(个/高倍镜视野)Tab.3Comparison of the number of PI3⁃K,mTOR and Beclin⁃1 immunoreactive cells in hippocampus of rats in each group(number/ high⁃power field)
2.5 实时定量PCR
与SO组比较,I/R组大鼠在在各时间点(6和24 h)PI3⁃KmRNA、mTORmRNA及Beclin⁃1mRNA表达明显增高(P<0.05)。与I/R组比较,IH7+I/R组、IH21+I/R组大鼠在各时间点(6和24 h)PI3⁃K mRNA、mTORmRNA及Beclin⁃1mRNA表达增高(P<0.05);上述变化在IH21+I/R组更为显著(P<0.05)。见表4。
3 讨论
OSAHS不仅是一种呼吸系统疾病,可损害并累及全身多系统,对神经系统损害尤为严重[7]。研究[8]显示,OSAHS由于反复低氧和高碳酸血症可引起脑代谢改变、氧化应激、炎症反应等,启动并加重脑缺血再灌注病理生理进程。本研究结果显示,OSAHS低氧各组与I/R组比较,大鼠海马区神经细胞存活率降低,神经细胞结构损伤严重,同时大鼠学习记忆能力出现明显的功能障碍,表明OSAHS模式低氧可以加重大鼠脑缺血再灌注后的神经损伤。与已报道的临床研究[9-10]结果基本一致。
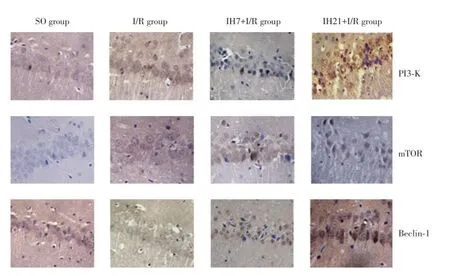
图3 各组大鼠脑缺血后24 h海马CA1区PI3⁃K、mTOR、Beclin⁃1阳性表达情况免疫组化×400Fig.3Expressions of PI3⁃K,mTOR and Beclin⁃1 of neurons in hippocampal CA1 region after I/R 24 h in each group Immunohisto⁃chemistry×400
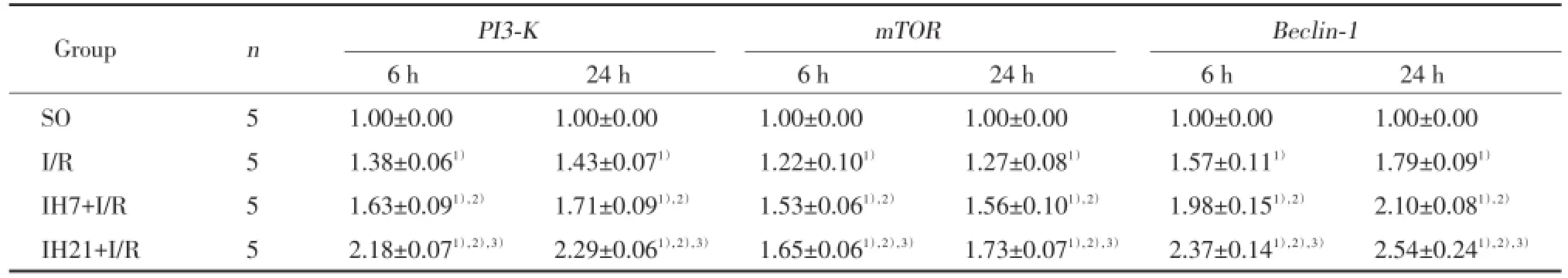
表4 各组大鼠海马区PI3⁃K、mTOR、Beclin⁃1 mRNA相对表达量的变化Tab.4Changes of the mRNA expressions of PI3⁃K,mTOR and Beclin⁃1 in hippocampus nerve cell in each group
自噬是真核细胞在生理或病理因子作用下通过溶酶体途径对功能受损的蛋白质和细胞器进行识别、降解和转复的一种现象,是细胞除坏死和凋亡外的第3种死亡方式[11]。WANG等[12]建立大鼠全脑缺血模型,并观察海马CA1区神经细胞,发现在缺血前1或0.5 h加入自噬抑制剂3⁃甲基腺嘌呤,全脑缺血引起的神经元损伤能明显减轻,表明该损伤产生的自噬可加重脑缺血导致的神经元损伤。本研究结果显示,与I/R组比较,间歇性低氧各组大鼠神经元结构损伤加重,神经元存活率降低,Beclin⁃1 mRNA表达增强,且上述变化在IH21+I/R组更为明显;表明自噬存在于单纯脑缺血再灌注过程中,间歇性低氧可以进一步促进自噬的激活,增加脑缺血后的神经细胞丢失。
自噬的激活依赖于PI3⁃K/Akt/mTOR信号通路,调节mTOR活性从而诱导自噬的发生[13-14]。刘琨等[15]的研究结论表明七氟醚预处理通过激活P13⁃K/ Akt信号通路来增强下游mTOR活性,降低缺血再灌注期间心肌细胞的自噬水平,从而发挥心肌保护作用。宫利等[16]采用SD大鼠建立局灶性脑缺血模型,发现PI3⁃K抑制剂(LY294002)抑制PI3⁃K/mTOR信号通路后,自噬也相应受到抑制,大鼠脑梗死面积增大。本研究结果显示,间歇性低氧各组PI3⁃K mRNA、mTORmRNA表达增加,且上述变化均与低氧程度有关,表明间歇性低氧通过激活PI3⁃K/Akt/ mTOR信号通路,提高脑缺血后自噬程度,加重脑缺血后的神经功能障碍。目前关于间歇性低氧调节PI3⁃K/Akt/mTOR信号活性的原因尚未明确,但研究显示OSAHS特征性慢性间断性缺氧,类似于缺血再灌注损伤,细胞缺氧、氧自由基、ATP耗竭以及炎性反应等各种因素加重[17],这可能是间歇性低氧提高脑缺血后PI3⁃K/Akt/mTOR通路活性的原因之一。
综上所述,本研究结果证明间歇性低氧可提高脑缺血后的自噬水平,加重脑缺血后神经功能障碍,与其调控PI3⁃K/Akt/mTOR级联信号通路活性有关,为临床OSAHS并发脑缺血的防治提供了实验依据。
[1]邓先柱,刘滨,李悦.阻塞性睡眠呼吸暂停低通气综合征与高血压的研究进展[J].心血管病学进展,2014,35(2):230-233.DOI:10.3969/j.issn.1004⁃3934.2014.02.029.
[2]CHO ER,KIM H,SEO HS,et al.Obstructive sleep apnea as a risk factor for silent cerebral infarction[J].J Sleep Res,2013,22(4):452-458.DOI:10.1111/jsr.12034.
[3]王珠,赵雅宁,李建民.葡萄籽原花青素对脑缺血再灌注大鼠氧化应激与学习记忆的影响[J].中国康复理论与实践,2014,20(9):827-830.DOI:10.3969/j.issn.1006⁃9771.2014.09.009.
[4]汪文英,崔德荣,江伟.自噬在大脑缺血再灌注损伤中作用的研究进展[J].上海交通大学学报(医学版),2014,34(2):248⁃253.
[5]SAMI A,KARSY M.Targeting the PI3K/AKT/mTOR signaling path⁃way in glioblastoma:novel therapeutic agents and advances in un⁃derstanding[J].Tumour Biol,2013,34(4):1991-2002.DOI:10.1007/s13277⁃013⁃0800⁃5.
[6]JEONG EH,CHOI HS,LEE TG,et al.Dual inhibition of PI3K/Akt/ mTOR pathway and role of autophagy in non⁃small cell lung cancer cells[J].Tuberc Respir Dis(Seoul),2012,72(4):343-351.DOI:10.4046/trd.2012.72.4.343.
[7]CAPAMPANGAN DJ,WELLIK KE,PARISH JM,et al.Is obstruc⁃tive sleep apnea an independent risk factor for stroke?A critically appraised topic[J].Neurologist,2010,16(4):269-273.DOI:10.1097/NRL.0b013e3181e5a66c.
[8]杨丹,柳志红.阻塞性睡眠呼吸暂停与心血管疾病的关系及发病机制探讨[J].心血管病学进展,2011,32(5):645-648.DOI:10.3969/j.issn.1004⁃3934.2011.05.010.
[9]鲁文莉,郭莺,李冬雪,等.阻塞性睡眠呼吸暂停综合征对缺血性脑卒中患者认知功能的影响研究[J].中国社区医师,2014,30(6):26-27.DOI:10.3969/j.issn.1007⁃614x.2014.6.16.
[10]MANSUKHANI MP,BELLOLIO MF,KOLLA BP,et al.Worse out⁃come after stroke in patients with obstructive sleep apnea:an obser⁃vational cohort study[J].J Stroke Cerebrovasc Dis,2010,28(10):979-984.DOI:10.1016/j.jstrokecerebrovasdis.2010.02.011.
[11]丁煌,唐映红,黄小平.自噬在脑缺血性损伤中的作用[J].中国药理学通报,2015,31(8):1048-1052.DOI:10.3969/j.issn.1001⁃1978.2015.08.004.
[12]WANG JY,XIA Q,CHU KT,et al.Severe global cerebral ischemia⁃induced programmed necrosis of hippocampal CA1 neurons in mt is prevented by 3⁃methyladenine:a widely used inhibitor of autoph⁃agy[J].J Neuropathol Exp Neurol,2011,70(4):314-322.DOI:10.1097/NEN.0b013e31821352bd.
[13]吴苗苗,苑玉和,陈乃宏.mTOR信号通路与神经退行性疾病研究进展[J].中国药理学通报,2011,27(11):1481-1483.DOI:10.3969/j.issn.1001⁃1978.2011.11.001.
[14]SENGUPTA S,PETERSON TR,SABATINI DM.Regulation of the mTOR complex 1 pathway by nutrients,growth factors,and stress[J].Mol Cell,2010,40(2):310-322.DOI:10.1016/j.molcel.2010. 09.026.
[15]刘琨,许鹏程.七氟醚预处理对大鼠离体心脏缺血再灌注损伤时自噬的影响及PI3K/Akt信号通路在其中的作用[J].中华麻醉学杂志,2014,34(4):492-496.DOI:10.3760/cma.j.issn.0254⁃1416.2014.04.032.
[16]宫利,王志,邢诒刚,等.缺血后处理对大鼠脑缺血-再灌注中细胞凋亡的作用及其机制研究[J].国际神经病学神经外科学杂志,2012,39(3):229-234.
[17]杨美丽,蔡若蔚.阻塞性睡眠呼吸暂停综合征和缺血性脑卒中的炎性反应[J].医学综述,2010,16(6):919-921.DOI:10.3969/ j.issn.1006⁃2084.2010.06.041.
(编辑陈姜)
GUO Xiangfei1,ZHAO Yaning1,LI Jianmin2,LIU Wenqian1,CHEN Changxiang1
(1.Community Nursing Department,College of Nursing and Rehabilitation in North China University of Science and Technology,Tangshan 063000,China;2.Depart⁃ment of Neurosurgery,Affiliated Hospital of North China University of Science and Technology,Tangshan 063000,China)
ObjectiveTo investigate the changes in the expression of phosphatidylinositol 3⁃kinase(PI3⁃K),mammalian target of rapamycin(mTOR)and Beclin⁃1 in the hippocampus of normal rats and intermittent hypoxia rats with cerebral ischemia/reperfusion,so as to explore the role of PI3K/mTOR/autophagy pathway in global cerebral ischemia/reperfusion injury aggravated by intermittent hypoxia.MethodsA total of 80 healthy male Wistar rats were randomly divided into sham operation group(SO group,n=20),merely ischemia/reperfusion group(I/R group,n= 20),intermittent hypoxia for 7⁃day ischemia/reperfusion group(IH7+I/R group,n=20),and intermittent hypoxia for 21⁃day ischemia/reperfusion group(IH21+I/R group,n=20).IH7+I/R group and IH21+I/R group were respectively given intermittent hypoxia for 7 days and 21 days before ischemia/reperfusion.The cerebral ischemia/reperfusion model was established by modified Pulsinelli four⁃vessel occlusion method.The morpholog⁃ical changes of nerve cells in hippocampal CA1 region were observed by HE staining and electron microscope.The protein expressions of PI3⁃K,mTOR and Beclin⁃1 of nerve cells in hippocampal CA1 region were detected by immunohistochemical staining and RT⁃PCR.The learning memory capacity of rats were assessed by the Morris water maze test.ResultsCompared with SO group,I/R group increased the never cells morphology damages,reduced the number of survival neurons,and declined the ability of learning and memory(P<0.05).Immunohistochemistry showed that the number of PI3⁃K immunoreactive cell,mTOR immunoreactive cell and Beclin⁃1 immunoreactive cell increased in I/R group compared with S0 group(P<0.05).RT⁃PCR showed that the expressions ofPI3⁃K,mTORandBeclin⁃1increased in I/R group compared with S0 group(P<0.05).Compared with I/R group,intermittent hypoxia groups increased the never cells morphology damages,decreased the number of survival neu⁃rons,and declined the ability of learning and memory(P<0.05).Immunohistochemistry showed that the number of PI3⁃K immunoreactive cell,mTOR immunoreactive cell and Beclin⁃1 immunoreactive cell increased in IH7+I/R and IH21+I/R groups compared with I/R group(P<0.05). RT⁃PCR showed that the expressions ofPI3⁃K,mTORandBeclin⁃1increased in IH7+I/R and IH21+I/R groups compared with I/R group(P<0.05),and the changes were more significant in IH21+I/R group(P<0.05).ConclusionIntermittent hypoxia can aggravate neurological injury after ischemia,which is related to PI3K/mTOR/autophagy pathway activation.
intermittent hypoxia;cerebral ischemia;phosphatidylinositol 3⁃kinase;mammalian target of rapamycin;autophagy
R743
A
0258-4646(2017)01-0062-06
10.12007/j.issn.0258⁃4646.2017.01.014
Role of PI3K/mTOR/autophagy Pathway in Global Cerebral Ischemia/reperfusion Injury Aggravated by Intermittent Hypoxia in Rats
郭向飞(1989-),女,硕士研究生.
赵雅宁,E-mail:zyning789@126.com
2016-06-13
网络出版时间:
