着眼于知识体系完善和化学素养提升的习题课教学策略
2017-04-15江苏省苏州市吴江汾湖高级中学215211
江苏省苏州市吴江汾湖高级中学(215211) 金 茹 ●
着眼于知识体系完善和化学素养提升的习题课教学策略
江苏省苏州市吴江汾湖高级中学(215211) 金 茹 ●
从完善化学知识体系和提升化学素质角度研究了习题课教学的策略.
知识体系;化学素养;习题教学策略
习题课是中学化学课堂教学的重要课型,习题课应该怎么设计?是简单地就题论题、将知识点一一罗列?还是海纳百川、大搞题海战术?还是舍简就繁,做个寻章摘句老雕虫?笔者认为习题课不仅要和学生罗列知识,更重要的是帮助学生建立知识体系,不能搞题海战术,要百里挑一地精选习题激活学生的思维,不钻牛角尖不专攻偏难题,是要紧扣概念、原理等学科主干知识,逐一扫除学生思维里的盲区,不为了方法而方法,注重思维过程,水到渠成地提升学生的化学学科素养.下面笔者就根据自己的教学实践简单谈谈几点感悟.
一、从概念、原理出发,正本清源,找准思维着眼点
很多时候,学生在解题过程中出现困惑是因为概念和原理不清导致的,我们在习题课教学中,尤其应该注重将概念和原理作为习题教学的立足点,由此出发帮助学生找准思维着眼点.
例1 在T℃时,向体积为2 L的某恒容密闭容器内通入2 mol一氧化碳气体和2 mol水蒸气,发生反应 CO,一段时间后达到化学平衡状态.(1)继续向该容器里通入2mol一氧化碳气体或2mol水蒸气,则化学平衡向____移动.(填“正向“、”逆向“或”不移动“)(2)继续向该容器里通入2mol一氧化碳气体和2mol水蒸气,则化学平衡向____移动.(填“正向“、”逆向“或”不移动“)
解析 第(1)问直接考查勒沙特利原理:在等温、等容条件下,增大了一氧化碳或水蒸气浓度,正反应速率瞬间加快,逆反应速率保持不变,致使v(正)>v(逆),从而导致反应向正方向移动.第(2)问则有分歧,有部分学生继续使用勒沙特利原理,迅速得出平衡右移的结论.而有部分学生则认为不能简单采用第一问单一平衡思路来解决,应以等效平衡原理为依据,“继续向该容器里通入2 mol一氧化碳气体和2 mol水蒸气”,相当于往2 L容器中一次性通入4 mol一氧化碳气体和4 mol水蒸气,若容器体积相应变为4 L,则显然与题设条件构成等效平衡,最终反应物的平衡转化率、平衡浓度、百分含量保持不变.容器体积变为2 L,相当于增大压强,考虑到该反应左右两端属于“m+n=p+q”型,即反应前后气体体积保持不变,增大压强对平衡无影响,所以得出平衡不移动的结论.貌似都有理有据,但真理只有一个,究竟怎样去伪存真呢?此时还是应该从基本概念入手,从结果看,最终平衡与初始平衡属于等效平衡,但并不完全相同,各物质的百分含量、温度、体积均相同,而各物质的浓度、压强则不同(对应成比例).不同的结果源自不同的过程,在继续通入一氧化碳气体和水蒸气后,正反应速率瞬间增大,逆反应速率未及变化,此时v(正)>v(逆),平衡向正方向移动.达到新平衡时,浓度的数据也证明了这一点,一氧化碳和水蒸气的浓度相对于通入气体瞬间减小,二氧化碳和氢气浓度则相应增大,都说明平衡正向移动了.
点评 化学平衡属于典型的动态平衡,一旦改变了外界条件,正逆反应速率相应改变,v(正)与v(逆)不再相等,平衡向正向或逆向移动.亦即化学平衡移动原理研究的是过程.等效平衡是指一定条件下,同一个可逆反应的不同的初始状态可以达到各种组分含量相同的平衡状态.阐述的是平衡状态与平衡状态的关系,研究的是状态.另外,各种组分含量相同并不等价于各种组分浓度相同,可以相同,也可以对应成比例.换言之,等效平衡其实包括各项参数全等的相同平衡和部分参数成比例的相似平衡.在习题教学时要注意以基本概念为出发点,严密梳理相关概念的内涵和外延,不断完善认知体系.
二、注意层层设疑,拾阶而上,提升思维着力点
有很多时候一个大问题摆在学生面前,学生不能立刻解决,如果我们从一个情境出发将问题细化,借助于层层设疑的方式给学生提供一串问题,往往能够有效发散学生的思维,提高解决问题的能力和学习效果.
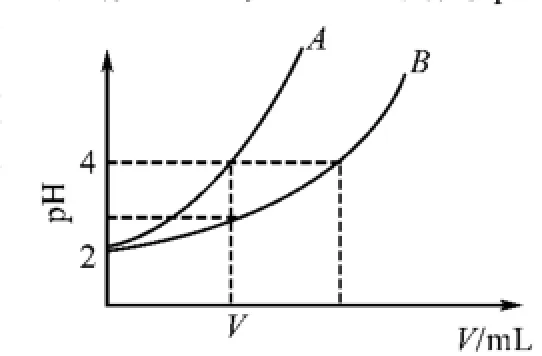
例2 在20℃时,两种一元酸HA与HB,经测定pH均为2.现取等体积的酸并加水稀释(忽略前后体积的变化),两种物质的pH变化与所加入的水的体积关系如右图所示,请完成下列问题:
(1)两种酸的起始浓度是否一样?电离度是否一样?
(2)从图形中观察,稀释相同倍数后,pH的变化如何?可以确定谁是弱酸?另外一种酸一定是强酸吗?稀释到pH为4,谁加入水的体积更多?
(3)比较两种酸的电离度大小?稀释前哪种酸的物质的量浓度大?
(4)向10 mL 0.01 mol/L的HA溶液中加入V mL水后,溶液的pH变为4,可见,HA是强酸吗?V是多少?
(5)取两块大小、形状均相同且足量的锌粒,分别投入体积相同的两份酸溶液中,产生氢气速率较快的是哪种酸溶液?产生气体体积较大的又是哪种?
(6)改变条件使得HB的电离度增大,下列正确的说法有( ).
A.c(H+)一定增大 B.c(B-)一定增大
C.溶液的温度一定升高 D.n(B-)一定增大
(7)总结如何判定一种酸为弱酸?
点评 绝大多数学生并不能一开始就高屋建瓴地把握住知识的全貌,因此在设计问题时要有意识地给学生的思维铺设阶梯.问题(1)帮助学生认识氢离子浓度与酸起始浓度的关系,以理解弱酸的电离度.(2)帮助学生学会图像解读,从图像数据中加以分析,得出两种酸的相对强弱(3)通过回顾电离度概念,熟练运用电离度定义公式进行电离度与浓度的相互转化.(4)在定性理解强、弱电解质稀释的基础上,定量计算强电解质溶液稀释过程中的pH变化.(5)从氢离子浓度变化角度阐述强弱电解质的区别,同时将所学理论知识用于实际问题的解决.(6)引导学生运用电离平衡原理分析外界条件改变对弱电解质电离的影响.问题(7)对上述五个问题进行了归纳总结,促进了学生认知体系的升华.
G632
B
1008-0333(2017)03-0091-01
