G蛋白信号转导调节因子4在肾癌组织中的表达及意义
2017-04-14安丰杨继宏崔振宇师晓强刘明锴郭景阳王洪福
安丰,杨继宏,崔振宇,师晓强,刘明锴,郭景阳,王洪福
(1河北大学附属医院,河北保定071000;2 华北石油总医院)
肾细胞癌(RCC)是泌尿生殖系统常见的恶性肿瘤之一,起源于肾小管上皮细胞,占成人恶性肿瘤的2%~3%[1]。近50%的RCC患者缺乏早期症状,25%的患者就诊时已属于晚期,存在局部侵袭或转移[2]。因此,明确RCC的起源、复发转移的分子机制对于RCC的诊断、治疗和预后具有重要意义。G蛋白信号转导调节因子(RGS)是G蛋白偶联信号通路中一类重要的调节蛋白,通过激活GTP酶激活蛋白(GAP)活性来中止G蛋白信号通路,从而调控G蛋白介导的下游信号传递[3]。RGS4是RGS蛋白家族中的重要成员之一,能有效中止G蛋白αq亚型(Gαq)介导的信号通路,参与神经调节和生物体发育等过程[4]。近年研究发现,RGS4参与了乳腺癌的发生发展,并在乳腺癌的转移中发挥重要的调节作用[5]。但目前对RGS4在RCC发生发展过程中的作用尚不明确。我们收集了2002年4月~2015年11月就诊的120例RCC患者的癌及癌旁组织,检测 RGS4的表达情况,探讨RGS4的表达变化及其与RCC患者临床病理特征的关系,为RCC的诊断和治疗提供依据。
1 资料与方法
1.1 临床资料 选择同期在我院住院行根治性肾切除术的RCC患者120例,男75例、女45例,年龄2~79岁、中位年龄49岁,均经病理诊断确诊RCC。术中切取癌组织及距肿瘤边缘至少2 cm的0.5 cm×0.5 cm×0.5 cm癌旁组织。排除有严重心肺肝肾等功能异常及全身感染史的患者。
1.2 RCC癌组织及癌旁组织RGS4蛋白定性表达检测 采用免疫组化两步法。取癌旁组织、癌组织制备石蜡切片,4 μm厚度石蜡切片脱蜡至水,双氧水阻断内源性过氧化物酶,微波抗原修复,5%山羊血清封闭。RGS4兔抗人一抗1∶100稀释后室温孵育1 h,酶标抗鼠聚合物室温孵育,常规DAB显色。以PBS缓冲液代替一抗作为阴性对照,同时设空白对照。根据阳性、阴性和空白对照的显色情况,计数每例患者肿瘤组织中的所有肿瘤细胞,以阳性细胞率>5%判定为阳性,计算阳性率。
1.3 RCC癌组织及癌旁组织RGS4蛋白半定量表达检测 采用Western blot法。取新鲜冰冻RCC的癌组织和癌旁组织,加入0.5 mL组织裂解液进行裂解。BCA法测定总蛋白浓度。配置10%分离胶和8%浓缩胶,取50 μg组织总蛋白行SDS-PAGE凝胶电泳,然后将凝胶上的蛋白湿转至 PVDF膜上。5%脱脂奶粉封闭1 h后,抗RGS4(1∶500)及抗内参GAPDH(1∶20 000)抗体室温孵育1 h,TBST漂洗后辣根过氧化物酶标记的二抗(抗鼠/抗兔)(1∶5 000)室温孵育1 h,TBST漂洗后电化学发光法检测。所有阳性条带均利用Image J软件分析其灰度值,以内参条带为蛋白定量参考,以RGS4与GAPDH的相对表达量作为RGS4表达量。
1.4 RCC癌组织及癌旁组织RGS4 mRNA表达检测 采用RT-PCR法。提取癌旁组织、癌组织RNA,反转录后,SYBR法检测mRNA水平。2-ΔCt法分析数据。

2 结果
2.1 RCC癌组织及癌旁组织RGS4蛋白定性表达比较 RGS4特异性表达于肾细胞的细胞质中,在癌旁组织中为浅黄色,在癌组织中多数为深黄色。癌旁组织、RCC癌组织RGS4蛋白表达阳性率分别为24.2%(29/120)、37.5%(45/120),RCC癌组织RGS4蛋白表达阳性率高于癌旁组织(P<0.05)。
2.2 RCC癌组织及癌旁组织RGS4蛋白半定量表达比较 癌旁组织、RCC癌组织RGS4蛋白表达量分别为0.66±0.03%、1.02±0.03,RCC癌组织RGS4蛋白表达量高于癌旁组织(P<0.05)。见图1。

图1 RCC癌组织及癌旁组织中RGS4蛋白表达情况(Western blot法)
2.3 RCC癌组织及癌旁组织RGS4 mRNA表达比较 癌旁组织、RCC癌组织RGS4 mRNA表达量分别为0.93±0.04、1.67±0.04,RCC癌组织RGS4 mRNA表达量高于癌旁组织(P<0.05)。
2.4 不同临床病理特征的RCC患者癌组织RGS4蛋白表达情况 RGS4在中重度肿瘤浸润患者中的阳性率显著高于轻度浸润患者(P<0.05)。不同性别、年龄、肿瘤直径的RCC患者癌组织中RGS4表达差异均无统计学意义(P均>0.05)。见表1。
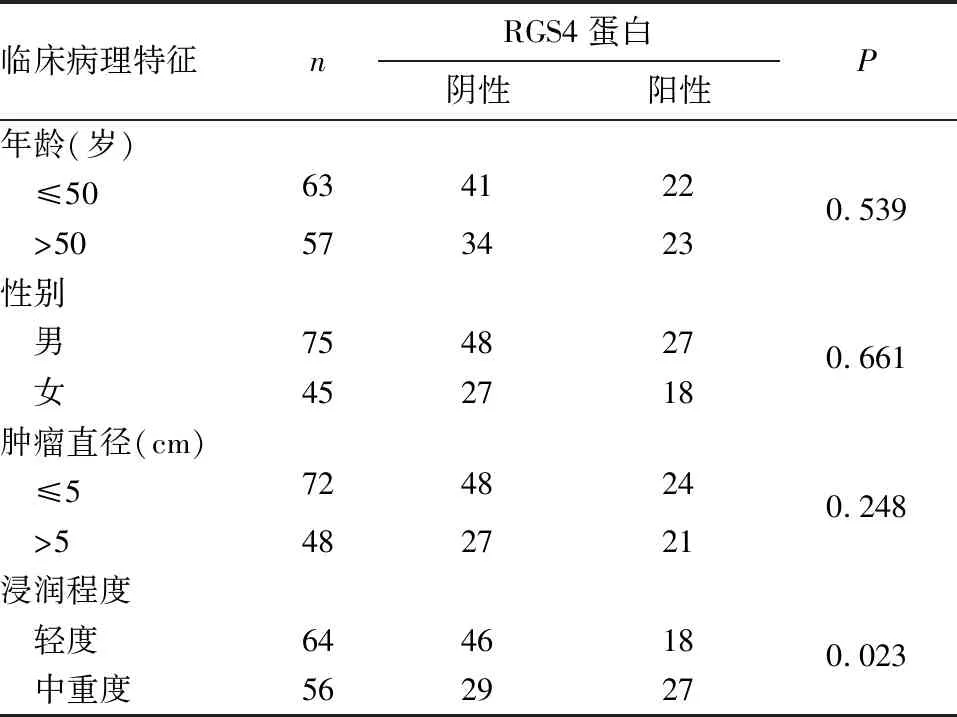
表1 不同临床病理特征的RCC患者癌组织RGS4蛋白表达情况(例)
3 讨论
作为泌尿系统最常见的肿瘤之一,RCC的诊断及治疗手段十分有限,其致病和发展的调控机制一直是RCC相关分子研究的重点,但对RCC相关信号通路的研究尚不深入。G蛋白信号通路是生物体中作用最广泛的信号通路,其中多种调节因子参与肾癌的致病调节[6,7]。有研究表明,RGS5在肾癌组织中的表达率是正常组织的6.6倍,并可抑制血管紧缩素Ⅱ、血小板衍生生长因子等多种血管发育关键因子,在肿瘤血管生成中发挥作用[8]。RGS4作为G蛋白信号通路的调节因子之一,在肝癌、乳腺癌、肺癌、卵巢癌中均发挥作用,但在肾癌中的研究仍为空白。
G蛋白偶联受体(GPCR)属于细胞表面受体蛋白,可以激活G蛋白三聚体,从而将细胞外信号传导到细胞内部,参与多种生物体信号的调控,并在肿瘤发生发展中具有重要的调节作用[9]。大量研究显示,许多GPCR在多种类型的肿瘤中与血管生成和转移密切相关,如CXC趋化因子受体4(CXCR4)、溶血磷脂酸受体和前列腺素E2受体[10,11]。RGS是GPCR通路的关键调节因子,含有高度保守的RGS结构域,具有GAP活性,可阻断GPCR介导的信号传递并抑制其下游级联效应,对G蛋白信号转导发挥负性调节作用。研究发现,RGS蛋白能够加速GTP酶活性达1 000倍,从而产生巨大的生理效应。除了作为异三聚体G蛋白的GAP功能,RGS结构域也作为效应拮抗剂起作用,通过竞争性结合G亚基或效应酶或动力支架,促进Ga亚基在激活和失活状态之间快速循环,从而实现对信号通路的调节作用[12,13]。近年研究[14,15]发现,RGS在多种类型癌组织中表达异常,RGS基因突变与肺癌和膀胱癌的患病风险降低相关。此外,RGS蛋白在前列腺癌、急性髓细胞白血病、卵巢癌、结肠癌和肿瘤血管生成中均发挥特异性作用[16~18]。研究显示,在高转移性乳腺癌细胞中,RGS4的mRNA水平显著增加,并通过调节小G蛋白Rac活性调节肿瘤转移[19]。在RCC中,小G蛋白Rac信号途径参与调节金属蛋白酶组织抑制剂等重要分子的活性,因此RGS4可能通过调节小G蛋白Rac活性或G蛋白的激活频率及活化时间,从而参与RCC调控[20]。然而,关于RGS4蛋白在RCC发病中的作用尚不明确。本研究发现,RCC癌组织中RGS4蛋白及mRNA表达均高于癌旁组织,提示RGS4可能参与了RCC的发生发展;中重度浸润的RCC患者RGS4阳性率高于轻度浸润患者,提示RGS4可能与肿瘤浸润程度有关,进而发挥其促进RCC生长的作用。
综上所述,RCC癌组织中RGS4表达增高,其增高程度与肿瘤浸润程度有关,参与RCC的发生发展,RGS4有望成为RCC治疗中一个潜在的有效靶点。
