NF-κB信号通路在类风湿关节炎患者甲氨蝶呤耐药机制中的作用
2017-04-14姚血明梁爽马武开宁乔怡钟琴侯雷黄颖唐芳
姚血明,梁爽,马武开,宁乔怡,钟琴,侯雷,黄颖,唐芳
(1贵阳中医学院第二附属医院,贵阳550001;2天津市海河医院)
类风湿关节炎(RA)是一种常见的炎性关节病,常表现为全身对称性、持久性多关节炎,其病因及发病机制尚不清楚[1]。RA的常用治疗药物包括非甾体类抗炎药(NSAIDs)、改善病情抗风湿药(DMARDs)、生物制剂、糖皮质激素等,其中DMARDs治疗是控制RA病情进展、延缓关节破坏进程的关键。甲氨蝶呤(MTX)属于DMARDs,因服药简便、价格低廉、不良反应发生率低、无远期致癌作用等特点,被作为RA治疗的首选用药广泛应用于临床。但临床治疗发现,约50%的RA患者在使用MTX后疗效不佳或复发后再次用药不敏感,提示存在MTX耐药。多药耐药(MDR)最初在肿瘤领域被发现,目前多项研究证实核转录因子-κB(NF-κB)参与介导了MDR[2~4],但对其在RA治疗中发生MDR的原因却尚不明确。近期研究[5]显示,MDR1基因的突变或者其表达水平的改变会通过影响P糖蛋白(P-gp)进而改变患者对药物的反应性,导致RA患者耐药,该反应是否与NF-κB信号通路相关,尚未得到证实。2015年1~12月,我们检测了120例RA患者发生MTX耐药后MDR1及NF-κB通路的表达变化,探讨NF-κB信号通路在RA患者MTX耐药形成机制中的作用。
1 资料与方法
1.1 临床资料 选择2015年1~12月在我院住院及门诊治疗的RA患者120例,均符合2010年美国风湿病学会/欧洲抗风湿病联盟中对RA的诊断标准[6]。纳入标准:年龄18~70岁;符合RA的诊断标准,且28个关节疾病活动度(DAS28,包括双肩、肘、腕、掌指、近端指间、膝关节)>3.2;未伴有其他影响治疗和检测指标的疾病;单独服用MTX,未联用其他DMARDs或糖皮质激素;愿接受检查治疗者,并签订知情同意书。排除标准:未按规定用药者;中途退出或资料不全,无法判断疗效,或因其他原因影响疗效及安全性评价者;不能合作者。选择我院未患有冠心病、糖尿病等慢性疾病,且血常规、肝肾功能、自身抗体检测均正常的体检健康人员20例作为正常对照组,男6例、女14例,年龄(43.70±10.10)岁。
1.2 治疗及分组方法 RA患者均给予MTX规范治疗,第1周1次口服MTX 10 mg,1次/周,每周递增2.5 mg,至15 mg维持。治疗12周后评价DAS28,如DAS28≤3.2者,纳入MTX敏感组;DAS28>3.2者,继续服药1次/周,每周递增2.5 mg,至20 mg维持,共服药24周后评价。其中DAS28≤3.2者,纳入MTX敏感组,DAS28评分仍>3.2者,纳入MTX耐药组。共纳入MTX敏感组67例、MTX耐药组53例,其中MTX敏感组男12例、女55例,年龄(42.71±7.89)岁,病程(14.85±5.30)年;MTX耐药组男11例、女42例,年龄(43.50±10.10)岁,病程(13.13±5.10)年。三组间年龄、性别差异无统计学意义,MTX敏感组、MTX耐药组间病程差异无统计学意义(P均>0.05)。
1.3 血清NF-κB、抑制蛋白IκBα(IκBα)、TNF-α及IL-1β水平检测 MTX敏感组、MTX耐药组于服用MTX后第3日清晨空腹抽取肘静脉血,正常对照组采集清晨空腹肘静脉血,采用ELISA法检测各组血清NF-κB、IκBα、TNF-α及IL-1β水平。
1.4 外周血淋巴细胞(PBMCs)中MDR1、TNF-α及IL-1β mRNA表达检测 MTX敏感组、MTX耐药组于服用MTX后第3日清晨空腹抽取肘静脉血,采用荧光PCR法,提取RNA后,将RNA逆转录为cDNA,配置反应体系,每个样本设两个复孔,反应条件为95 ℃ 5 s、60 ℃ 30 s共40个循环,用7500 Real-time PCR仪及自带软件进行分析。采用2-ΔΔCt法计算目的基因mRNA相对含量。
1.5 PBMCS中P-gp表达及功能检测 采用流式细胞术检测P-gp表达,采用罗丹明123(Rh123)间接法检测P-gp功能[7]。MTX敏感组、MTX耐药组于服用MTX后第3日清晨空腹抽取肘静脉血,正常对照组采集清晨空腹肘静脉血,以流式细胞仪检测到的细胞内Rh123荧光强度代表Rh123的蓄积量,作为反映P-gp功能的指标。

2 结果
2.1 各组血清NF-κB、IκBα、TNF-α及IL-1β水平比较 MTX敏感组及MTX耐药组血清NF-κB、TNF-α、IL-1β水平均高于正常对照组,IκBα水平均低于正常对照组(P均<0.05);MTX耐药组血清NF-κB、TNF-α、IL-1β水平均高于MTX敏感组,IκBα水平低于MTX敏感组(P均<0.05)。见表1。
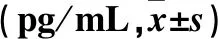
表1 各组血清NF-κB、IκBα、TNF-α及IL-1β水平比较
注:与正常对照组比较,*P<0.05;与MTX敏感组比较,#P<0.05。
2.2 MTX敏感组及MTX耐药组MDR1、TNF-α、IL-1β mRNA表达比较 MTX耐药组MDR1、TNF-α及IL-1β mRNA表达均高于MTX敏感组(P均<0.05)。见表2。

表2 MTX敏感组及MTX耐药组MDR1、TNF-α、IL-1β mRNA表达比较
注:与MTX敏感组比较,*P<0.05。
2.3 各组PBMCs中P-gp表达及功能比较 MTX敏感组及MTX耐药组P-gp荧光值均高于正常对照组,Rh123荧光值均低于正常对照组(P均<0.05)。MTX耐药组P-gp荧光值高于MTX敏感组,Rh123荧光值低于MTX敏感组(P均<0.05)。见表3。

表3 各组PBMCs中P-gp、Rh123荧光值表达比较
注:与正常对照组比较,*P<0.05;与MTX敏感组比较,#P<0.05。
3 讨论
RA是一种慢性进行性自身免疫性疾病,因医疗费用高和关节致残丧失劳动,给社会造成沉重经济负担,影响全球0.5%~1%的人口[1,8]。目前,MTX作为治疗RA的首选药物,已广泛应用于临床。MTX通过抑制二氢叶酸还原酶,从而阻碍DNA的合成而发挥作用,其抗RA的机制尚不清楚,可能与抑制免疫反应及抗炎作用有关。虽然MTX作为抗风湿治疗的一线用药可以减轻关节症状、控制滑膜炎症、延缓病情进展,从而使患者病情得到有效控制,但仍有近一半患者在使用MTX后疗效不佳或复发后再次用药不敏感。荷兰的一项研究[9]报告显示,RA患者用MTX治疗失败后,采用常规的DMARDs治疗也无效。循证医学证据显示,对比MTX单药治疗失败的RA患者,MTX联合治疗也没有显著优势[10]。因此,MTX治疗失败的RA患者可能存在类似于肿瘤患者的MDR问题。由于RA患者需长期服药,保持MTX的药物效果具有重要意义,虽然单纯通过增加药物剂量可能提高疗效,但势必会增加其不良反应。因此,对RA患者MTX耐药的机制尚需进行深入研究。
在有关MDR机制的研究中,对于MDR基因的研究是最多的。人类MDR基因族主要由MDR1、MDR2组成,前者的作用是参与抗肿瘤药物的转运,在耐药中起主导作用,后者主要参与磷脂的转运。MDR1基因位于7号染色体长臂2区1带1亚带上,其大小约210 kb,包含29个外显子,是较早发现的MOR基因。MDR1 的表达除受Y盒结合蛋白-1(YB-1)影响外,还受 NF-κB、环氧化酶-2(COX-2)、细胞色素P450酶3A4(CYP3A4)、丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3激酶(PI-3K)等多种物质、信号通路的调控。研究发现,在MDR1基因启动子区存在NF-κB作用的结合位点,考虑MDR1可能是NF-κB 的下游基因[11,12]。本研究发现,MTX耐药组MDR1 mRNA表达高于MTX敏感组,提示发生MTX耐药的RA患者MDR1 mRNA表达增高,MDR1基因的表达与RA患者MTX耐药相关[5]。
MDR1编码的P-gp在MTX的外排机制中具有重要地位,P-gp可通过两个核苷酸结合位点水解ATP获得的能量,将有毒性的亲脂性药物从细胞内泵出到细胞外,使细胞内药物浓度降低而产生耐药。P-gp对药物的特异性很小,能够运输多种结构不同的底物,因此发生MDR的细胞能对许多结构和作用机制不同的药物产生耐药。Tsujimura等[13]研究发现,人PBMCS上P-gp过度表达可引起DMARDs和糖皮质激素的药物外排,进而导致RA患者产生MDR。本研究发现,MTX敏感组及耐药组P-gp荧光值均高于正常对照组,MTX耐药组P-gp荧光值高于MTX敏感组,提示RA患者P-gp的表达高于正常人群,且发生MTX耐药的RA患者P-gp的表达高于MTX敏感患者;MTX敏感组及耐药组Rh123荧光值均低于正常对照组,MTX耐药组Rh123荧光值低于MTX敏感组,提示RA患者的P-gp功能高于正常人群,且发生MTX耐药的RA患者P-gp功能高于MTX敏感患者,表明P-gp表达和功能影响了RA患者对MTX的疗效,参与了RA的MOR。
既往研究发现,NF-κB信号通路的激活与肿瘤治疗中的MDR现象密切相关[2~4]。NF-κB是一种分布广泛的核转录因子,由Rel家族中的成员以同源或异源二聚体的形式存在,参与机体的免疫应答、炎症反应等。一般NF-κB与IκB结合以无生物学活性的状态存在于细胞质中。当细胞受到刺激时,经过一系列级联反应IκB磷酸化、NF-κB发生核易位,活化的NF-κB进入细胞核内与κB位点结合,诱导NF-κB调控MDR1的表达[14]。NF-κB激活后可使MDR1/P-gp表达升高,促进MTX外排,导致耐药,耐药的产生又使疾病恶化,炎症活动度增加,造成恶性循环。另一方面,活化的NF-κB调节多种炎症基因的表达,如TNF-α、IL-1β等,而TNF-α、IL-1β又可以通过一系列级联反应,促进NF-κB的活化,形成正反馈机制。研究证实,RA患者的滑膜中有着NF-κB的大量表达,而NF-κB的下游炎症因子TNF-α、IL-1β也与RA骨破坏密切相关[15,16]。TNF-α主要由单核细胞和巨噬细胞产生,是一种多效应性细胞因子,不仅可以刺激滑膜细胞产生胶原酶及前列素E2,诱导骨吸收,还可以体外抑制骨形成,导致骨骼的破坏[17]。IL-1β同TNF-α有着相似的功能及信号转导途径[18]。本研究发现,MTX敏感组及MTX耐药组血清NF-κB、TNF-α、IL-1β水平均高于正常对照组,IκBα水平均低于正常对照组,提示RA患者体内IκBα大量被降解,导致NF-κB激活释放,下游炎症因子TNF-α、IL-1β释放增加;MTX耐药组血清NF-κB、TNF-α、IL-1β水平及mRNA均高于MTX敏感组,IκBα水平低于MTX敏感组,提示对MTX耐药的RA患者NF-κB进一步激活,TNF-α、IL-1β释放明显增加,随着大量炎症因子的不断堆积,MTX控制疾病的效果降低,难以控制疾病;IκBα在炎症因子的不断刺激下被降解,NF-κB不断激活,通过NF-κB信号通路传导使MDR1、P-gp表达升高,MTX在细胞内浓度降低,导致耐药的发生。
综上所述,RA患者MTX耐药的产生可能与NF-κB信号通路的激活有关,一方面使MDR1、P-gp表达增加,促进MTX外排;另一方面可通过促进炎症因子TNF-α、IL-1β的释放,形成正反馈机制,可能是介导MTX的耐药产生的机制之一。
