壳聚糖黄原胶鼠李糖乳杆菌微胶囊的制备及其特性的研究
2017-04-14王远一飞宋莹莹黄亚萍
王远一飞,丁 武,宋莹莹,黄亚萍
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
壳聚糖黄原胶鼠李糖乳杆菌微胶囊的制备及其特性的研究
王远一飞,丁 武*,宋莹莹,黄亚萍
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
本研究利用壳聚糖和黄原胶作为壁材,用乳化法包埋鼠李糖乳杆菌,以包埋率为指标,探究其最佳的制备工艺,发现当壳聚糖浓度为0.8%,黄原胶浓度为1.0%,转速为900 r/min时效果最佳,最佳包埋率为88.9%。制备的微胶囊粒径在300 μm左右,分布较为均匀。在模拟胃液和模拟胆液中静置2 h后仍分别有3.56 lg CFU/mL和3.4 lg CFU/mL活菌体,表明其对菌体有较强的保护作用。
壳聚糖,黄原胶,鼠李糖乳杆菌,微胶囊,包埋
鼠李糖乳杆菌是由美国科学家在20世纪80年代从健康人的肠道中分离出的一种益生菌[1],属于第三代益生菌,也是全球迄今为止研究最多的一种益生菌[2]。国内外文献报道表明,该菌种具有缓解乳糖不耐症,平衡肠道菌群,抑制有害菌,降低胆固醇和血氨,提高机体的免疫力和抗癌作用等,对人体有极好的生理保健功能[3-4]。但要让鼠李糖乳杆菌在人体真正发挥自身功效,就必须保证有一定数量的菌体经过人体消化道,成功到达肠道[5]。虽然鼠李糖乳杆菌相对于其他益生菌更能耐受动物消化道的酸环境,在人或动物肠道内定殖起到益生作用[6],但在经过低pH的胃环境以及受到胆盐毒害时依然会遭到严重破坏或其活性受到严重抑制,从而大大降低了鼠李糖乳杆菌的活性以及到达肠道中菌体的数量[7]。因此,如何在保证鼠李糖乳杆菌活性的情况下使其能够更多地进入到肠道,成为了问题的关键。近几年,随着微胶囊技术在食品行业中的发展,利用微胶囊技术将益生菌包埋,则能够大大提高菌体的耐受性,从而解决这一问题[8-11]。
目前,微胶囊制备方法有200多种,常见的有乳化交联法、喷雾成型法和挤压法[12]。赵洪磊等[13]利用压力法制备了嗜酸乳杆菌微胶囊,但微胶囊粒径过大,不便于应用于市场。相对于其他方法,乳化法制备得到的益生菌微胶囊具有粒径小,表面致密,且易于工业化大规模生产的特点[14]。因此本实验选用乳化法制备鼠李糖乳杆菌微胶囊,采用了对人体完全无害的壳聚糖和黄原胶作为壁材,利用其在水溶液中发生聚电解质络合作用形成共混凝胶的原理包埋益生菌[15],以包埋率为指标,探究了鼠李糖乳杆菌微胶囊的最佳制备工艺,并对其抵抗胃酸、胆汁的特性以及在肠道中的释放情况作了探究,为鼠李糖乳杆菌微胶囊产品的开发和应用奠定基础。
1 材料与方法
1.1 材料与仪器
鼠李糖乳杆菌 本实验室保藏;壳聚糖 阿拉丁试剂(上海)有限公司,脱乙酰度≥95;黄原胶 内蒙古阜丰生物科技有限公司,食品级;胰蛋白酶 Amresco公司,1∶250;胃蛋白酶 Amresco公司,1∶3000;牛胆盐 北京奥博星生物技术有限责任公司,胆酸含量>60%;MRS肉汤培养基、MRS琼脂培养基 北京陆桥技术股份有限公司;大豆油 中粮佳悦有限公司,一级;模拟肠液(解囊液) 0.68%的磷酸二氢钾溶液调pH至6.8和1%的胰蛋白酶1∶1混合;模拟胃液 1%的胃蛋白酶溶液调pH至1.5;模拟胆液 1%的牛胆盐溶液;其他试剂均为国产分析纯。
85-2A恒温测速磁力搅拌器 金坛市荣华仪器制造有限公司;SZX7变焦距实体显微镜 奥林巴斯;Hitachi S-3400N扫描电子显微镜 Hitachi。
1.2 实验方法
1.2.1 微胶囊的制备
1.2.1.1 菌种活化及菌悬液的制备 取甘油保存的鼠李糖乳杆菌平板上划线,37 ℃培养48 h。用接种环挑取生长旺盛的菌落于MRS液体培养基中,37 ℃培养24 h。以3%的接种量传代培养三次。取3%活化好的菌液于MRS肉汤培养基中37 ℃培养15 h,完成活化。取10 mL充分活化的菌液8000 r/min离心10 min,弃去上清。用1 mL生理盐水吹打均匀后备用。
1.2.1.2 乳化液的制备 称取一定量的黄原胶,置于80 ℃的水浴锅溶解30 min后冷却至室温。取一定量黄原胶与浓缩菌液混合均匀,用注射器吸取混合后的菌胶溶液,快速加入大豆油中,高速搅拌20 min,充分乳化。
1.2.1.3 微胶囊的制备 称取一定量的壳聚糖,溶解于30%的0.5 mol/L醋酸溶液中,调pH至5.0,加蒸馏水定容。量取30 mL壳聚糖溶液并置于磁力搅拌器上匀速搅拌,用注射器吸取10 mL乳化液快速加入壳聚糖溶液中,搅拌1 h后,过夜静置。
1.2.2 实验设计
1.2.2.1 单因素实验 根据预实验,以微胶囊成囊性为依据,选择可以成囊且微粒较为均匀的条件制备,发现在乳化液体系为30 mL油胶比为3∶1时,乳化液整体呈乳白色,短时静置不会分层,乳化效果良好;在胶囊液为40 mL体系乳化液与壳聚糖比为1∶3时胶囊成囊性较好,颗粒均匀,絮状物少或无,胶囊密度较高,故选作固定条件。其他条件为:固定黄原胶浓度为1.2%,转速为1300 r/min,考察不同壳聚糖浓度(0.6%、0.8%、1.0%、1.2%)对包埋率的影响;固定壳聚糖浓度为1%,转速为1300 r/min,考察不同黄原胶浓度(0.8%、1.0%、1.2%、1.4%)对包埋率的影响;固定壳聚糖浓度为1%,黄原胶浓度为1.2%,考察不同转速(900、1100、1300、1500 r/min)对包埋率的影响。
1.2.2.2 正交实验 根据单因素实验结果,选择L9(34)正交表,具体因素水平如表1。
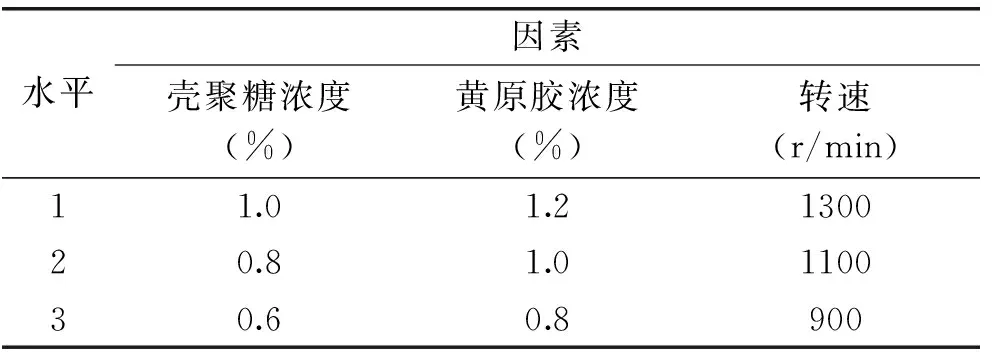
表1 正交实验因素水平表
1.2.3 包埋率的测定 将过夜静置的胶囊液全部装入离心管内,6000 r/min离心10 min,弃去上清液,用生理盐水冲洗1次,再5000 r/min离心10 min,取下层胶囊,用20 mL解囊液吹打悬浮各管内的胶囊,置于37 ℃环境下180 r/min解囊2 h,再将解囊液稀释涂布,37 ℃培养48 h后计数。
包埋率(%)=(解囊液菌落数/制备微胶囊的原菌液菌落数)×100
1.2.4 微胶囊的外观形态观察 变焦距实体显微镜观察:用胶头滴管吸取少量微胶囊,均匀滴在载玻片上,置于变焦距实体显微镜上观察记录。
扫描电镜观察:用胶头滴管吸取少量微胶囊,均匀滴在圆形盖玻片上,自然干燥完全后,喷金观察记录。
1.2.5 耐胃酸实验 称取2 g鼠李糖乳杆菌微胶囊放入盛有20 mL人工胃液的离心管,将离心管放在37 ℃、180 r/min的恒温摇床中,在0、0.5、1.0、1.5和2.0 h时5000 r/min离心5 min收集下层胶囊,之后置于装有20 mL解囊液的离心管中37 ℃解囊2 h,待菌体完全释放后涂布计数。另外,取2 g空胶囊和游离菌体作对照实验。
1.2.6 耐胆盐实验 称取2 g鼠李糖乳杆菌微胶囊放入盛有20 mL人工胆液的离心管,将离心管放在37 ℃、180 r/min的恒温摇床中,在0、0.5、1.0、1.5和2.0 h时5000 r/min离心5 min收集下层胶囊,之后置于装有20 mL解囊液的离心管中37 ℃解囊2 h,待菌体完全释放后涂布计数。另外,取2 g空胶囊和游离菌体作对照实验。
1.2.7 肠溶性实验 称取2 g鼠李糖乳杆菌微胶囊放入盛有20 mL人工肠液的离心管,对照组用生理盐水代替人工肠液解囊,将离心管放在37 ℃、180 r/min的恒温摇床中,分别在0.5、1.0、1.5、2.0 h时置于光学显微镜下观察微胶囊形态。
1.3 数据处理
采用Excel作图,用Minitab 16.2.3处理数据分析其显著性。
2 结果与分析
2.1 微胶囊的制备工艺的优化
2.1.1 单因素实验
2.1.1.1 壳聚糖浓度对包埋率的影响 由图1可知,包埋率随着壳聚糖浓度的增大呈现先增大后减小的趋势,在0.8%时达到最大值,随后迅速下降。分析其原因,可能是由于壳聚糖浓度较低时,微胶囊表面膜层不容易形成,且形成的膜所需时间较长,受到磁力搅拌器的机械伤害较大,微胶囊容易在搅拌过程中破损,导致包埋率较低;当壳聚糖浓度较高时,形成的微胶囊表面膜层较厚且较致密,在解囊液中不容易释放菌体,故包埋率较低。所以,壳聚糖浓度应该控制在0.6%~1.0%之间包埋率较高。
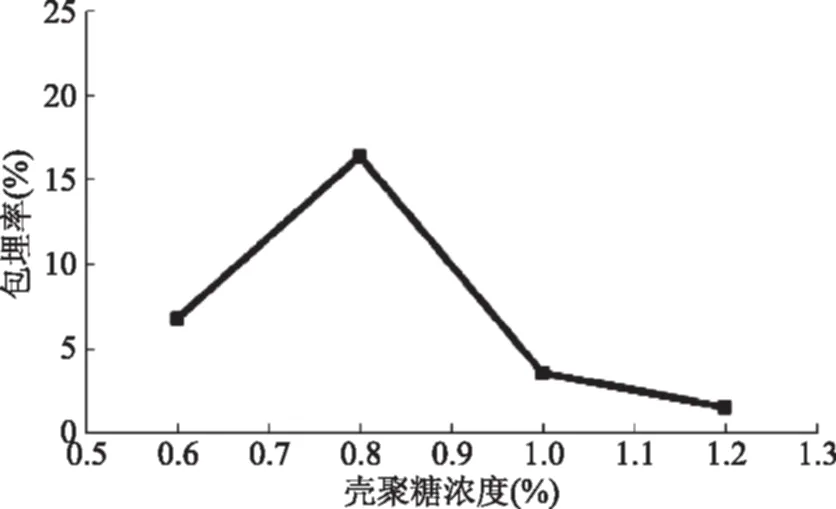
图1 壳聚糖浓度对包埋率的影响Fig.1 Effect of chitosan concentration on the rate of encapsulation
2.1.1.2 黄原胶浓度对包埋率的影响 由图2可知,包埋率随着黄原胶浓度的增大呈现先增大后减小的趋势,在达到1%时包埋率达到最大值,随后迅速下降。分析其原因,可能是由于黄原胶浓度过低,微胶囊表面膜层不容易形成,且形成的膜层较薄较疏松,受到磁力搅拌器机械伤害较大,微胶囊容易在搅拌、收集过程中破损,导致包埋率较低;黄原胶的浓度较高时,类似于壳聚糖浓度较高时的模型,微胶囊的表面膜层较厚且较致密,在解囊液中不容易释放菌体,故包埋率较低。所以,黄原胶浓度应控制在0.8%~1.2%之间包埋率较高。

图2 黄原胶浓度对包埋率的影响Fig.2 Effect of xanthan gum concentration on the rate of encapsulation
2.1.1.3 转速对包埋率的影响 由图3可知,随着转速增加,包埋率呈下降趋势,在900 r/min时包埋率最高,然后随即下降。分析其原因,可能是由于转速越快,微胶囊外形粒径越小(此结论在预实验中已得知),数量越多,但微胶囊间碰撞越频繁,在微胶囊表面附着或包埋在微胶囊表层的益生菌容易被甩出或由碰撞挤出,导致包埋率过低;而转速越慢,微胶囊粒径越大,在实际应用中有较大局限性。所以,考虑到微胶囊的实际使用价值和包埋率应较高的原则,转速应选择在900~1300 r/min时最佳。
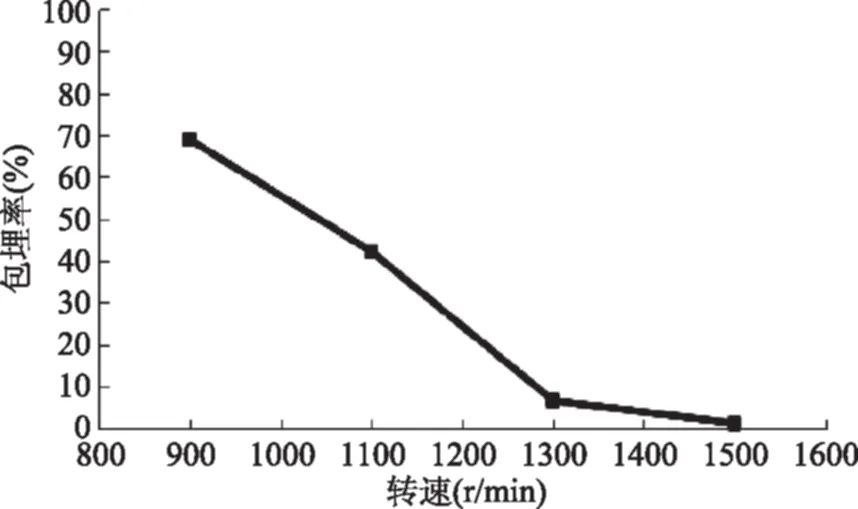
图3 转速对包埋率的影响Fig.3 Effect of rotational speed concentration on the rate of encapsulation
2.1.2 正交实验 正交实验结果如表2所示。
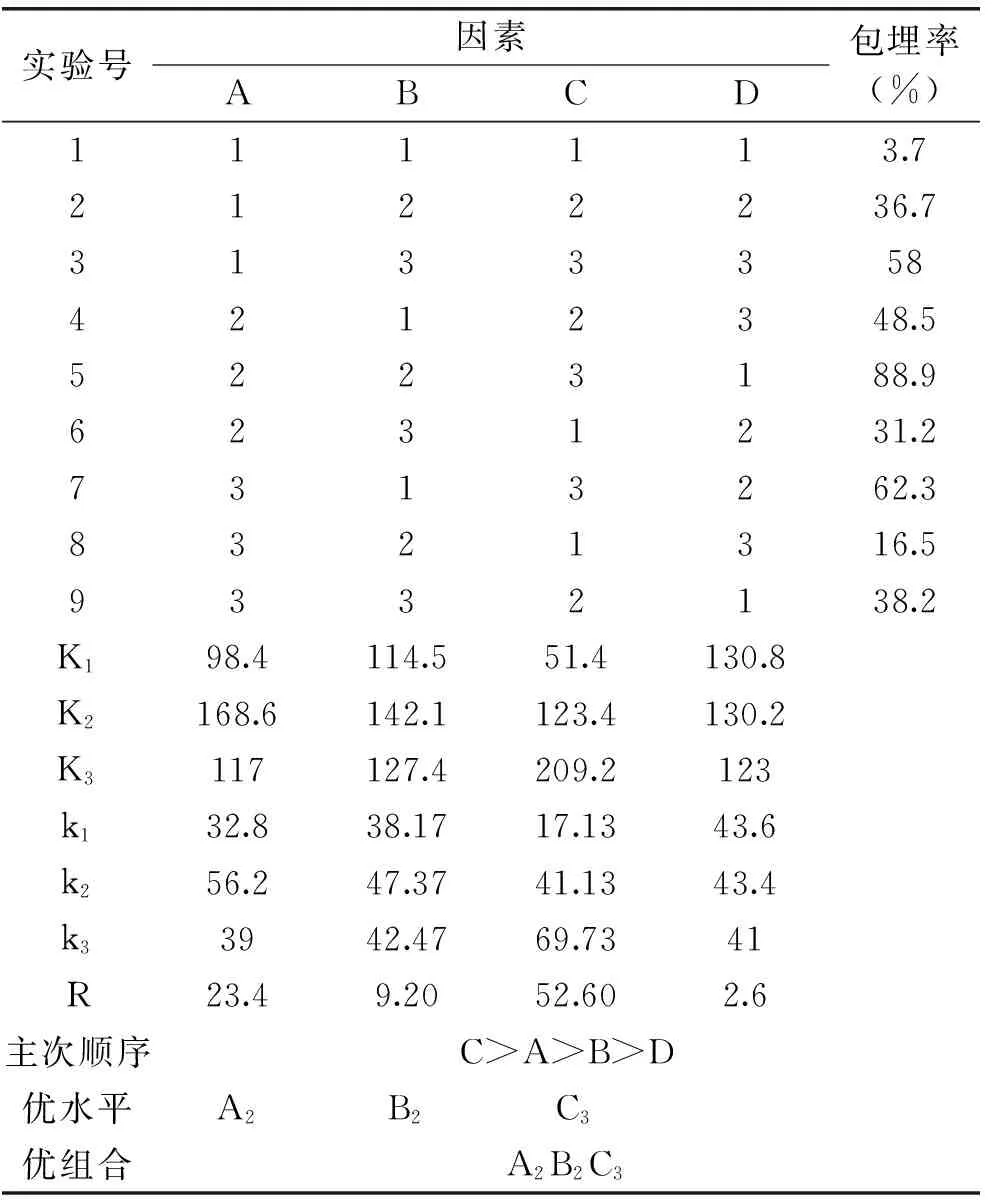
表2 正交实验设计及结果
根据表2可知,各因素的极差R从大到小的顺序为C>A>B>D,D为空列,由此可知影响鼠李糖乳杆菌微胶囊制备的因素按主次顺序排列为C>A>B,即对鼠李糖乳杆菌微胶囊制备影响最大的是转速,其次是壳聚糖浓度,黄原胶浓度的影响最小。最优组合为A2B2C3,即壳聚糖浓度为0.8%,黄原胶浓度为1.0%,转速为900 r/min,最佳包埋率为88.9%。再对实验结果进行方差分析,具体结果如表5所示。
注:*差异显著(p<0.05),**差异极显著(p<0.01)。
由方差分析结果可以看出,因素C的p<0.01,则磁力搅拌器的转速对微胶囊制备的实验指标的影响极显著;因素A的0.01
2.2 微胶囊的外观形态
微胶囊的粒径和分布是微胶囊特性的一个重要指标,它不仅影响微胶囊的缓释性能,也影响微胶囊的保护作用。由图4~图6可知,用该方法制得的微胶囊外形近球形,分布均匀,粒径大小约300 μm,符合微胶囊粒径基本要求[16]。
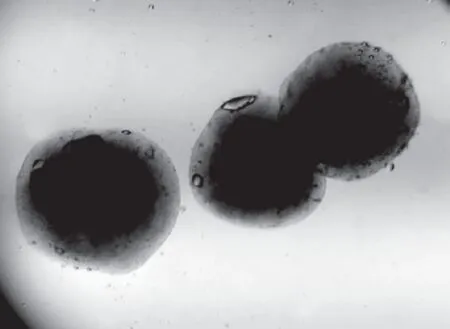
图4 变焦距实体显微镜观察结果(200×)Fig.4 Zoom stereo-microscope of microcapsules(200×)

图5 微胶囊解剖照片(100×)Fig.5 Microcapsules anatomy photo(100×)
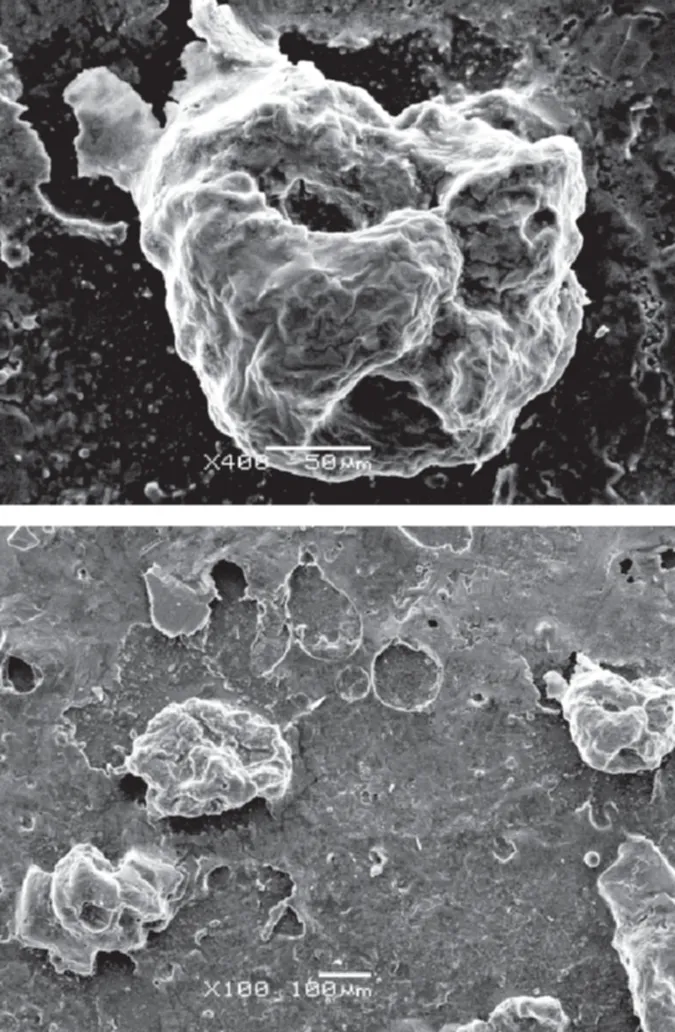
图6 干燥后微胶囊的扫描电镜观察结果Fig.6 Scanning electron micrographs of dried microcapsules
2.3 耐胃酸实验
如图7所示,未经包埋的菌悬液和微胶囊的菌落数在0.5 h内都在高速下降,原因可能是在前0.5 h内,微胶囊处于暴释阶段[17],在微胶囊表面吸附的菌体都在短时间内分散到模拟胃液中,从而受到强酸环境的破坏。在1.5 h时菌悬液中仅存在少量活菌体。在2 h时,菌悬液中未检测出活菌体,而微胶囊中还有3.56 lg CFU/mL数量活菌。这说明人工胃液的所造成的酸环境只能对裸露在其中的菌体造成较大破坏,对包埋在微胶囊内的菌体破坏较小,微胶囊在一定程度上保护了菌体。
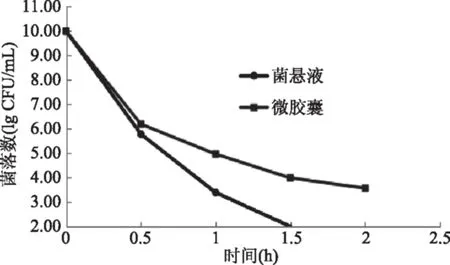
图7 微胶囊在人工胃液中的耐受性Fig.7 Tolerance of microcapsules in artificial gastric juice
2.4 耐胆盐实验
胆盐是一种阴离子型表面活性剂,能够破坏细胞膜结构,产生氧化损伤,从而使得益生菌细胞致死,因此在人体胃肠道中,小肠上部的高胆盐环境也是影响益生菌存活率的主要因素[18-19]。如图8所示,未经包埋的菌悬液的菌落数在模拟胆液中一直以较快速度下降,在1 h时就下降了6 lg CFU/mL,而微胶囊下降了不到5 lg CFU/mL。在2 h时菌悬液中未检测出活菌体,而微胶囊中还存在3.4 lg CFU/mL数量活菌。这说明人工胆液主要对裸露的菌体造成较大破坏,对被微胶囊包埋的菌体破坏较小,微胶囊在一定程度上保护了菌体。

图8 微胶囊在人工胆液中的耐受性Fig.8 Tolerance of microcapsules in artificial bile
2.5 肠溶性实验
微胶囊对益生菌的包埋效果不仅仅是指微胶囊对其在模拟胃液中的进行保护,还体现在微胶囊在进入肠道之后逐步发生降解,将其包埋的活菌在大肠中进行靶向释放,才能起到将活菌载运并定殖于大肠处的作用[20-21]。如图9所示,壳聚糖黄原胶微胶囊在人工肠液中0.5 h时表面明显变薄,部分胶囊出现凹洞,表明其已经开始解囊,1.0 h时解囊效果良好,部分胶囊已经成碎片状,2.0 h时几乎全部解囊,肉眼看不见球状微胶囊,说明该微胶囊肠溶性良好。对照组中微胶囊无明显变化。
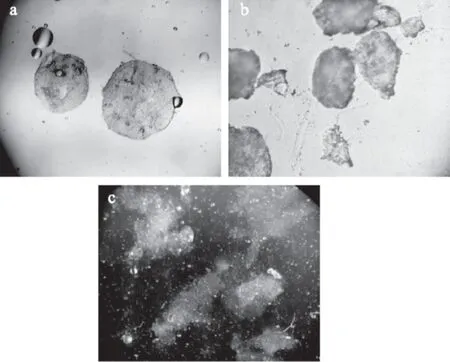
图9 微胶囊肠溶性照片(100×)Fig.9 Microcapsules enteric photo(100×)注:(a)微胶囊在人工肠液中0.5 h;(b)微胶囊在人工肠液中1.0 h;(c)微胶囊在人工肠液中2.0 h。
3 结论
本研究得到最佳制备条件为壳聚糖浓度0.8%,黄原胶浓度1.0%,转速900 r/min,最佳包埋率可高达88.9%。用此法制备的微胶囊粒径为300 μm左右,外形近球形,分布均匀。微胶囊在胃酸中2 h,还有3.56 lg CFU/mL数量活菌,在胆液中2 h,还有3.4 lg CFU/mL数量活菌,表明其有较好的抵抗胃酸和胆盐的能力,可以起到保护芯材益生菌的效果,且其在模拟肠液中肠溶性良好,2 h左右即可全部解囊释放。用该方法制得的微胶囊能满足一定的市场要求,为进一步开发益生菌微胶囊产品在食品中的应用打下了基础。
[1]马鹏飞,陈有亮,金鸟君. 鼠李糖乳杆菌功能特性的研究进展[J]. 科技通报,2009(2):202-206.
[2]贺璟,聂乾忠,邓洁红. 鼠李糖乳杆菌功能特性的研究进展[J]. 农产品加工·学刊,2012(3):117-120.
[3]Zubillaga M,Weill R,Postaire E,et al. Effect of probiotics and functional foods and their use in different diseases[J]. Nutrition Research,2001,21(3):569-579.
[4]刘谦典,李长虹,刘鹭,等. 微生态制剂的作用机理与临床应用[J]. 中国医院药学杂志,1998(6):40-41.
[5]刘茜,张娟,陈坚,等. 喷雾冷凝法制备高性能乳酸菌微胶囊[J]. 应用与环境生物学报,2012(5):824-830.
[6]雷艳琴. 益生菌的特性及其在成人奶粉中的应用[J]. 中国乳业,2008(10):54-55.
[7]陈卫,谭惠子,胡斌,等. 益生菌对消化道胃酸和胆盐胁迫的应激机理[J]. 中国食品学报,2010(6):1-6.
[8]Sultana K,Godward G,Reynolds N,et al. Encapsulation of probiotic bacteria with alginate-starch and evaluation of survival in simulated gastrointestinal conditions and in yoghurt[J]. International Journal of Food Microbiology,2000,62(1-2):47-55.
[9]Anal A K,Singh H. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J]. Trends in Food Science & Technology,2007,18(5):240-251.
[10]Mortazavian A,Razavi S H,Ehsani M R,et al. Principle's and methods of microencapsulation of probiotic microorganisms[J]. Iranian Journal of Biotechnology,2007,5(1):1-18.
[11]Hunkeler D. Polymers for bioartificial organs[J]. Trends in Polymer Science,1997,5(9):286-293.
[12]朱守创.益生菌LGG微胶囊化及对提高其存活性的机制研究[D].郑州:郑州大学,2013.
[13]赵红磊,田丰伟,陈卫,等. 压力喷雾法制备嗜酸乳杆菌微胶囊的工艺研究[J]. 食品工业科技,2010(6):196-198.
[14]邹强,梁华忠,龚春雪,等. 海藻酸钠和乳清蛋白作为益生菌包埋壁材的比较[J]. 食品科学,2014(15):207-211.
[15]何东保,石毅,冯峰,等. 壳聚糖/黄原胶凝胶化性能的研究[J]. 武汉大学学报:理学版,2001(6):717-720.
[16]刘剑萍,陆大年. 壳聚糖微胶囊制备过程的研究[J]. 浙江化工,2003(7):10-12.
[17]邹强.双歧杆菌微胶囊的研究[D].无锡:江南大学,2012.
[18]Radmacher E,Vaitsikova A,Burger U,et al. Linking central metabolism with increased pathway flux:L-valine accumulation by Corynebacterium glutamicum[J]. Applied and Environmental Microbiology,2002,68(5):2246-2250.
[19]Cheow W S,Kiew T Y,Hadinoto K. Controlled release of Lactobacillus rhamnosus biofilm probiotics from alginate-locust bean gum microcapsules[J]. Carbohydrate Polymers,2014,103:587-595.
[20]Acarturk F,Takka S. Calcium alginate microparticles for oral administration:II effect of formulation factors on drug release and drug entrapment efficiency[J]. Journal of Microencapsulation,1999,16(3):291-301.
[21]Tonnesen H H,Karlsen J. Alginate in drug delivery systems[J]. Drug Development and Industrial Pharmacy,2002,28(6):621-630.
The preparation and properties of chitosan xanthan gumLactobacillusrhamnosusmicrocapsules
WANG Yuan-yi-fei,DING Wu*,SONG Ying-ying,HUANG Ya-ping
(College of Food Science and Engineering,Northwest A & F University,Yangling 712100,China)
Using chitosan and xanthan gum as wall materials,the experiment embeddedLactobacillusrhamnosuswith emulsion method to explore its best preparation technology with embedding rate as the indicators. The study revealed that when chitosan's concentration was 0.8%,the xanthan gum concentration was 1.0%,and the best rotational speed was 900 r/min,the optimal embedding rate was 88.9%. The diameters of microcapsules were about 300 μm,relatively evenly distributed. There were 3.56 lg CFU/mL and 3.4 lg CFU/mL live bacteria still in the simulated gastric juice and the simulated bile fluid after 2 h. It showed that it had a strong protective effect on the cell.
chitosan;xanthan gum;Lactobacillusrhamnosus;microcapsules;embedding
2016-08-16
王远一飞(1994-),男,大学本科,研究方向:畜产食品深加工与安全控制,E-mail:Wangyyf163@163.com。
*通讯作者:丁武(1971-),男,博士,教授,研究方向:畜产食品深加工与安全控制,E-mail:dingwu10142000@hotmail.com。
国家自然基金项目(31172236);陕西省自然科学基金项目(K33202096)。
TS201.1
B
1002-0306(2017)06-0229-05
10.13386/j.issn1002-0306.2017.06.035
