复合酶法高效提取海带中褐藻糖胶
2017-04-14杨晓雪董学前张永刚杜金华刘建军
杨晓雪,董学前,张永刚,王 伟,杜金华,刘建军,,*
(1.山东农业大学食品科学与工程学院,山东泰安 271000;2.山东省食品发酵工业研究设计院,山东济南 250000)
复合酶法高效提取海带中褐藻糖胶
杨晓雪1,董学前2,张永刚2,王 伟2,杜金华1,刘建军1,2,*
(1.山东农业大学食品科学与工程学院,山东泰安 271000;2.山东省食品发酵工业研究设计院,山东济南 250000)
本研究以海带为原料,采用复合酶法提取其中的褐藻糖胶(Fucoidan),目的是通过优化提取条件以及与传统水提法和其他酶提取法作比较,得到一种高效提取褐藻糖胶的方法。研究表明,通过单因素实验确定了复合酶即纤维素酶、果胶酶、木聚糖酶、α-淀粉酶和酸性蛋白酶的比例为25∶10∶10∶1∶5;在单因素实验基础上设计正交实验优化,得到的复合酶提取海带中褐藻糖胶的最佳条件是复合酶添加量(以海带干重计)为4.6%,酶解温度为59 ℃,pH为4.5,时间为18 h,料水比为1∶30。根据优化条件得到的褐藻糖胶的得率为2.04%,一次提取率为90.20%,明显高于已有研究报道。本研究建立了全新的复合酶高效提取褐藻糖胶的工艺,为后续工业放大提供理论与实践基础。
褐藻糖胶,复合酶,海带,多糖
海带是一种在低温海水中生长的大型海藻类植物,同时具有良好的食用和药用价值[1-2],是目前提取褐藻糖胶的主要原料。褐藻糖胶(Fucoidan)又名岩藻聚糖硫酸酯,主要存在于各种藻类植物中,具有多种生理功能如抗肿瘤、抗凝血、抗病毒、抗氧化、降血脂和调节免疫[3-7]。在海带中,褐藻糖胶的主要存在位置是细胞壁。海带细胞壁的主要成分包括纤维素、果胶、半纤维素等,另外还有少量海带多糖(海藻酸、褐藻糖胶和海带淀粉)和蛋白质,其中前三者对海带细胞壁具有骨架支撑作用。褐藻糖胶的含量在不同地域和不同部位的海带中都有所不同,且随季节和生长期的变化而变化。根据测定数据,海带中褐藻糖胶的含量为2.26%。近几年来,由于褐藻糖胶具有多种生物学活性,其受到国内外广泛关注,成为当今海洋食品和医学领域的研究热点。
目前,从海带中提取褐藻糖胶的方法主要有热水提取法、酸提取法、微波辅助法、超声波提取法和酶法。其中,热水提取法是制备褐藻糖胶的主要方式,但其耗能多,提取时间长,得率较低[8],浸提过程中高温导致褐藻糖胶的活性被破坏;酸提取法能提高褐藻糖胶得率,但能显著降解褐藻糖胶分子使其生物活性降低[9-10],并且大量的酸性化学药品会对环境造成污染;微波辅助法虽然加热均匀、选择性好、提取效率高、节能环保,但由于成本较高不易应用于工业生产;超声波提取法与酸提法相比能显著提高褐藻糖胶的含量,但粗多糖的提取率增幅并不明显[11-12];酶法与其他提取方法相比条件较为温和,对褐藻糖胶的结构基本没有破坏作用,易于实现大规模工业化生产,随着酶制剂工业的快速发展成熟,其具有良好的应用前景。但目前酶法提取褐藻糖胶的研究尚处于起步阶段,研究报道少,且大部分研究采用单一酶解,综合效果不具有显著优势,因此有必要开发更具显著优势的复合酶解方法。
研究表明海带细胞壁的主要成分包括纤维素、果胶、半纤维素、褐藻多糖和少量蛋白质等。首先,纤维素、果胶、半纤维素对海带细胞壁具有骨架支撑作用,因此要快速有效的破解海带细胞壁以释放出可溶性的褐藻糖胶,需要有效破坏三者形成的稳定胞壁结构,所以选择了纤维素酶、果胶酶和木聚糖酶;其次,以海带淀粉为主的褐藻多糖对褐藻糖胶的提取有一定影响,因此选择α-淀粉酶除去;最后,少量蛋白质对褐藻糖胶在溶液中的释放存在一定影响,因此要除去这部分蛋白质。研究表明,褐藻糖胶提取时,蛋白酶除蛋白的效果优于酸法和Sevage法[13],所以最终选择酸性蛋白酶,以加速细胞崩解,有利于目标产物的释放。
本研究通过大量的前期筛选实验并借鉴前人的研究成果,采用纤维素酶、果胶酶、木聚糖酶、α-淀粉酶和酸性蛋白酶对海带进行复合酶解,通过有效破坏海带细胞壁稳定结构来高效提取褐藻糖胶,建立全新的复合酶高效提取褐藻糖胶的工艺,并进行实验室小试实验优化,为后续工业放大提供理论与实践基础。
1 材料与方法
1.1 材料与仪器
干海带 购于荣成市场;纤维素酶(50万U/g)、果胶酶(30万U/g)、木聚糖酶(29万U/g)、酸性蛋白酶(50万U/g) 山东隆科特酶制剂有限公司;α-淀粉酶(1万U/mL) 诺维信(中国)生物技术有限公司。
HH-1数显恒温水浴锅 常州博远实验分析仪器厂;JJ-1精密增力电动搅拌器 常州博远实验仪器分析厂;7200型可见分光光度计 济南龙瑞商贸有限公司;L530多管架自动平衡离心机 湖南湘仪实验室仪器开发有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;SHK-III循环水式多用真空泵 郑州科泰实验设备有限公司;GB-300电子天平 梅特勒-托利多仪器(上海)有限公司;TF-FD-18冷冻干燥机 上海田枫实业有限公司。
1.2 实验方法
1.2.1 复合酶提取工艺 工艺流程:干海带切块→浸泡冲洗除杂→调温调pH→加入复合酶恒温酶解→打碎→离心除海带渣→钙凝→离心除海藻酸钙→浓缩→除钙离子→中和→醇沉→减压抽滤→真空冷冻干燥→粗褐藻糖胶[14]
称取30 g干海带浸泡后冲洗除杂,按一定比例的料水比加蒸馏水;放入水浴锅中,恒温后调pH至酸性;加入一定比例的复合酶(以海带干重计,下同)恒温酶解一定时间;酶解结束后打碎海带,4000 r/min离心15 min以除去海带渣得到上层液;向上层液中边搅拌边加入30% CaCl2溶液,放置一段时间至液体澄清,4000 r/min离心15 min除去海藻酸钙;旋转蒸发浓缩;向浓缩液中加入20% Na2CO3溶液,搅拌后4000 r/min离心15 min除钙离子,重复操作至溶液澄清;用HCl溶液中和已除去钙离子的清液;用无水乙醇分级沉淀,4 ℃静置过夜;减压抽滤得到沉淀物,真空冷冻干燥后即为粗褐藻糖胶制品。
1.2.2 单因素实验 在进行复合酶的单因素实验过程中,各种酶的基本添加量分别为纤维素酶2.5%、果胶酶0.5%、木聚糖酶0.5%、α-淀粉酶0.04%和酸性蛋白酶0.5%,复合酶解条件为料水比1∶20、pH4.8~5.0、温度53 ℃、时间24 h,分别改变其中一种酶的添加量或一个酶解条件,其他各酶添加量和酶解条件不变进行单因素实验。
1.2.3 正交实验 在单因素实验的基础上,选取复合酶添加量、温度、pH、时间和料水比5个因素设计正交实验L16(45),来确定复合酶法提取褐藻糖胶的最佳提取条件,正交实验因素及水平如表1所示。
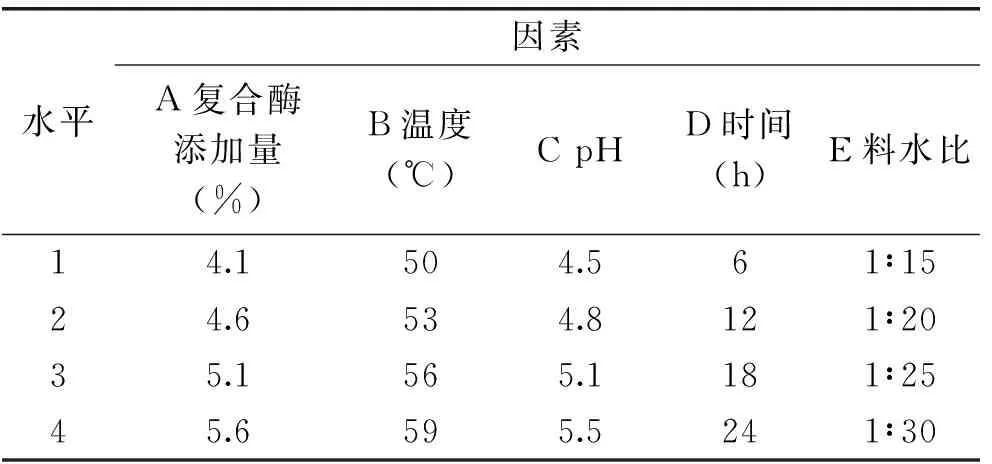
表1 正交实验因素及水平表
1.3 测定方法
1.3.1 褐藻糖胶含量的测定 采用苯酚-硫酸法[15]测定总糖的含量,菲林滴定法[16]测定还原糖的含量。褐藻糖胶含量(以多糖含量表示)=总糖-还原糖。
1.3.2 计算公式 如下:
褐藻糖胶得率(%)=溶液中褐藻糖胶质量(g)/干海带质量(g)×100
褐藻糖胶一次提取率(%)=褐藻糖胶得率(%)/海带中褐藻糖胶含量(%)×100
1.4 数据处理
单因素实验结果使用Origin 8.0作图分析,正交实验设计及结果使用正交设计助手Ⅱ分析。
2 结果与分析
2.1 单因素实验
2.1.1 酶添加量单因素实验 根据1.2.1酶法提取工艺的操作要点,在其他条件不变的情况下,纤维素酶、果胶酶、木聚糖酶、酸性蛋白酶和α-淀粉酶的添加量单因素实验结果见图1。

图1 不同酶添加量对褐藻糖胶得率的影响Fig.1 Effect of diffident enzyme on the yield of fucoidan
在其他条件不变的情况下,由图1(a)可知,褐藻糖胶得率随纤维素酶添加量的增加而提高,添加量达到2.5%后得率增加缓慢,随后开始下降,由此确定纤维素酶的最佳添加量为2.5%。由图1(b)可知,褐藻糖胶得率随果胶酶、木聚糖酶和酸性蛋白酶添加量的增加而提高,果胶酶和酸性蛋白酶的添加量分别达到0.5%和1.0%时得率最大,随后得率出现下降的趋势,由此确定果胶酶和酸性蛋白酶的最佳添加量分别为1.0%和0.5%,木聚糖酶添加量达到1.0%后得率增加的较为缓慢甚至出现下降的趋势,由此确定木聚糖酶的最佳添加量为1.0%。由图1(c)可知,褐藻糖胶得率随α-淀粉酶添加量的增加而提高,添加量达到0.1%后得率出现平缓增加的趋势,由此确定α-淀粉酶的最佳添加量为0.1%。由酶添加量单因素实验可以得到各种酶添加量的最佳比例,即纤维素酶、果胶酶、木聚糖酶、α-淀粉酶和酸性蛋白酶的比例为25∶10∶10∶1∶5。
2.1.2 时间单因素实验 根据1.2.1酶法提取工艺的操作要点,在其他条件不变的情况下,时间单因素实验结果见图2。
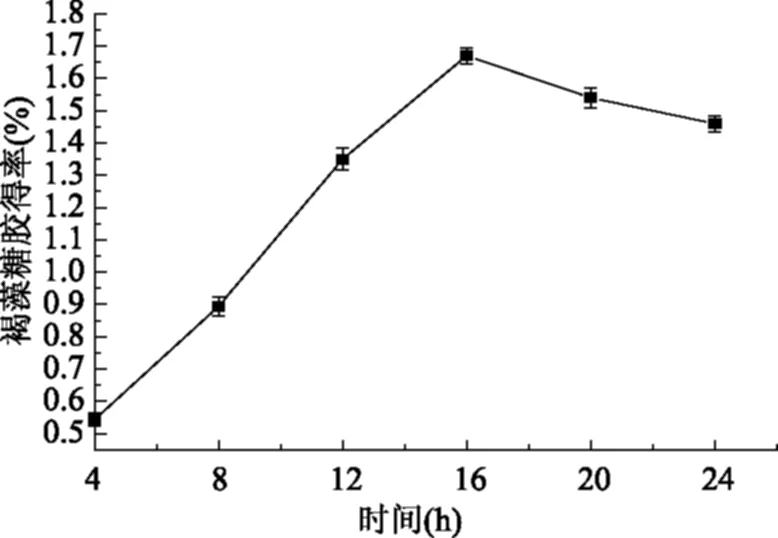
图2 时间对褐藻糖胶得率的影响Fig.2 Effect of time on the yield of fucoidan
由图2可知,在其他条件不变的情况下,褐藻糖胶得率随酶解时间的延长而提高,当酶解时间达到16 h后得率出现下降的趋势,由此确定最佳时间为16 h。
酶解过程中得率出现下降趋势可能是因为酶解时间过长,多糖结构发生变化或降解,从而使褐藻糖胶得率下降[17]。
2.1.3 温度单因素实验 根据1.2.1酶法提取工艺的操作要点,在其他条件不变的情况下,温度单因素实验结果见图3。
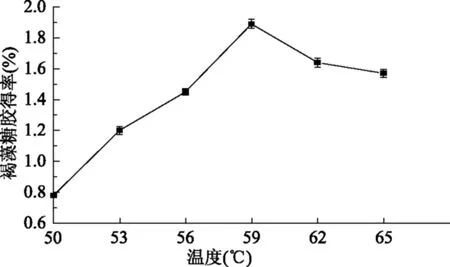
图3 温度对褐藻糖胶得率的影响Fig.3 Effect of temperature on the yield of fucoidan
由图3可知,在其他条件不变的情况下,褐藻糖胶得率随酶解温度增加而提高,当酶解温度达到59 ℃后得率出现下降的趋势,由此确定最佳温度为59 ℃。从50 ℃开始,温度升高加快反应速度,使褐藻糖胶提取率增加,但由于酶也是一种蛋白质,过高的温度会使酶活性降低甚至失去活性,降低褐藻糖胶得率。
2.1.4 pH单因素实验 根据1.2.1酶法提取工艺的操作要点,在其他条件不变的情况下,pH单因素实验结果如图4所示。
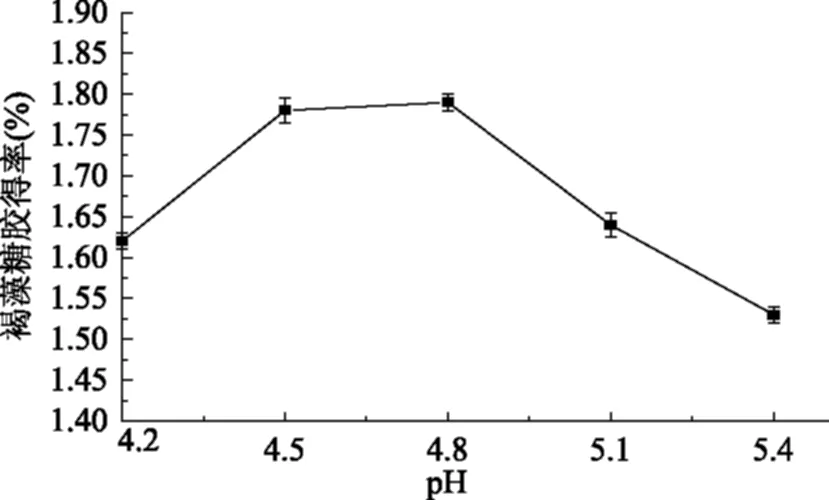
图4 pH对褐藻糖胶得率的影响Fig.4 Effect of pH on the yield of fucoidan
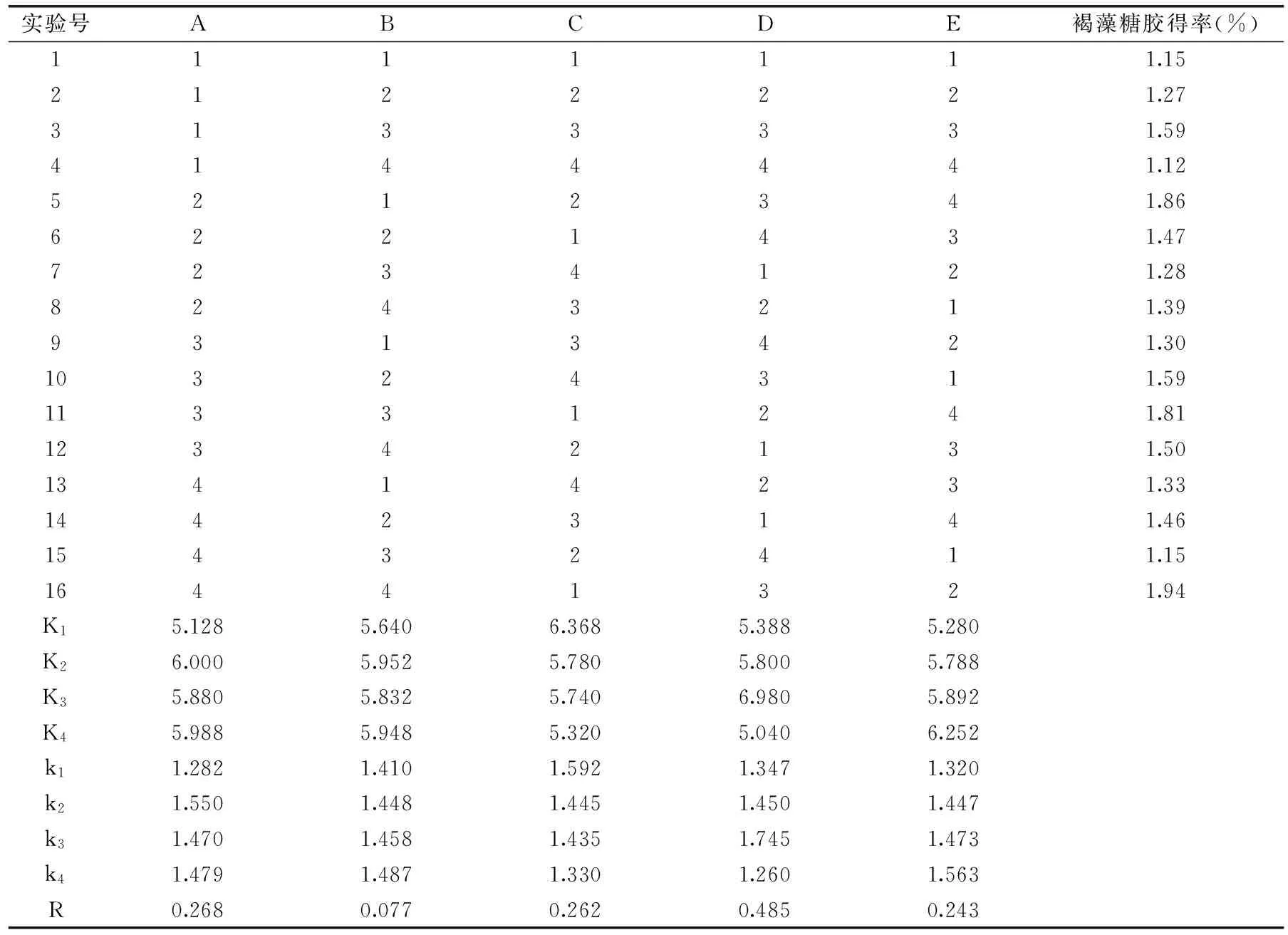
表2 正交实验设计及结果
由图4可知,在其他条件不变的情况下,褐藻糖胶得率随pH增加而提高,pH4.5后得率平缓增加,pH4.8后出现下降的趋势,由此确定最佳pH为4.5。纤维素酶、果胶酶、木聚糖酶、α-淀粉酶和酸性蛋白酶均在酸性条件下有较好的酶解作用,由于在过酸或过碱的条件下,酶的空间结构受到了破坏,影响了与底物的结合,从而使得褐藻糖胶的提取效果下降[18]。
2.1.5 料水比单因素实验 根据1.2.1酶法提取工艺的操作要点,在其他条件不变的情况下,料水比单因素实验结果如图5所示。
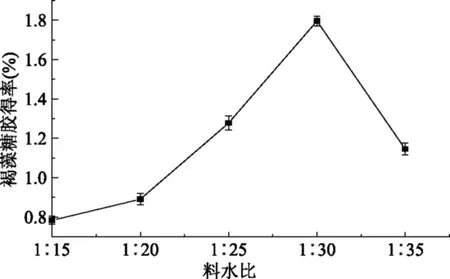
图5 料水比对褐藻糖胶得率的影响Fig.5 Effect of solid-liquid ratio on the yield of fucoidan
由图5可知,在其他条件不变的情况下,褐藻糖胶得率随料水比增加而提高,当料水比达到1∶30时得率最大,随后得率出现下降的趋势,由此确定最佳料水比为1∶30。
2.2 正交实验
在单因素实验基础上设计正交实验L16(45)。正交实验设计及结果如表2所示,正交实验方差分析如表3所示。
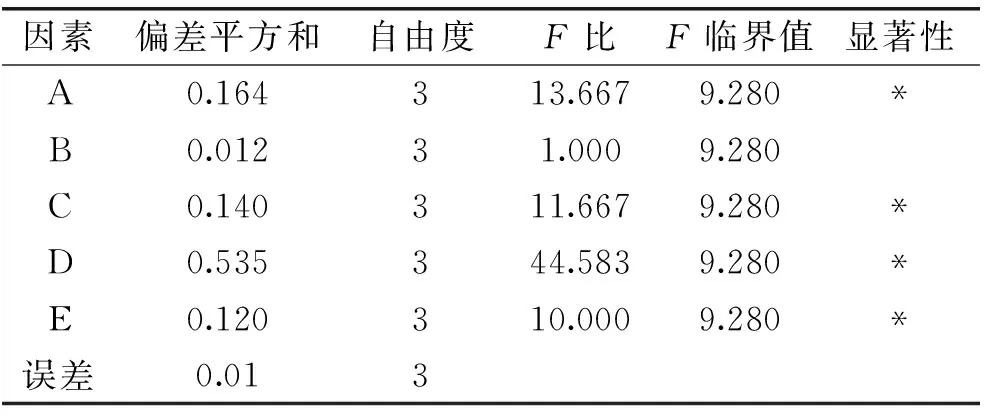
表3 正交实验方差分析
注:“*”表示影响显著(p<0.05)。
由表2中的极差值R可知,五个因素的主次关系为:D>A>C>E>B,即时间>复合酶添加量>pH>料水比>温度。由平均值k可以得出,最优组合为A2B4C1D3E4,即复合酶添加量4.6%,酶解温度59 ℃,pH4.5,时间18 h,料水比1∶30。由表3可知,复合酶添加量、pH、时间和料水比对褐藻糖胶得率影响显著。
在以上正交实验得到的最佳酶解条件,即复合酶添加量4.6%、温度59 ℃、pH4.5、时间18 h和料水比1∶30下进行三次平行实验,得到褐藻糖胶平均得率约为2.04%,一次提取率为90.20%。何云海[19]等用传统水煮法得到的岩藻聚糖硫酸酯的得率为0.968%,赵前程等[14]通过同步加酶法得到的褐藻糖胶提取率为77.8%。本研究通过五种酶进行复合酶解提取褐藻糖胶,显著提高了褐藻糖胶的得率和一次提取率,结果高于其他研究报道的结果。
3 结论
通过酶含量的单因素实验可以得到各种酶添加量的最佳比例,即纤维素酶、果胶酶、木聚糖酶、α-淀粉酶和酸性蛋白酶的比例为25∶10∶10∶1∶5。通过正交实验得到复合酶解的最佳条件为复合酶添加量4.6%,温度59 ℃,pH4.5,时间18 h,料水比1∶30,在此条件下,褐藻糖胶得率达到2.04%,一次提取率达到90.20%,显著高于已有研究报道。后续将进行该复合酶解方法获得的褐藻糖胶产品化学组成、分子结构及生理活性的比较研究,分析其与现有褐藻糖胶产品的异同,阐明复合酶解对于褐藻糖胶产品性质的影响,通过继续改进优化获得高品质的褐藻糖胶产品,为工业化生产放大奠定良好的基础。
[1]李德远,徐现波,熊亮,等.海带的保健功效及海带生理活性多糖研究现状[J].食品科学,2002,23(7):151-154.
[2]钱风云,傅德贤,欧阳藩. 海带多糖生物功能研究进展[J]. 中国海洋药物,2003,91(1):55-59.
[3]Athukorrala Y,Lee K W,Kim S K,et al. Anticoagulant activity of marine green and brown algae collected from Jeju Island in Korea[J]. Bioresource Technology,2007,98(9):1711-1716.
[4]Pereira M G,Benevides N M,Melom R S,et al. Structure and anticoagulant activity of a sulfated galactan from red alga,GelidiumCrinale. Is there a specific structural requirement for the anticoagulant action[J]. Carbohydrate Research,2005,340(12):2015-2023.
[5]Scappaticci F A,Contreras A,Boswell C A,et al. Polyclonal antibodies to xenogeneic endothelial cells induce apoptosis and block support of tumor growth in mice[J]. Vaccine,2003,21(19/20):2667-2677.
[6]张英慧,曲爱琴,宋剑秋,等. 海带多糖FGS对小鼠巨噬细胞细胞毒活性的影响[J]. 免疫学杂志,2002(5):22-26.
[7]Kwona M J,Nam T J. A polysaccharide of the marine alga Capsosiphon Fulvescens induces apoptosis in AGS gastric cancer cells via an IGF-IR-mediated PI3K/Aktpathway[J]. Cell Biology International,2007,31(8):768-775.
[8]卢茳虹,林宗毅,崔春,等. 柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J]. 食品工业科技,2012,33(23):93-96.
[9]李波,许时婴. 羊栖菜中褐藻糖胶的提取纯化研究[J]. 食品工业,2004(2):40-42.
[10]Black WAP,Dewar ET,Woodward FN. Manufacture of a1ga Chemicals.IV laboratory scale isolation of fucoidan from brown marine algae[J]. Sci Food Agric,1952(3):122-129.
[11]刘利萍,钟引飞. 海带多糖的超声波提取及对自由基清除作用研究[J]. 绍兴文理学院学报,2005,25(7):49-51.
[12]廖建民,张瑾,沈子龙. 海带多糖的超声波提取及对自由基清除作用研究[J].药物生物技术,2002,9(3):157-163.
[13]余华. 海带多糖中蛋白质去除方法的对比研究[J]. 成都大学学报:自然科学版,2005,24(4):265-267.
[14]赵前程,滕钊,汪秋宽,等. 复合酶法提取海带多糖的研究[J]. 沈阳农业大学学报,2007,38(2):220-223.
[15]张惟杰. 复合多糖生化研究技术[M]. 上海:上海科学技术出版社,1987:6-7.
[16]中华人民共和国卫生部 中国国家标准化管理委员会. GB/T 5009.7-2008食品中还原糖的测定[S]. 北京:中国标准出版社,2008.
[17]李书倩,张博,辛广等. 复合酶法提取红蘑多糖工艺[J]. 食品科学,2010,31(18):143-146.
[18]马春,董秀萍,朱蓓薇. 复合酶法提取姬松茸胞内多糖[J]. 大连轻工业学院学报,2005,9(3):195-198.
[19]何云海,汪秋宽,张婷,等. 海带岩藻聚糖硫酸酯酶解工艺及分离和纯化研究[J]. 沈阳农业大学学报,2007,38(2):215-219.
Efficient extraction of fucoidan fromLaminariajaponicby compound enzymes
YANG Xiao-xue1,DONG Xue-qian2,ZHANG Yong-gang2,WANG Wei2,DU Jin-hua1,LIU Jian-jun1,2,*
(1.Shandong Agricultural University,Taian 271000,China;2.Shandong Food Ferment Industry Research & Design Institute,Ji’nan 250000,China)
This study was designed to extract the fucoidan fromLaminariajaponicabycompound enzyme. By optimizing the extraction conditions and comparing with traditional extraction method and other enzyme extraction method,our target was to develope an efficient method which might product more fucoidan. According to single factor experiment,the ratio of compound enzyme of cellulase,pectinase,xylanase,α-amylase and acid protease was 25∶10∶10∶1∶5. By using orthogonal test which was based onsingle factor experiment and the variance analysis,the optimal hydrolysis conditions for fucoidan extraction fromLaminariajaponicawere4.6% compound enzyme,extraction temperature of 59 ℃,pH4.5,extraction time of 18 h and solid-liquid ratio 1∶30. Under these conditions,the extraction yield of fucoidan was 2.04% and an extraction rate was 90.20%. It was significantly higher than the existing research reports. This study established a new efficient extraction of fucoidan by compound enzymes,to provide theoretical and practical foundation for further scale-up.
Laminariajaponica;compound enzyme;fucoidan;polysaccharide
2016-07-18
杨晓雪(1992-),女,硕士研究生,研究方向:食品加工原理与技术,E-mail:819113180@qq.com。
*通讯作者:刘建军(1962-),男,博士,研究员,研究方向:微生物资源开发,E-mail:liujj-2000@163.com。
山东省科技重大专项支持项目(2015ZDZX05001)。
TS254.1
A
1002-0306(2017)06-0142-05
10.13386/j.issn1002-0306.2017.06.019
