寡雄蛋白(Oligandrin)处理对马铃薯块茎干腐病及苯丙烷代谢的影响
2017-04-14潘静宇李永才高春丽
刘 筱,潘静宇,李永才,杨 兰,高春丽,毕 阳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
寡雄蛋白(Oligandrin)处理对马铃薯块茎干腐病及苯丙烷代谢的影响
刘 筱,潘静宇,李永才*,杨 兰,高春丽,毕 阳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
本实验以“新大坪”马铃薯(Solanumtuberosum)为试材,通过体内实验,研究了寡雄蛋白(oligandrin)对马铃薯块茎干腐病的控制效果;同时从生化和分子水平上分析揭示了寡雄蛋白处理对马铃薯块茎苯丙烷代谢的调控机理。结果表明:56、24、18、12、6 μg/mL寡雄蛋白处理对马铃薯块茎干腐病的扩展都有一定的控制效果,其中24 μg/mL寡雄蛋白处理效果最佳,处理后块茎病斑直径为对照的58.33%;进一步研究表明寡雄蛋白处理能提高与马铃薯块茎组织苯丙烷代谢相关的苯丙氨酸解氨酶(PAL)、肉桂酸脱氢酶(CAD)、肉桂酸羟化酶(C4H)和4-香豆酰-辅酶A连接酶(4CL)的活性及相关基因的表达;同时抗性物质总酚、类黄酮及木质素含量也因寡雄蛋白处理而提高,在处理后第3 d类黄酮含量出现高峰,高于对照果实54%。可见寡雄蛋白可通过增强组织的苯丙烷代谢而提高马铃薯块茎的抗病性。
马铃薯,干腐病,寡雄蛋白,苯丙烷代谢
作为世界上第四大粮食作物的马铃薯[1],在采后贮藏期间因采后生理和病理等方面的因素而造成严重的腐烂,腐烂率高达20%~25%,不仅造成了巨大的经济损失,也给整个马铃薯产业带来严重影响[2]。其中,由硫色镰刀菌(Fusariumsulphureum)引起的干腐病则导致了中国西北地区马铃薯的烂窖[1]。目前马铃薯采后病害的控制主要通过化学杀菌剂处理,虽然化学杀菌剂的使用能够有效地控制马铃薯采后贮藏过程中干腐病的发展,但化学杀菌剂易带来环境污染、农药残留等问题,并且会使病原物产生抗药性[3]。因此,亟需寻找一种安全有效且能够应用于大规模生产实际的经济、实用的方法来替代化学杀菌剂。近年来,有关生防菌诱导采后果蔬产生抗病性的效果和机理已经进行了许多研究,但是开发新型防治方法仍然具有非常广阔的研究前景。
寡雄腐霉(Pythiumoligandrum)属于卵菌纲、霜霉目、腐霉科、腐霉属,主要通过腐生,重寄生作用杀死致病真菌后吸取其营养成分[4]。寡雄蛋白(oligandrin)是一种从寡雄腐霉的培养滤液中分离所得到的分子量约为10 ku、等电点为4.5且与激发子有相似功能的信号传导蛋白[5],可诱导植株产生系统获得抗病性(SAR)。研究表明寡雄蛋白能诱导番茄产生对镰刀菌引起的根腐病的抗性[6],并能不同程度地诱导番茄叶片中与抗性相关的酶(过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶)的活性升高,另外寡雄蛋白处理显著抑制了番茄果实灰霉病,即在室温条件下贮藏发现处理后番茄果实腐烂率相比对照降低了49.5%[7]。可见寡雄蛋白作为一种新型的生物农药具有广阔的应用前景。
苯丙烷代谢是酚类物质代谢的重要途径,在植物抗病防卫反应中具有重要的作用[8],此外,苯丙烷代谢也是植物响应病原物侵染过程中被激活的一种生化反应途径[9]。葛永红等[10]研究结果表明,100 mg/L的苯并噻重氮(BTH)处理苹果果实后,显著提高了组织PAL和4CL活性,并且促进了苯丙烷代谢产物总酚、类黄酮和木质素含量的提高,增强了果实抵抗病原物侵染的能力。陈年来等[11]用诱导剂BTH、SA喷雾处理甜瓜叶片并接种白粉菌后发现,甜瓜叶片抗性相关酶(PAL)的活性和抗菌物质(总酚、类黄酮)含量的增加程度与甜瓜对白粉病的抗性呈显著的正相关。Hatem等[12]研究发现硫胺素(VB1)处理诱导了葡萄树叶片中苯丙烷代谢产物总酚、类黄酮以及木质素的积累,并且提高了叶片对霜霉病菌的抗性。综上研究结果表明苯丙烷代谢途径关键酶的活性增强及其代谢产物的积累均与果蔬抵抗病原菌的能力密切相关。
本实验以甘肃马铃薯品种“新大坪”为试材,研究了寡雄蛋白处理对马铃薯块茎组织苯丙烷代谢的影响,以期为进一步阐明寡雄蛋白在病害控制方面的生防调控机制,并对采后马铃薯病害安全控制技术的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
供试“新大坪”马铃薯(Solanumtuberosum) 购于甘肃省定西市安定区,挑选健康、无机械损伤、大小均匀的马铃薯块茎,装袋运抵实验室后于5~8 ℃下贮藏1 d备用;多利维生寡雄腐霉(Pythiumoligandrum) 由北京比奥瑞生物科技有限公司提供;硫色镰刀菌(Fusariumsulphureum) 分离纯化自感病的马铃薯块茎。
SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;H-1850R型离心机 长沙湘仪离心机仪器有限公司;UV-2450型分光光度计 日本岛津公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;DHP-9272B型恒温培养箱 上海一恒科技有限公司;CX21FS1C生物显微镜 奥林巴斯(广州)工业有限公司
1.2 实验方法
1.2.1 寡雄蛋白的诱抗作用
1.2.1.1 寡雄腐霉滤液的制备 参照Wang等[13]的方法,并稍作修改。在玻璃三角瓶(规格为50 mL)中装入液体培养基并进行灭菌。之后每瓶接入8块经活化的寡雄腐霉菌饼(直径8 mm),于25 ℃、150 r/min下暗培养7 d,培养液经8000 r/min离心10 min,上清液用4层无菌滤纸过滤,即得无菌发酵液,浓度为100%,置于4 ℃冰箱中备用。寡雄腐霉液体培养基简称PO培养液,参照Bonnet等[14]的方法制备。
1.2.1.2 寡雄蛋白的提取、纯化 参照林钗等[7]方法,在得到的寡雄腐霉滤液中边加固体硫酸铵边搅拌,加至硫酸铵最终浓度为100%,4 ℃静置过夜,10000 r/min离心15 min,沉淀保存于-20 ℃备用;上清液中再加固体硫酸铵至50%,静置过夜、离心、保存沉淀;上清液再加固体硫酸铵至60%(所有方法同上),依此类推,一直加到100%,每级收集的沉淀用双蒸水溶解,装入分子截留量为8 ku的透析袋中,放在生理盐水中透析48 h以除去盐类物质,期间更换生理盐水数次,用0.2% BaCl2检测硫酸铵是否除去。吸取透析袋中液体,剩余沉淀即为寡雄蛋白。
1.2.1.3 蛋白浓度的测定 参考Bradford[15]的方法,用牛血清蛋白质为标准蛋白质制作标准曲线,并计算蛋白的含量。
1.2.1.4 寡雄蛋白最佳诱抗浓度的筛选 根据1.2.1.3中方法测得的蛋白浓度为56 μg/mL,用无菌水稀释不同倍数后,在马铃薯块茎及切片上进行诱抗处理,通过观察块茎与切片的发病情况与病斑直径筛选出最佳的诱抗浓度。
1.2.1.5 寡雄蛋白对马铃薯块茎的诱抗作用 采用本实验室成熟方法,选择贮藏于5~8 ℃下的外观整齐,无病虫害的马铃薯块茎,先用自来水清洗后,再用2%的次氯酸钠溶液浸泡2 min后立即用无菌水冲洗,并自然晾干,之后再用75%的酒精进行表面消毒,最后用直径3 mm的无菌铁钉在马铃薯块茎赤道部位均匀刺3 mm×3 mm的伤口3个,之后用接种针接种10 μL 56、24、18、12、6 μg/mL寡雄蛋白,诱抗12 h后的块茎分别接种10 μLF.sulphureum孢子悬浮液,对照接种10 μL无菌水,之后用PE保鲜袋(30 cm×40 cm)包装,在室温条件贮藏并测量不同时期的块茎病斑直径。每个处理3个块茎,重复3次。
1.2.1.6 寡雄蛋白对马铃薯切片的诱抗作用 参照杨志敏等[16]的方法并作修改。用无菌刀和打孔器将马铃薯块茎制成厚1 cm、直径为35 mm的圆片。切片用无菌水清洗后再用75%酒精消毒,并在酒精灯火焰上轻微灼烧除去多余酒精,之后置于铺有无菌湿滤纸且已灭菌的大培养皿上,黑暗恒温恒湿条件下培养4 h后,用无菌涂布器分别在切片上均匀涂布50 μL 56、24、18、12、6 μg/mL寡雄蛋白,诱抗12 h之后的切片在其中央位置接种培养7 d的F.sulphureum菌饼(直径3 mm),菌饼含菌丝面与切片接触,将处理后的切片培养在25 ℃,相对湿度(RH)为72%~75%的条件下,并于不同时期测定切片的病斑直径。每个处理8个切片,重复3次。
1.2.2 寡雄蛋白对苯丙烷代谢的影响
1.2.2.1 取样方法 参照Bi[17]的方法并稍作修改。先将马铃薯制成切片,用最佳浓度的寡雄蛋白进行诱抗处理后接种培养1周的F.sulphureum菌饼(直径3 mm),分别取处理后第0、0.5、1、2、3、4 d各处理组的切片,用无菌不锈钢刀切取切片表层0~3 mm处的马铃薯组织3 g,用锡箔纸包好后立即用液氮进行冷冻,然后保存于-80 ℃超低温冰箱中进行各项指标的测定。

表1 引物设计表
1.2.2.2 苯丙氨酸解氨酶(PAL)和肉桂酸脱氢酶(CAD)活性的测定 PAL活性的测定参照Yin[18]的方法并稍作修改。称取3 g冷冻样品置于预冷的研钵中,加入5 mL经4 ℃预冷的100 mmol/L硼酸缓冲液(pH8.8,含1% PVP、1 mmol/L EDTA和50 mmol/Lβ-巯基乙醇),冰浴条件下充分研磨,然后于4 ℃ 11250×g 条件下离心 20 min,收集上清液立即用于酶活性的测定。取三支试管分别标记为Ⅰ、Ⅱ和Ⅲ,向Ⅰ、Ⅱ两支试管分别加入3 mL 7 mmol/L L-苯丙氨酸溶液(用50 mmol/L 硼酸缓冲液配制),再分别向Ⅰ和Ⅲ两支试管中加入500 μL 上清液后立即于37 ℃保温1 h,保温完毕后立即在290 nm波长处测定其吸光度值,以Ⅱ和Ⅲ混合后测定的吸光度值为初始值,Ⅰ中测定值为终止值。另以提取液代替上清液按照上述方法测得的吸光度分别作为初始值和终止值的对照。PAL活性表示为0.01ΔOD290/h·g。
CAD活性的测定参照Goffner[19]的测定方法并修改。取3 g冷冻样品加入3 mL预冷0.1 mmol/L pH6.25 PBS(含15 mmol/L巯基乙醇和2% PEG及约0.1 g PVPP),冰浴条件下充分研磨,18000×g,4 ℃离心20 min,上清液用于酶活性测定。取200 μL酶粗提液加800 μL反应液(含10 mmol/L NADP,5 mmol/L反式肉桂酸),以200 μL PBS加800 μL反应液为对照,37 ℃水浴30 min,1 mol/L HCl终止反应后在340 nm处测吸光值。
1.2.2.3 4-香豆酰-辅酶A连接酶(4CL)和肉桂酸羟化酶(C4H)活性的测定 4CL活性参照 Knobloch[20]等的方法测定。取3 g冷冻样品,加入3 mL,0.2 mol/L Tris-HCl缓冲液(pH8.0,含25%甘油、0.1 mol/L DTT),冰浴条件下充分研磨,10000×g离心20 min,上清液用于酶活测定。反应体系包括0.45 mL 15 μmol/L Mg2+、0.15 mL 15 μmol/L p-香豆酸、0.15 mL 50 μmol/L ATP、0.15 mL 1 μmol/L CoA以及0.5 mL 酶液(对照不加香豆酸),于333 nm处测定吸光值。连续测定3 min,以反应液在333 nm处吸光值每分钟增加0.01为1个酶活性单位(U)。
C4H 活性参照Lamb[21]的方法进行测定,称取3 g冷冻样品,加入5 mL的0.2 mol/L Tris-HCl提取缓冲液(pH8.9,含15 mmol/Lβ-巯基乙醇、4 mmol/L MgCl2、5 mmol/L 抗坏血酸、10 μmol/L亮抑酶肽、1 mmol/L PMSF、0.15% PVPP和10%甘油),冷冻研磨匀浆,在4 ℃下12000 r/min离心20 min,取上清液待测。反应液包括2 μmol/L反式肉桂酸、2 μmol/L NADPNa2、5 μmol/L 6-磷酸钠葡萄糖,参比不加酶提取液,于340 nm处测定吸光值。以反应液在340 nm处吸光度值每分钟增加0.01为1个酶活性单位。
1.2.2.4 总酚物质和类黄酮含量的测定 总酚物质的测定参照Pirie和Mullins[22]的方法,称取3 g样品,加入5 mL的1%的HCl-甲醇溶液,冷冻研磨匀浆,在0~4 ℃下12000 r/min离心20 min,取上清液并于280 nm波长处测定吸光度值,含量用OD280/g mf表示。
类黄酮含量的测定参照Pirie等[22]的方法测定。称取3 g马铃薯组织,加入5 mL的1% HCl-甲醇在冰浴条件下研磨提取2 h后,于4 ℃下 15000×g离心30 min,于325 nm测定吸光值,含量单位表示为OD325/g mf,样品重复测3次。
1.2.2.5 木质素含量的测定 参照林葵等[23]的方法并进行改进。称取3 g样品,加入3 mL 95%乙醇研磨匀浆,转入带盖离心管中,12000×g离心10 min,沉淀物用95%乙醇反复洗涤3次,再用乙醇(95%)∶正己烷=1∶2(v/v)反复洗涤3次,随后收集沉淀物氮气吹干,将其溶于1 mL 25% 溴乙酞冰醋酸溶液中,加盖于70 ℃水浴中放置30 min,加1 mL 2 mol/L NaOH溶液终止反应,再加入2 mL冰醋酸,0.1 mL 7.5 mol/L羟胺盐酸,振动混匀后在1000 r/min离心10 min,上清液即为木质素待测液。取0.1 mL待测液,加冰醋酸定容至5 mL,振动混匀,在280 nm下测定样品吸光值,含量用OD280/g mf表示。
1.2.3 寡雄蛋白处理后相关基因表达 取寡雄蛋白诱抗处理后的马铃薯组织,液氮速冻后放置于-80 ℃超低温冰箱中保存。采用 TRIZOL法对其进行RNA的提取。RNA提取完成后取1 μL提取液并稀释至70 μL,测OD值,计算RNA浓度,之后电泳检测RNA是否降解。

表3 PCR扩增程序
1.2.3.1 引物设计 根据NCBI查得马铃薯的序列(见表1),进而设计特异性引物,选择内参基因18 S(GenBank ID:AB971541.1),用于Real-time PCR,用于比较Ct值的相对定量。
这部分实验在生工生物工程(上海)有限公司进行,通过柱式植物总RNA抽提纯化试剂盒,按照标准抽提步骤进行基因蛋白的分离纯化,并进行测定。
PCR反应条件设定为:95 ℃变性3 min 1 cycle;95 ℃变性15 s;60 ℃延伸40 s;记录荧光强度,40cycles。完毕后产生熔解曲线(melting curve,或称解离曲线dissociation curve)。完成上述步骤后,把加好样品的96/384孔板放在Light Cycler 480 Software Setup(Roche罗氏)中进行反应。对于比较Ct值的相对定量,则根据目的基因的Ct值,按照2-ΔΔCtQ的分析方法,对于目的基因的表达谱进行分析。
1.2.3.2 实时定量PCR扩增 按表2建立实时定量PCR扩增体系,之后进行PCR扩增,扩增程序如表3所示。

表2 PCR扩增体系
1.3 数据分析
实验数据使用Microsoft Excel 2010软件整理数据,计算标准偏差并绘制图表。用SPSS 19.0软件进行方差分析和多重差异显著性分析。
2 结果与分析
2.1 寡雄蛋白对马铃薯抗干腐病的诱导
用不同浓度的寡雄蛋白处理马铃薯块茎或切片后再进行损伤接种,发现其能不同程度的抑制病斑的扩展。除56 μg/mL外,随着蛋白浓度的减小,病斑的扩展增加。其中最佳诱抗浓度为24 μg/mL。在块茎培养9 d、切片培养3 d后,最佳诱抗浓度处理后的病斑直径分别为对照组的58.33%(图1A)和79.3%(图1B)。
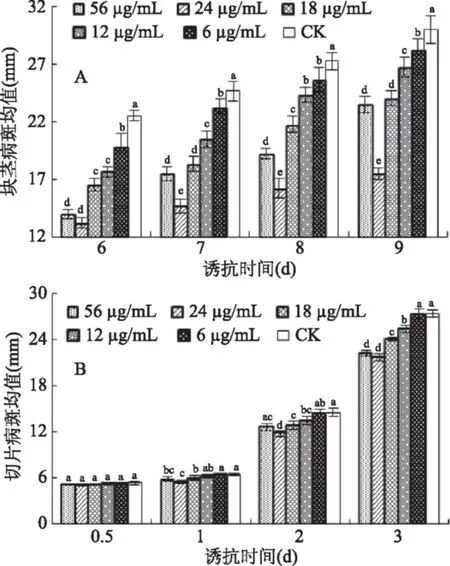
图1 不同浓度寡雄蛋白对马铃薯块茎(A)和切片(B)抗干腐病的诱导Fig.1 Induction effect of different concentrations oligandrin treatment on potato tuber(A)and slice(B)resistance to dry rot注:不同小写字母表示不同处理、同一时间差异显著(p<0.05);图2~图4同。
2.2 寡雄蛋白处理对马铃薯苯丙烷代谢相关酶活性及产物、基因表达的影响
2.2.1 对PAL、CAD、C4H、4CL活性的影响 从图2(A)中可以看出,寡雄蛋白诱抗处理对马铃薯PAL活性的影响,对照组马铃薯切片PAL在贮藏期间总体呈现较稳定的趋势,处理组活性在12 h达到最大值,比对照高22.9%。随贮藏时间延长,对照组切片组织的CAD活性呈波浪形变化的趋势。寡雄蛋白诱抗处理提高了马铃薯切片组织CAD的活性,并且在第3 d达到高峰,比对照组高22.17%(图2B)。寡雄蛋白处理诱导后,马铃薯C4H的活性呈现先升高后降低的趋势,在整个贮藏期间出现了一个高峰趋势,即在处理后第2 d出现峰值,比对照组高22.5%(图2C),对照组活性在贮藏期间呈现出先升后降的总体趋势。寡雄蛋白诱抗处理马铃薯后对其4CL活性有一定的影响,处理组活性在贮藏期间呈现先降后升的总体趋势,并在第4 d达到最大值,比对照高10.1%。对照组4CL活性在第2 d时出现峰值(图2D)。
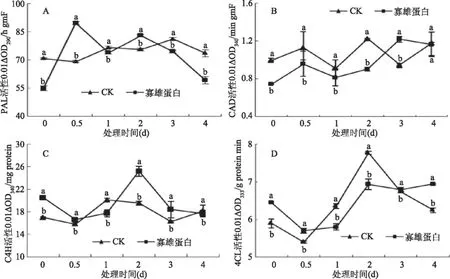
图2 24 μg/mL寡雄蛋白处理对马铃薯切片PAL(A)、CAD(B)、C4H(C)和4CL(D)活性的影响Fig.2 Effect of 24 μg/mL oligandrin treatment on the PAL activity(A),CAD activity(B),C4H activity(C)and 4CL activity(D)in slices of potato tuber

图3 24 μg/mL寡雄蛋白处理对马铃薯切片PAL(A)、CAD(B)、C4H(C)和4CL(D)基因表达的影响Fig.3 Effect of 24 μg/mL oligandrin treatment on expression of PAL(A)、CAD(B)、C4H(C)和4CL(D)genes of potato tissue
2.2.2 对PAL、CAD、C4H和4CL基因表达的影响 寡雄蛋白诱抗处理诱导了马铃薯PAL基因表达量的升高,处理组马铃薯切片在培养期间总体呈现先升高后降低的趋势,并且表达量在12 h达到最大值,比对照高1.69倍(图3A)。在贮藏后期,寡雄蛋白诱导处理对马铃薯切片CAD的基因表达量有显著影响,处理组切片组织在贮藏期间基因表达总体呈现先升高后降低的趋势,并且表达量在12 h达到最大值(图3B)。随贮藏时间延长,处理组与对照组马铃薯切片的C4H基因表达量均呈现先升后降的趋势。处理组C4H基因表达量在12 h时出现高峰,比对照组高53.07%(图3C);处理和对照切片组织的4CL基因表达量在贮藏期间总体呈现先上升后下降的趋势,蛋白诱抗处理在一定程度上促进了马铃薯4CL基因表达量的升高,并且在12 h时达到最大值,比对照组高出1.71倍(图3D)。
2.2.3 对总酚、类黄酮及木质素含量的影响 由图4(A)可知,寡雄蛋白处理对马铃薯切片组织中总酚含量有一定的影响,且处理组和对照组之间的总酚含量存在一定的差异,处理组中总酚含量整体呈先下降后升高的趋势。寡雄蛋白诱抗处理提高了切片组织类黄酮的含量,处理后类黄酮总体呈先降后升的趋势,并在第3 d出现高峰,高于对照果实54%(图4B)。木质素含量在处理后开始下降,而对照组木质素含量则出现上升的趋势,此时处理组比对照减少41%(图4C)。

图4 24 μg/mL寡雄蛋白处理对马铃薯总酚(A)、类黄酮(B)和木质素(C)含量的影响Fig.4 Effect of 24 μg/mL oligandrin treatment on the content of total phenolic(A),flavonoid(B)and lignin(C)in potato
3 讨论
寡雄腐霉不仅能对大多数病原微生物产生很强的寄生或拮抗作用[24-25],而且也能诱导植物产生系统抗性[5,26]。Benhamou等[6]研究发现番茄根系统的细胞并没有因为寡雄腐霉菌丝体的进入而受到损害,且寡雄腐霉进一步诱导番茄植株对尖孢镰刀菌产生防卫反应,阻止了病原物的侵入和生长繁殖[7]。本研究发现不同浓度的寡雄蛋白对马铃薯块茎和切片抗干腐病均具有一定的诱导作用,且存在浓度效应(图1),表明寡雄蛋白也能诱导采后植物组织产生抗性。
苯丙烷类代谢是生物特别是植物次级代谢中很重要的一条途径,在苯丙氨酸解氨酶(PAL)作用下,生成香豆酸、阿魏酸、绿原酸等中间产物,再进一步代谢转化为木质素、酚类物质、植保素等抗菌物质[27]。这些次级代谢产物在植物的生长发育、抵御病虫害、抗逆反应等方面发挥着重要作用[28]。苯丙氨酸解氨酶(PAL)、4-香豆酰-辅酶A连接酶(4CL)、肉桂酸羟化酶(C4H)是苯丙烷代谢途径中的关键酶系[29]。总酚、木质素和类黄酮是该代谢途径的最终产物,是植物体内最主要的抗菌物质。
本实验结果表明,寡雄蛋白处理对马铃薯中苯丙烷代谢相关酶PAL、C4H、4CL、CAD酶活性及代谢产物总酚、类黄酮和木质素的积累有一定影响,但是处理前期作用不明显,后期酶活性以及代谢产物都有所增加(图2、图4),实时定量PCR结果表明其相应酶的基因表达量也有一定的增加(图3)。这与Picard等[5]在黄瓜和番茄幼苗上的研究结果一致。Lou等[30]研究发现,10 μg/mL的寡雄蛋白处理番茄叶片后,在接种Botrytis cinerea后第3 d叶片组织的PPO、POD、PAL的酶活性均有所增加,同时王爱英等[31-32]研究表明,寡雄蛋白处理不仅诱导了番茄果实苯丙氨酸解氨酶(PAL)的活性的增加,同时也提高了果实总酚及木质素含量,这均与本文的研究结果有相似之处,表明对苯丙烷代谢的促进是寡雄蛋白诱导植物体抗病性提高的主要原因之一。
有关寡雄蛋白处理诱导马铃薯抗性的增强的其他作用机理及其在采后果蔬中的应用技术,尚需进一步研究。
4 结论
本实验研究了寡雄蛋白对马铃薯块茎干腐病及组织苯丙烷代谢的调控作用,结果表明寡雄蛋白处理能显著提高马铃薯块茎对干腐病的抗性,其中24 μg/mL寡雄蛋白处理效果最佳,其处理后块茎病斑直径仅为对照的58.33%;且24 μg/mL寡雄蛋白处理能提高马铃薯组织的苯丙烷代谢相关酶PAL、CAD、C4H、4CL的酶活性及其基因表达;抗性物质类黄酮及木质素含量也因诱抗处理而提高。
[1]杨志敏,毕阳,李永才,等. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J]. 中国农业科学,2012,45(1):127-134.
[2]Li Y C,Bi Y,Ge Y H,et al. Antifungal activity of sodium silicate on Fusarium sulphureum and its effect on dry rot of potato tubers[J]. Journal of Food Science,2009,74(5):213-218.
[3]Li Y C,Yang Z M,Bi Y,et al. Antifungal effect of borates against Fusarium sulphureum on potato tubers and its possible mechanisms of action[J]. Postharvest Biology and Technology,2012,74:55-61.
[4]Al Rawahi A K,Hancock J G. Parasitism and biological control of Verticillium dahliae by Pythium oligandrum[J]. Plant Disease,1998,82(10):1100-1106.
[5]Picard K,Ponchet M,Blein J P,et al. Oligandrin. A proteinaceous molecule produced by the mycoparasite Pythium oligandrum induces resistance to Phytophthora parasitica infection in tomato plants[J]. Plant Physiology,2000,124(1):379-396.
[6]Benhamou N,Bé1anger R R,Rey P. Oligandrin,the elicifin-like protein produced by the mycoparasite Pythium oligandrum,induces systemic resistance to Fusarium crown and root rot in tomato plants[J]. Plant Physiology Biochemistry,2001,39:681-698.
[7]林钗. 寡雄腐霉的拮抗作用及寡雄蛋白的诱导抗性研究[D].杭州:浙江大学,2008.
[8]徐晓梅,杨署光. 苯丙氨酸解氨酶研究进展[J]. 安徽农业科学,2009,37(31):15115-15119.
[9]Rosalba T R,Alberto S E,Tania C,et al. A fungal elicitor enhances the resistance of tomato fruit to Fusarium oxysporum infection by activating the phenylpropanoid metabolic pathway[J]. Phytoparasitica,2013,41(2):133-142.
[10]葛永红,李灿婴,朱丹实,等. 采后BTH处理对苹果果实苯丙烷代谢和病程相关蛋白积累的增强作用[J]. 食品工业科技,2015,36(5):306-310.
[11]陈年来,胡敏,代春艳,等. 诱抗处理对甜瓜叶片酚类物质代谢的影响[J]. 园艺学报,2010,37(11):1759-1766.
[12]Hatem B,Anne P,Monhamed A W,et al. Thiamine modulates metabolism of the phenylpropanoid pathway leading to enhanced resistance to Plasmopara viticola in grapevine[J]. BMC Plant Biology,2013,13:31.
[13]Wang A Y,Lou B G,Xu T,et al. Inhibitory effect of the secretion of Pythium oligandrum on plant pathogenic fungi and the control effect against tomato grey mould[J]. Acta Phytophylacica Sinica,2007,34(1):57-60.
[14]Bonnet P,Bourdon E,Ponchet M,et al. Acquired resistance triggered by elicitins in tobacco and other plants[J]. European Journal of Plant Pathology,1996,102(2):181-192.
[15]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[16]杨志敏,毕阳,李永才,等. 马铃薯干腐病菌硫色镰孢的生物学特性[J]. 菌物学报,2012(4):574-583.
[17]Bi Y,Tian S P,Ge Y H,et al. Sodium silicate reduces postharvest decay on Hami melons:induced resistance and fungistatic effects[J]. Plant Disease,2006,90(3):279-283.
[18]Yin Y,LI Y C,Bi Y,et al. Postharvest treatment withβ-aminobutyric acid induces resistance against dry rot caused by Fusarium sulphureum in potato tuber[J]. Agricultural Sciences in China,2010,9(9):1372-1380.
[19]Goffner D,Joffroy I,Grima-pettenati J,et al. Purification and characterization of isoforms of cinnamyl alcohol dehydrogenase from Eucalyptus xylem[J]. Planta,1992,188(1):48-53.
[20]Knobloch K H,Hanlbrock K. Isoenzymes of p-Coumarate:CoA ligase from cell suspension cultures of glycine max[J]. European Journal of Biochemistry,1975,52(2):311-320.
[21]Lamb C J,Rubery P H. A spectrophotometric assay for trans-cinnamic acid 4-hydroxylase activity[J]. Analytical Biochemistry,1975,68(2):554-561.
[22]Pirie A,Mullins M G. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate,and abscisic acid[J]. Plant Physiology,1976,58(4):468-472.
[23]林葵,黄祥辉. 甜瓜子叶不定芽分化过程中PAL活性和木质素含量变化研究[J]. 华东师范大学学报:自然科学版,1996(2):92-97.
[24]贺水山,张炳欣,葛起新. 寡雄腐霉重寄生作用的研究[J]. 植物病理学报,1992,22(2):77-81.
[25]Benhamou N,Rey P,Picard K,et al. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens[J]. Phytopathology,1999,89(6):506-517.
[26]Takenaka S,Sekiguchi H,Nakaho K,et al. Colonization of Pythium oligandrum in the tomato rhizosphere for biological control of bacterial wilt disease analyzed by real-time PCR and confocal laser-scanning microscopy[J]. Phytopathology,2008,98(2):187-195.
[27]欧阳光察,薛应龙. 植物苯丙烷类代谢的生理意义及其调控[J]. 植物生理学通讯,2012,24(3):9-16.
[28]贺立红,张进标,宾金华. 苯丙氨酸解氨酶的研究进展[J]. 食品科技,2006,31(7):31-34.
[29]Dixon R A,Achnine L,Kota P,et al. The phenylpropanoid pathway and plant defence:a genomics perspective[J]. Molecular Plant Pathology,2002,3(5):371-390.
[30]Lou B G,Wang A Y,Lin C,et al. Enhancement of defense responses by oligandrin against Botrytis cinerea in tomatoes[J]. African Journal of Biotechnology,2011,10(21):11442-11449.
[31]王爱英. 寡雄腐霉RCUl菌株及寡雄蛋白诱导番茄抗病性的研究[D].杭州:浙江大学,2010.
[32]Wang A Y,Lou B G,Xu T,et al. Defense responses in tomato fruit induced by oligandrin against Botrytis cinerea[J]. African Journal of Biotechnology,2011,10(22):4596-4601.
Effects of oligandrin treatment on dry rot and phenylpropanoid pathway metabolism of potato tubers
LIU Xiao,PAN Jing-yu,LI Yong-cai*,YANG Lan,GAO Chun-li,BI Yang
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Effects of oligandrin on dry rot development of potato tubers(cv. Xindaping)were evaluated throughinvivotests,regulation mechanism of oligandrin treatment on phenylpropanoid pathway metabolism of potato tubers was also revealed at biochemical and molecular level. The results showed that the dry rot development of potato tuber was effectively controlled with 56,24,18,12 and 6 μg/mL oligandrin treatments in potato tubers,and treatment with 24 μg/mL oligandrin showed the best effect as lesion diameter of potato tubers after this treatment with oligandrin was only 58.33% of the control. Further studies showed that oligandrin enhanced related enzymes activities of phenylpropanoid pathway metabolism including PAL,CAD,C4H,4CL and the corresponding gene expression of potato tuber. At the same time,antifungal substances such as total phenols,flavonoids and lignin content increased with oligandrin treatment,the content of flavonoids was 54% higher than the control 3 days after treatment. The findings suggested that oligandrin possibly increased disease resistance of potato tubers by enhancing phenylpropanoid pathway metabolism.
potato tubers;dry rot;oligandrin;phenylpropanoid pathway metabolism
2016-09-06
刘筱(1993-),女,硕士研究生,研究方向:采后果蔬贮藏与保鲜,E-mail:liuxiao0028@163.com。
*通讯作者:李永才(1972-),男,博士,教授,研究方向:采后果蔬贮藏病害控制,E-mail:lyc@gsau.edu.cn。
TS201.3
A
1002-0306(2017)06-0339-07
10.13386/j.issn1002-0306.2017.06.056
