红松松塔多酚对S180荷瘤小鼠抗肿瘤及免疫活性
2017-04-14伊娟娟王振宇周丽萍李景彤
伊娟娟,王振宇,*,周丽萍,王 化,李景彤,曲 航
(1.哈尔滨工业大学化工学院,黑龙江哈尔滨 150090;2.黑龙江省科学院自然与生态研究所,黑龙江哈尔滨 150040)
红松松塔多酚对S180荷瘤小鼠抗肿瘤及免疫活性
伊娟娟1,王振宇1,*,周丽萍2,王 化2,李景彤1,曲 航1
(1.哈尔滨工业大学化工学院,黑龙江哈尔滨 150090;2.黑龙江省科学院自然与生态研究所,黑龙江哈尔滨 150040)
目的:研究红松松塔多酚40%乙醇洗脱物PPP-40对S180荷瘤小鼠体内抗肿瘤及免疫调节作用。方法:首先建立S180 实体瘤模型,连续灌胃PPP-40为10 d。然后,对小鼠抑瘤率、肿瘤细胞周期、脾脏指数及脾淋巴细胞增殖能力进行分析。结果:实验表明PPP-40中剂量(150 mg/kg)能够显著抑制肿瘤细胞生长(抑瘤率:48.29%,p<0.01),促进肿瘤细胞周期阻滞在G0/G1和G2/M;且能显著提高小鼠脾脏指数(3.29±0.26,p<0.01)及脾淋巴细胞增殖能力(p<0.01)。结论:这些结果表明PPP-40是一种天然抗肿瘤药剂,对S180荷瘤小鼠具有显著的抗肿瘤作用(p<0.01),其抗肿瘤机制和肿瘤细胞周期阻断及小鼠免疫活性的提高有关。
红松松塔多酚,S180小鼠模型,抗肿瘤,免疫活性
癌症已经成为当下人类健康的巨大威胁,据世界卫生组织统计,癌症的发病率逐年增加,预计到2025年,每年会产生2000万的新增癌症病例[1-3]。因此,寻找恶性肿瘤有效的防治方法迫在眉睫。多酚化合物因天然存在于多种植物中,资源广泛,生理功能强大,而深受国内外学者的广泛关注。流行病学调查显示,膳食多酚的摄入量与癌症发病率密切相关[4]。
大量研究证实植物多酚具有很强的抗肿瘤效应,并且对正常细胞不会造成损伤,具有开发应用前景[5-9]。癌症的发生往往与机体免疫能力下降相关,且肿瘤细胞还分泌一些抑制免疫细胞发挥功能的抑制因子,使免疫细胞处于肿瘤微环境中,不能发挥正常免疫反应。研究表明植物多酚类物质能够改善 S180 荷瘤鼠的免疫活性,调节小鼠免疫指数直接降低肿瘤活性,达到抑制肿瘤生长的作用[10]。
红松(Pinuskoraiensis),亦称果松、海松,在我国主要分布在长白山和小兴安岭一带。国外关于松科植物多酚化合物研究最多的是法国海岸松松皮萃取物,商品名称为碧落芷(Pycnogenol),是国际公认优良的营养和功能添加剂。国外还几乎没有见到关于红松松塔活性成分的研究报告。国内关于红松松塔的研究主要集中于松塔多酚化合物提取工艺的优化[11]、多酚化合物的纯化[12]、体外抗氧化[13]、体外抗肿瘤[14]、体外免疫调节[15]及体内抗辐射的研究[16]。关于红松松塔多酚化合物体内抗肿瘤及免疫调节作用的研究还很少报道,是一个巨大的研究空白区,非常具有研究意义。
因此,本文通过建立S180荷瘤小鼠肿瘤模型,研究红松松塔多酚提取物对荷瘤小鼠体重、抑瘤率、肿瘤细胞周期、小鼠脾脏指数及脾淋巴细胞增殖能力等指标的影响,旨在为红松松塔的综合利用提供科学依据及实践指导。
1 材料与方法
1.1 材料与仪器
红松松塔鳞片(PineconesofPinuskoraiensis) 来自伊春林业局,经哈尔滨工业大学化工学院王振宇教授鉴定;雄性健康昆明小鼠 购自哈尔滨黑龙江中医药大学,体重 22~25 g,动物生产许可证号码SYXK(黑)2013-012;S180细胞 购自上海中科院细胞库,细胞培养在含10%胎牛血清的RPMI 1640培养基中,于37 ℃ 5% CO2条件下培养;RPMI 1640培养基 美国Hyclone公司;胎牛血清 杭州四季青生物工程材料有限公司;二甲基亚砜(DMSO) Sigma公司;MTT Amresco公司;红细胞裂解液 碧云天生物技术研究所。
CJ-25分析天平 上海精天电子仪器厂;CLASS100 CO2恒温培养箱 Thermo电子公司;HT-2酶标仪 Biocell公司;XSZ-H光学显微镜 南京冀飞科技有限公司;FACSCalibur流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 红松松塔多酚的提取与纯化 选取红松球果鳞片5 kg,50 ℃烘箱干燥12~24 h,每2 h测一下质量,质量不变,表明到达干燥终点。然后经高速万能粉碎机粉碎(24000 r/min)15 min 后过30目筛子。按料液比1∶20加60%乙醇(V/V)超声辅助提取1 h,重复2次,合并滤液,4000 r/min下离心10 min,合并上清液后真空旋转蒸发仪50 ℃条件下浓缩滤液,定容体积至原体积20%后测定多酚的浓度。
对上述制备的红松松塔多酚粗提物进行一、二级纯化。一级纯化采用AB-8大孔树脂结合响应面法进行纯化[12]。二级纯化采用D101大孔树脂结合不同乙醇浓度(20%、40% 及60%)梯度洗脱法进行纯化,获得二级分离物PPP-40,其纯度为57.25%,主要组成为儿茶素和花旗松素[14]。
1.2.2 荷瘤小鼠模型的建立 无菌条件下,将培养状态良好的S180肿瘤细胞收集并使用生理盐水最终调整细胞浓度为5.0×106cells/mL,选取健康昆明小鼠无菌环境下快速接种上述S180细胞悬液0.2 mL。饲养7 d后,无菌条件下提取S180荷瘤小鼠的腹水,调整腹水浓度,无菌环境下注射于健康小鼠腹腔内,继续饲养一周,腹水传代3~4次后建模。
1.2.3 实验分组及灌胃方法 将实验小鼠分为5组,每组12只,分别为空白组、模型组和PPP-40低、中、高剂量处理组。模型组和空白组给予和给药处理组相同量的生理盐水,对照组腹腔注射环磷酰胺(20 mg/kg·d),PPP-40低、中、高剂量组灌胃剂量分别为50、150和300 mg/kg·d,连续给药10 d,于第11 d处死取血及脾脏。
1.2.4 荷瘤鼠脾脏指数的测定 小鼠处死后,取其相应脾脏,生理盐水冲洗,滤纸除去水后,于分析天平中快速称得脾脏质量,记录数据,并按下列公式计算脾脏指数:
式(1)
式中:I-脾脏指数,m-脾脏质量(mg),M-鼠体质量(g)。
1.2.5 PPP-40对S180实体瘤的抑制率 小鼠肿瘤组织瘤体质量称量后,计算抑瘤率S:
S(%)=(A0-A1)/A0×100
式(2)
式中:S-抑瘤率(%),A0-模型组瘤体质量(g),A1-给药组瘤体质量(g)。
1.2.6 S180小鼠肿瘤细胞周期及DNA含量分析方法 细胞周期通常为细胞分裂产生新细胞的生长开始到下一次细胞分裂形成子细胞结束为止所经历的过程。主要包括DNA合成前期(G0/G1期)、DNA合成期(S期)和DNA合成后期(G2期)与DNA分裂期(M期)四个阶段。正常的细胞都要经历这四个阶段,周期循环是细胞正常生长和分化的必要保证。植物多酚抗肿瘤效应与其对肿瘤细胞周期干扰阻断有着密切的关系。故本实验采用流式细胞仪对小鼠肿瘤细胞周期及DNA含量进行考察。具体操作如下:将处死的小鼠快速剥离肿瘤组织后,瘤体立即在低温无菌环境下进行处理,收集各组肿瘤组织中肿瘤细胞于无菌的比色管中,调整细胞到适宜浓度,70%无水乙醇4 ℃放置24 h后,加入PI避光染色30 min后检测肿瘤细胞周期分布及DNA含量[17]。
1.2.7 S180小鼠脾淋巴细胞增殖能力测定 将用于脾淋巴细胞增殖实验的小鼠处死后75%乙醇灭菌,用剪刀在无菌洁净的环境下小心的取出小鼠的完整脾脏,用冰PBS漂洗去除血液及结缔组织后,于灭过菌的200目筛网上剪碎成小块后研磨,PBS冲洗筛网过滤下的液体于试管中,1000 r/min离心5~10 min加红细胞裂解液,3~5 min 后,离心沉淀用PBS反复洗涤2次后,去除上清液,加入培养基调整细胞浓度呈脾淋巴细胞悬浮液。将收集到的每份脾淋巴细胞调整到适宜浓度后加入到96孔板中,常规操作铺板每孔加入95 μL细胞悬液后,向每孔中加入5 μL浓度为150 μg/mL的ConA溶液,使其每孔内终浓度为7.5 μg/mL,培养72 h后,按照MTT后续步骤于570 nm波长下测得吸光度值[18]。
1.3 统计学分析
实验中测定结果均进行3次重复,实验结果均以测定且对实验数据采用统计分析软件SPSS(Version 18.0)进行ANOVA单因素方差分析,数据以平均值±标准差(X±S)表示,p<0.05有显著性差异,p<0.01为极显著性差异。
2 结果与分析
2.1 PPP-40对S180小鼠外观特征的影响
如表1所示,接种S180实体瘤细胞次日,小鼠外观、饮食及活动均正常;给药第3 d后,模型组小鼠生长状态变差,逐渐出现精神萎靡,行动迟缓,毛发杂乱干涩等现象。不同给药组的不同剂量对荷瘤小鼠外观特征及饮食行动影响明显,其中环磷酰胺及PPP-40中剂量组作用效果最突出,对小鼠整体改善效果接近正常组。

表3 PPP-40对S180小鼠肿瘤细胞周期的影响

表1 PPP-40对S180小鼠的外观特征影响
2.2 PPP-40对S180实体瘤生长的抑制作用
根据瘤重计算PPP-40对其的抑制率如表2所示,结果表明3个剂量的PPP-40对S180实体瘤生长均具有显著的抑制作用(p<0.05);PPP-40低、中、高处理组对实体瘤的抑制率分别为12.68%、48.29%和32.20%。环磷酰胺对S180实体瘤的抑制率59.02%,低、中、高剂量的PPP-40对S180实体瘤生长的抑制作用显著低于环磷酰胺组(p<0.01)。以上结果表明,PPP-40对S180 实体瘤生长具有很好的抑制作用,进一步揭示了PPP-40在体内具有显著的抗肿瘤作用。

表2 PPP-40对S180实体瘤生长的抑制作用
注:*与模型组比较,p<0.05;**与模型组比较,p<0.01;#与阳性对照组比较,p<0.05;##与阳性对照组比较,p<0.01;表3、表4同。
2.3 PPP-40对S180小鼠肿瘤细胞周期分布的影响
由表3可知,模型组肿瘤组织中G0/G1期和S期细胞的比例分别为44.23%和53.79%。与模型组比较,环磷酰胺组S期肿瘤细胞显著减少(p<0.01),大部分细胞处于G0/G1期(73.21%)。而PPP-40中剂量组显著的影响了肿瘤细胞在G0/G1期的变化,相继影响了S期到G2/M期的转变,使肿瘤细胞更多的从S期转变到G2/M期,细胞阻滞在G2/M期的比例增多;其细胞在G0/G1期、S期和G2/M期各周期所占的比例分别为56.97%、3.59%和39.44%。
实验结果证明阳性对照环磷酰胺组能够显著诱导S180荷瘤小鼠肿瘤细胞停滞在G0/G1期,从而抑制肿瘤细胞DNA复制、转录和蛋白质的合成,促进肿瘤细胞的凋亡。PPP-40高、低剂量组与模型组相比,各周期的细胞数量差异不显著,而PPP-40中剂量组与模型组相比,使S期的细胞更多的进入到G2/M期,阻滞在G2期。研究表明,芒果苷可以时间和剂量依赖地抑制人骨髓性白血病细胞的增长,明显改变蛋白激酶和细胞周期相关因子表达水平,是通过ATR-Chk1通路使肿瘤细胞停滞在G2/M期发挥抗白血病作用[19]。也有文献报道肉桂的水提多酚混合物具有抗肿瘤活性,它们也是通过阻断肿瘤细胞G2-M期而发挥抗肿瘤作用的[20]。
2.4 PPP-40对S180小鼠肿瘤细胞DNA含量的影响
用流式细胞仪检测技术对细胞内DNA含量进行检测,结果如图1所示。
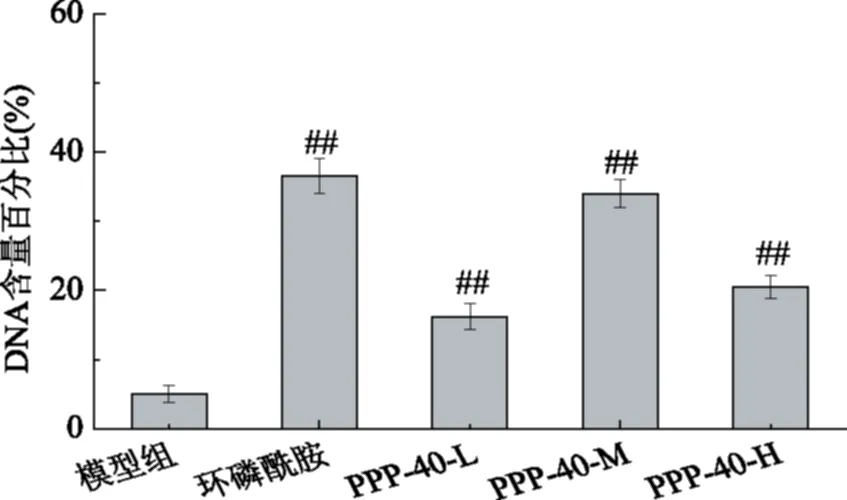
图1 PPP-40对S180小鼠肿瘤细胞DNA含量的影响Fig.1 Effect of PPP-40 on contents of tumor cells DNA in S180 mice注:PPP-40-H,PPP-40-M,PPP-40-L分别表示PPP-40高、中、低剂量组;注:##与模型组比较,p<0.01。
灌胃低、中、高剂量PPP-40的荷瘤鼠肿瘤组织DNA含量百分比分别为18.24%、33.97%、20.56%,而阳性对照组肿瘤组织DNA含量为36.50%。表明松多酚二级分离物PPP-40各剂量组均不同程度的对肿瘤细胞起到一定的凋亡促进作用。
2.5 PPP-40对S180小鼠脾脏指数的影响
由表4可知,与正常组相比,模型组小鼠的脾脏指数显著降低(p<0.01),这表明肿瘤的发生导致脾脏细胞的损伤或凋亡。与模型组相比,PPP-40各剂量处理组对小鼠的脾脏指数均有显著升高(p<0.01)。其中,中剂量处理组的改善效果优于低、高剂量处理组。而阳性对照环磷酰胺组与模型组相比没有显著差异(p<0.05),其脾脏指数低于模型组,表明环磷酰胺没有起到免疫修复作用,相反起到免疫抑制效果。
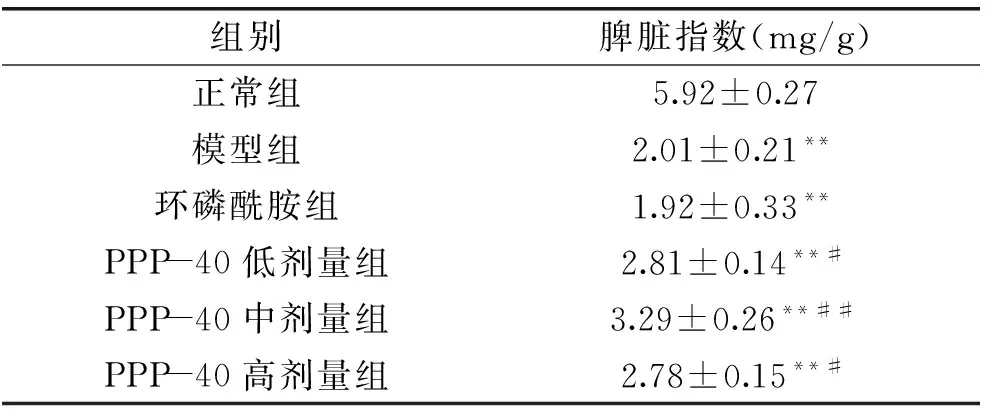
表4 PPP-40对S180小鼠脾脏指数的影响
2.6 PPP-40对S180小鼠脾淋巴细胞增殖的调节
由图2可以看出,与正常组相比,模型小鼠的脾淋巴细胞增殖能力受到明显的抑制(p<0.01);与模型组相比,PPP-40中剂量处理组促进脾淋巴细胞增殖作用极其显著(p<0.01),优于其它两个剂量处理组。而阳性对照组环磷酰胺对脾淋巴细胞增殖与模型组相比没有显著差异,表明阳性对照组对荷瘤小鼠脾脏没有修复作用,这与文献报道的环磷酰胺免疫抑制功能相同。这种现象也说明了阳性对照试剂环磷酰胺对肿瘤的抑制途径不是通过免疫调节通路。
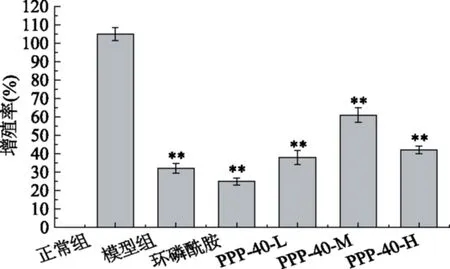
图2 PPP-40对S180小鼠脾淋巴细胞增殖的影响Fig.2 Effect of PPP-40 on proliferation of splenocytes in S180 mice注:*与正常组比较,p<0.05;**与正常组比较,p<0.01;#与模型组比较,p<0.05;##与模型组比较,##p<0.01。
3 讨论与结论
本文在红松松塔多酚PPP-40体外抗肿瘤研究的基础上,通过在体内建立S180荷瘤小鼠肿瘤模型,对PPP-40体内抗肿瘤活性及免疫调节活性进行系统研究。通过对S180小鼠体内抑瘤率及肿瘤细胞周期、肿瘤细胞DNA含量、脾脏指数以及脾淋巴细胞增殖等指标综合分析,结果看出:PPP-40中剂量(150 mg/kg·d)处理组的抑瘤效果最明显,抑瘤率为48.29%;且肿瘤细胞周期检测也发现 PPP-40中剂量(150 mg/kg·d)处理组将肿瘤细胞更多地阻滞在G0/G1期及G2/M期,表明松塔多酚PPP-40体内抗肿瘤作用可能是通过抑制肿瘤细胞DNA复制、调节细胞周期阻滞来实现的。
肿瘤的发生与转移与机体免疫系统功能抑制有着直接关系,如肿瘤微环境的影响使机体不能对肿瘤细胞产生正常的免疫应答而引起肿瘤的发展和恶化。脾脏是机体最大的外周免疫器官,是衡量机体免疫功能的重要指标。脾淋巴细胞分化的T、B淋巴细胞与机体的细胞免疫及体液免疫关系非常密切[21]。在本研究中PPP-40中剂量(150 mg/kg·d)处理组能够显著提高S180荷瘤小鼠的脾脏指数、脾淋巴细胞增殖能力,从而有效提高S180 荷瘤小鼠的免疫功能。这个结果与左丽丽等人的研究结果相一致[22]。
[1]曾红梅,陈万青. 中国癌症流行病学与防治研究现状[J]. 化学进展,2013,25(9):1415-1420.
[2]Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. International Journal of Cancer,2015,136(5):E359-E386.
[3]杨吉龙. 调查揭示中国癌症生存率远低于发达国家[J]. 中国肿瘤临床,2014,41(24):1607-1608.
[4]Liu J R,Dong H W,Chen B Q,et al. Fresh apples suppress mammary carcinogenesis and proliferative activity and induce apoptosis in mammary tumors of the Sprague-Dawley rat[J]. Journal of Agricultural and Cood Chemistry,2008,57(1):297-304.
[5]Sagara Y,Miyata Y,Nomata K,et al. Green tea polyphenol suppresses tumor invasion and angiogenesis in N-butyl-(-4-hydroxybutyl)nitrosamine-induced bladder cancer[J]. Cancer Epidemiology,2010,34(3):350-354.
[6]Hajiaghaalipour F,Kanthimathi M S,Sanusi J,et al. White tea(Camellia sinensis)inhibits proliferation of the colon cancer cell line,HT-29,activates caspases and protects DNA of normal cells against oxidative damage[J]. Food Chemistry,2015,169:401-410.
[7]Lin X,Wu G,Huo W Q,et al. Resveratrol induces apoptosis associated with mitochondrial dysfunction in bladder carcinoma cells[J]. International Journal of Urology,2012,19(8):757-764.
[8]Li X,Huang J M,Wang J N,et al. Combination of chrysin and cisplatin promotes the apoptosis of Hep G2 cells by up-regulating p53[J]. Chemico-Biological Interactions,2015,232:12-20.
[9]Ouyang L,Luo Y,Tian M,et al. Plant natural products:from traditional compounds to new emerging drugs in cancer therapy[J]. Cell Proliferation,2014,47(6):506-515.
[10]苏晓雨. 红松种壳组成及多酚提取分离与抗氧化抗肿瘤功能研究[D]. 哈尔滨:哈尔滨工业大学,2010.
[11]曾祥红. 多通道二维色谱分离松多酚及对抗氧化物质的活性跟踪[D]. 哈尔滨:哈尔滨工业大学,2013.
[12]Yi J J,Wang Z Y,Bai H N,et al. Optimization of Purification,Identification and Evaluation of theinvitroantitumor activity of polyphenols from Pinus Koraiensis Pinecones[J]. Molecules,2015,20(6):10450-10467.
[13]Li H,Wang Z Y. Enrichment and purification of polyphenols in pine cone extracts of Pinus koraiensis Sieb. et Zucc. using a novel multi-channel parallel-serial chromatographic system packed with macroporous resin[J]. Rsc Advances,2015,5(39):30711-30718.
[14]Yi J J,Wang Z Y,Bai H N,et al. Polyphenols from pinecones of Pinus koraiensisinduce apoptosis in colon cancer cells through the activation of caspaseinvitro[J]. RSC Advances,2016,6(7):5278-5287.
[15]Yi J J,Qu H,Wu Y Z,et al. Study on antitumor,antioxidant and immunoregulatory activities of the purified polyphenols from pinecone of Pinus koraiensis on tumor-bearing S180 miceinvivo[J]. International Journal of Biological Macromolecules,2017,94:735-744.
[16]Li H,Wang Z Y,Xu Y,et al. Pine polyphenols from Pinus koraiensis prevent injuries induced by gamma radiation in mice[J]. Peer J,2016,4(1870e):DOI 10.7717/peerj.1870
[17]Lau F Y,Chui C H,Gambari R,et al. Antiproliferative and apoptosis-inducing activity of Brucea javanica extract on human carcinoma cells[J]. International Journal of Molecular Medicine,2005,16(6):1157-1162.
[18]Wang L,Li X Y,Wang Z Y. Whole body radioprotective effect of phenolic extracts from the fruits of Malus baccata(Linn.)Borkh[J]. Food Function,2016,7:975-981.
[19]Peng Z G,Yao Y B,Yang J,et al. Mangiferin induces cell cycle arrest at G2/M phase through ATR-Chk1 pathway in HL-60 leukemia cells[J]. Genetics and Molecular Research,2015,14(2):4989-5002.
[20]Schoene N W,Kelly M A,Polansky M M,et al. Water-soluble polymeric polyphenols from cinnamon inhibit proliferation and alter cell cycle distribution patterns of hematologic tumor cell lines[J]. Cancer Letters,2005,230(1):134-140.
[21]Szmigielski S. Reaction of the immune system to low-level RF/MW exposures[J]. Science of the Total Environment,2013,454:393-400.
[22]左丽丽. 狗枣猕猴桃多酚的抗氧化与抗肿瘤效应研究[D]. 哈尔滨:哈尔滨工业大学,2013.
Antitumor and immunomodulation activities of polyphenols from pinecone ofPinuskoraiensisin cancer-bearing S180 mice
YI Juan-juan1,WANG Zhen-yu1,*,ZHOU Li-ping2,WANG Hua2,LI Jing-tong1,QU Hang1
(1.School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150090,China;2.Institution of Natural Resources and Ecology of Heilongjiang Academy of Sciences,Harbin 150040,China)
Objective:The aim of this study was to investigate the antitumor and immunoregulatory activities of the 40% ethanol eluent of polyphenols from pinecone ofPinuskoraiensis(PPP-40)on S180 mice. Methods:Firstly,S180 solid tumor-bearing mice were given PPP-40 by oral for 10 days. Then,the tumor inhibition rate,cell cycle of tumor cells,spleen index and spleen lymphocytes proliferation ability were analyzed. Results:Pretreatment with PPP-40(150 mg/kg)could significantly inhibit of tumor growth(Inhibition rate:48.29%,p<0.01),promote tumor cells cycle arrest at G0/G1and G2/M,enhance spleen index(3.29±0.26,p<0.01)and accelerated the proliferation of splenocytes(p<0.01). Conclusion:These results suggested that PPP-40 was a natural antitumor agent and possesses strong antitumor effect in S180 mice(p<0.01). The antitumor effect may be related to the arrest of tumor cell cycle and the improvement of immunomodulatory activity.
polyphenols ofPinuskoraiensispinecone;S180 solid tumor;antitumor activity;immunomodulation activity
2016-08-29
伊娟娟(1988-),女,在读博士,研究方向:天然产物提取与功能分析,E-mail:yijuanjuanmsn@126.com。
*通讯作者:王振宇(1957-),男,教授,主要从事活性成分的分离合成调控,新资源开发与利用方面的研究,E-mail:wangzhenyu13001@163.com。
TS201.2
A
1002-0306(2017)06-0345-05
10.13386/j.issn1002-0306.2017.06.057
