复方肿节风溶液抗炎和平喘作用的研究
2017-04-13梁正敏张明昕彭健波杨善忠唐廷崇赖胜基何家康
梁正敏,张明昕,彭健波,杨善忠,唐廷崇,赖胜基,何家康*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西兽药制剂工程技术研究中心,广西南宁 530003)
兽医临床
复方肿节风溶液抗炎和平喘作用的研究
梁正敏1,张明昕1,彭健波2,杨善忠2,唐廷崇1,赖胜基1,何家康1*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西兽药制剂工程技术研究中心,广西南宁 530003)
为考察复方肿节风溶液的抗炎平喘作用,进行了该药的体外抗炎和体内平喘作用研究。用脂多糖(LPS)诱导RAW 264.7细胞建立体外炎症模型,MTT法检测复方肿节风对RAW 264.7细胞活力的影响,ELISA检测细胞上清液中TNF-α、IL-1 和IL-6 浓度,Griess法检测NO水平。体内试验通过卵清蛋白(OVA)致敏、激发Wistar大鼠建立哮喘模型,并灌服不同剂量(12、6、3 g/kg)的复方肿节风溶液。ELISA检测大鼠血清中IL-4、IL-17、IFN-γ及IgE水平;瑞特-吉姆萨染色血涂片,用血细胞计数器计数血液白细胞总数和嗜酸性粒细胞数,肺组织HE染色,观察肺组织病理变化。体外抗炎试验结果表明,复方肿节风溶液在10 μg/mL~40 μg/mL的浓度范围内对RAW 264.7细胞活力无显著影响。10、20、40 μg/mL的复方肿节风溶液能不同程度抑制LPS诱导的RAW 264.7细胞产生TNF-α、IL-6、IL-1和NO的水平(P<0.05),并存在一定的剂量依赖关系。体内平喘试验结果表明,与哮喘模型组相比,复方肿节风溶液能明显下调血清中IL-4、IL-17和IgE的高分泌,上调血清中IFN-γ水平(P<0.05)。表明复方肿节风溶液抗炎平喘作可能通过抑制相关炎症因子的表达来实现的。
复方肿节风溶液;小鼠单核-巨噬细胞;抗炎;平喘;炎症因子
复方肿节风溶液系由肿节风、苦玄参两味中药,经加工精制而成的新型中药复方口服溶液,其处方来源寓意于《中华人民共和国药典》中“万通炎康片”的立方宗旨,具有疏风清热、解毒消肿的功效;用于外感风热所致的咽部红肿,牙龈红肿、疮疡肿痛;急慢性咽炎、扁桃体炎、牙龈炎、疮疖等证候者[1]。本研究采用LPS诱导RAW 264.7细胞建立体外炎症模型,以OVA致敏、激发建立体内哮喘模型,探讨复方肿节风溶液的抗炎平喘作用,为该制剂的临床应用提供药效学依据。
1 材料与方法
1.1 材料
1.1.1 细胞和实验动物 小鼠单核-巨噬细胞系RAW 264.7细胞,购自中国医学科学院基础医学研究所细胞库。Wistar大鼠,雌性,36只,SPF级,体重200 g±20 g,购自广西医科大学实验动物中心,动物合格证号:SCXK桂2013-0002,试验前适应性饲养1周。
1.1.2 试剂 RPMI-1640 培养基、DMEM培养基、新生牛血清、0.5 g/L胰蛋白酶-EDTA,均为Gibco公司产品;MTT、L-谷氨酰胺、LPS和OVA,均为Sigma产品;活性氧试剂盒,购自北京普利莱基因技术有限公司;TNF-a 、IL-l、IL-6、IL-4、IL-17、IFN-γ和IgE ELISA检测试剂盒,均购自欣博盛生物科技有限公司;磷酸盐缓冲液(PBS)购自索莱宝生物科技有限公司;二甲基亚砜(DMSO),购自楚杰生物科技有限公司。
1.2 方法
1.2.1 药品制备 复方肿节风溶液制备:取肿节风、苦玄参二味中药,加水煎煮2次,每次2 h,合并煎液,滤过,滤液浓缩至相对密度为1.10~1.15(75℃)的清膏,冷却,加入3倍量乙醇,搅匀,静置24 h,取上清液回收乙醇,浓缩至相对密度为1.10~1.20(70℃)的清膏,加水至约1 000 mL,搅匀,冷藏(4℃~7℃)24 h,滤过,滤液加适量的防腐剂,加水至1 000 mL,搅匀,灌装,灭菌,即得(每1 mL相当于原生药1.2 g)。经检验,每1 mL口服液含有效成分迷迭香酸0.15 mg。
1.2.2 体外抗炎试验
1.2.2.1 复方肿节风溶液对RAW 264.7细胞活力的影响 取对数生长期的RAW 264.7细胞,调整浓度为1×l06个/mL,每孔100 μL接种于96孔培养板,37℃、体积分数为5%的CO2培养箱培养过夜。次日弃去上清液,每孔加入200 μL用培养液稀释的不同浓度复方肿节风溶液(10、20、40 μg/mL,以肿节风有效成分迷迭香酸计)预处理1 h,加入10 μL终浓度为10 μg/mL的LPS,空白对照组加入200 μL培养液,LPS对照组加入200 μL 10 μg/mL的LPS。每组设定6个平行孔,培养12、24、48 h。每孔加20 μL MTT溶液,37℃ 孵育4 h。弃去上清液,每孔加入100 μL DMSO,用酶标仪检测OD 490 nm值。
1.2.2.2 Griess法测定细胞上清液中的NO水平 取对数生长期的RAW 264.7细胞,调整浓度为1×l06个/mL,每孔400 μL,接种于24孔培养板,37℃、体积分数为5%的CO2培养箱培养过夜。设空白对照组,LPS对照组,高(40 μg/mL)、中(20 μg/mL)、低(10 μg/mL)剂量复方肿节风溶液组。弃去上清液,药物组加入400 μL高、中、低剂量的复方肿节风溶液预处理1 h,加入10 μL终浓度为10 μg/mL的LPS,空白对照组加入400 μL培养液,LPS对照组加入400 μL 10 μg/mL的LPS。培养4、8、24、48 h后终止培养,收集细胞上清液,用于NO测定。测定方法:于96孔板中每孔加入50 μL细胞上清液,分别加入 50 μL Griess Reagent Ⅰ和50 μL Griess Reagent Ⅱ,微振荡摇匀,避光反应10 min,用酶标仪测OD450 nm值,用亚硝酸钠制备不同浓度标准液,最后根据标准曲线方程换算NO释放量。
1.2.2.3 ELISA检测细胞上清液中的TNF-α、IL-l、IL-6含量 试验处理同1.2.2.2,复方肿节风溶液作用细胞24 h后收集细胞上清液,置-80℃保存用于TNF-α、IL-l、IL-6浓度测定,按照ELISA试剂盒说明书进行操作。
1.2.3 体内平喘试验
1.2.3.1 哮喘模型建立与分组处理 把36只Wistar大鼠随机分为6组,每组6只,分别为空白对照组、哮喘模型组、复方肿节风溶液高、中、低剂量组和地塞米松药物对照组。大鼠于干燥、通风、安静的环境下适应性饲养3 d后进行试验。模型组和各治疗组于试验的第1、8天腹腔注射1 mL 100 g/L OVA(含氢氧化铝佐剂)致敏大鼠,2周后用10 g/L OVA溶液雾化吸入激发大鼠,每天1次,每次30 min,连续激发7 d,空白对照组以生理盐水代替OVA。以出现呼吸急促、口唇发绀、腹肌痉挛、点头呼吸及安静爬卧等表现为哮喘模型诱发成功。
各组哮喘模型诱发成功后,于试验第15天开始给药,复方肿节风溶液高、中、低剂量组分别以12、6、3 g/kg(以原生药计)灌服,地塞米松按3 mg/kg腹腔注射,空白对照组和模型对照组注射等量生理盐水。每天1次,连续给药7 d。最后一次激发24 h后取样,剪尾采血做血涂片,瑞特-吉姆萨染色,显微镜下计数白细胞总数和嗜酸性粒细胞数。眼球采血分离血清用于细胞因子和抗体检测,肺组织于40 g/L多聚甲醛溶液中固定,经脱水、石蜡包埋,HE染色。
1.2.3.2 ELISA检测血清中IL-4、IL-17、IFN-γ和IgE含量 ELISA检测血清中IL-4、IL-17、IFN-γ和IgE的水平,按照ELISA 试剂盒说明书进行测定。
1.2.4 数据分析 用SPSS17.0软件进行分析,结果用平均值±标准差表示,组间比较采用单因素ANOVA分析及t检验。以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 体外抗炎作用
2.1.1 复方肿节风溶液对RAW164.7细胞增殖的影响 复方肿节风溶液分别作用12 h和24 h时,与空白对照组相比,LPS对照组细胞增殖受到一定程度的抑制,但差异不显著,中、高剂量复方肿节风溶液显著促进细胞增殖(P<0.05);而复方肿节风溶液作用48 h后,与空白对照组相比,复方肿节风溶液组增殖能力有所降低(表1),这可能与LPS刺激细胞诱发炎症有关。
2.1.2 复方肿节风溶液对LPS诱导的RAW264.7细胞释放NO的影响 与空白对照组相比,LPS刺激导致细胞释放NO水平极显著升高(P<0.01);而与LPS对照组相比,复方肿节风溶液能够极显著抑制NO的释放(P<0.01),且存在明显的剂量依赖关系。表明复方肿节风溶液可显著抑制LPS诱导的RAW 264.7细胞释放NO的水平(表2)。这可能是其发挥抗炎作用的机制之一。此外,本研究发现LPS刺激细胞8 h时NO水平最高,在24 h时有所下降,这可能与细胞本身的免疫调节作用有关。

表1 复方肿节风溶液对RAW 264.7细胞增殖的影响
注:*表示与空白对照组比较差异显著(P<0.05);**表示与空白对照组比较差异极显著(P<0.01)。
Note:*indicates siginificant difference compared with normal control group (P<0.05);**indicates extremely siginificant difference compared with normal control group (P<0.01).
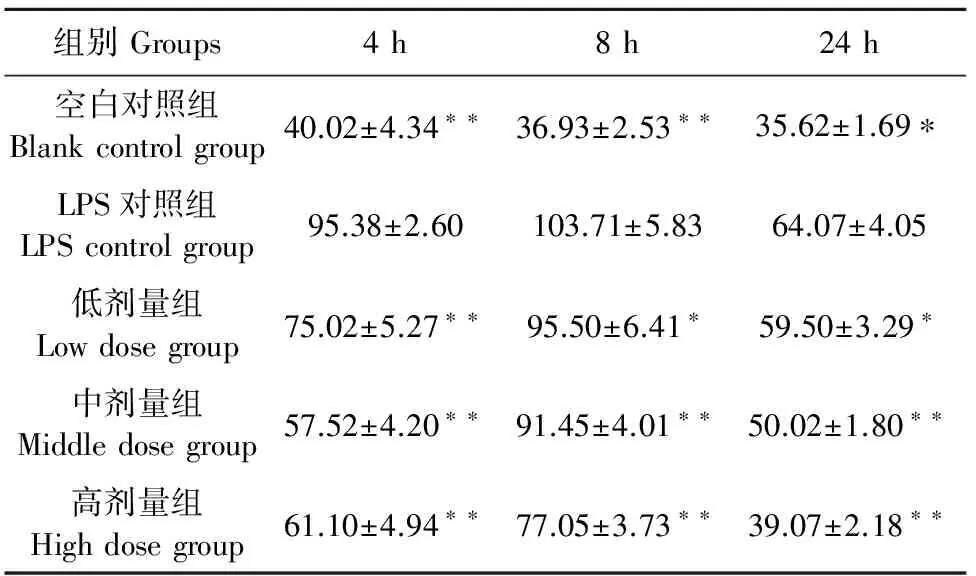
表2 复方肿节风溶液对LPS诱导的RAW 264.7细胞释放NO的影响
注:*表示与LPS对照组比较差异显著(P<0.05);**表示与LPS对照组比较差异极显著(P<0.01)。
Note:*indicates siginificant difference compared with LPS control group (P<0.05);**indicates extremely siginificant difference compared with LPS control group (P<0.01).
2.1.3 复方肿节风溶液对LPS诱导的RAW 264.7细胞分泌IL-1、IL-6 和TNF-α的影响 与空白对照组相比,LPS对照组IL-1、IL-6和 TNF-α水平显著升高,与LPS对照组比较差异极显著(P<0.01),高、中、低剂量复方肿节风溶液不同程度地抑制了IL-1、IL-6和 TNF-α的分泌。其中以高剂量组的抑制作用表现最优(表3)。表明复方肿节风溶液可明显降低LPS诱导的RAW 264.7细胞分泌IL-1、IL-6 和TNF-α水平。
2.2 体内平喘作用
2.2.1 大鼠哮喘模型的建立 本研究建立大鼠哮喘模型的致敏原为卵白蛋白(OVA),以氢氧化铝为佐剂,致敏方式为腹腔注射;采用超声雾化吸入OVA的方式进行激发。连续激发14 d后,模型组和复方肿节风溶液高、中、低剂量组、地塞米松药物对照组出现烦躁不安、呼吸急促、频繁搔痒、抓鼻、腹肌痉挛、点头呼吸及扎堆趴卧等症状,表明本试验成功建立了大鼠哮喘模型。而大鼠通过复方肿节风溶液和地塞米松治疗后,观察到上述症状显著的缓解,具体的临床表现为呼吸逐步平稳,行动灵活,瘙痒改善等。
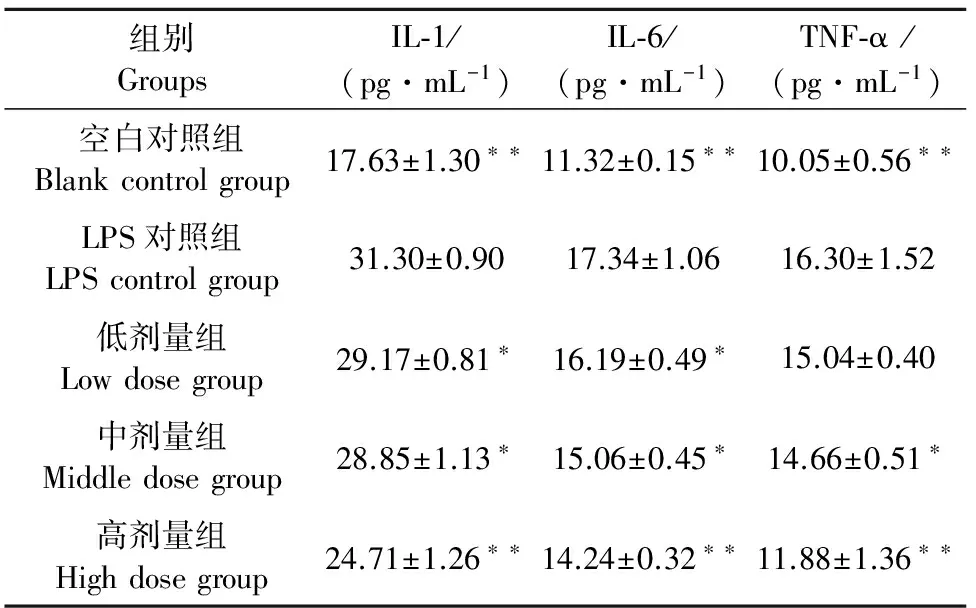
表3 复方肿节风溶液对LPS诱导的RAW 264.7细胞分泌IL-1、IL-6 和TNF-α的影响
注:*表示与LPS阳性对照组比较差异显著(P<0.05);**表示与LPS阳性对照组比较差异极显著(P<0.01)。
Note:*indicates siginificant difference compared with LPS control group (P<0.05);**indicates extremely siginificant difference compared with LPS control group (P<0.01).
2.2.2 复方肿节风溶液对哮喘大鼠血液嗜酸性粒细胞的影响 与空白对照组相比,模型组白细胞总数和嗜酸性粒细胞数明显增多(P<0.01);用药后,高、中、低剂量组白细胞数和嗜酸性粒细胞数较模型组有所减少,其中高剂量组和中剂量组极显著减少白细胞总数和嗜酸性粒细胞数(P<0.01)(表4)。
2.2.3 复方肿节风溶液对哮喘大鼠血清IgE、IL-4、IL-17和IFN-γ的含量的影响 与空白组相比,哮喘模型组血清IL-4、IL-17和IgE分泌异常升高,浓度极显著升高(P<0.01),而哮喘大鼠服用复方肿节风溶液后IL-4、IL-17 和IgE浓度明显下降,表明复方肿节风溶液可抑制IL-4、IL-17和IgE的分泌,其中以高剂量组的抑制作用最显著(P<0.01)。对INF-γ,哮喘模型组较空白组浓度极显著减少,给药后血清中INF-γ浓度有所上升(表5),表明复方肿节风溶液可明显促进INF-γ分泌,以高剂量的促进作用表现最优(P<0.01)。
2.2.4 大鼠肺组织病理组织学观察 正常大鼠的支气管和血管周围无炎性细胞浸润,管壁结完整,肌层厚度合适。模型组大鼠支气管和血管周围有大量以嗜酸性粒细胞和淋巴细胞为主的炎性细胞浸润,管壁结构不完整。复方肿节风溶液低剂量组肺组织和气管及其周围的炎性细胞数量明显减少,气管壁的组织结构较完整。复方肿节风溶液高剂量组肺组织和气管及其周围仅见少量炎性细胞浸润,气管壁较完整(图1)。

表4 复方肿节风溶液对哮喘大鼠血液白细胞的影响
注:*表示与哮喘模型组比较差异显著(P<0.05);**表示与哮喘模型组比较差异极显著(P<0.01)。
Note:*indicates siginificant difference compared with the asthma control group (P<0.05);**indicates extremely siginificant difference compared with the asthma control group (P<0.01).
3 讨论
NO既是炎症反应与免疫调节的效应因子,也是关键的调节因子,参与多种炎症信号传导。外来刺激如细菌、病毒、前炎症因子类如IL-1、IL-6、TNF-α等都可激活NOS合成NO,主要的NOS诱导剂是内毒素LPS[2]。体内NO水平升高可从多个途径影响病理生理进程,关系到多种疾病的发生发展。因此,有效地抑制NOS不仅能在初始阶段影响炎症的发生,也对抑制和终结炎症有作用。因此减少NO的过度分泌、抑制NOS的基因表达成为预防、治疗炎症性疾病的重要方式,本试验采集用药4、8、24 h后的细胞上清液作为样品,分时段测定了细胞上清液中NO的含量,观察到复方肿节风溶液在不同刺激时间对LPS诱导的RAW 264.7细胞释放NO水平的变化,结果表明复方肿节风溶液对NO的抑制作用持续而稳定。
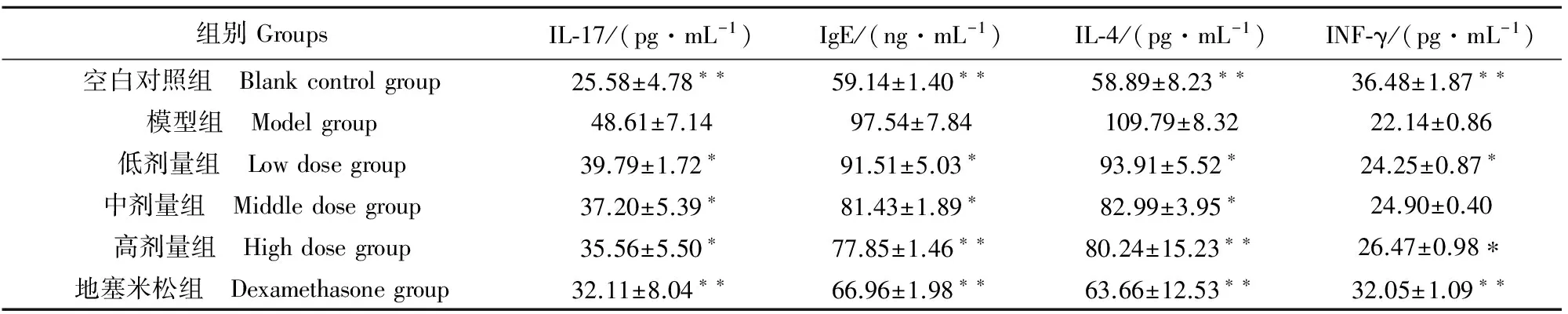
表5 复方肿节风溶液对哮喘大鼠血清中IgE、IL-4、IL-17 和IFN-γ的影响
注:*表示与哮喘模型组比较差异显著(P<0.05);**表示与哮喘模型组比较差异极显著(P<0.01)。
Note:*indicates siginificant difference compared with the asthma control group (P<0.05);**indicates extremely siginificant difference compared with the asthma control group (P<0.01).
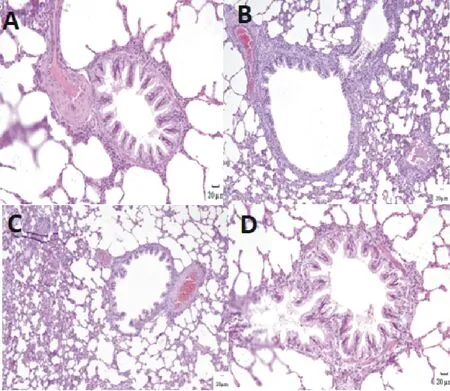
A.空白对照组;B.模型组;C.低剂量组;D.高剂量组
IL-6、TNF-α是最重要的促炎细胞因子,其中IL-6可促进B细胞分化,活化丝裂原活化蛋白激酶,激活信号转导子和转录激活子而加重炎症反应过程[3-4]。TNF-α作为重要的参与炎症反应的因子,在许多病理生理过程中发挥重要的作用。而白细胞介素则是由多种细胞产生并作用于多种细胞的一类细胞因子。它们在免疫细胞的成熟、活化增殖和免疫调节等一系列过程中均发挥重要作用。本研究结果显示,复方肿节风溶液能够降低LPS诱导的RAW 264.7细胞分泌IL-6 、IL-1、TNF-α和NO等炎症因子的含量,表现在降低上清液中细胞因子IL- 1、IL-6、TNF-α的含量,表明复方肿节风溶液对改善细胞炎症反应具有明显的作用。
哮喘是气道慢性炎症性病变,病理特征主要为以嗜酸性粒细胞为主的炎性细胞浸润、气道的高反应性以及黏液高分泌等。EOS是哮喘发生机制中重要的炎症效应细胞。减少EOS在变态反应中的数量或调节其凋亡,可以减轻炎症反应,促进炎症消退。试验结果显示,复方肿节风溶液明显降低了血液中白细胞总数和嗜酸性粒细胞数。另外,哮喘模型的血清学特征主要是总IgE水平和OVA特异性IgE水平增高[5-6]。而IL-4可诱导IgG向IgE转换[7],体内IL-4增多,IL-4/IFN-γ的比例失衡,是哮喘患者体内IgE合成过多的主要机制之一[8]。IL-17是一个关键的促炎细胞因子,它是由CD4+T细胞、T淋巴细胞和嗜酸性粒细胞产生,有报道称IL-17促进中性粒细胞炎症和气道重塑[9]。IFN-γ由于可抑制气道嗜酸性粒细胞的侵润,对于抑制气道炎症具有重要作用[10]。本试验结果表明,复方肿节风溶液能明显下调哮喘大鼠血清中IgE、IL-4、IL-17浓度,上调IFN-γ水平,能够有效调节IL-4/IFN-γ的动态平衡,减轻哮喘大鼠肺组织炎性细胞的浸润,从而改善大鼠的哮喘症状。
复方肿节风溶液由肿节风、苦玄参两味中药组成,具有疏风清热、解毒消肿之功效;主用于咽喉肿痛,急慢性咽炎、扁桃体炎等[1]。肿节风是方中君药,具有清热凉血、活血消斑、祛风通络等功效;苦玄参具有清热解毒、消肿止痛的功效;两药合用共奏疏风清热、解毒消肿之功效[11]。本研究表明复方肿节风溶液具有明显的体外抗炎和平喘作用,这为复方肿节风溶液用于畜禽慢性呼吸道疾病的研究提供了理论基础。复方肿节风溶液的抗炎平喘机制可能与复方肿节风溶液能抑制相关炎性介质的产生有关,也可能是抑制了控制炎性介质的相关基因或蛋白的表达,这需要进一步深入研究。
[1] 国家药典委员会主编.中华人民共和国药典[M].北京:化学工业出版社,2015.
[2] Funatogawa K,Matsuura M,Nakano M,et al.Relationship of structure and biological activity of monosaccharide lipid A analogues to induction of nitric oxide production by murine macrophage RAW 264.7 cells[J].Infect Immun,1998,66(12):5792-5798.
[3] Adams J L,Czuprynski C J.Mycobacterial cell wall components induce the production of TNF-alpha,IL-1,and IL-6 by bovine monocytes and the murine macrophage cell line RAW 264.7[J].Microbial Pathogene,1994,16(6):401-411.
[4] Hodge D R,Hurt E M,Farrar W L.The role of IL-6 and STAT3 in inflammation and cancer[J].Eur J Cancer,2005,41(16):2502-2512.
[5] Liang Z,Xu Y,Wen X,et al.Rosmarinic acid attenuates airway inflammation and hyper-responsiveness in a murine model of Asthma[J].Molecules,2016,21(6):769.
[6] Wei D,Ci X,Chu X,et al.Hesperidin suppresses ovalbumin-induced airway inflammation in a mouse allergic asthma model[J].Inflammation,2012,35(1):114-121.
[7] Kraft M,Lewis C,Pham D,et al.IL-4,IL-13, and dexamethasone augment fibroblast proliferation in asthma[J].J Allergy Clin Immunol,2001,107(4):602-606.
[8] 黄 勋,陈伟斌.辛苍滴鼻凝胶剂对哮喘大鼠血,肺泡灌洗液中 IL-4,IFN-γ 及嗜酸性粒细胞计数的影响[J].江苏中医药,2012,44(1):72-74.
[9] Tan H L,Rosenthal M.IL-17 in lung disease: friend or foe?[J].Thorax, 2013,68(8):788-790.
[10] 赵克明.加味小柴胡汤干预大鼠哮喘模型的实验研究[D].辽宁沈阳:辽宁中医药大学,2010.
[11] 方兔慧,丘 琴,甄汉深,等.苦玄参近年研究的进展[J].中国民族民间医药,2011,20(24):62-62.
Experimental Study of Compound Zhongjiefeng Oral Liquid on Anti-inflammatory and Antiasthmatic Activities
LIANG Zheng-min1,ZHANG Ming-xin1,PENG Jian-bo2,YANG Shan-zhong2,TANG Ting-chong1,LAI Sheng-ji1,HE Jia-kang1
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi530005,China; 2.GuangxiEngineeringResearchCenterforVeterinaryMedicine,Nanning,Guangxi,530003,China)
In order to investigate the anti-inflammatory and antiasthmatic activities of compound Zhongjiefeng oral liquid,the cell inflammation model of RAW 264.7 cells was induced by LPSinvitro.MTT assay was used to measure the RAW 264.7 cell activity,ELISA method was used to measure TNF-a,IL-1 and IL-6 concentrations in cell supernatant,and NO level was measured by Griess method.In addition,female Wistar rats were sensitized and challenged with ovalbumin (OVA) to establish asthma model,and then treated daily with compound Zhongjiefeng oral liquid(12,6,3 g/kg)invivo.ELISA method was used to measure IL-4,IL-17 and IFN-γ and IgE concentrations in serum;The total leukocytes and the number of eosinophils in the blood were detected with hemacytometer and cytospins by staining with the Wright-Giemsa staining method.Lung sections were stained with hematoxylin and eosin (H&E) for histopathological lesions.Anti-inflammatory experimentinvitroresults showed the compound Zhongjiefeng oral liquid in the concentration range of 10 to 40 μg/mL on RAW 264. 7 cell viability had no significant effect.10,20,40 μg/mL of compound Zhongjiefeng oral liquid can significantly inhibit the levels of TNF-α,IL-6,IL-1 in RAW 264.7 cells induced by LPS with a dose dependent relationship (P< 0.05).Studiesinvivoresults showed that the compound Zhongjiefeng oral liquid makedly down-regulated IL-4,IL-17 and IgE hypersecretion and up-regulated IFN -γ in serum compared with the asthma model group (P< 0.05).The results suggested that the protective effects of the compound Zhongjiefeng oral liquid on the cell inflammation model or rats asthma model might be mediated by the inhibition of inflammatory factors.
Zhongjiefeng oral liquid;RAW 264.7 cell;anti-inflamation;inhibiting asthma;inflammatory factors
2016-08-31
国家自然科学基金项目(31360624);广西自然科学基金项目(2014GXNSFAA118115)
梁正敏(1992-),女,贵州遵义人,硕士研究生,主要从事中兽医药研究。
1007-5038(2017)04-0120-06
*通讯作者
