番鸭细小病毒安徽分离株结构蛋白基因的克隆及序列分析
2017-04-13张丹俊赵瑞宏沈学怀胡晓苗侯宏艳潘孝成周学利
戴 银,张丹俊,赵瑞宏,沈学怀,胡晓苗,侯宏艳,潘孝成,周学利
(安徽省农业科学院畜牧兽医研究所,安徽合肥 230031)
番鸭细小病毒安徽分离株结构蛋白基因的克隆及序列分析
戴 银*,张丹俊*,赵瑞宏,沈学怀,胡晓苗,侯宏艳,潘孝成,周学利
(安徽省农业科学院畜牧兽医研究所,安徽合肥 230031)
为研究番鸭细小病毒(MDPV)安徽分离株的遗传变异特征,通过PCR扩增获得了MDPV结构蛋白(VP)基因全长序列AH-MDPV-VP,并将该序列与GenBank中登录的12条MDPV和鹅细小病毒(GPV)VP基因序列进行比对。结果显示,AH-MDPV-VP基因全长2 199 bp,包括完整的VP1、VP2和VP3蛋白编码区。MDPV与GPV的VP基因部分序列一致,但具有明显的差异。进化分析显示,MDPV安徽分离株与基因重组型MDPV上海分离株SAAS-SHNH为同一分支,亲缘关系较近。同源性分析显示二者核苷酸序列同源性最高,为99.9%,且AH-MDPV-VP与GPV毒株SHFX1201的序列同源性也有89.5%。此外安徽分离株与其他MDPV的VP1、VP2和VP3基因同源性有逐步下降的趋势,而与GPV则相反呈上升趋势。进一步显示MDPV安徽分离株与基因重组型MDPV上海分离株SAAS-SHNH相似,可能为MDPV和GPV基因重组型水禽细小病毒。
番鸭细小病毒;结构蛋白基因;克隆;序列分析
番鸭细小病毒(Muscovy duck parvovirus,MDPV) 属于细小病毒科细小病毒亚科依赖病毒属成员[1]。MDPV可引起番鸭的细小病毒病,该病是一种严重危害番鸭养殖业的急性传染性病,可通过多种方式传播,无明显的季节性,但冬春两季多发,1周龄~3周龄雏番鸭较为易感,一旦感染,发病率和病死率均很高。耐过病愈鸭大多生长发育缓慢,其经济价值受到很大影响[2-5]。MDPV基因组均为线性、单链DNA,大小约为5 kb,包括两个开放阅读框(open reading frame,ORF),左侧编码非结构蛋白(NS),右侧编码结构蛋白(VP)。依据不同的起始密码子和蛋白裂解位置,VP可生成VP1、VP2、VP3三种结构蛋白。编码VP1、VP2和VP3的核苷酸分别为2 199、1 764、1 605 bp,三者共用同一终止密码,但起始密码子的位置不同。VP2基因序列中包含VP3的全部基因序列,而VPl基因序列中又包含VP2、VP3的全部基因序列,形成套式结构[6-7]。番鸭细小病毒病在世界各地均可发生,近年来,我国福建、浙江、安徽等地均有不同程度发生,给番鸭养殖业带来巨大的经济损失[8-11]。本研究对安徽番鸭细小病毒分离株的结构蛋白全长基因进行了克隆和序列分析,旨在研究该病毒的基因遗传变异特征,为进一步研究该病毒的基因功能和致病机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株基因组DNA 番鸭细小病毒安徽分离株基因组DNA,安徽省农业科学院畜牧兽医研究所实验室分离、鉴定并保存。
1.1.2 菌株、质粒、工具酶和试剂 大肠埃希菌DH5α菌株,本实验室提供;载体pMD18-T、DNA Marker DL 2000、T4连接酶等,宝生物工程(大连)有限公产品司;dNTP、Taq酶、琼脂糖(电泳纯)等,上海生工生物工程技术服务有限公司产品;DNA清洁/PCR产物清洁试剂盒、DNA凝胶回收试剂盒、质粒小量抽提试剂盒,杭州维特洁生化技术有限公司产品。
1.2 方法
1.2.1 引物设计 参照GenBank中登录的MDPV基因组序列(登录号:KC171936),用Primer Premier 5.0软件设计两对特异性扩增引物。P-1:5′-TGCTATTGATGATATGGAGA-3′;P-2:5′-CAGGTTCGGAGCCTTCGGTG-3′;P-3:5′- CCGAACCTGTGGCAGCATCTAAAATGGCAGAG-3′;P-4:5′- TGATTGGCTGGTTCGAACGAACGAA-3′。预期目的扩增片段大小分别为890 bp和1 733 bp,拼接后基因片段包括完整的VP基因的编码区,命名为AH-MDPV-VP。引物由宝生物工程(大连)有限公司合成。
1.2.2 AH-MDPV-VP基因的分段扩增 以保存的基因组DNA为模板,分别采用P1 、P2和P3 、P4为上、下游引物扩增。PCR反应体系:10×PCR buffer 5.0 μL,dNTP Mixture 3.0 μL, 上、下游引物各1.0 μL,DNA 2.5 μL,TaqDNA 聚合酶0.5 μL,加双蒸水补足60 μL。分别按以下程序进行扩增:94℃ 5 min;94℃ 1 min,51℃ 30 s,72℃ 2 min,32个循环;72℃ 10 min。94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 3 min,32个循环;72℃延伸10 min。扩增产物经8 g/L琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒,然后连入pMDl8-T载体,16℃水浴过夜,转化感受态大肠埃希菌DH5α,涂布于含氨苄青霉素(Amp)的LB琼脂平板上,37℃温箱培养过夜,初步筛选阳性克隆,并用小量碱法提取质粒,送上海生工生物工程技术服务有限公司测序。
1.2.3 基因序列分析 测序后的基因序列在NCBI (http://blast.ncbi.nlm.nih.gov/blast.cgi)数据库中进行同源性比对搜索, 利用SeqMan进行序列拼接,获得VP基因全长核苷酸序列,并推导其氨基酸序列。选择番鸭和鹅细小病毒株共12条参比序列作为分析样本,参考毒株信息见表1。使用Clustal X 1.83软件比对序列,采用DNA Star、MegAlign等软件分析各序列特征。

表1 参考毒株信息
2 结果
2.1 番鸭AH-MDPV-VP基因的扩增
以 MDPV的基因组DNA为模板,P1、 P2和P3、 P4为引物PCR分别扩增获得了一条约 890 bp 和 1 733 bp 大小的特异性DNA片段(图1),将扩增的基因产物纯化、测序。测序结果与GenBank中登录的相应基因序列进行比对,均为目的基因序列。

A.P1、 P2引物的PCR产物;B.P3、 P4引物的PCR产物;M.DNA 标准DL 2 000;1、2.基因组DNA的PCR产物
2.2 基因序列特征分析
序列分析可见,AH-MDPV-VP基因全长2 199 bp,包含完整MDPV VP1、VP2和VP3蛋白质阅读框,分别为2 199、1 764、1 605 bp,编码733、588、534个氨基酸。MDPV和GPV的VP基因核苷酸均未见缺失,VP2的起始密码子ACG均位于VPl基因序列的436 bp处,VP3的起始密码子ATG位于VPl基因序列的595 bp处,三者共用同一终止密码子。同时可见MDPV与GPV的VP基因序列存在较多一致的核苷酸位点,但部分序列差异较为明显,尤其是MDPV位于VP3区域的核苷酸替代较为显著。
2.3 序列进化分析
采用MEGA分析软件,将获得的13条番鸭和鹅的细小病毒VP基因序列构建系统发育树(图2)。结果可见,所比对序列分为番鸭和鹅细小病毒两个类群。AH-MDPV-VP与国内MDPV上海分离株SAAS-SHNH的基因序列KC171936,以及广西分离株MDPV-GX5的基因序列KM093740聚集为同一组,尤其是与分离株SAAS-SHNH的遗传距离较近;与国内较早分离株的基因序列JF926698、AY510603、JF926697,以及欧洲分离株基因序列X75093和Z68272遗传距离较远。
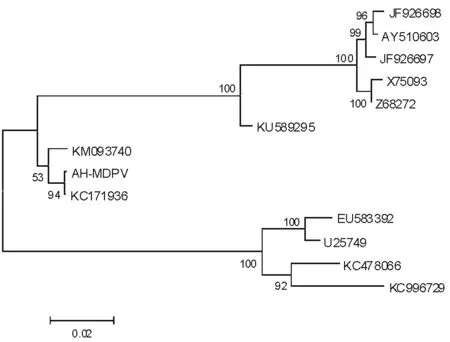
遗传距离在图的下方;聚类分析的可靠性用bootstrap置信区限检测,同时每1 000 bootstrap测试结果大于50%的在节点上显示
2.4 同源性分析
将安徽分离株全长基因序列AH-MDPV-VP与其他在GenBank获得的番鸭和鹅的VP基因序列进行同源性比较(表2)。结果表明,AH-MDPV-VP与MDPV分离株SAAS-SHNH的基因序列同源性最高,为99.9%,与MDPV福建P1毒株同源性较低,为88.9%,而与GPV上海SHFX1201毒株序列的同源性达89.5%。进一步分析可见,安徽分离株与其他MDPV的VP1、VP2、VP3同源性分别介于99.9%~88.9%、99.9%~86.6%、99.9%~85.4%之间,从VP1到VP3同源性有逐步下降的趋势;与鹅细小病毒VP1、VP2、VP3同源性分别介于89.5%~88.6%、91.0%~89.0%、93.2%~91.3%之间,从VP1到VP3的同源性则有逐步上升的趋势。
3 讨论
本研究通过分段扩增获得了MDPV安徽分离株的全长结构蛋白基因序列AH-MDPV-VP,该基因全长2 199 bp,包括完整MDPV VP1、VP2和VP3蛋白质编码区,分析可见3个蛋白质具有不同的起始密码子,但共用同一终止密码子。这与目前已有相关报道基本一致[6,12]。此外,序列比对可见,虽然MDPV与GPV的VP基因部分序列一致,但仍具有明显的差异,尤其是MDPV位于VP3区域的核苷酸替代较为明显,变异程度较高。系统发育树进一步显示,AH-MDPV-VP与近年在国内分离的MDPV上海毒株SAAS-SHNH和广西MDPV-GX5分离株的基因序列KC171936和KM093740为同一小分支,尤其是与分离株SAAS-SHNH亲缘关系较近,二者来源于共同祖先;与国内较早分离的4个毒株,以及欧洲分离的2毒株基因序列遗传距离较远。该研究结果表明MDPV的遗传变异规律与分离株发生的地理和时间呈现一定程度的相关性,但是否确切仍需要研究更多不同地点和时间分离的MDPV毒株。

表2 VP基因核苷酸序列同源性
研究发现MDPV与GPV存在一定交叉反应, MDPV只能感染番鸭,但GPV既可感染鹅,也可感染番鸭,在生产中小鹅瘟活疫苗和抗血清也能够提高雏番鸭对MDPV的抵抗能力[13-15]。依据13个VP基因核苷酸序列的同源性比对结果,可见MDPV和GPV的全长VP基因序列同源性介于89.5%~79.6%之间,安徽分离株与上海分离株SAAS-SHNH的同源性最高,达99.9%,与MDPV福建P1毒株同源性相对较低,为88.9%,但与GPV上海SHFX1201毒株也有89.5%的同源性。MDPV和GPV基因核苷酸序列如此高的同源性,也正说明了二者具有交叉反应特性的根本原因。此外,有研究表明,某些病毒在自然遗传进化过程中会发生基因变异、交叉重组现象,从而产生一种新的致病病毒。这种现象可能更有利病毒逃避寄主的免疫应答,提高本身适应环境的能力。一些动物细小病毒就存在这种基因重组现象,其中MDPV分离株SAAS-SHNHB被认为是由MDPV和GPV基因重组而来的水禽细小病毒[1,16]。VP1、VP2、VP3三者同源性分析表明,安徽分离株与其他番鸭细小病毒株,从VP1到VP2再到VP3基因同源性有逐步下降的趋势,而与鹅细小病毒从VP1到VP3的同源性则有逐步上升的趋势,表明安徽分离株与MDPV和GPV不同节段的VP基因各有较高的同源性。这些特点显示了安徽分离株与亲缘关系较近分离株SAAS-SHNH相似,可能为基因重组型水禽细小病毒。本试验初步研究了安徽MDPV分离株结构蛋白VP基因的分子结构特征,将为深入研究该基因型番鸭细小病毒的遗传变异特点,以及获得有效的预防控制方法奠定了基础。
[1] 万春和,陈红梅,傅秋玲,等.番鸭细小病毒浙江分离株VP基因的克隆与序列分析[J].中国畜牧兽医,2015,42(10):2600-2605.
[2] 谢丽基,谢芝勋,刘加波,等.番鸭细小病毒荧光定量PCR方法的建立及初步应用[J].中国预防兽医学报,2013,35(3):218-221.
[3] 陈 瑶,关 淼.雏番鸭细小病毒病的诊断与防制[J].现代畜牧兽医,2010(4):42-44.
[4] 程晓霞,陈仕龙,陈少莺,等.番鸭细小病毒和鹅细小病毒的抗原相关性研究[J].福建农业学报,2013,28(9):869-871.
[5] 崔国杰,陈少莺.番鸭细小病毒和小鹅瘟病毒混合感染的诊治[J].畜牧与兽医,2015,47(3):147-148.
[6] 王建业,黄 钰,龚建森,等.番鸭细小病毒鹅胚化弱毒株FZ91-30的全基因组克隆及序列分析[J].中国家禽,2015,37(22):46-48.
[7] 季 芳,张毓金,杨增岐,等.番鸭细小病毒和鹅细小病毒广东株VPl基因的克隆与序列分析[J].中国预防兽医学报,2004,26(4):245-247.
[8] Woolcock P R,Jestin V,ShivaPrasad H L,et al.Evidence of muscovy duck parvovirus in muscovy duckling in California[J].Vet Rec,2000,1:68-72.
[9] 宋永峰,吴发兴,宋延华,等.2008年—2009年广东番鸭细小病毒分子流行病学研究[J].中国动物检疫,2010(1):39-40.
[10] 王文秀,张松林,付 强,等.番鸭细小病毒ZQ分离株非结构蛋白基因的克隆及序列分析[J].动物医学进展,2013,34(12):79-83.
[11] 张丹俊,戴 银,沈学怀,等.番鸭细小病毒的VP3基因克隆和序列分析[J].动物医学进展,2015,36(11):7-10.
[12] 张 云,耿宏伟,郭东春,等.鹅和番鸭细小病毒全基因克隆与序列分析[J].中国预防兽医学报,2008,30(6):415-419.
[13] Zadori Z,Stefancsik R,Rauch T,et al.Analysis of complete nueleotide sequence of goose and muscovy duck parvovirus indicates common ancestral origin with adeno-associated virus [J].Virol,1995,212:562-573.
[14] 刘 伟,程晓霞,陈少莺.番鸭源小鹅瘟病毒和番鸭细小病毒的结构蛋白及其抗原性[J].福建农林大学学报:自然科学版,2015,44(1):64-68.
[15] 范文胜,吴阳开,方文棋,等.番鸭细小病毒与鹅细小病毒鉴别诊断方法的建立及初步应用[J].中国家禽,2014,36(22):20-23.
[16] Zhu Y,Zhou Z,Huang Y,et al.Identification of a recombinant Muscovy duck parvovirus (MDPV) in Shanghai,China [J].Vet Microbiol,2014,174(3-4):560-564.
Cloning and Sequence Analysis of Structural Protein Gene of Muscovy Duck Parvovirus Anhui Isolate
DAI Yin,ZHANG Dan-jun,ZHAO Rui-hong,SHEN Xue-huai,HU Xiao-miao,HOU Hong-yan,PAN Xiao-cheng,ZHOU Xue-li
(InstituteofAnimalHusbandryandVeterinaryScience,AnhuiAcademyofAgriculturalScience,Hefei,Anhui,230031,China)
To investigate the variation status of muscovy duck parvovirus(MDPV) Anhui isolate,the structural protein (VP) gene was cloned by PCR,which was named as AH-MDPV-VP. And we compared AH-MDPV-VP with the sequence of twelve VP genes of MDPV and goose parvovirus (GPV) in the GenBank database.The results showed that AH-MDPV-VP gene was 2 199 bp,coding full-length open reading frames of VP1,VP2,and VP3.The partial sequences were consistent,but obvious difference was observed between MDPV and GPV genes.Evolution analysis revealed that Anhui isolate and the genetic recombinant MDPV of Shanghai isolate SAAS-SHNH gathered together in the same branch,they had a close genetic relationship.Similarity analysis showed that the nucleotide sequence homology between two isolates was the highest,99.9%,and the sequence homology of Anhui isolate and GPV isolate SHFX1201 was 89.5%.Moreover,the VP1,VP2 and VP3 homology of Anhui isolate and other MDPV had a tendency to decline gradually.On the contrast,the rising trend of the homology with GPV was found.The result further showed that MDPV Anhui isolate and genetic recombinant Shanghai SAAS-SHNH isolate were similar,they may be waterfowl parvoviruses,recombined with MDPV and GPV.
Muscovy duck parvovirus;structural protein gene;cloning;sequence analysis
2016-07-19
安徽省农业科学院人才发展专项资金项目(17F0404);安徽省家禽产业技术体系资金项目
戴 银(1980-),女,安徽蒙城人,副研究员,博士,主要从事兽医微生物与免疫学研究。
S852.659.4;Q789
A
1007-5038(2017)04-0024-04
*通讯作者
