猪圆环病毒2型ORF2基因的原核表达及反应原性分析
2017-04-13欧云文马小元丁耀忠张永光
欧云文,马小元,王 俊,丁耀忠,张永光,张 杰*
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃兰州 730046)
研究论文
猪圆环病毒2型ORF2基因的原核表达及反应原性分析
欧云文1,2,马小元2,王 俊2,丁耀忠2,张永光2,张 杰2*
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃兰州 730046)
研究猪圆环病毒2型(PCV2)Cap蛋白的抗原性,为开发PCV2的检测方法奠定基础。以PCV2 CAU0673毒株的DNA为模板,扩增获得702 bp的目的片段,扩增产物克隆入pET30a(+)原核表达载体,构建pET30a-PCV2-ORF2重组质粒,转入大肠埃希菌BL21(DE3);在37 ℃以1 mmol/L IPTG诱导表达6 h;采用Ni-NTA树脂亲和层析纯化重组蛋白,并用不同浓度的尿素对纯化蛋白进行复性。SDS-PAGE分析表明,该ORF2编码基因在大肠埃希菌中得到表达,蛋白大小约为34 ku;Western blot检测结果表明,该重组Cap蛋白与PCV2阳性血清发生特异性反应,与NA-PRRSV和PPV1血清不发生交叉反应。成功构建了PCV2-ORF2原核表达载体,实现了在大肠埃希菌中的表达,纯化后的复性蛋白具有较好的反应原性,为猪圆环病毒2型检测方法建立或试剂盒的开发奠定了基础。
猪圆环病毒2型;ORF2基因;原核表达;反应原性
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是无囊膜的、环状、单股负链DNA病毒,为目前已知最小的动物病毒;猪感染该病毒后,导致其免疫机能及生产机能下降,常表现消瘦、黄疸、呼吸急促、咳喘等临床症状,是严重影响国内外养猪业发展的重要病原之一[1]。猪圆环病毒分为两个基因型,即猪圆环病毒1型(PCV1)和猪圆环病毒2型(PCV2)。1974年,Tischer I等[2]首次从PK-15细胞系中分离出PCV1,长期研究表明,该病毒无明显致病性,广泛存在于正常猪体内的多个组织器官之中[3-4];PCV2于1991年在加拿大首次被分离,该病毒可导致断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS),PCV2是猪圆环病毒家族中非常重要的成员,也是猪群中最常见的猪圆环病毒型[5]。与此同时,PCV2常和猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪细小病毒(Porcine parvovirus,PPV)、猪伪狂犬病病毒(Pseudorabies virus,PRV)等繁殖障碍性病毒混合感染而导致猪只发病,给养猪业造成严重的经济损失[6-9]。因而,加强PCV2的研究,对有效预防和控制猪圆环病毒2型有着重要意义。
PCV2是环状、单股负链DNA病毒,基因组大小为1 768 bp,病毒粒子呈二十面体对称结构,病毒基因组包含有11个开放阅读框(open reading frame,ORF)[10]。其中ORF1主要编码Rep蛋白,该蛋白是病毒复制过程中必需的非结构蛋白[11];ORF3基因位于ORF1区域之内,但是与ORF1的转录方向相反,ORF3编码一种病毒复制所非必需的非结构蛋白,但是其可以诱导宿主细胞的凋亡[12-13];ORF4位于ORF3基因的内部,编码方向与ORF3相同,其也不是病毒复制所必需的[14];ORF5、ORF7、ORF10与ORF1在5′-3′方向相同,位于病毒基因组的负链上,ORF6、ORF8、ORF9、ORF11 与ORF2、ORF3、ORF4在5′-3′方向相同,位于病毒基因组互补链上,并且这些阅读框互相重叠,使PCV2的遗传信息得到充分表达[10]。ORF2主要编码Cap蛋白,Cap蛋白分子量大小约27. 8 ku,由233个~234个氨基酸构成,该蛋白是PCV2唯一的结构蛋白,完整的病毒颗粒由Cap蛋白包裹病毒基因组而形成,以及该蛋白与猪圆环病毒2型的感染与免疫有着密切关系[15]。因此,Cap蛋白常常作为研发PCV2疫苗和PCV2检测方法的目的蛋白[16-18]。本研究主要以PCV2的ORF2基因为参考序列,以PCV2毒株(CAU0673)的DNA为模板,设计了编码Cap蛋白的表达引物,诱导表达该氨基酸片段,并对表达产物进行鉴定,探讨该重组蛋白的反应原性,为后续的诊断方法或试剂盒开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 pET30a(+)载体,Novagen公司产品;即用型透析袋,Spectrum公司产品;Ni-NTA树脂,Qiagen公司产品;PCV2毒株(CAU0673),中国兽药监察所保存;PCV2阳性血清、NA-PRRSV阳性血清,VMRD公司产品;PPV1阳性血清,猪细小病毒灭活疫苗(WH-1株,购于中牧实业股份有限公司)制备的高免阳性血清;NA-PRRSV-N重组蛋白、PPV1-VP2重组蛋白,家畜疫病病原生物学国家重点实验室抗体工程课题组实验室制备;Trans109感受态和BL21(DE3)感受态,抗体工程课题组实验室保存。
1.1.2 主要试剂 DNA Marker DL 2 000、蛋白分子质量标准、BamH Ⅰ、XhoⅠ限制性酶,TaKaRa公司产品;质粒小量制备试剂盒、DNA胶回收试剂盒、PCR清洁试剂盒,AxyPrep公司产品;TaqDNA聚合酶,Fermentas公司产品;异丙基-β-D-硫代半乳糖甘(IPTG)、辣根过氧化物酶(HRP)标记兔抗猪IgG,Sigma公司产品;蛋白胨、酵母提取物, Oxoid(英国)公司产品;卡那霉素,Hyclone公司产品;其他试剂为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank公布的PCV2的ORF2基因为参考序列(登录号:DQ235696),设计Cap蛋白编码区的表达特异性引物,在上游引物加上BamH I限制性酶切位点,在下游引物加上XhoI限制性酶切位点。上游引物P1:5′-CGCGGATCCATGACGTATCCAAGGAGGCGTTTC-3′;下游引物P2:5′-CCGCTCGAGTCTTAGGGTTAAGTGGGGGGTCTTT-3′,引物由Invitrogen(上海)公司合成。
1.2.2 病毒DNA提取与PCR扩增 按照TaKaRa公司 MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0试剂盒的操作说明提取PCV2毒株(CAU0673)DNA,以抽提的DNA为模板,采用50 μL反应体系,即Ex-Taq酶25 μL,上、下游引物各1 μL,模板 2.5 μL,补水至50 μL。反应程序为:94 ℃ 5 min;94 ℃ 30 s,58 ℃30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。取10 μL扩增产物进行10 g/L琼脂糖凝胶电泳,凝胶成像系统观察,用DNA凝胶回收试剂盒回收目的片段,样品置-20 ℃保存。
1.2.3 pET30a-PCV2-ORF2重组载体的构建与鉴定 利用BamH I和XhoI分别对pET30a(+)载体和DNA凝胶回收产物进行酶切反应,反应体系为:PCR胶回收产物或pET30a(+)载体20 μL,10×K buffer 3 μL,BamH I 2 μL,XhoI 2 μL,ddH2O 3 μL,总体积为30 μL。轻微振荡混匀,瞬时离心,先放入30 ℃水浴3 h,再37 ℃水浴3 h。酶切产物经T4连接酶16 ℃连接过夜,取连接产物转化于Trans109大肠埃希菌感受态细胞,涂布于含卡那霉素抗性的LA平板上,37 ℃培养12 h,挑取单菌落过夜培养,离心收菌,质粒提取试剂盒提取质粒,对质粒进行BamH I、XhoI酶切鉴定,将构建成功的pET30a-PCV2-ORF2重组质粒转入大肠埃希菌BL21(DE3)感受态细胞,并按上述相同方法培养,提取质粒,对质粒分别进行PCR鉴定和BamH I、XhoI酶切鉴定,反应产物进行10 g/L琼脂糖凝胶电泳,同时将阳性重组质粒送往GENEWIZ(金唯智)公司进行测序。
1.2.4 重组蛋白表达及SDS-PAGE电泳鉴定 分别设置终浓度为0.5、1、2 mmol/L的IPTG,诱导温度为25、30、37 ℃,诱导时间为6、12、24 h,优化诱导表达条件;将筛选出的阳性重组质粒的表达菌(即大肠埃希菌BL21(DE3)感受态)于37 ℃振荡培养约3 h,至OD nm 600值为0.6~1.0时,加入终浓度为1 mmol/L IPTG于37 ℃诱导6 h,12 000 r/min离心收菌,ddH2O悬浮洗涤,对菌体进行SDS-PAGE电泳分析,观察重组蛋白表达情况,再对重组菌体悬浮液进行超声破碎,离心收集上清裂解液和沉淀,分别进行SDS-PAGE电泳分析,分析重组蛋白的存在方式。
1.2.5 重组蛋白Ni-NTA树脂纯化及复性 按照QIAGEN公司的Ni-NTA树脂使用说明书对以包涵体形式表达的重组蛋白分别用包涵体洗涤缓冲液(pH8.0)、2 mol/L尿素洗涤2次~3次,离心弃上清液保留沉淀,再用buffer B(pH8.0)溶解包涵体沉淀,离心弃沉淀保留上清液。将样品与Ni- NTA树脂室温结合40 min,上柱,然后分别用buffer C(pH6.3)、buffer D(pH5.9)、buffer E(pH4.5)洗涤柱子,并分别收集对应积份,对每个积份进行SDS-PAGE分析,确定目的蛋白存在于何种积份,并测定含有目的蛋白条带积份的OD 280 nm值。再将纯化后的蛋白液依次放于8、4、2、1 mol/L尿素、PBS液中进行透析复性,每种透析液透析时间为6 h,最后对复性蛋白进行SDS-PAGE分析。
1.2.6 重组蛋白的Western blot分析 纯化的复性重组蛋白经SDS-PAGE电泳后,转印至PVDF膜,50 g/L脱脂奶粉室温封闭1 h,加PCV2阳性血清(1∶100稀释)于室温摇床孵育1 h,PBST缓冲液洗涤PVDF膜3遍,再加HRP标记的猪二抗(1∶5 000稀释)于室温摇床孵育1 h,PBST缓冲液洗PVDF膜3遍,HRP-DAB底物显色试剂避光显色10 min,暗室中曝光,同时设pET30a空载体诱导表达菌作为阴性对照;采用上述相同的方法将复性PCV2-Cap重组蛋白与复性NA-PRRSV-N重组蛋白,复性PCV2-Cap重组蛋白与复性PPV1-VP2重组蛋白分别转印至2张PVDF膜,脱脂奶粉封闭,分别加猪繁殖与呼吸综合征病毒(NA-PRRSV)阳性血清(1∶100稀释)、猪细小病毒1型(PPV1)阳性血清(1∶100稀释)作为一抗,再加HRP标记的兔抗猪二抗(1∶5 000稀释),显色曝光。
2 结果
2.1 PCR扩增结果
以PCV2毒株(CAU0673)DNA为模板,P1、P2为引物,扩增获得1条约702 bp的目的片段,而阴性对照组无目的片段(图1),与预期结果相符合。
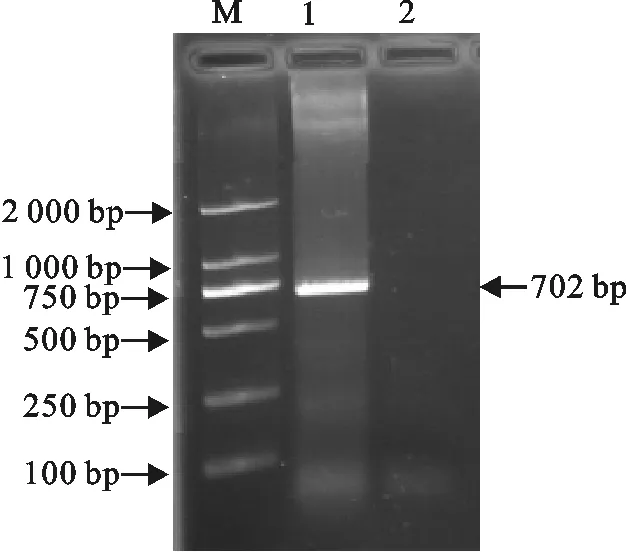
M.DNA 标准DL 2 000;1.PCV2-ORF2的PCR扩增产物;2.阴性对照
2.2 重组质粒的鉴定结果
构建的重组质粒pET30a-PCV2-ORF2经PCR鉴定,获得702 bp的部分ORF2基因目的片段,而阴性对照无目的条带(图2);重组质粒经BamH I、XhoI酶切鉴定,获得702 bp的ORF2基因片段和5 422 bp的pET30a(+)载体片段(图3)。

M.DNA 标准DL 2 000;1、2重组质粒pET30a-PCV2-ORF2(BL21)PCR产物; 3、4.重组质粒pET30a-ORF2(Trans109)PCR产物;5.阴性对照
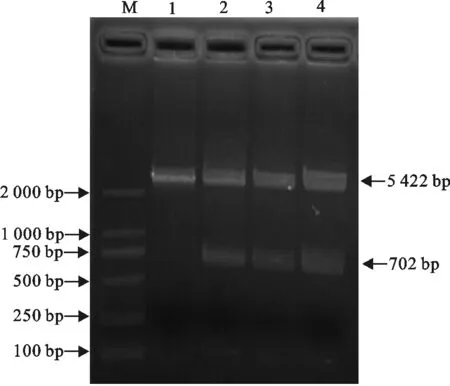
M.DNA 标准DL 2 000;1.pET30a-PCV2-ORF2重组质粒;2~4. pET30a-PCV2-ORF2用BamH I和Xho I双酶切产物
2.3 重组蛋白表达、Ni-NTA树脂纯化及复性结果
大肠埃希菌BL21(DE3)表达菌在IPTG终浓度为1 mmol/L、诱导温度37 ℃、诱导时间6 h的条件下,进行诱导表达,经SDS-PAGE电泳分析,发现表达产物的分子质量约为34 ku,与理论值相一致,同时发现目的蛋白主要以包涵体形式存在(图4),Ni-NTA树脂纯化的目的蛋白主要集中于E2~E7积份,其中在E2-E5阶段出现较集中的洗脱峰(图5和图6)。
2.4 重组蛋白的Western blot分析结果
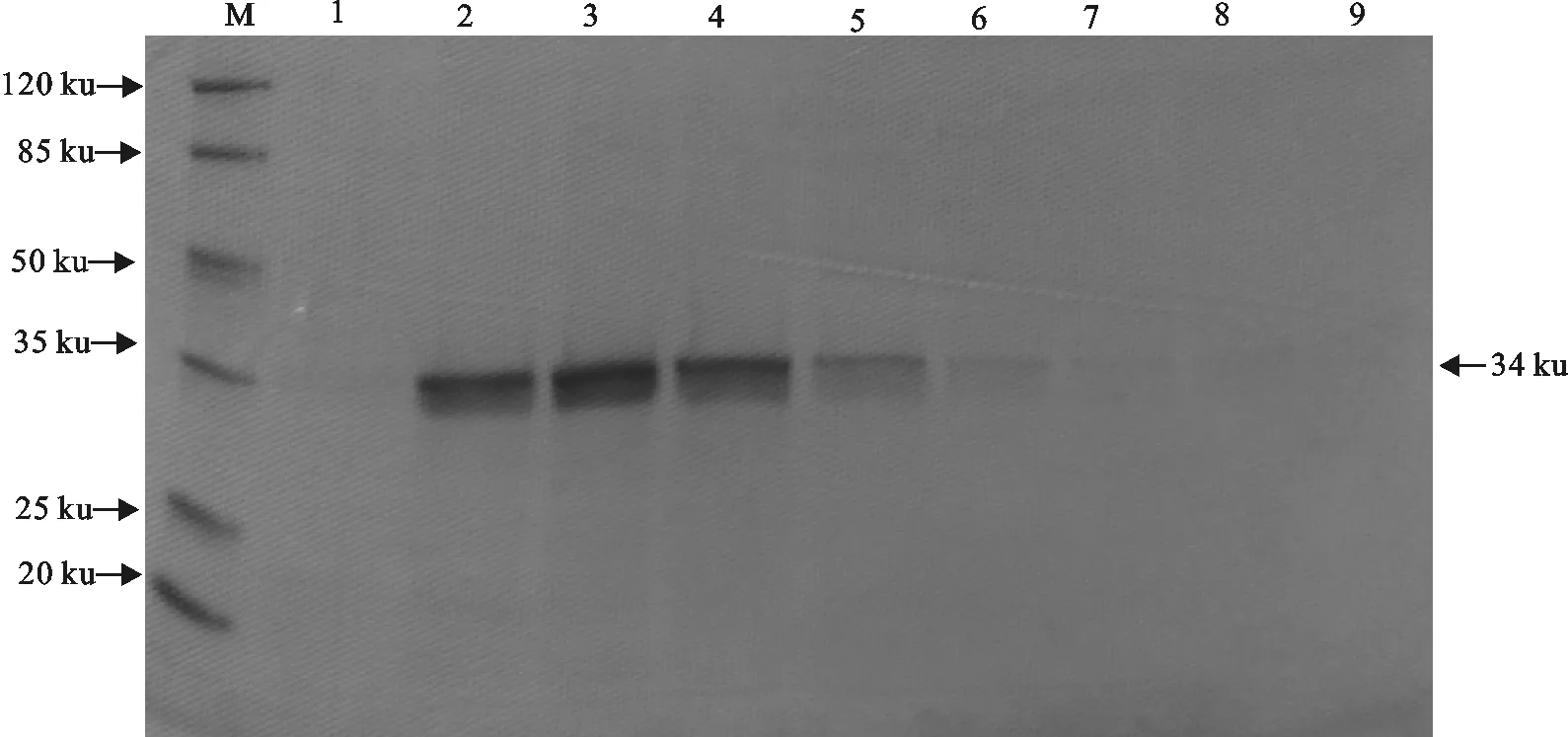
PCV2-Cap重组蛋白经SDS-PAGE电泳分离后转印至PVDF膜,用PCV2阳性血清检测重组蛋白的反应原性。结果表明,在34 ku处出现特异性的显色条带,而pET30a空载体处无特异性条带(图7)。因此,PCV2-ORF2重组蛋白与PCV2阳性血清发生特异性反应,具有良好的反应原性。同时,复性后的纯化重组蛋白不与PPV1、NA-PRRSV阳性血清发生交叉反应,这表明该重组蛋白具有很好的特异性(图7)。
3 讨论
猪圆环病毒2型作为严重影响国内外养猪业发展的重要病原之一,猪感染该病毒后,其免疫机能及生产机能降低,常常发生坏死性淋巴结炎、繁殖障碍、呼吸道综合征和坏死性肺炎、猪皮炎肾病综合征、增生性肠炎、渗出性表皮炎等多系统疾病[19]。
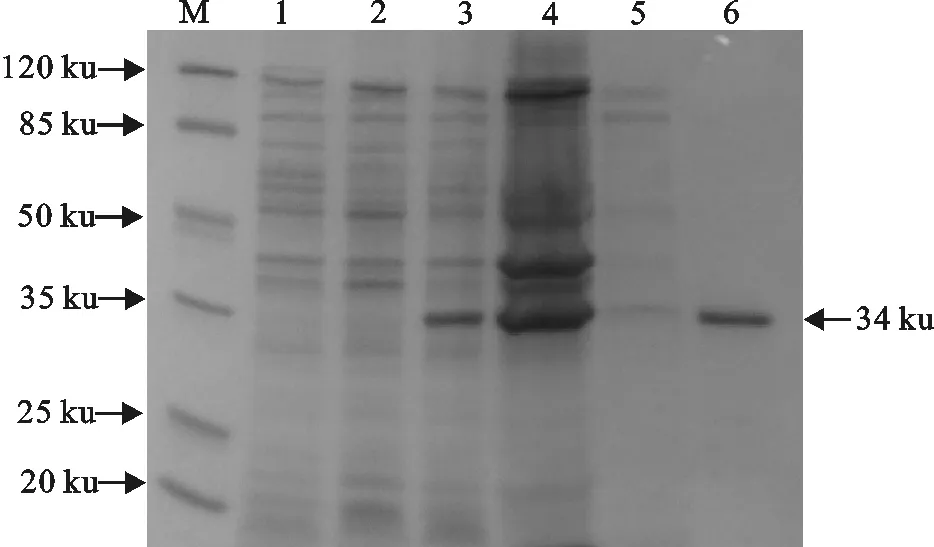
M.蛋白分子质量标准;1.pET30a空载体;2.pET30a-PCV2-ORF2(BL21)诱导前菌体;3.pET30a-PCV2-ORF2(BL21)诱导超声破碎后沉淀;4.pET30a-PCV2-ORF2(BL21)诱导后菌体;5.pET30a-PCV2-ORF2(BL21)诱导、超声破碎后上清液;6.纯化后复性PCV2-Cap蛋白
M.蛋白分子质量标准;1.E1液;2.E2液;3.E3液;4.E4液;5.E5液;6.E6液;7.E7液;8.E8液;9.E9液

图6 各积分的蛋白浓度
由于透明带作用的消失,病毒感染胚胎后,导致胚胎或胎儿死亡[20]。由ORF2编码的Cap蛋白作为病毒唯一的结构蛋白,常用于PCV2疫苗和诊断方法的研究。徐文娟等[21]采用细菌展示技术(APEx) 系统的筛选位于PCV2b-Cap蛋白上的抗原表位,为该蛋白的深入研究奠定了基础。张璐等[22]对非核定位信号区的Cap蛋白进行了诱导表达纯化,并制备单克隆抗体,分析了该区域的抗原表位,为PCV2在胚胎孵育过程中,血清学诊断和抗原检测奠定了基础。目前,有学者采用杆状病毒系统、枯草芽胞杆菌等对Cap蛋白进行表达研究[23-24]。大肠埃希菌表达载体作为非常成熟的表达载体,其拥有生长速度快、便于培养等特点,并且其中的pET30a载体可用于目的基因的大量诱导表达[25]。

1,2,6,8.PCV2-Cap重组蛋白;3,4,7.pET30a空载体;5.NA-PRRSV重组N蛋白; 9.PPV1-VP2重组蛋白
本试验通过扩增PCV2-ORF2基因(长度为702 bp),构建pET30a-PCV2-ORF2重组表达载体,BamH I、XhoI酶切鉴定呈阳性。重组大肠埃希菌表达系统在IPTG的诱导下,诱导表达出大小约为34 ku的重组Cap蛋白,研究发现目的蛋白以包涵体形式存在。通过Ni-NTA树脂对包涵体蛋白进行纯化,得到较高纯度的目的重组蛋白,并对纯化后蛋白进行复性处理;研究发现,复性后的重组蛋白纯度高于复性前,由于蛋白复性是一个非常复杂的过程,这可能是重组蛋白在恢复高级结构的过程中,在蛋白疏水键的形成以及透析膜的滤过等作用下,对重组蛋白完成了一定程度的纯化作用[26]。重组Cap蛋白与PCV2阳性血清进行Western blot反应呈阳性,表明该重组蛋白具有很好的反应原性,与NA-PRRSV、PPV1阳性血清Western blot反应呈阴性,表明不与NA-PRRSV、PPV1阳性血清发生交叉反应。因此,该重组Cap蛋白可被用于猪圆环病毒2型的诊断方法或试剂盒的后续研究,为猪圆环病毒2型的防控和诊断奠定了基础。
[1] 刘 辉,赵宏坤,柴同杰.一种新猪病:猪圆环病毒感染[J].畜牧与兽医,2002,34(11):41-43.
[2] Tischer I,Rasch R,Tochtermann G.Characterization of papovavirus and picornavirus-like particles in permanent pig kidney cell lines[J].Zenibl Bukt,1974,226(2):153-167.
[3] Allan G,McNeilly F,Cassidy J,et al.Pathogenesis of porcine circovirus;experimental infections of colostrum deprived piglets and examination of pig foetal material[J].Vet Microbiol,1995,44(1):49-64.
[4] Saha D,Lefebvre D J,Ducatelle R,et al.Outcome of experimental porcine circovirus type 1 infections in mid-gestational porcine foetuses[J].BMC Vet Res,2011,7(1):64-69.
[5] Sorden S D.Update on porcine circovirus and postweaning multisystemic wasting syndrome (PMWS)[J].Swine Health Prod,2000,8(3):133-136.
[6] 贾 赟,芦银华,张素芳,等.猪圆环病毒2型,猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[7] 韩银涛,刘剑锋,王建辉,等.猪伪狂犬病毒与猪圆环病毒2型混合感染的诊治[J].中国动物保健,2016,18(1):34-37.
[8] 周俐兵,樊 银.猪圆环病毒和PRRSV在断乳仔猪群中并发感染[J].畜牧与兽医,2003,35(9):34-35.
[9] 温永俊,蔡雪辉.猪繁殖与呼吸综合征病毒和猪圆环病毒2型混合感染研究进展[J].中国预防兽医学报,2006,28(6):720-724.
[10] 代振江,王伟丞,曾智勇,等.猪圆环病毒基因组结构与功能研究进展[J].畜牧与兽医,2016(3):151-154.
[11] Cheung A K.Porcine circovirus:Transcription and DNA replication[J].Virus Res,2012,164(1):46-53.
[12] Liu J,Chen I,Du Q,et al.The ORF3 protein of porcine circovirus type 2 is involved in viral pathogenesisinvivo[J].J Virol,2006,80(10):5065-5073.
[13] Liu J,Chen I,Kwang J.Characterization of a previously unidentified viral protein in porcine circovirus type 2-infected cells and its role in virus-induced apoptosis[J].J Virol,2005,79(13):8262-8274.
[14] 高章照.猪圆环病毒II型ORF4表达缺失株的构建及其功能研究[D].浙江杭州:浙江理工大学,2013:8-25.
[15] Nawagitgul P,Morozov I,Bolin S R,et al.Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J].J Gene Virol,2000,81(9):2281-2287.
[16] 张挺杰,刘 星,孙 涛,等.表达猪圆环病毒2型ORF2基因的重组猪繁殖与呼吸综合征病毒的构建与鉴定[J].病毒学报,2015,31(1):65-73.
[17] 赵晓云,乔绪稳,陈 瑾,等.利用E.coli表达猪圆环病毒2型Cap蛋白生产病毒样颗粒疫苗[J].中国农业科学,2015,48(5)976-986.
[18] 吴 洋,李庆伟,杨娜娜.猪PCV-2 ORF2蛋白I-ELISA检测方法的建立及猪场血清抗体检测分析[J].免疫学杂志,2015(1):71-73.
[19] Segalés J,Rosell C,Domingo M.Pathological findings associated with naturally acquired porcine circovirus type 2 associated disease[J].Vet microbiol,2004,98(2):137-149.
[20] Mateusen B,Maes D,Van Soom A,et al.Effect of a porcine circovirus type 2 infection on embryos during early pregnancy[J].Theriogenology,2007,68(6):896-901.
[21] 徐文娟,张瑛杰,李青青,等.利用细菌展示技术系统地筛选猪圆环病毒2型衣壳蛋白的线性抗原区域[J].中国预防兽医学报,2016,38(5):398-402.
[22] 张 璐,王延群,郝立沙,等.猪圆环病毒2型Cap蛋白单克隆抗体制备及线性抗原表位鉴定[J].中国预防兽医学报,2014,36(4):310-313.
[23] 张 晓,尹秀凤,徐 凯,等.猪圆环病毒2型Cap蛋白在杆状系统中的表达与纯化[J].中国动物传染病学报,2015(4):53-56.
[24] 陈灵艳,陈先进,蒋 烨,等.猪圆环病毒衣壳蛋白在枯草芽孢杆菌中的表达研究[J].生物技术通报,2016,32(5):140-145.
[25] 张云鹏,温 彤,姜 伟.大肠杆菌和酵母表达系统的研究进展[J].生物技术进展,2014,4(6):389-393.
[26] 应莲芳.包涵体蛋白复性技术研究进展[J].微生物学免疫学进展,2012,40(2)84-88.
Prokaryotic Expression of ORF2 Gene Fragment of Porcine Circovirus Type 2 and the Reactinogenicity Analysis of the Expressed Protein
OU Yun-wen1,2,MA Xiao-yuan2,WANG Jun2,DING Yao-zhong2,ZHANG Yong-guang2,ZHANG Jie2
(1.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou,Gansu,730070,China;2StateKeyLaboratoryofVeterinaryEtiologicalBiology,LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou,Gansu,730046,China)
This experiment was aimed to study the antigenicity of Cap protein of porcine circovirus type 2(PCV2).The gene was amplified from the DNA of PCV2-CAU0673 strain by PCR,whose product was approximately 702 bp.The product was cloned into pET30a(+)vector,PCR,digestion and sequencing were used to identify positive plasmid.The positive recombined plasmid was expressed byE.coliBL21 (DE3) and was induced by IPTG.The recombinant protein was purified by Ni-NTA and refolding.The results of SDS-PAGE showed that the recombined protein was successfully expressed inE.coliBL21 (DE3) with a relative molecular weight of 34 ku.The results of Western blot showed that this recombined protein was specifically reacted with PCV2 positive serum;no cross reacted with NA-PRRSV and PPV1 positive serum.The recombinant vector pET30a-PCV2-ORF2 was successfully constructed,and the recombined Cap protein with excellent reactinogenicity was successfully expressed inE.coliwhich laid a foundation for the diagnosis of PCV2.
Porcine circovirus type 2;ORF2 gene;prokaryotic expression;reactinogenicity
2016-07-28
国家国际合作项目 (2012DFG31890);国家自然科学基金项目(31072143) 作者简介:欧云文(1990-),男,重庆人,硕士,主要从事人兽共患病及公共卫生学研究。
S852.659.2
A
1007-5038(2017)04-0001-06
*通讯作者
