分泌超高血清AFP胃肝样腺癌1例并文献复习
2017-04-13陈青娟司小敏
毛 维 陈青娟 司小敏 张 消 蒋 成
·个 案·
分泌超高血清AFP胃肝样腺癌1例并文献复习
毛 维 陈青娟 司小敏 张 消 蒋 成
胃肝样腺癌(Hepatoid adenocarcinoma of the stomach,HAS)属于胃癌中较为罕见的一种病例类型,恶性程度极高,预后差,易发生肝脏及淋巴结转移。本文报道1例近期发生的胃肝样腺癌病例,以期提高临床医师对这类疾病的认识和积累治疗经验。
胃肝样腺癌;甲胎蛋白;免疫组化
胃肝样腺癌(Hepatoid adenocarcinoma of the stomach,HAS)是一种罕见的特殊病理类型的胃癌,文献报道该病的发病率仅占普通胃癌的0.38%~1%[1-2]。HAS的组织形态与肝细胞癌相似,常伴有血清甲胎蛋白(AFP)的异常升高[3],故容易与原发性肝癌混淆,该病理类型的胃癌易发生血管淋巴管浸润,淋巴结、肝脏等远处器官的转移,预后极差。由于该病发病率较低,目前尚无标准化的治疗方案,现就近期遇到的1例分泌超高AFP的HAS进行报道,以期为临床医生对该病的诊断和治疗提供一定的理论依据。
1 病历资料
患者,女,51岁,既往无肝炎病史。因“上腹部胀痛1月余”行上腹部增强CT(图1):肝内多发低密度影,增强呈环形强化,多考虑肝转移瘤;肝门区及肝胃间隙多发椭圆形软组织密度影,增强呈环形强化,多考虑淋巴结转移。为明确原发灶,行胃镜检查,结果提示:胃角破坏,见巨大深溃疡,底不平,被污秽苔,周围黏膜结节状病灶侵及胃体侧胃窦小弯侧。胃镜活检病理示(图2)“胃角”病变中可见肝样分化区及腺癌区,结合免疫组化结果提示胃肝样腺癌。免疫组化:TTT-1(-),Glypican-3(+),AFP(+),α1-抗胰蛋白酶(α1-AAT)(+),α1-抗糜蛋白酶(α1-ACT)(+),CK19(+),CK20(-),CDX2(1+)。免疫荧光检测示Her-2阳性。检测肿瘤标志物提示:AFP 12 100 ng/mL,CEA 5.90 ng/mL。因患者血清AFP值极高,不能排除胃癌及肝癌双原发癌的可能,故进一步行肝脏包块穿刺活检,病理提示:肝内包块中分化腺癌,组织形态与胃角病变相似,符合胃癌肝转移。因该类型的胃癌较为罕见,目前尚无标准化疗方案,考虑到患者胃角巨大溃疡,口服替吉奥或者卡培他滨出血风险高,结合中国人民解放军301医院肿瘤内科专家意见,为患者选择FOLFOX6方案化疗+赫赛汀靶向治疗。但因患者经济条件有限,化疗同时没有加用赫赛汀靶向治疗。化疗3周后复查上腹部增强CT(图3)提示肝脏病灶较前增大、增多,AFP仍维持在12 100 ng/mL。提示原方案无效,需更换化疗方案,考虑到患者肝脏多发病变,口服药物存在肝脏首过效应,可以更好地作用于肝脏病变,故换用SP方案化疗1周期。化疗后复查上腹部CT提示病灶进一步增多,肝功能明显恶化,考虑病情进展,综合考虑后给予对症支持治疗,患者于初诊后3月因肝性脑病治疗无效死亡。
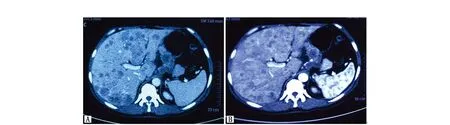
图1 上腹部增强CT(化疗前)Figure 1 Enhanced CT(Pre-chemotherapeutic)
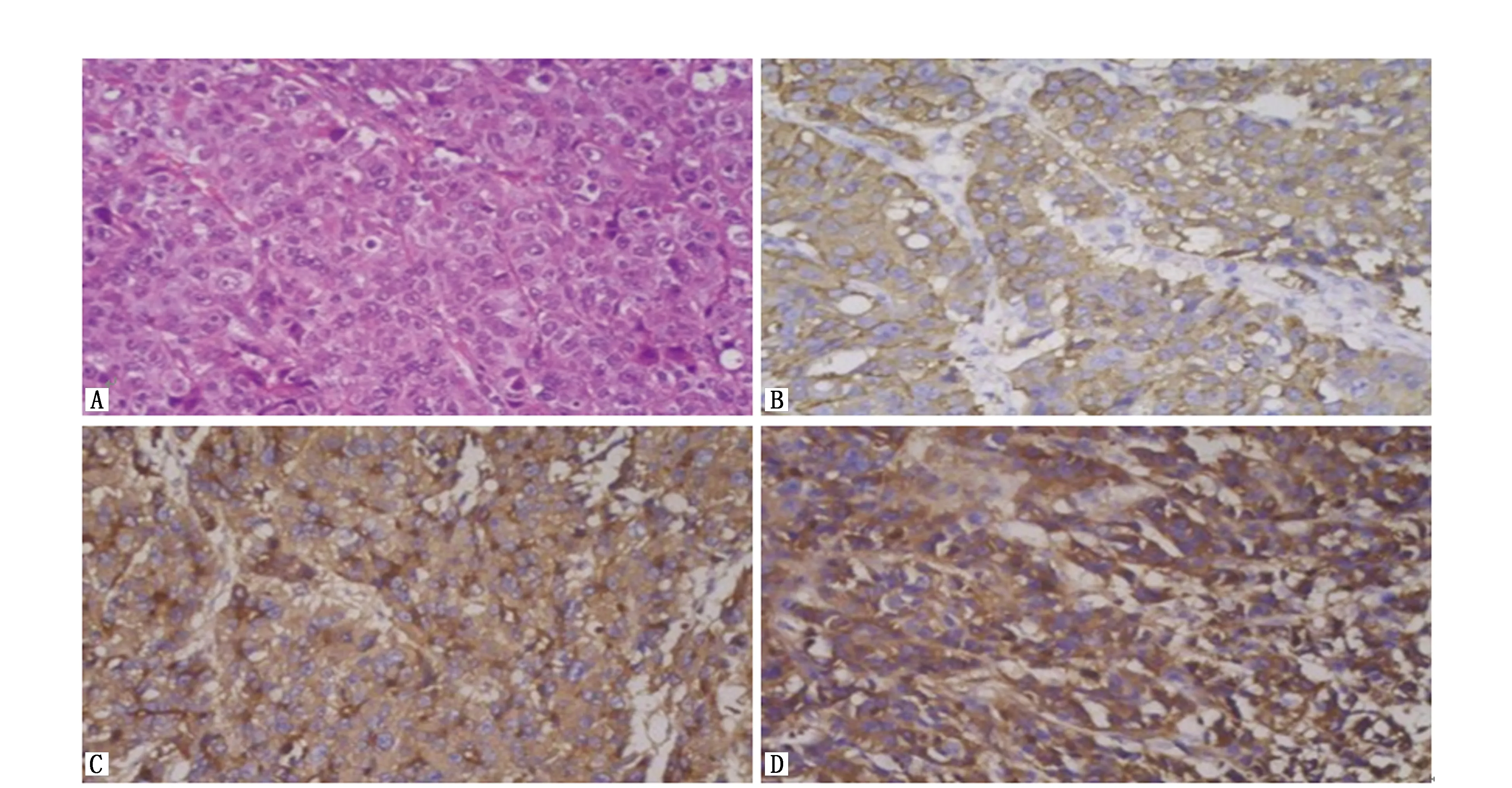
图2 组织化学和免疫染色结果Figure 2 Histochemical and immunostaining results
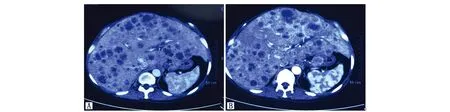
图3 上腹部增强CT(化疗后)Figure 3 Enhanced CT(After chemotherapy)
2 讨论
Ishikura等[4]在1985年首次提出HAS的概念,HAS好发于中老年人,男性多于女性,男女之比为2.32∶1,平均发病年龄约为63.5岁,病变多位于胃窦部[5]。胃肝样腺癌易发生血管、淋巴管浸润,淋巴结转移和肝转移,其肝转移率高达75.6%,5年生存率仅为9%。血清AFP的高表达是HAS的特征性表现,以往国内外文献报道的最高值为8 189.0 ng/mL[6],本例AFP数值为12 100 ng/mL,经治疗后AFP居高不下,与肝脏病变及病情呈正相关,故动态监测血清AFP的变化可评价治疗效果及预测其复发风险[7]。HAS诊断的金标准是组织形态学特征及免疫组化,在病理切片中必须有胃腺癌分化区及肝细胞癌样分化区两个区域,二者之间相互移形过渡。其中肝样分化区中肿瘤细胞的形态特点及排列方式与原发性肝癌相似,细胞体积较大,卵圆形或多角形,胞浆丰富,呈嗜酸性,细胞以小梁状、腺管状或巢状的方式排列,巢和小梁间富于纤维血窦[8]。免疫组化在肝样分化区的瘤细胞内AFP、α1-AAT和α1-ACT以及Glypican-3呈阳性表达,部分CK19呈阳性,原位杂交在瘤细胞内可检测到血清白蛋白mRNA[9]。本例患者的免疫组化表现为AFP、α1-AAT、α1-ACT和Glypican-3呈阳性表达,支持胃肝样腺癌的诊断。当HAS发生淋巴结及肝转移时,其转移的肿瘤组织在形态上难以与原发性肝癌相区别,但两者的预后明显不同,因此有必要予以鉴别,避免误诊,其鉴别要点如下:(1)原发性肝癌大多有乙肝或丙肝病史,或合并有肝硬化,而转移性肝癌影像学多表现为多发结节,肝脏没有基础病变;(2)原发性肝癌无乳头状及管状结构,而绝大多数HAS与乳头状或管状腺癌共存;(3)HAS原发肿瘤在胃黏膜向浆膜层呈浸润生长,而原发性肝癌转移至胃壁者首先侵犯胃浆膜层,呈结节状、膨胀性凸向黏膜层;(4)虽然HAS和原发性肝癌免疫组化染色均可表达AFP,但HepaPr1一般在HAS中呈阴性表达,而在原发性肝癌中多呈阳性,其次,HAS中α1-抗胰蛋白酶(α1-AAT)和α1-抗糜蛋白酶(α1-ACT)以及Glypican-3呈阳性表达,而原发性肝癌呈阴性。
HAS早期病变患者以胃癌根治术为主,可同时切除肝脏转移灶。术后可联合化疗、分子靶向治疗等综合治疗。但HAS发现时大部分已处于晚期,治疗主要以姑息化疗为主,但胃肝样腺癌对化疗药物的敏感性与普通胃癌不同,故目前尚缺乏标准的化疗方案,根据文献报道,可选用紫杉类、铂类、5-Fu及其口服制剂的组合方案化疗。Hiromitsu等[6]报道了1例HAS伴肝多发转移的病人,通过应用S-1加紫杉醇方案,使其转移病灶大大缩小,AFP降至正常水平,病人的生活质量得以提高。另周少飞等[10]报道1例局部晚期伴有肝转移的患者,先给予4周期多西他赛+奥沙利铂+替吉奥+贝伐珠单的新辅助化疗后肿瘤缩小,之后行根治性全胃切除术+胰体尾部切除+脾切除+横结肠部分切除+肝部分切除术,术后给予FOLFIRI方案辅助化疗,随访1年无复发。Shimada等[11]用伊立替康联合低剂量顺铂方案治疗2例有多发肝脏转移的HAS患者,使得肝转移灶达到CR水平,血清AFP降至正常。该病例中病人使用FOLFOX6方案化疗1周期后病情出现进展,更换为SP方案后病情仍不能控制,提示常规的奥沙利铂或顺铂联合氟尿嘧啶的方案治疗无效,分析其原因可以分为两点,一是患者发病时已处于晚期,治疗效果差,预后差;二是该病理类型的胃癌恶性程度极高,对化疗药物敏感性差。这些临床经验提示我们应当将普通胃癌与胃肝样腺癌区别开来,有条件的情况下可以检测肿瘤对各种化疗药物的敏感性,通过药敏实验筛选合适的化疗药物进行治疗。该患者Her-2检测阳性,但因经济原因未能使用赫赛汀治疗,关于胃肝样腺癌的靶向治疗国内外文献中也报道较少,故化疗联合赫赛汀的分子靶向治疗疗效尚需要进一步的研究。
综上所述,HAS是胃癌中非常特殊且少见的一种类型,易发生转移,预后差,故早发现早治疗是获得长期生存的关键所在。临床医生应注意将HAS与原发性肝癌及生殖胚胎性细胞肿瘤相鉴别,避免因误诊延误治疗。HAS在治疗上应将根治术做为首选方案,若发现时已属于晚期,可采用静脉化疗、肝转移瘤的介入化疗及分子靶向治疗等在内的多学科综合治疗模式。
1 Liu X,Cheng Y,Sheng W,et al.Analysis of clinicopathologic features and prognostic factors in hepatoid adenocarcinoma of the stomach[J].Am J Surg Pathol,2010,34(10):1465-1471.
2 Kumashiro Y,Yao T,Aishima S,et al.Hepatoid adenocarcinoma of the stomach:histogenesis and progression in association with intestinal phenotype[J].Hum Pathol,2007,38(6):857-863.
3 侍孝红,王前玉,陈焰,等.5例胃肝样腺癌临床病理分析[J].现代肿瘤医学,2010,18(10):2012-2014.
4 Ishikura H,Fukasawa Y,Ogasawara K,et al.An AFP-producing gastric carcinoma with features of hepatic differentiation.A case report[J].Cancer,1985,56(4):840-848.
5 Liu XM,Chen GQ,Li SL,et al.Hepatoid adenocarcinoma of the stomach:A case report and literature review[J].Exp Ther Med,2015,9(6):2133-2136.
6 Takeyama H,Sawai H,Wakasugi T,et al.Successful paclitaxel-based chemotherapy for an alpha-fetoprotein-producing gastric cancer patient with multiple liver metastases[J].World J Surg Oncol,2007,5(1):1-5.
7 Ye MF,Tao F,Liu F,et al.Hepatoid adenocarcinoma of the stomach:a report of three cases[J].World J Gastroenterol,2013,19(27):4437-4442.
8 贾静,陈剑,王华,等.胃肝样腺癌临床病理、免疫表型及预后分析[J].临床与实验病理学杂志,2014,10(4):443-446.
9 李楠,冯振中,谷从友,等.胃肝样腺癌的临床病理特征[J].中国组织化学与细胞化学杂志,2013,22(1):75-78.
10 周少飞,毛伟征.胃肝样腺癌1例并文献综述[J].临床普外科电子杂志,2013,50(4):46-47.
11 Shimada S,Hayashi N,Marutsuka T,et al.Irinotecan plus low-dose cisplatin for alpha-fetoprotein-producing gastric carcinoma with multiple liver metastases:report of two cases[J].Surg Today,2002,32(12):1075-1080.
(收稿:2016-04-02)
Alpha-fetoprotein-high-producing hepatoid adenocarcinoma of the stomach:A case report and literature review
MAOWei,CHENQingjuan,SIXiaomin,ZHANGXiao,JIANGCheng
Xianyang Center Hospital,Xianyang 712000,China
Hepatoid adenocarcinoma of the stomach(HAS)belongs to one of the rare cases in gastric cancer types,which has extremely high malignant degree and poor prognosis.Lymph node metastasis and liver metastasis are common in HAS.In this article,we reported alpha-fetoprotein-high-producing hepatoid adenocarcinoma of the stomach(HAS),and reviewed the related literature at home and abroad in order to improve clinical physicians understanding of these diseases and treatment experience.
Hepatoid adenocarcinoma of the stomach;Alpha fetoprotein;Immunohistochemistry
咸阳市中心医院(咸阳 712000)
毛维,女,(1989-),硕士,住院医师,从事肿瘤内科的研究。
陈青娟,E-mail:312871805@qq.com
R735.2
A
10.11904/j.issn.1002-3070.2017.01.008
