体素内不相干运动扩散加权成像在乳腺疾病诊断中的应用及进展
2017-04-13李卓琳丁莹莹
谢 瑜 李卓琳 丁莹莹
体素内不相干运动扩散加权成像在乳腺疾病诊断中的应用及进展
谢 瑜 李卓琳 丁莹莹
乳腺疾病;磁共振成像;扩散加权成像;体素内不相干运动;综述
扩散加权成像(DWI)已被广泛应用于乳腺疾病的检出及鉴别诊断;Le Bihan等[1]发现随扩散梯度因子(b)值变化的单指数模型计算出的表观扩散系数(ADC)值并不能完全反映组织的病理生理学表现。体素内不相干运动(intravoxel incoherent motion,IVIM)应用多b值采集图像测量DWI信号的衰减及ADC值,更加接近体内水分子的真正运动情况,既可以提供与水分子布朗运动相关的信息,还可以提供组织内血流灌注的相关信息。本文对IVIM的DWI在乳腺疾病诊断中的应用及进展作一综述。
1 基本原理
ADC值对DWI不同方向水分子扩散运动的速度和范围需采集2种b值的DWI图像,以体素为基础,进行线性拟合后计算回归斜率。在进行常规拟合时,假定DWI信号衰减为单指数衰减,与水分子的运动成比例,即SI=SI0exp(-bADC)。其中,SI代表有扩散加权信号强度,SI0代表无扩散加权信号强度。由2种b值计算ADC值,即ADC=ln(S1-S2)/(b2-b1)。S1及S2分别为2次b值时的体素内信号强度。肿瘤组织通常含有较高的细胞密度,故水分子扩散受限,在DWI图像上表现为高信号和一个较低的ADC值。 但研究发现,由单指数模型计算的ADC值并不能真实反映组织内水分子的生理学行为。原因在于DWI检测的水分子微观运动,不仅受到水分子扩散及组织结构的影响,还受到毛细血管网内血液微循环的影响。其既可以反映与水分子布朗运动相关较慢的扩散成分,又可以反映毛细血管网内分子大幅度运动相关的快速成分[2]。当使用单指数模型时,ADC值被高估。IVIM理论的双指数模型可以从水分子扩散中将血流灌注产生的假扩散剔除,使用拟合方法通过定量参数分析组织的扩散参数及微血管灌注参数。
IVIM理论的双指数模型即:
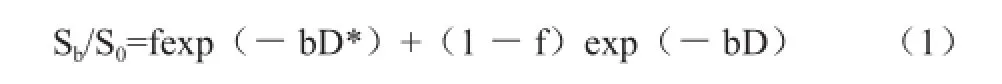
其中,S0及Sb表示b为0及b为其他值时的体素内信号强度;f为灌注分数,代表体素内微循环灌注效应扩散占总体扩散效应的容积率;D为扩散系数,代表体素内单纯的水分子扩散运动,又称慢池扩散;D*为假扩散系数,代表体素内微循环灌注相关扩散运动,又称灌注相关扩散或快池扩散。由于毛细血管网的伪随机性器官分布,毛细血管内的水分子随血流运动可视为无序的随机运动,即“假性扩散”,其与毛细血管网的结构及血流速度相关。当施加扩散敏感梯度时,毛细血管内血流灌注也可以引起体素内质子群相位不相干,导致ADC值偏高[3]。
应用IVIM可以同时获得D值、D*值及f值,用于量化DWI中的2种运动成分。由于空间分布和分子运动速度上的不同,D*较D高出数十个数量级。因此,D*在b值>200 s/mm2时灌注效应所产生的信号绝大部分已经衰减,其可能与体素内单纯的水分子扩散相关;而b值<200 s/mm2时DWI对微循环灌注效应更敏感,所测信号衰减的同时反映了组织内水分子的扩散和毛细血管网内水分子的假性扩散[4]。f值是由毛细血管和肿瘤组织信号强度的比值决定的。f值对所使用的最大b值较敏感。
2 影响成像的因素
Kwee等[5]运用多指数模型的DWI序列测量扩散参数更接近活体组织中水分子扩散的不均质性和多区间性,但不同研究者间所测数值仍存在差异,尤其是D*和f值,不同仪器、不同b值、患者情况以及计算方法等均可能导致上述差异。
IVIM的特点是在b值分布合理的前提下,其测量参数较为独立[6]。常规DWI所采用的单指数模型计算的ADC值包含了水分子的真性扩散和微循环灌注形成的假性扩散。当b值较低时,微循环灌注效应在ADC值中占较大比例,随着b值逐渐升高,ADC值中微循环灌注所占比例逐渐减小,使其更加真实地反映组织内的水分子扩散。但其缺陷是过高的b值导致图像信噪比明显降低,而且其测量数据重复、准确性较差,故限制了b值>1000 s/mm2的临床应用。研究发现对于临床相关的b值组合,不排除与排除低b值(<100 s/mm2)的ADC值最大偏倚为11.8%,说明b值的选择影响恶性乳腺病变的ADC值;然而,通过排除低b值,ADC值更接近双指数D值,说明微灌注影响扩散信号[7]。因此,当进行低b值的ADC值计算时需谨慎。
由于需要完成大范围的快池扩散及慢池扩散的衰减,IVIM序列需要采用多b值进行DWI。因检查时间较久,患者可能无法耐受而产生运动伪影,从而导致图像质量较差,在临床应用中受到一定的限制。
IVIM处理软件通过计算感兴趣区(ROI)内每个体素数值的平均值得出其相应数值。因此,在IVIM处理软件的设置方面,由于计算误差导致数据的溢出,D*值伪彩参数图中有较多的体素点为明显的假性高值,为不影响结果,在生成D*值伪彩图时设置上限参数,高于上限参数的体素点将会被剔除,这样才能得到较为可靠的ROI的D*值[8]。
研究发现,计算方法不同将会导致乳腺癌IVIM最终参数值的不同。若先估算D值,再计算D* 和f值,其结果与动态增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)灌注参数一致性更高[9]。
3 IVIM各参数在乳腺疾病诊断中的意义
浸润性导管癌的D值较传统单指数模型的ADC值低,其原因为:①恶性肿瘤细胞增殖旺盛,增加了细胞密度,从而使细胞外间隙减小;同时生物膜限制,大分子物质对水分子的吸附作用增强,阻止了恶性肿瘤细胞内水分子的有效运动,显著限制了扩散[10]。②由于D值消除了毛细血管内水分子扩散及血流灌注的影响,更真实地反映了细胞内水分子的扩散情况,因此浸润性导管癌的D值较良性病变及正常腺体组织明显降低。
D*值体现了毛细血管中血液的不相干运动,与平均毛细血管长度及平均血流速度成比例[11]。关于D*值的诊断价值的差异,可能与不同肿瘤的血管生成特点不一致有关。D*值较D值高出数十倍,因此在低b值时,D*值对于MRI信号的衰减更为敏感。D*值计算的准确度也会随着多b值序列中低b值部分的增加而相应升高。
浸润性导管癌的f值由毛细血管和肿瘤组织的信号强度比值决定。f值升高提示恶性肿瘤中具有更多的肿瘤新生血管,因此f值明显高于良性病变及正常的乳腺组织[12]。f值对b值范围敏感,当b值≤750 s/mm2时,f值随b值增加而增加;而当b值>750 s/mm2时,f值会降至与良性肿瘤或正常组织相似,甚至更低,因此不能用来鉴别良恶性病变。f值除与b值的大小相关外,还与回波时间相关,回波时间越长,低b值时组织信号衰减越明显,f值就越大[13]。
4 IVIM在乳腺疾病鉴别诊断中的应用价值
Liu 等[14]采用多b值IVIM显示正常乳腺组织、单纯型囊肿、乳腺良恶性病变的扩散及灌注特点,其中囊肿由简单的单指数模拟,ADC值和D值较高,且两者间差异无统计学意义。而单纯型囊肿由纯水组成而不含有毛细血管,故其f值较低;同时由于没有灌注效应对ADC值产生影响,故D值与ADC值间差异无统计学意义。而正常乳腺组织、良恶性病变呈非线性衰减过程,且当b值<200 s/mm2时,恶性病变的衰减速度明显快于正常乳腺组织及良性病变。所以对IVIM-DWI的b值组合,应该较多地选用<200 s/mm2,这对得到较准确的双指数模型参数至关重要。
Bokacheva等[15]采用IVIM鉴别乳腺良恶性病变及正常乳腺实质,得出恶性病变的f值为(6.4±3.1)%,明显高于良性病变的(3.1±3.3)%及正常乳腺实质的(1.5±1.2)%;D值为(1.29±0.28)×10-3mm2/s,明显低于良性病变的(1.56±0.28)×10-3mm2/s及正常乳腺实质的(1.86±0.34)×10-3mm2/s;D值与f值联合的诊断效能亦高于ADC值。
何杰等[16]采用多b 值双指数信号衰减模型的DWI(0、10、20、50、100、200、400、600、800、1000、1200、1500 s/mm2)对乳腺良恶性病变进行鉴别诊断。结果乳腺恶性病变的ADCslow值低于良性病变,而ADCfast值与良性病变之间无明显差异。分析原因,虽然乳腺恶性肿瘤较良性肿瘤细胞排列更紧密,细胞外间隙更窄,但可能由于微血管血流灌注的补充,使恶性肿瘤本应下降的ADCfast值趋向于与良性肿瘤相同;此外研究中乳腺纤维腺瘤占良性组的绝大多数,而纤维腺瘤是富血供肿瘤,因而乳腺良恶性病变ADCfast值差异无统计学意义。
梁玉玉等[17]采用IVIM理论的多b值DWI双指数模型,发现ADCslow值与传统DWI单指数模型ADC值对浸润性导管癌均有较高的诊断价值。但与传统ADC值相比,双指数模型ADCslow值诊断的敏感度(91.7%比87.5%)、特异度(81.8%比77.3%)及准确度(86.4%比77.3%)均有提高。
5 IVIM灌注参数与DCE-MRI灌注参数的相关性
IVIM中的f值和D*值均可以反映组织的血流灌注,常规DCE-MRI需静脉注射对比剂后才可显示病变组织内的血流灌注。关于IVIM的灌注参数与DCE-MRI灌注参数间的相关性在其他器官已有报道,表现为f值与组织的早期强化率、血流量、血流率呈正相关[18-19]。IVIM的灌注参数f值代表毛细血管的容积分数,而DCE-MRI的参数Vp也代表了组织内的血浆容积分数,因此,f值与Vp值间应存在相关性,也有研究发现f值与Vp值间呈正相关(r=0.88),提示f值可能比定量DCE-MRI的Vp值及常规的DCE-MRI更能反映肿瘤内的血管生成情况;由于恶性肿瘤中除含有较多的血管生成外,同时血管的通透性也增加,故f值与Ktrans、Kep间亦呈正相关,但f值与两者间的相关性低于其与Vp间的相关性[20]。
王庆军等[21]研究显示,联合使用DCE-MRI中的时间-信号强度曲线和IVIM中的D值(b值为0、10、20、50、100、200、300、400、600、800 s/mm2)可以较好地区分肿块样乳腺良恶性病变,其AUC值可高达0.99。
6 IVIM在乳腺癌分级及分子分型中的应用
不同组织学分级及分子分型的乳腺癌患者生物学特性和病理特征不同,其治疗方案及预后也会有差异。较低的ADC值与ER(+)、PR(+)及高Ki-67标记指数均有关[22]。邓丹琼等[23]也指出ADC值与乳腺癌病理组织学分级成反比。
刘春玲[20]研究显示D值与乳腺癌的分级呈负相关,即肿瘤级别越高,D值越低,其原因可能与肿瘤细胞的形态、排列及细胞外基质情况相关,而与肿瘤的细胞数量无关。D值可以反映细胞的构成,也间接反映了乳腺癌的组织学分级。该研究还发现D、f及D*值在乳腺浸润性导管癌1级和3级及2级和3级中存在明显差异。浸润性导管癌3级比浸润性导管癌1、2级的D值和D*值更低,f值更高,提示浸润性导管癌3级具有更多的肿瘤细胞及更多的肿瘤血管生成。
Sigmund等[24]发现HER2阳性乳腺癌患者的f值较HER2阴性患者高,激素受体阳性乳腺癌患者的f值较激素受体阴性低,但其差异均无统计学意义。
7 展望
IVIM使DWI既可以得到真性扩散系数,又可以在不使用对比剂的情况下得到灌注系数;可以提供水分子真正的扩散运动信息,还可以提供灌注信息,从而为评估肿瘤的生物学行为、预测肿瘤治疗的效果提供更多的帮助,为肿瘤良恶性的鉴别诊断及病理学特征提供了一种新的无创性检查方法。
[1] Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology, 1986, 161(2): 401-407.
[2] Mazaheri Y, Afaq A, Rowe DB, et al. Diffusion-weighted magnetic resonance imaging of the prostate: improved robustness with stretched exponential modeling. J Comput Assist Tomogr, 2012, 36(6): 695-703.
[3] 马婉玲. 体素内不相干运动扩散加权成像的临床应用进展. 功能与分子医学影像学(电子版), 2014, 3(1): 50-55.
[4] Yoon JH, Lee JM, Yu MH, et al. Evaluation of hepatic focal lesions using diffusion-weighted MR imaging: comparison of apparent diffusion coefficient and intravoxel incoherent motion-derived parameters. J Magn Reson Imaging, 2014, 39(2): 276-285.
[5] Kwee TC, Galbán CJ, Tsien C, et al. Comparison of apparent diffusion coeff i cients and distributed diffusion coeff i cients in highgrade gliomas. J Magn Reson Imaging, 2010, 31(3): 531-537.
[6] 王蕾, 王武. 体素内不一致运动磁共振成像的原理及临床应用.中日友好医院学报, 2014, 28(3): 176-178.
[7] Nilsen B, Fangberget A, Geier O, et al. Quantitative analysis of diffusion-weighted magnetic resonance imaging in malignant breast lesions using different b value combinations. Eur Radiol, 2013, 23(4): 1027-1033.
[8] 何杰. 体素内不相干运动扩散加权成像在乳腺病变中的应用.郑州:郑州大学, 2014.
[9] Suo S, Lin N, Wang H, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of breast cancer at 3.0 tesla: comparison of different curve-fitting methods. J Magn Reson Imaging, 2015, 42(2): 362-370.
[10] 朱萍, 王亚非, 黄昊, 等. MR扩散加权成像表观扩散系数在乳腺结节病变诊断中的应用价值. 中华放射学杂志, 2011, 45(12): 1117-1121.
[11] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1988, 168(2): 497-505.
[12] Sumi M, Van Cauteren M, Sumi T, et al. Salivary gland tumors: use of intravoxel incoherent motion MR imaging for assessment of diffusion and perfusion for the differentiation of benign from malignant tumors. Radiology, 2012, 263(3): 770-777.
[13] Pang Y, Turkbey B, Bernardo M, et al. Intravoxel incoherent motion MR imaging for prostate cancer: an evaluation of perfusion fraction and diffusion coefficient derived from different b-value combinations. Magn Reson Med, 2013, 69(2): 553-562.
[14] Liu C, Liang C, Liu Z, et al. Intravoxel incoherent motion (IVIM) in evaluation of breast lesions: comparison with conventional DWI. Eur J Radiol, 2013, 82(12): e782-e789.
[15] Bokacheva L, Kaplan JB, Giri DD, et al. Intravoxel incoherent motion diffusion-weighted MRI at 3.0T differentiates malignant breast lesions from benign lesions and breast parenchyma. J Magn Reson Imaging, 2014, 40(4): 813-823.
[16] 何杰, 张焱, 程敬亮, 等. 双指数模型 DWI在乳腺良恶性病变鉴别诊断中的价值. 实用放射学杂志, 2014, 30(7): 1137-1140.
[17] 梁玉玉, 朱蓉蓉, 哈若水. 比较双指数与传统单指数模型ADC值对浸润性导管癌诊断效能研究. 临床放射学杂志, 2014, 33(8): 1165-1169.
[18] Woo S, Lee JM, Yoon JH, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma: correlation with enhancement degree and histologic grade. Radiology, 2014, 270(3): 758-767.
[19] Federau C, O'brien K, Meuli R, et al. Measuring brain perfusion with intravoxel incoherent motion (IVIM): initial clinical experience. J Magn Reson Imaging, 2014, 39(3): 624-632.
[20] 刘春玲. 体素内不相干运动成像在乳腺病变中的应用研究. 广州:南方医科大学, 2014.
[21] 王庆军, 李小娟, 张静, 等. 磁共振体素内不相干运动对于肿块样乳腺良恶性病变的诊断价值. 中华临床医师杂志(电子版), 2014, 8(19): 21-25.
[22] Choi SY, Chang YW, Park HJ, et al. Correlation of the apparent diffusion coeff i ciency values on diffusion-weighted imaging with prognostic factors for breast cancer. Br J Radiol, 2012, 85(116): e474-e479.
[23] 邓丹琼, 涂蓉, 尤小光, 等. 磁共振扩散加权成像ADC值与乳腺癌病理组织分级的相关性研究. 临床放射学杂志, 2013, 32(10): 1428-1431.
[24] Sigmund EE, Cho GY, Kim S, et al. Intravoxel incoherent motion imaging of tumor microenvironment in locally advanced breast cancer. Magn Reson Med, 2011, 65(5): 1437-1447.
10.3969/j.issn.1005-5185.2017.02.022
R445.2;R737.9
2016-09-15
2016-11-28
(本文编辑 周立波)
昆明医科大学第三附属医院(云南省肿瘤医院)放射科云南昆明 650118
丁莹莹 E-mail: d_yying@hotmail.com
