肝癌靶向治疗的功能影像学评价现状
2017-04-13彭诗云综述审校
彭诗云(综述) 丁 红(审校)
肝癌靶向治疗的功能影像学评价现状
彭诗云(综述) 丁 红(审校)
癌,肝细胞;靶向治疗;体层摄影术,X线计算机;磁共振成像;超声检查;造影剂;综述
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝恶性肿瘤,据GLOBOCAN 2012的统计数据,全球有78.2万例新诊断的原发性肝癌,其中中国有39.5万例[1]。早期肝癌往往没有症状,50%以上的HCC患者在诊断时已属巴塞罗那临床肝癌分期(BCLC)的B期和C期,其中部分C期患者接受索拉非尼治疗[2]。
在肿瘤微环境中,许多重要的信号转导途径包含酪氨酸激酶受体,活化的酪氨酸激酶受体信号经第二信使调节细胞生理过程及基本表达模式。酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)抑制了酪氨酸激酶受体的自动磷酸化,通过竞争性结合三磷酸腺苷或异位抑制,干扰信号转导。目前研发出的多数治疗HCC的TKIs靶向几条信号转导途径中的不同因子,索拉非尼抑制了包括血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)及血小板源性生长因子受体在内的酪氨酸激酶受体[3-4]。新生血管是肿瘤进展过程中关键的一环,TKIs可干扰这一过程。索拉非尼的抗血管新生和抗肿瘤增殖效应主要表现为减少肿瘤的灌注,引起肿瘤坏死、瘤内出血及细胞水肿,但不会明显缩小肿瘤病灶,甚至因为水肿,肿瘤还可能变大,但是患者的生存期明显延长[5-6]。功能影像学能够反映肿瘤的灌注,因此成为评价肝癌靶向治疗的主要手段,早期、客观的评价可以指导临床用药,尽早发现肿瘤进展可以避免不必要的副作用,还可以减少治疗费用[3]。
1 肝癌靶向治疗影像学评价标准的变化
1.1 RECIST标准 实体肿瘤疗效评价标准(response evaluation criteria of solid tumors,RECIST)是评价实体瘤疗效的传统标准,主要通过测量靶病灶大小的变化来判断肿瘤是否进展。然而靶向治疗药物的临床实践中,RECIST所得出的评价不能很好地预计患者的总体生存。在索拉非尼的Ⅲ期SHARP试验中,尽管患者的生存期得到明显延长,根据RECIST,客观反应(objective response,OR)率不到3%[5](图1)。
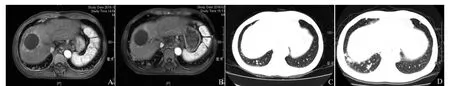
图1 男,55岁,HCC术后双肺多发转移。索拉非尼治疗前,肝脏术区周围复发灶(A),双肺多发转移(C);索拉非尼治疗3个月后,肝脏术区病灶无明显进展(B),肺部病灶明显进展(D),RECIST评估为疾病进展
1.2 EASL标准[7]和mRECIST标准[7]2000年,欧洲肝病协会(European Association for the Study of the Liver,EASL)认可了基于肿瘤活性部分的评价标准(仅纳入动脉期增强的部分病灶),用于局部治疗(射频消融及化疗栓塞等)的疗效评价,称为EASL标准。在EASL及RECIST的基础上,Lencioni和Llovet提出了mRECIST标准[7],主要以活性部分最大径之和来评估靶病变;当靶病变的增强不典型时,应用RECIST。
1.3 Choi标准[2]Choi等在研究胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)的影像学评价时,同样发现了RECIST与GISTs靶向治疗预后相关性较差,因此结合强化CT值变化与肿瘤长径变化提出了Choi标准,并放宽了RECIST对于治疗缓解的定义,将长径缩小≥10%或CT值下降≥15%作为缓解的标准,并在GISTs靶向治疗评价中证实了与预后的相关性较RECIST更好[7-8]。
Gavanier等[9]学者试用Choi标准来评价索拉非尼治疗晚期HCC,并分别比较了RECIST、Choi、EASL及mRECIST,发现相对于其他标准,Choi标准与患者总体生存率表现出更好的联系。而根据RECIST、mRECIST及EASL,部分缓解(partial response,PR)患者与疾病稳定(stable disease,SD)患者总生存期无显著差异。
另一项相似研究中[2],各种标准所判定的疾病进展(progressive disease,PD)率相差不大,Choi标准所得出的OR率最高,其次是EASL及mRECIST,最少的是RECIST,尽管各个标准所判定的OR组和PD组、SD 组和PD组之间的总体生存率都有差别,但仅有Choi标准所判定的OR组和SD组之间总体生存率有明显的差异,其他标准则没有。因此,Choi标准是预测预后较好的标准[2]。
在部分病例中原发病灶符合典型HCC的影像学特点,新发病灶却是低血管化的,这可能是应用Choi标准的一个限制[9]。
2 肝癌靶向治疗评价的影像学技术及可能用于评价的新指标
既往研究报道增强CT、增强MR、超声造影等影像学技术在评价靶向药物治疗HCC中的应用,并发现了部分可能有价值的参数[10-15]。
2.1 CT RECIST即是基于CT的,mRECIST及Choi标准纳入了增强CT的应用,还有研究探索了灌注CT在靶向治疗中的应用[11-14]。
在Salvaggio等[10]初步研究中,通过测量肿瘤动脉期的密度来评价肿瘤血管分布程度的减少,发现mRECIST判定的PR组动脉期增强的减少程度显著高于SD组及PD组。Gavanier等[9]的研究中,这项发现并未得到进一步证实,mRECIST判定的有效组与无效组之间无显著差异。目前尚无更多证据支持单独应用肿瘤密度的变化可用于评价靶向治疗。
灌注CT评价肿瘤病灶的参数主要包括血容量(blood volume,BV)、血流量(blood flow,BF)、肝动脉指数(hepatic arterial fraction,HAF)、表面通透性(permeability surfaceproduct,PS)和平均通过时间(mean transit time,MTT)[11]。
Sacco等[12]的研究中,索拉非尼治疗3个月后,所有患者的血清甲胎蛋白(alpha fetal protein,AFP)水平和BV、BF及PS均下降(但这几个参数的变化与患者的预后无显著关系),而MTT较基线显著增高,MTT与患者的血清AFP水平反向变化,并与患者1年生存率相关,且该研究发现MTT变化值(ΔMTT)较大的患者预后更好。
一项贝伐单抗的2期临床试验报道了灌注CT优于RECIST或是单纯的肿瘤密度评价:在肿瘤密度仅有轻微变化、大小无明显变化时,灌注参数已发生明显的变化,且较高的基线MTT与较好的预后有关[13]。另一项贝伐单抗治疗晚期HCC的研究发现,治疗后MTT显著增高,相比完全缓解(complete response,CR)或PR的患者,PD的患者基线MTT较低,治疗后MTT增高程度也较大[14],这与Sacco等[12]的研究结果相反。
以MTT为代表的灌注参数作为潜在指标,对于估计预后可能有一定意义,还需进一步的研究加以证实。
另外,在Bargellini等[15]的一项研究中,以增强CT动脉期肿瘤体积评价索拉非尼的疗效,发现体积增大率≤1.1%时,1年累计生存率达90%;而体积增大率>1.1%时,1年累计生存率仅为45.4%,提出肿瘤体积变化可能是一个早期预测指标。
需要注意的是,尽管mRECIST及Choi标准均纳入了增强CT的应用,增强CT用于评价肝肿瘤仍存在一些问题:首先,肿瘤在哪个时相增强最明显可能会受治疗影响,此外,注射后获取影像的时间对密度影响较大,可能造成肿瘤密度变化由治疗引起的错误印象;其次,部分肾功能差的患者不能应用造影剂。
2.2 MRI 与CT相比,MRI的诸多序列可提供更丰富的信息。在MRI评价索拉非尼治疗肝肿瘤疗效的研究中,在T1和T2加权图像上2~4周即可观察到疗效,通常有效的患者T1和T2信号增强,T1更为明显,这种改变提示肿瘤内的出血和坏死;无效病例则无信号改变。由于治疗导致的坏死和细胞变性,扩散受限减少,扩散加权成像(DWI)和表观扩散系数(ADC)也用于早期预测索拉非尼的疗效,往往会出现早期ADC值降低[6]。但Lewin等[16]发现,扩散分数和ADC值与总体生存之间均无明显联系,因此在应用DWI和ADC时需更加注意。动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)中,容积转移常数(volume transfer constant,Ktrans)和初始曲线下面积(initial area under the gadolinium concentration-time curve,IAUC)是2个常用的指标。靶向治疗后,Ktrans常明显下降,可能与血管通透性降低有关。Hsu等[17]发现PR和SD的患者Ktrans和IAUC的降低程度较PD患者更显著,并且Ktrans变化率独立地预测了肿瘤缓解、无进展生存及总体生存:Ktrans每下降10%,PR及SD的机会增加1.8倍,疾病进展及死亡的风险分别降低87%及80%。Ktrans作为潜在指标,对于估计预后可能有较高的价值。
MRI相对于CT的优点是造影剂增强程度更高,并且不受碘油沉积的影响[6]。然而,不同于CT值与局部碘造影剂浓度的线性关系,Ga造影剂浓度与MR信号的强度关系是非线性的,定量分析更加复杂[5]。
2.3 US 许多研究探索了动态增强超声造影(dynamic contrast enhanced ultrasound,DCE-US)在肝癌靶向治疗中的应用。在造影剂、探测技术及图像后处理方法上的发展使超声成为探测器官血流变化的良好工具。
在一项贝伐单抗治疗鼠移植瘤模型的研究中,活检结果显示治疗组的微血管密度(MVD、CD-31阳性区域)显著低于控制组,而且MVD与DCE-US测量的对比增强区域明显相关[18]。一项用VEGFR2靶向微泡造影分辨伊马替尼和舒尼替尼的抗新生血管效应的研究中,治疗24 h后的造影检查即发现评估VEGFR2表达的指标靶向增强强度(differential targeted enhancement,dTE)的变化,在192 h后测量到对比增强区域的变化[19]。Sugimoto等[20]在贝伐单抗治疗HCC的研究中,治疗后3 d测量的时间-强度曲线的曲线下面积(area under the curve,AUC)和AUCout与患者的总体生存相关。上述研究均表明DCE-US能够早期预测靶向药物抗血管新生的效果。
Frampas等[21]研究显示,治疗后1个月DCE-US中AUC下降40%以上的患者,在治疗2个月的RECIST评估中均未进展。另一项研究也显示,治疗后AUC下降40%以上预测了更长的进展时间[22]。Zocco等[23]研究发现,AUC、峰值时间和wash-in斜率均与更长的生存时间有关,可用于筛选适合用索拉非尼治疗的患者。一项使用3D探头超声造影评价索拉非尼治疗兔移植瘤的研究中,在治疗第1天后,3D与2D DCE-US所得出的灌注参数变化相似,时间-强度曲线的峰值强度、斜率和AUC均明显下降[24]。以AUC为代表的灌注参数的变化作为潜在的预测指标,可能有一定意义。
微泡造影剂是严格的血管内造影剂,更好地反映了MVD,无肾毒性;检查过程无电离辐射、性价比高,适合重复检查,且设备便携,可床旁检查[5]。DCE-US的局限性:首先是测量常局限于一个切面,未充分顾及肿瘤内部的异质性;其次是保持每次随访均测量同一切面较困难;此外,目前DCE-US缺少常规自动团注,可能会造成误差[18]。新的注射方式、3D超声造影等为解决目前超声造影的局限提供了思路[22]。
2.4 其他影像学技术 Lee等[25]应用正电子发射型计算机断层扫描(positron emission computed, PET)的研究中,治疗前较低的氟脱氧葡萄糖(f l uorodeoxyglucose, FDG)标准摄取值预测了较好的无进展生存和总体生存。不过,由于PET检查对于HCC的敏感性并不高,随访性价比较低,还有待更多的研究探索其在靶向治疗中的价值。
3 总结与展望
靶向药物可以使有限的部分肝癌患者受益,但是临床实践也证实其作用并未达到靶向药物刚问世时所预期的效果,未来,联合免疫治疗、改善肿瘤微环境以提高疗效、改善靶向药物耐药等,可能是靶向治疗的发展方向[26]。无论肝癌的靶向治疗如何发展,有效及时的评估尤为重要,目前尚无公认的影像学评价标准与指标。
总结目前各项相关研究,Choi标准相对于其他标准,与预后的相关性更好。灌注CT、DCE-MRI及DCE-US的各项灌注参数可能具有较高的应用价值,代表性的参数是灌注CT的MTT值,DCE-MRI的Ktrans和DCE-US的AUC。肿瘤体积测定作为一个新的指标,与预后的相关性较好。目前,以上参数在靶向治疗中的价值均需进一步研究加以证实。
[1] ARC. Globocan 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012. International Agency for Research on Cancer (IARC). [2016-02-10].http://globocan.iarc.fr/Default.aspx.
[2] Ronot M, Bouattour M, Wassermann J, et al. Alternative response criteria (choi, european association for the study of the liver, and modified response evaluation criteria in solid tumors [RECIST]) versus RECIST 1.1 in patients with advanced hepatocellular carcinoma treated with sorafenib. Oncologist, 2014, 19(4): 394-402.
[3] Villanueva A, Llovet JM. Targeted therapies for hepatocellular carcinoma. Gastroenterology, 2011, 6(3): 209-218.
[4] Aravalli RN, Steer CJ. Hepatocellular carcinoma: cellular and molecular mechanisms and novel therapeutic strategies. Cham Heidelberg New York Dordrecht London: Springer, 2014: 33-38.
[5] Zhu AX, Duda DG, Sahani DV, et al. HCC and angiogenesis: possible targets and future directions. Nat Rev Clin Oncol, 2011, 8(5): 292-301.
[6] Choi JI, Imagawa DK, Bhosale P, et al. Magnetic resonance imaging following treatment of advanced hepatocellular carcinoma with sorafenib. Clin Mol Hepatol, 2014, 20(2): 218-222.
[7] Fournier L, Ammari S, Thiam R, et al. Imaging criteria for assessing tumour response: RECIST, mRECIST, Cheson. Diagn Interv Imaging, 2014, 95(7-8): 689-703.
[8] 张晓鹏, 唐磊. 胃肠间质瘤靶向治疗的影像学评价. 中华胃肠外科杂志, 2012, 15(3): 208-212.
[9] Gavanier M, Ayav A, Sellal C, et al. CT imaging findings in patients with advanced hepatocellular carcinoma treated with sorafenib: alternative response criteria (choi, european association for the study of the liver, and modif i ed response evaluation criteria in solid tumor (mRECIST)) versus RECIST 1.1. Eur J Radiol, 2016, 85(1): 103-112.
[10] Salvaggio G, Furlan A, Agnello F, et al. Hepatocellular carcinoma enhancement on contrast-enhanced CT and MR imaging: response assessment after treatment with sorafenib: preliminary results. Radiol Med, 2014, 119(4): 215-221.
[11] Sahani DV, Holalkere NS, Mueller PR, et al. Advanced hepatocellular carcinoma: CT perfusion of liver and tumor tissue-initial experience. Radiology, 2007, 243(3): 736-743.
[12] Sacco R, Faggioni L, Bargellini I, et al. Assessment of response to sorafenib in advanced hepatocellular carcinoma using perfusion computed tomography: results of a pilot study. Dig Liver Dis, 2013, 45(9): 776-781.
[13] Jiang T, Kambadakone A, Kulkarni NM, et al. Monitoring response to antiangiogenic treatment and predicting outcomes in advanced hepatocellular carcinoma using image biomarkers, CT perfusion, tumor density, and tumor size (RECIST). Invest Radiol, 2012, 47(1): 11-17.
[14] Zhu AX, Holalkere NS, Muzikansky A, et al. Early antiangiogenic activity of bevacizumab evaluated by computed tomography perfusion scan in patients with advanced hepatocellular carcinoma. Oncologist, 2008, 13(2): 120-125.
[15] Bargellini I, Scionti A, Mismas V, et al. Identif i cation of responders to sorafenib in hepatocellular carcinoma: is tumor volume measurement the way forward? Oncology, 2014, 86(4): 191-198.
[16] Lewin M, Fartoux L, Vignaud A, et al. The diffusion-weighted imaging perfusion fraction f is a potential marker of sorafenibtreatment in advanced hepatocellular carcinoma: a pilot study. Eur Radiol, 2011, 21(2): 281-290.
[17] Hsu CY, Shen YC, Yu CW, et al. Dynamic contrast-enhanced magnetic resonance imaging biomarkers predict survival and response in hepatocellular carcinoma patients treated with sorafenib and metronomic tegafur/uracil. J Hepatol, 2011, 55(4): 858-865.
[18] Watanabe R, Munemasa T, Matsumura M. Contrast-enhanced ultrasound with perf l ubutane in the assessment of anti-angiogenic effects: early prediction of the anticancer activity of bevacizumab in a mouse xenografted model. Ultrasound Med Biol, 2015, 41(9): 2497-2505.
[19] Payen T, Dizeux A, Baldini C, et al. VEGFR2-targeted contrastenhanced ultrasound to distinguish between two anti-agiogenic treatments. Ultrasound Med Biol, 2015, 41(8): 2202-2211.
[20] Sugimoto K, Moriyasu F, Saito K, et al. Hepatocellular carcinoma treated with sorafenib: early detection of treatment response and major adverse events by contrast-enhanced US. Liver Int, 2013, 33(4): 605-615.
[21] Frampas E, Lassau N, Zappa M, et al. Advanced hepatocellular carcinoma: early evaluation of response to targeted therapy and prognostic value of perfusion CT and dynamic contrast enhancedultrasound. Preliminary results. Eur J Radiol, 2013, 82(5): e205-211.
[22] Hudson JM, Williams R, Tremblay-Darveau C, et al. Dynamic contrast enhanced ultrasound for therapy monitoring. Eur J Radiol, 2015, 84(9): 1650-1657.
[23] Zocco MA, Garcovich M, Lupascu A, et al. Early prediction of response to sorafenib in patients with advanced hepatocellular carcinoma: the role of dynamic contrast enhanced ultrasound. J Hepatol, 2013, 59(5): 1014-1021.
[24] Kim J, Kim JH, Yoon SH, et al. Feasibility of using volumetric contrast-enhanced ultrasound with a 3-D transducer to evaluate therapeutic response after targeted therapy in rabbit hepatic VX2 carcinoma. Ultrasound Med Biol, 2015, 41(12): 3131-3139.
[25] Lee JH, Park JY, Kim DY, et al. Prognostic value of18F-FDG PET for hepatocellular carcinoma patients treated with sorafenib. Liver Int, 2011, 31(8): 1144-1149.
[26] Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia. Cancer Cell, 2014, 26(5): 605-622.
10.3969/j.issn.1005-5185.2017.02.020
R445;R735.7
2016-07-29
2016-11-05
(本文编辑 张晓舟)
国家自然科学基金面上项目(81571675)。
复旦大学附属中山医院超声科,上海市影像医学研究所上海 200032
丁 红 E-mail: ding.hong@zs-hospital.sh.cn
