双眼致盲后大鼠跨感觉通道重组的锰增强磁共振成像的实验研究
2017-04-13容肖泽彬唐作华冯晓源钱
王 容肖泽彬唐作华*冯晓源钱 雯
王 杰3吴灵捷4钟玉凤5王文韬6
双眼致盲后大鼠跨感觉通道重组的锰增强磁共振成像的实验研究
王 容1肖泽彬1唐作华1*冯晓源2*钱 雯1
王 杰3吴灵捷4钟玉凤5王文韬6
目的:探讨双眼盲大鼠听、视觉通路锰增强磁共振成像(ME MRI)的形态学改变,并与病理结果相对照,验证视听跨感觉通道重组(听觉代偿通路)的产生。方法:14只健康新生雄性Sprague-Dawley(SD)大鼠随机分为双眼盲组(Group A)与正常组(Group B)(每组n=7),采用视神经离断法使大鼠致盲,盲后4个月分别经两组大鼠的左侧内耳外淋巴注入0.4M MnCl2,24h后比较ME MRI表现,观察是否建立听觉代偿通路,并与病理结果相对照,以帮助确定听觉代偿功能的产生。结果:ME MRI结果显示双眼盲大鼠双侧内侧膝状体、听皮质、外侧膝状体、上丘及视皮质的对比度均较正常大鼠增高,差异具有统计学意义,以听皮质较显著(P<0.01),视觉中枢差异更加明显(P<0.001)。ME MRI表现与病理结果具有较好一致性。结论:新生大鼠致盲4月后,MEMRI改变结合病理结果,提示产生视听跨感觉通道重组(听觉代偿通路)。
MnCl2;磁共振成像;神经可塑性;跨感觉通道重组;双眼盲
神经科学研究中,视觉障碍人群以神经可塑性为基础的跨感觉通道重组已成为一个热点问题[1]。跨感觉通道重组是指当完全剥夺一个专门感觉通道中的正常感觉输入时,负责这一专门感觉通道的脑区会逐渐对其它通道的感觉输入做出反应[2]。尽管许多技术已经被应用于跨感觉通道重组的研究,如事件相关电位(ERP)、正电子发射断层扫描(PET)、透颅磁刺激(TMS)及血氧水平依赖的功能磁共振成像(BOLD-fMRI)等,然而上述方法均有较突出的局限性,如空间分辨率差、具有一定的主观性、研究只能局限于视觉皮质的个别区域等。锰增强磁共振成像(manganese-enhanced MRI,ME MRI)能客观、直接、清晰、完整地显示神经纤维和脑皮质形态[3],近年来已被广泛应用于研究显示活体动物的视觉和听觉通路并取得了令人鼓舞的结果。然而,迄今为止,鲜有应用MEMRI研究双眼致盲后大鼠的视觉通路与听觉通路之间是否建立神经纤维联系——视听跨感觉通道重组的形态学改变的相关研究报道。本文利用MEMRI来研究双眼致盲后大鼠是否建立视听跨感觉通道重组和听觉功能代偿,并与病理结果相对照,为今后盲人跨感觉通道重组的解剖研究、功能定位、盲人的听觉代偿功能及机制的研究奠定基础。
方 法
1. 实验动物与分组
本动物实验通过研究生院医学伦理委员会批准,选取复旦大学实验动物科学部提供的健康雄性Sprague-Dawley(SD)新生大鼠(出生后约一周)14只,平均体重250±30g。采用随机数字表法随机分为双眼盲组(Group A)和对照组(Group B)(每组n=7)。实验前禁水、禁食约12h。体温维持在38℃。大腿后上部肌群肌注氯胺酮和甲苯噻嗪混合液分别约0.1ml(视神经离断法)、0.3ml(蜗窗内给药)及0.4ml(MR检查),俯卧位分别固定于自制模板及大鼠专用磁共振线圈。
2. 模型制备
采用视神经离断法,先剪开左侧颞侧球结膜,钝性分离球筋膜组织直至清晰暴露球后视神经。缝线在眼球正上方偏鼻侧方的结膜,向鼻下方牵引,在其上方剪一切口,深入找到巩膜,紧贴巩膜向后寻找视神经,离巩膜0.5mm处剪断视神经,先剪一头,再剪另一头,并将断段取下,即可确定视神经完全离断,缝合剪开的上下结膜并予复位,结膜囊内涂托百士眼膏。以同样的方法离断右侧视神经。
3. 内耳外淋巴内注射MnCl2过程
将已麻醉的双眼致盲4个月后的大鼠放在已消毒的铺巾上,显微镜下剪断左侧耳廓后,以肌腱和面神经为标志物,在其根部剪开,可见听泡。打开听泡为白色隆起骨性包壳,剪开一圆洞,透过洞可见白色的耳蜗,上方红色的即为动脉。在镫骨附着处前庭窗附近,红色动脉下即可见蜗窗(圆窗),剪开其表面的肌肉,将微量注射器针头插入蜗窗中,左耳缓慢注入0.4M MnCl23μl+0.5μl气泡于外淋巴中。留置肌腱补圆窗,再用骨水泥填封听泡圆洞,手术结束。模型建立成功标致:给药后24h行大鼠磁共振常规平扫T1WI扫描,大鼠左侧下丘及上丘T1WI成高信号,说明听觉代偿通路模型建立成功,如未见高信号区,表示未成功。
4. 磁共振成像
在Siemens-Magnetom Verio 3.0T MR扫描仪上完成,梯度场45mT/m,最大切换率200T/ m/s。信号采集线圈为大鼠专用线圈。肌注全麻,俯卧位放置于线圈内,头部位于线圈中央位置。薄布单覆盖保暖,胶带固定大鼠胸部以适当限制呼吸运动。扫描序列及主要参数:三平面定位扫描后,行全脑T1WI轴位、T1WI 3D FLASH(fast low angle shot,FLASH)矢状位扫描。主要扫描参数:T1WI采用自旋回波序列(spin echo,SE),TE/TR=13ms/400ms,FOV=78mm×78mm,层厚1.5mm,层间距0mm,矩阵256×256,激励次数2次,翻转角90°,扫描层数8层。T1WI 3D FLASH成像,采用GSE序列,TE/TR=4.3ms/12ms,FOV=78mm×78mm, 层 厚0.2mm, 矩 阵384×384,激励次数12次,翻转角25°,扫描层数112层。总扫描时间约40min。
5. 数据后处理
将所有数据全部传送至西门子磁共振后处理工作中,并重建双侧视觉通路全程的多平面重组图像(multiple planar reformation,MPR)、最大强度投影(maximum intensity projection,MIP)及薄层块最大强度投影(thin slab maximum intensity projection,TSMIP)的图像。
6. 图像分析
磁共振图像分析在西门子后处理工作中完成。两组大鼠经ME MRI检查后,分别测定各解剖结构的信号强度(signal intensity,SI)值。听、视觉通路信号强度通过在双侧耳蜗核、外侧丘系、下丘、内侧膝状体、听皮质及视觉中枢(包括外侧膝状体、上丘及视皮质)等不同解剖部位的中央区勾画感兴趣区(region of interest,ROI)获得,ROI大小约2~3mm2。通过磁共振自带软件分析,可直接测得ROI平均信号强度值及信号标准差值(standard deviation,SD)。根据视觉通路强化峰值时间,选取峰值时间点图像在对侧及正常大鼠的对应图像进行对比分析。通过下列公式定义参数CNR(contrast-to-noise ratio,CNR)=0.665(SMn-S0)/ SDair, 其 中SMn和S0分别表示注入MnCl2后强化的和正常大鼠未强化(同侧)的耳蜗核、外侧丘系、下丘、内侧膝状体、听皮质及视觉中枢等部位兴趣区内的SI值,SDair为空气中感兴趣区内的两次信号强度的SD平均值。
7. 病理学检查
ME MRI检查后的大鼠行多聚甲醛灌流并取脑固定。显微镜下,先剥离耳蜗神经、三叉神经,尽量剥离出完整的听觉通路。观察双眼致盲后组大鼠双侧听觉通路和视觉通路的部位、形态、大小、范围、粗细、色泽等特点。于10%中性甲醛固定液中两次固定约2天至1周,经轴位、冠状位、矢状位分别切取耳蜗核、外侧丘系、下丘、内侧膝状体、听皮质、外侧膝状体、上丘、视皮质的标本染色。经大脑半球听觉通路代表区的矢状位连续石蜡切片,厚度4μm,并行HE和快蓝(LFB)染色。显微镜下观察两种染色后标本双侧听觉通路和视觉中枢神经元、神经纤维、支持细胞内细胞器结构、形态、颜色、走向等特点,并与正常大鼠相应结构及其关系相比较。听、视觉通路定位参照Georg Paxinos & Charles Watson所著大鼠脑立体定位图谱。
8. 统计学分析
应用SPSS 18.0统计软件,采用单因素方差分析,两两比较采用最小显著差异法(LSD)。双眼致盲组及正常组听觉通路、视觉中枢的双侧CNR差异采用配对t检验,左、右侧双眼致盲组与正常组听觉通路、视觉中枢的CNR差异亦采用配对t检验;P<0.05为差异有统计学意义。
结 果
双眼致盲后4个月,左圆窗注入0.4 M MnCl224h后,7例大鼠T1WI均显示左侧下丘(SC) 及上丘(IC)信号增高,表明双眼致盲后4个月后ME MRI造模成功,造模成功率100%(7/7)。再行T1WI 3D FLASH扫描,经过三维重建后处理,TSMIP通过旋转均可立体观察到完整的听觉通路、视觉中枢。
如表1、2所示,正常大鼠和双眼致盲后大鼠的ME MRI显示左、右侧各解剖结构CNR差异具有统计学意义,且左侧明显高于右侧(P<0.01)。同时,双眼致盲后大鼠双侧的内侧膝状体、听皮质、外侧膝状体、上丘及视皮质的CNR较正常大鼠均有增高,差异具有统计学意义,以听皮质较显著(P<0.01),听觉中枢(即外侧膝状体、上丘及视皮质)差异更加显著(P<0.001)。此外,双眼致盲后大鼠的MEMRI还显示双侧下丘与外侧膝状体及上丘之间、听皮质与视皮质之间均有连续高信号,提示有神经纤维联系。
正常组及双眼致盲组大体观察显示,与正常组相比,双眼致盲组可见双眼球萎缩、变小,双侧视神经已离断,断端后视神经变细、变小,颜色由白色变淡,神经纤维紊乱扭曲及缠结,且与嗅神经等周围纤维相互缠结,为纤维紊乱或异常反应增生。视束、外侧膝状体及上丘均可疑萎缩,显示欠佳。外观相当于耳蜗核、下丘、内侧膝状体及听皮质等部位表面均较正常组大鼠稍变白,略变大,为水肿或代偿反应,未见明显出血表现(图1)。
双侧视、听觉通路的HE及LFB染色显示,双眼致盲组大鼠双侧视神经纤维已离断,残余段萎缩变小并被肌肉替代,周围伴有增生纤维缠结。双侧视束、视交叉、外侧膝状体、上丘、视放射及视皮质大致对称,未见明显神经元萎缩或增生肥大。双侧耳蜗核、外侧丘系、下丘、内侧膝状体、听放射及听皮质亦大致对称。上丘与下丘间可见较多神经纤维连接,HE染色呈紫红色,LFB染色呈蓝色,同时听皮质与视皮质间、下丘与外侧膝状体间亦可见神经纤维连接,呈紫红色(HE染色)或蓝色(LFB染色)(图2)。
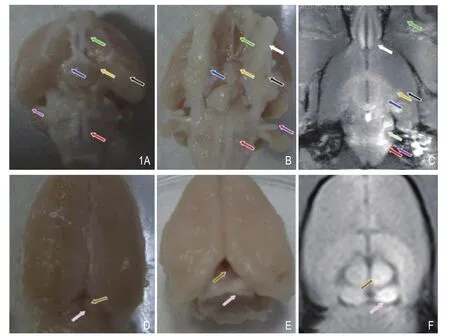
图1 左耳外淋巴注入 0.4 M MnCl2。 A. 经ME MRI显示的听觉通路的正常大体标本;B.经ME MRI显示听、视觉通路的双眼致盲后大体标本;C.经ME MRI显示双眼致盲后的听、视觉通路;D.经ME MRI显示的正常上丘、下丘大体标本;E.经ME MRI显示的双眼致盲后上丘、下丘大体标本;F.经ME MRI显示双眼致盲后的上丘、下丘呈高信号。注:视神经(绿箭)、外侧丘系(浅绿箭)、内侧膝状体(蓝箭)、外侧膝状体(黄箭)、耳蜗核(红箭)、听皮质(黑箭)、嗅束(白箭)、听神经(紫箭)、上丘(咖啡箭)、下丘(粉箭)。
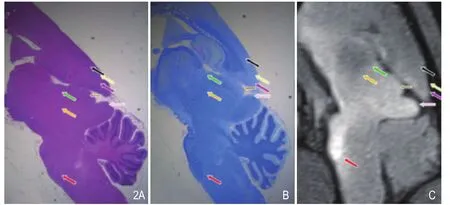
图2 A.视、听通路矢状位HE染色;B.视、听通路矢状位LFB染色;C.视、听通路TSMIP矢状位显示上丘、下丘、外侧丘系及耳蜗核均呈高信号。注:耳蜗核(红箭),内侧膝状体(黄箭),上丘(咖啡箭),下丘(粉箭),听辐射(绿箭),听皮质(黑箭),视皮质(紫箭),视、听皮质间纤维连接(浅黄箭)。
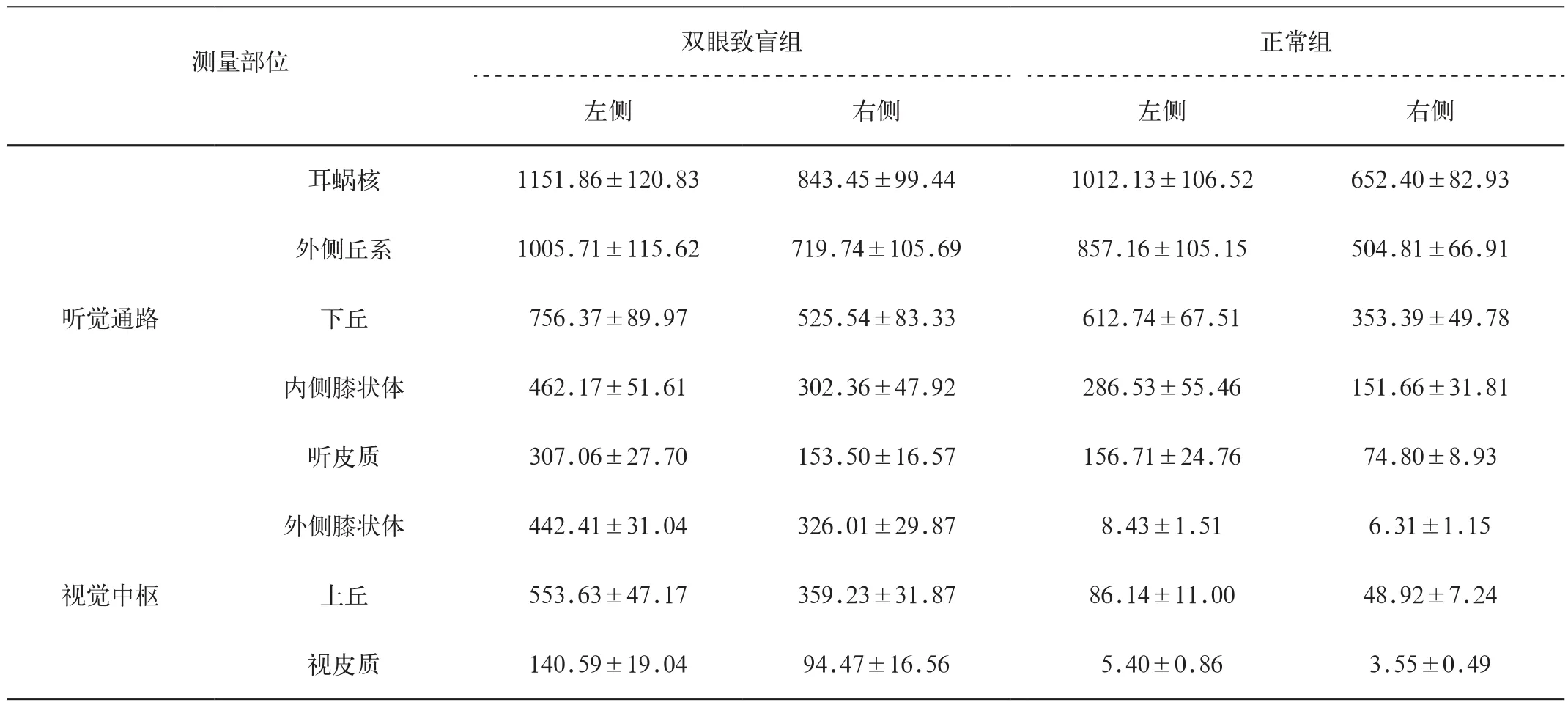
表1 双侧听觉通路、视觉中枢的正常和致盲后对比度(均数±标准差,×10-3)
讨 论
1. 锰增强磁共振成像在跨感觉通道重组研究中的应用价值
目前,白内障、视网膜脱离等疾病的手术治愈率较高,但部分盲人仍存在手术并发症和术后未复明等问题;此外,常见的致盲性疾病如青光眼等,一旦失明则永远不能复明,且即使采用目前最先进的眼科、电生理、常规MR检查仍然无法发现病人的器质性病变或致盲原因[4]。因此,寻找一种新方法来查找病因并判断盲人除局部病变外的视觉通路是否建立跨通道重组以便保证手术后可成功复明对临床至关重要。到目前为止,通过BOLD-fMRI、脑磁图、脑电图和事件相关电位等对盲人的视觉通路研究虽然国内外已有相关报道[5-7],但每种研究方法均有较突出的缺点,如空间分辨率差,仅局限于个别区域的研究(如视皮质),未有完整的视觉通路的显示报道。在此迫切需求下,利用锰增强磁共振成像技术对致盲后大鼠的视觉通路进行研究,拟在解决以上问题方面找到突破口,为建立大鼠视觉通路模型,并进一步研究盲人是否建立跨通道重组和听觉代偿作用的探索提供新途径,以便今后为盲人进行完整视觉通路的深入研究奠定基础,指导临床治疗和手术方案的选择。
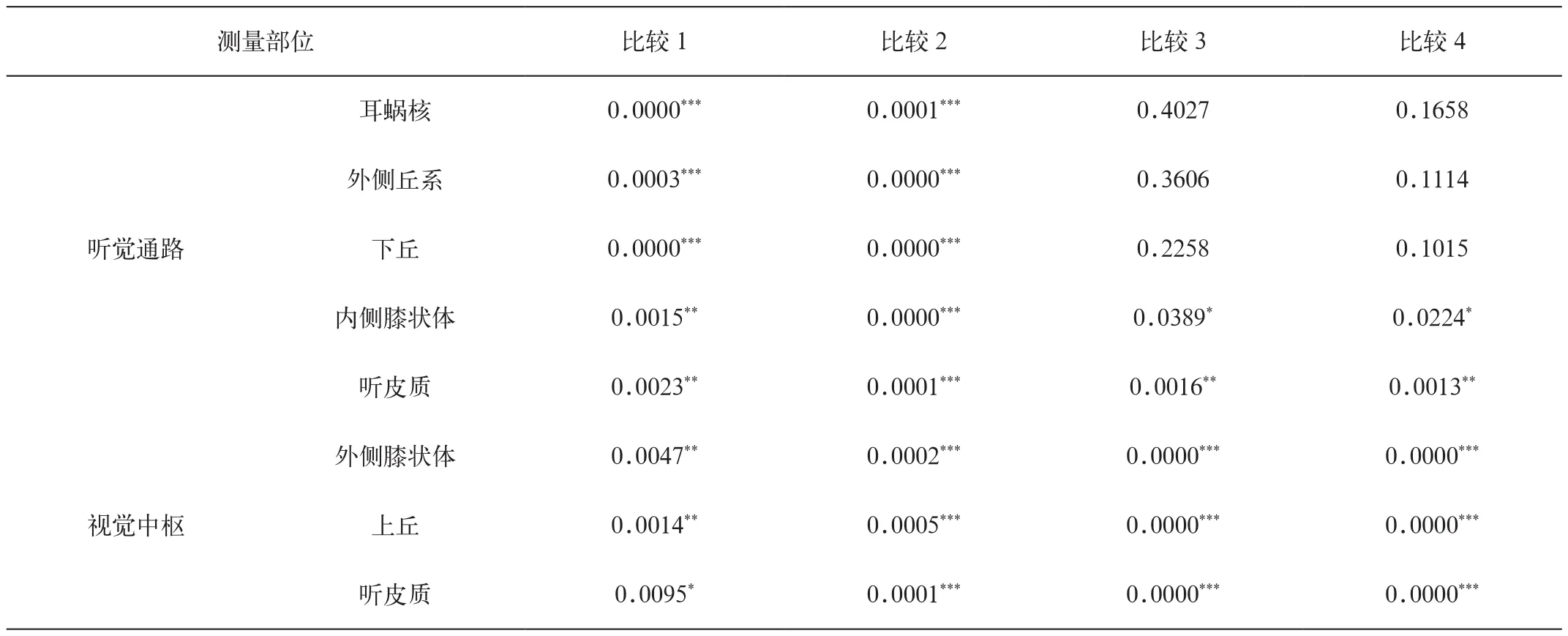
表2 听觉通路、视觉中枢的左右侧及致盲后与正常大鼠两两比较
2. 双眼致盲后大鼠的双侧听觉通路、视觉中枢的ME MRI表现
新生大鼠双眼致盲4个月后,左侧圆窗注入0.4M MnCl224h后,T1WI显示左侧上丘及下丘信号均有明显增高,表明双眼致盲4个月后ME MRI造模成功,提示视觉中枢的典型代表结构已发生改变,且与听觉通路有联系[8]。T1WI 3D FLASH扫描及重建后,通过TSMIP及旋转可立体观察完整的听觉通路,尚可见信号增高的其他视觉中枢(如外侧膝状体及视皮质)结构,初步表明这些结构亦发生了改变,即与听觉通路产生联系。进一步研究发现,正常大鼠与致盲后大鼠的ME MRI显示的听觉通路、视觉中枢各结构对比度,左右侧均有差别,且左侧明显高于右侧,这可能与听觉通路自耳蜗核发出的纤维主要投射到同侧的外侧丘系有关。同时,致盲后大鼠的双侧内侧膝状体、听皮质、外侧膝状体、上丘及视皮质的CNR均较正常大鼠增高,差异有统计学意义,以听皮质显著(P<0.01),视觉中枢更加显著(P<0.001),这表明双眼致盲4个月后,双侧听觉通路、视觉中枢信号均发生改变,兴奋性有所提高,且以视觉中枢更为显著,进一步提示视觉中枢各结构发生了异化,参与了听觉信息的整合和处理。
ME MRI还显示双眼致盲4个月后大鼠的双侧下丘与外侧膝状体及上丘间、听皮质及视皮质间存在连续高信号,提示有神经纤维联系,即听觉代偿通路,说明确实有视听跨感觉通道重组的产生,与以往Doron等[9]及Chabot等[10]通过给盲大鼠或地鼠用WGA-HRP[9]及C-Fos等[10]不同标记物直接显示外侧膝状体接受来自下丘的听觉信息、听皮质与视皮质连接[11]的报道基本一致。此外,上丘信号较显著增高,且与下丘间存在较多神经纤维联系,这一现象尚未有文献报道,进一步分析这可能与上丘作为潜在的听觉通路参与整合一些听觉信息[12],完成听觉反射,提示此时上丘更加兴奋,且接受和处理更多的听觉信息,并进一步将信息传递到视皮质。当然,这一现象仍需增加样本量深入研究来证实。
3. 双眼致盲后大鼠的双侧听觉通路、视觉中枢的病理学表现
本组大体标本观察显示,与正常对照组相比,双眼致盲组的双侧视神经已离断,断端后视神经萎缩变细、颜色变淡,神经纤维紊乱扭曲,且与嗅神经等周围纤维相互缠结,可能为纤维自身紊乱或异常反应增生所致,同时,视束、外侧膝状体及上丘均可疑萎缩,耳蜗核、下丘、内侧膝状体及听皮质等部位外观稍变白,略变大,考虑为注入MnCl2后引起的轻度毒性水肿或代偿增生可能[13]。目前,关于视听跨感觉通道重组的文献报道多是采用甲酚紫染色或脱氧葡萄糖、羰花青、C-Fos等材料标记,尚未见HE和LFB(快蓝)染色方面的报道,鉴于后两者具有可显示神经纤维和神经元的优点,特别是LFB对神经纤维显示更加清晰,故本组采用HE和LFB染色对经ME MRI显示的双侧视、听觉通路进行染色发现,双侧视神经已离断,残余段萎缩变细并被肌肉取代,周围伴有增生纤维缠结,与本组大体解剖、Toldi等[14]研究结果相一致。双侧视束、视交叉、外侧膝状体、上丘、视放射及视皮质均未见明显神经元萎缩或增生肥大,表明双侧视皮质可能均轻度萎缩,亦有可能同时发生轻度代偿,与Toldi等[14]报道相一致。耳蜗核、外侧丘系、下丘、内侧膝状体、听放射及听皮质双侧大致对称,表明仅为ME MRI表现提示听力功能增强[15],尚未引起形态及病理学改变。此外,上丘与下丘间、听皮质与视皮质间均可见神经纤维联系,下丘与外侧膝状体间似亦有神经纤维联系,这些均与ME MRI结果相一致,并验证了以往用电生理或标记物对视听跨感觉通道重组的研究报道[9-10]。
综上所述,本组ME MRI与病理结果提示,新生大鼠双眼致盲4个月后,视皮质不但直接与听皮质建立了联系,且接受从下丘(听觉通路)传导外侧膝状体(视觉通路)的听觉信息,亦可能接受从下丘传到上丘的听觉信息并加以整合处理,表明视觉通路与听觉通路之间产生视听跨感觉通道重组,即为神经适应性改变。
[ 1 ]Zhou I Y, Liang Y, Chan R W, et al. Brain resting-state functional MRI connectivity: Morphological foundation and plasticity. NeuroImage,2014,84:1-10.
[ 2 ]Kujala T, Alho K, Nen R N T. Cross-modal reorganization of human cortical functions. Trends in Neurosciences,2000.
[ 3 ]Eschenko O, Canals S, Simanova I, et al. Behavioral, electrophysiological and histopathological consequences of systemic manganese administration in MEMRI. Magnetic Resonance Imaging,2010,28:1165-1174.
[ 4 ]张 放, 文 雯, 朱文卿,等. 原发性青光眼视放射损害的磁共振弥散张量成像研究. 中国医学计算机成像杂志, 2016, 22:17-21.
[ 5 ]Urbanski M, Coubard O A, Bourlon C M. Visualizing the blind brain: brain imaging of visual field defects from early recovery to rehabilitation techniques. Frontiers in Integrative Neuroscience,2014,8.
[ 6 ]Butt O H, Benson N C, Datta R, et al. The Fine-Scale Functional Correlation of Striate Cortex in Sighted and Blind People[J]. Journal of Neuroscience,2013,33:16209-16219.
[ 7 ]Burton H, Mclaren D G, Sinclair R J. Reading embossed capital letters: An fMRI study in blind and sighted individuals. Human Brain Mapping,2006,27:325-339.
[ 8 ]Van Brussel L, Gerits A, Arckens L. Evidence for Cross-Modal Plasticity in Adult Mouse Visual Cortex Following Monocular Enucleation. Cerebral Cortex,2011,21:2133-2146.
[ 9 ]Doron N, Wollberg Z. Cross-modal neuroplasticity in the blind mole rat Spalax ehrenbergi: a WGA-HRP tracing study. Neuroreport,1994,5:2697-2701.
[10]Chabot N, Robert S, Tremblay R, et al. Audition differently activates the visual system in neonatally enucleated mice compared with anophthalmic mutants. European Journal of Neuroscience,2007,26:2334-2348.
[11]Dewey R S, Hartley D E. Cortical cross-modal plasticity following deafness measured using functional near-infrared spectroscopy. Hear Res,2015,325:55-63.
[12]Chuang K, Koretsky A P. Accounting for nonspecifc enhancement in neuronal tract tracing using manganese enhanced magnetic resonance imaging. Magnetic Resonance Imaging,2009,27:594-600.
[13]文 颂, 高歌军, 余 辉,等. 大鼠脑皮层结构的高分辨锰离子增强7.0 T MRI研究. 中华放射学杂志, 2010, 44:202-206.
[14]Toldi J, Feher O, Wolff J R. Neuronal plasticity induced by neonatal monocular (and binocular) enucleation. Prog Neurobiol,1996,48:191-218.
[15]Chan K C, Fan S, Chan R W, et al. In vivo visuotopic brain mapping with manganese-enhanced MRI and resting-state functional connectivity MRI. NeuroImage,2014,90:235-245.
Manganese-enhanced MR imaging (ME MRI) in the Study of Cross-model Plasticity in Experimental Rat Models with Binocular Blindness
WANG Rong1, XIAO Ze-bin1, TANG Zuo-hua1*, FENG Xiao-yuan2*, QIAN Wen1,
WANG Jie3, WU Ling-jie4, ZHONG Yu-feng5, WANG Wen-tao6
Purpose:To determine the establishment of visual to auditory cross-modal plasticity by manganese-enhanced MR imaging (ME MRI).Methods:Fourteen healthy male Sprague-Dawley (SD) newborn rats were randomly divided into two groups (n=7 for Group A and B). The optic nerve (ON) transection was performed in the 7 rats of Group A to obtain binocular deprived models and the 7 rats of Group B were chosen for the control study. Four months later, 0.4 M MnCl2 was injected into the rats in two groups via the left inner ear perilymph. Twenty-four hours later, auditory pathway and visual center of MEMRI were compared with that of normal rats to determine whether there were new auditory compensatory pathway and nerve fber connection between visual and auditory pathway. And the demonstrations of MEMRI were compared with pathology results to identify the generation of auditory compensatory function.Results:The contrast-to-noise ratio (CNR) of bilateral medial geniculate nucleus, auditory cortex, lateral geniculate nucleus (LGN), superior colliculus (SC) and visual cortex in rats after 4 months of binocular deprivation were increased when compared with the normal rats, the differences were with more signifcance (P<0.01) in auditory cortex, with the most signifcance (P<0.001) in visual center (including LGN, SC and visual cortex).Conclusion:MEMRI could display the changes of auditory and visual pathways in binocular deprived rats, and demonstrate the generation of visual to auditory cross-modal plasticity (auditory compensatory pathway), which was confrmed by pathology result.
MnCl2; MRI; Neural plasticity; Cross-modal reorganization; Binocular blindness
R445.2
A
1006-5741(2017)-01-0094-07
2016.08.11;修回时间:2016.09.12)
中国医学计算机成像杂志,2017,23:94-100
1复旦大学附属眼耳鼻喉科医院放射科
2复旦大学附属华山医院放射科
3复旦大学附属眼耳鼻喉科医院放疗科
4复旦大学附属眼耳鼻喉科医院耳鼻喉科
5复旦大学附属金山医院放射科
6复旦大学附属眼耳鼻喉科医院中心实验室
通信地址:上海市徐汇区汾阳路83号,上海市200031
唐作华(电子邮箱:tzh518sunny@163.com);
共同通信作者:冯晓源(电子邮箱: cjr.fengxiaoyuan@vip.163.com)
上海市科委自然科学基金项目NO. 09ZR1405600,14411962000;上海市科委基础重点项目NO. 09JC1403100。
Chin Comput Med Imag,2017,23:94-100
1Department of Radiology, Eye & ENT Hospital of Shanghai Medical School, Fudan University, Shanghai
2 Department of Radiology, Huashan Hospital of Shanghai Medical School, Fudan University
3 Department of Radiotherapy, Eye & ENT Hospital of Shanghai Medical School, Fudan University
4 Department of Otolaryngology, Eye & ENT Hospital of Shanghai Medical School, Fudan University
5 Department of Radiology, Jinshan Hospital of Shanghai Medical School, Fudan University
6 Central Laboratory, Eye & ENT Hospital of Shanghai Medical School, Fudan University
Address: No. 83, Fenyang Rd., Shanghai 200031, P.R.C.
Address Correspondence to TANG Zuo-hua(E-mail: tzh518sunny@163.com).
Address Co-Correspondence to FENG Xiao-yuan(E-mail: cjr. fengxiaoyuan@vip.163.com).
Foundation item: The Grant of Science and Technology Commission of Shanghai Municipality NO. 09ZR1405600, 14411962000; The Funds for Key Basic Research of Science and Technology Commission of Shanghai Municipality NO. 09JC1403100.
