DCE-MRI直方图分析在脑胶质瘤分级中的应用
2017-04-13韩秋月武江芬鲁珊珊宋佳成曹鹏洪汛宁
韩秋月武江芬鲁珊珊宋佳成曹 鹏洪汛宁
DCE-MRI直方图分析在脑胶质瘤分级中的应用
韩秋月1武江芬2鲁珊珊1宋佳成1曹 鹏2洪汛宁1
目的:探索动态增强磁共振成像(DCE-MRI)结合以整个肿瘤体积为基础的直方图(Histogram)分析方法在脑胶质瘤分级中的应用价值。方法:回顾性分析31例经过DCE-MRI检查的胶质瘤患者,其中包括8例低级别胶质瘤(LGG)和23例高级别胶质瘤(HGG)。应用血流动力学模型计算出各个病例的渗透参数,包括容积转运常数(Ktrans)、回流速率常数(Kep)、血管外细胞外容积比(Ve)和血浆容积(Vp);选取肿瘤实质区作为感兴趣区(ROI),并计算出各渗透参数的直方图参数,包括平均值、标准差、峰度、偏度及第90百分位数。不同级别胶质瘤的Ktrans、Kep、Ve和Vp直方图参数值的比较采用Mann-Whitney U检验,采用ROC分析直方图各参数值鉴别HGG和LGG的诊断效能,应用组内相关系数(ICC)分析数据测量的可重复性。结果:Ktrans值的平均值、标准差、峰度、偏度及第90百分位数在鉴别LGG与HGG中的差异均具有统计学意义(P<0.05)。ROC分析显示以上各值在鉴别高、低级别胶质瘤中均有较好的诊断效能,其中Ktrans值的偏度诊断准确性最高。各组ICC值显示出较好的可重复性。结论:DCE-MRI成像结合全肿瘤直方图分析方法在胶质瘤的分级中具有重要的应用价值。
直方图;动态增强磁共振成像;胶质瘤
胶质瘤是脑内最常见的原发肿瘤,其治疗方案及患者预后往往取决于肿瘤的良、恶性程度[1],合成微血管的能力是评价胶质瘤恶性程度的重要标准之一[1-3]。不同级别的胶质瘤形成微血管的能力不同,微血管的通透性也有差异。高级别胶质瘤(HGG)的微血管形成显著,较低级别胶质瘤(LGG)有更多不成熟的微血管,通透性也更高[2]。定量分析不成熟微血管的通透性可以提高胶质瘤分级的准确性。动态对比增强磁共振成像(dynamic contrastenhanced magnetic resonance imaging, DCE-MRI)作为一种无创性的成像方法,以肿瘤的微血管通透性为基础[15],在胶质瘤的良、恶性鉴别中有重要作用[1-2]。
通常,我们选择血流最多的肿瘤实性部位作为ROI,但这种方法对胶质瘤的评估是很有限的,因为这种方法存在个人选择误差及样本误差[4],而且胶质瘤是一种非常不均质的肿瘤,选择某一部位并不能代表肿瘤整体的异质性,因此会造成对肿瘤级别的低估[4-5]。Histogram是以整个肿瘤体积为基础的分析方法,对胶质瘤的异质性分析很有帮助,可提高对胶质瘤级别的诊断准确率[5]。
本文目的在于采用基于全肿瘤直方图析方法探讨DCE-MRI定量在胶质瘤分级中的应用价值。
方 法
1. 研究对象
本研究包括2014年9月-2015年12月期间在本院搜集的31例经病理证实的脑胶质瘤患者,其中男性19例,女性12例,年龄范围34~77岁,平均57岁。每例患者术前均经过常规MRI和DCE-MRI检查。根据2007年WHO胶质瘤分级标准,将所有患者分为两组,即高级别胶质瘤组和低级别胶质瘤组,其中11例低级别胶质瘤中Ⅱ级8例(5例星形细胞瘤,3例少突胶质细胞瘤),23例高级别胶质瘤中Ⅲ级10例(3例间变型星形细胞瘤,7例间变型少突胶质细胞瘤)、Ⅳ级13例(13例胶质母细胞瘤)。本研究所有患者均书面知情同意。
2. DCE-MRI序列与参数
本研究的所有病例均在3.0T MR(Siemens Verio)上进行扫描,采用16通道相控阵头颅线圈。每例病人术前均行常规平扫及DCE-MRI检查。常规序列的具体扫描参数:TlWI(TR/TE:400ms/2.48ms,FOV:230mm×230mm,Matrix: 320×256, 带 宽:360Hz/Px),T2WI(TR/TE:5090ms/91ms,FOV:230mm×230mm,Matrix:320×320,带宽:203Hz/Px),层厚5mm。DCEMRI采用横断面T1梯度3D序列扫描,检查前先进行3组T1-Vibe平扫(TR/TE3.89/1.31ms,层厚3mm,FOV230mm×230mm;矩阵224×165;flip angle分别为:5°,10°,15°),随后进行动态增强检查,共包括40次采集,在第3次采集结束后,经肘静脉以速率4ml/s、总量0.1mmol/kg注入对比剂钆双胺 [欧乃影,通用电气药业(上海)有限公司],DCE-MRI检查的所有定位层面保持一致,动态采集序列的翻转角为15°,其余参数与前面的平扫序列相同。
3.图像处理与分析
所有数据均传入Siemens工作站,运用GE公司的OmniKinetics(通用电气医疗集团)软件进行数据处理,分析采用的血流动力学模型是Extended Tofts Liner两室模型,在上矢状窦勾画VIF(血管输入函数),获得脑组织的时间-信号强度曲线,勾画原则为:病灶层面血管中心均匀区域,10个像素大小。运用MRIcro画图软件画出肿瘤所有层面病灶即整个肿瘤作为ROI(图1 B、E),然后运用自己编写的Matlab软件提取出ROI内Ktrans、Kep、Ve和Vp等参数所有像素值,最后应用SPSS21.0统计软件当中的直方图分析方法求取各参数值的平均值、标准差、峰度、偏度及第90百分位数(图2)。选择ROI时除去囊变、坏死、出血与含有正常血管的区域[6](图1)。
4. 统计分析
应用SPSS 21.0统计软件对数据结果进行统计分析,统计结果以均数±标准差表示。对不同级别胶质瘤Ktrans、Kep、Ve和Vp值的平均值、标准差、峰度、偏度及第90百分位数值的差异,应用Mann-Whitney U检验,P<0.05具有统计学意义。采用ROC分析直方图各参数值鉴别HGG和LGG的诊断效能。应用组内相关系数(ICC)分析同一测试者两次测量及两个不同测试者数据测量的可重复性。
结 果
1. 高、低级别胶质瘤Ktrans、Kep、Ve和Vp值的直方图参数比较

图1 高低级别胶质瘤参数比较示意图。 A~C.女性53岁,低级别星形胶质细胞瘤,WHOⅡ级。A.病变位于右侧额颞叶。B.MRIcron画图软件画出的ROI(红色)。C.KtransMap红蓝图,病变显示为低渗透性。D~F.男性50岁,胶质母细胞瘤,WHO IV级。D.病变位于左侧额叶,病变内可见不规则坏死区。E. MRIcron画图软件画出的ROI(红色),选择ROI时尽量去除坏死区。F.KtransMap图。
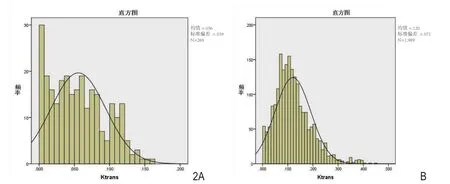
图2 Ktrans直方图。 A.图1的A~C病例;B.图1的D~F病例。

图3 Ktrans值的直方图参数区分高、低级别胶质瘤的诊断效能的比较。 A.Ktrans值的平均值、标准差及第90百分位数的ROC曲线图; B. Ktrans值的峰度及偏度的ROC曲线图。Ktrans值的平均值、标准差、峰度、偏度及第90百分位数在特定阈值时对高级别胶质瘤有较好的诊断效能,其中偏度值对高、低级别的诊断准确性最高。

表1 高、低级别胶质瘤Ktrans、Kep、Ve与Ve值的直方图参数检验结果
表1统计显示高、低级别胶质瘤的Ktrans、Kep、Ve与Vp值,其中HGG组及LGG组的Ktrans值的平均值、标准差、峰度、偏度及第90 百分位数值差异有统计学意义(P<0.05)。
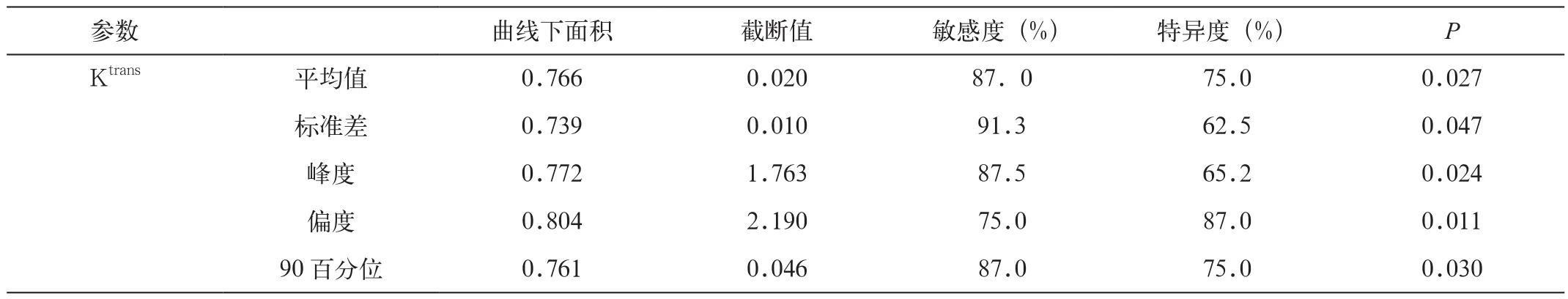
表2 Ktrans值的直方图参数的诊断效能
2. Ktrans值的直方图参数的诊断效能
表2显示Ktrans值的平均值、标准差、峰度、偏度及第90百分位数都对高、低级别胶质瘤具有较好的诊断效能,其中Ktrans值的偏度在所有参数当中具有最高的诊断效能(图3)。
3. 重复性检验
同一测试者两次测量及两个不同测试者间的ICC值均较高(其ICC值分别为平均值0.813,0.830;标准差0.816,0.787;峰度0.682,0.613;偏度0.799,0.803;第90百分位数0.856,0.785)
讨 论
胶质瘤是脑内最常见的原发肿瘤,微血管增生是脑内胶质瘤的一个很重要的组织学特征。肿瘤的新生微血管与正常血管相比不成熟,基膜不完整,微血管通透性增高,很容易引起血管内对比剂分子外漏,且微血管增生程度随着肿瘤级别的增高而增多[7]。当对比剂分子从血管内渗漏到血管外细胞外间隙(extravascular extracellular space,EES)时,血管内外的对比剂分布发生改变,磁豫也随之发生变化。应用DCE-MRl分析胶质瘤微血管通透性可以提高胶质瘤分级的准确性[2-3]。常规MRI增强虽然可以从形态学上提示胶质瘤的恶性程度,但是无法定量地对结果进行分析,因为常规MRI增强仅表明血脑屏障的破坏程度,并不能真正反映胶质瘤的微血管情况。通过DCE-MRI获得的Ktrans值又称容积转运常数(volume transfer constant),反映对比剂分子从血管内渗漏到血管外细胞外间隙(EES)的能力,能够定量测量肿瘤不成熟微血管的通透性[3]。
在正常脑组织中,由于血脑屏障的存在,没有对比剂从血管内渗漏到血管外,Ktrans值趋向于0。胶质瘤尤其是高级别胶质瘤可生成大量不成熟的微血管,血管通透性增高,Ktrans值增高。本研究结果显示,HGG组的Ktrans值的各直方图参数值均高于LGG组,两者间差异有统计学意义(P<0.05),与相关文献报道一致[8],说明HGG比LGG有更多不成熟的新生血管,肿瘤增殖分化能力更强,Ktrans的各直方图参数值在特定诊断阈值时对高级别胶质瘤的诊断具有较好的敏感性和特异性。Kep值指回流速率常数,与Ktrans相反,反映对比剂从血管外细胞外间隙(EES)回流到血管内的能力,同样反映肿瘤血管的通透性,数值越高表示血管的通透性越强[8]。关于Kep值与肿瘤级别的关系文献报道较少,本研究中Kep值在高、低级别间未见明显统计学差异。Ve指血管外细胞外(EES)容积比,反映EES的容积分数,EES可能受到很多因素的影响,如细胞密度、微血管通透性、坏死及囊变等[9]。有研究[9]发现EES容积在坏死、囊变区增加,而在细胞密集区则减小,且分别由DCE-MRI和显微分析测得的Ve值与EES大小具有统计学意义,因此EES容积变化会间接引起Ve值的变化。很多研究表明Ve值与肿瘤级别成正相关[8,10],本文结果未表现出明显差异,分析原因,可能是因为本组病例中少突胶质细胞瘤较多,相关文献报道,含少突成分的胶质瘤无论级别高低,血供均较丰富[6],且少突胶质细胞瘤镜下可见肿瘤细胞排列紧密[11],是否会影响EES有待进一步研究。Vp值反映血浆容积,其生理学意义与DSC-MRI中rCBV的意义相同,反映肿瘤的血流灌注[6,11,12],DSC-MRI灌注由于忽略了渗漏对比剂引起的T1缩短效应,使得计算的rCBV降低,而DCE-MRI消除了T1缩短效应,同时反映微血管的通透性,在定量反映肿瘤的血流灌注方面更加准确[13],相关文献表明[13-14],Vp值与肿瘤级别成正相关,本组病例中Vp值各参数也显示明显统计学差异。
传统选择肿瘤的某一部位作为ROI的方法存在个人选择误差及样本误差,因此会造成对肿瘤级别的低估,而且高级别胶质瘤坏死、出血常见(图1A~C),选取ROI时,虽然避开了这些区域,但肿瘤内一些微小的坏死区没有办法精确地去除,这种情况下,选取整个肿瘤为ROI可以减小由于单一层面选择带来的误差,能够更加全面地反映胶质瘤内部的异质性特征。标准差、峰度及偏度可反映肿瘤实质区像素点之间差异大小、分布集中程度以及对称性,结果显示, HGG组的Ktrans的峰度高于LGG组,HGG组的Ktrans的偏度低于LGG组,与高级别胶质瘤的异质性高于低级别胶质瘤的观点相一致[4-5],说明直方图在DCE参数中的应用对胶质瘤的分级具有良好的应用价值,能够更好地反映二者之间的异质性差异。与传统的平均值相比,异质性参数显示出更高的诊断效能,这一方面是由于我们采用了全肿瘤ROI的方式,更加准确地捕捉到肿瘤参数的整体分布情况,另一方面也说明肿瘤自身具有复杂的结构,单一的参数值对其诊断能力非常有限。Falk等[6]的研究结论与本文一致。两种测量的ICC值均较高,说明全肿瘤直方图DCE-MRI参数分析方法具有较高的可重复性,测量较容易且准确。
本研究的缺点:一是病例数太少,尤其是低级别胶质瘤,可能会对研究结果造成影响;二是本组病例中少突胶质细胞瘤较多,如前所述,少突胶质细胞瘤成分特别,可能会对测量结果产生一定的影响;三是画ROI时某些肿瘤边界较难界定,某些肿瘤内的小血管和坏死区无法精确地去除,以致产生一定的误差。
总的来说,本文的研究结果显示全肿瘤直方图DCE-MRI参数分析在对脑胶质瘤的分级中有重要的临床应用价值,异质性参数标准差、峰度、偏度和90百分位数显示出更好的诊断效能,肿瘤级别越高,肿瘤异质性特征越显著。已有较多文献报道Ktrans值与肿瘤级别呈正相关[3,5],本文显示出很好的一致性。Kep、Ve和Vp值在本文中未显示出明显的统计学差异,可能与本文病例数太少及少突胶质肿瘤所占比例较大有关,有待于收集更多的病例进一步探索。
我们的研究结果显示Ktrans值可以准确地评估脑胶质瘤微血管的通透性与病理分级。因此,DCEMRI可以为评估脑胶质瘤微血管通透性提供重要的临床参考价值。
[ 1 ]张佩佩,曾 强,黄 宁,等. 动态对比增强MRI在脑胶质瘤分级中计算模型的选择及应用研究. 中华放射学杂志, 2015, 49: 907-911.
[ 2 ]Zhang N, Zhang L, Qiu B, et al. Correlation of volume transfer coeffcient Ktrans with histopathologic grades of gliomas. Journal of Magnetic Resonance Imaging,2012,36:355-363.
[ 3 ]Jia Z Z, Gu H M, Zhou X J, et al. The assessment of immature microvascular density in brain gliomas with dynamic contrastenhanced magnetic resonance imaging. European Journal of Radiology,2015,84:1805-1809.
[ 4 ]Kang Y, Choi S H, Kim Y J, et al. Gliomas: Histogram analysis of apparent diffusion coefficient maps with standard- or high-b-value diffusion-weighted MR imaging--correlation with tumor grade. Radiology,2011,261:882-890.
[ 5 ]Just N. Improving tumour heterogeneity MRI assessment with histograms. British Journal of Cancer,2014,111:2205-2213.
[ 6 ]Falk A, Fahlström M, Rostrup E, et al. Discrimination between glioma grades II and III in suspected low-grade gliomas using dynamic contrast-enhanced and dynamic susceptibility contrast perfusion MR imaging: a histogram analysis approach. Neuroradiology, 2014, 56:1031-1038.
[ 7 ]贾中正,张 军,汤伟军,等. DCE-MRI评估脑胶质瘤微血管通透性. 中国医学计算机成像杂志, 2013, 19: 293-296.
[ 8 ]Jia Z Z, Geng D Y, Liu Y, et al. Microvascular permeability of brain astrocytoma with contrast-enhanced magnetic resonance imaging: correlation analysis with histopathologic grade. Chin Med J (Engl),2013,126:1953-1956.
[ 9 ]Li X, Zhu Y, Kang H, et al. Glioma grading by microvascular permeability parameters derived from dynamic contrast-enhanced MRI and intratumoral susceptibility signal on susceptibility weighted imaging. Cancer Imaging,2015,15:4.
[10]Jia Z, Geng D,Liu Y, et al. Low-grade and anaplastic oligodendrogliomas: Differences intratumour microvascular permeability evaluated with dynamic contrast-enhanced magnetic resonance imaging. Journal of Clinival Neuroscience, 2013, 20: 1110-1113.
[11]Smits M. Imaging of oligodendroglioma. The British Journal of Radiology,2016,89:20150857.
[12]Taoka T, Kawai H, Nakane T, et al. Application of histogram analysis for the evaluation of vascular permeability in glioma by the K2 parameter obtained with the dynamic susceptibility contrast method: Comparisons with Ktrans obtained with the dynamic contrast enhance method and cerebral blood volume. Magn Reson Imaging,2016,34:896-901.
[13]Artzi M, Liberman G, Nadav G, et al. Human cerebral blood volume measurements using dynamic contrast enhancement in comparison to dynamic susceptibility contrast MRI. Neuroradiology,2015,57:671-678.
[14]Arevalo-Perez J, Peck K K, Young R J, et al. Dynamic contrastenhanced perfusion MRI and diffusion-weighted imaging in grading of gliomas. J Neuroimaging,2015,25:792-798.
Application of the Histogram Analysis in the Grading of Gliomas with DCE-MRI
HAN Qiu-yue1, WU Jiang-fen2, LU Shan-shan1, SONG Jia-cheng1, CAO Peng2, HONG Xun-ning1
Purpose:To explore the value of dynamic contrast enhanced MRI (DCE-MRI) with histogram analysis in the grading of brain gliomas.Methods:Thirty-one patients with gliomas who were undergone DCE-MRI before surgery were analyzed retrospectively. Of the 31 patients, 8 were with low grade gliomas (LGG) and 23 were with high grade gliomas (HGG). The commonly used pharmacokinetic parameters (Ktrans, Kep, Ve, Vp) of every case were calculated using the pharmacokinetic model. The ROI was drawn on the solid portion of the lesion. And the histogram parameters, including mean, standard deviation, kurtosis, skewness and 90th percentiles, were calculated. Comparison of the histogram parameters(Ktrans, Kep, Ve, Vp) between the tumors with different grades was conducted using the Mann-Whitney U test. Receiver operating characteristic (ROC) curve was constructed to determine the diagnostic effcacy of every histogram parameter, and intra-class correlation coeffcients (ICC) were used to determine the diagnostic ability and reproducibility of the parameters.Results:The mean, standard deviation, kurtosis, skewness and 90thpercentiles values of Ktransin HGG were signifcantly higher than that in LGG(P<0.05). With ROC analysis, all the parameters showed high diagnostic effciency in the differentiation between high and low grade gliomas, of which the skewness of Ktransvalue had the highest accuracy. The Ktransvalue showed high reproducibility.Conclusion:DCE-MRI with histogram analysis has an important clinical value in the grading of gliomas..
Histogram; DCE-MRI; Gliomas
R445.2
A
1006-5741(2017)-01-0007-06
2016.06.15;修回时间:2016.10.20)
中国医学计算机成像杂志,2017,25:7-12
1 南京医科大学第一附属医院影像科
2 通用电气医疗集团
通信地址:江苏省南京市鼓楼区广州路300号, 南京 210029
洪汛宁(电子邮箱:hongxunning@sina.com)
Chin Comput Med Imag,2017,23:7-12
1 Department of Radiology, the First Affliated Hospital of Nanjing Medical University
2 General Electric Medical Group
Address:300 Guangzhou Rd., Nanjing 210029, P.R.C.
Address Correspondence to HONG Xun-ning (E-mail: hongxunning@sina. com)
