基底节铁沉积差异的SWI研究:不同利手者间的差异
2017-04-13赵金丽周国锋陈小华吴献华顾红梅
田 浩 赵金丽 周国锋 陈小华 吴献华 顾红梅
基底节铁沉积差异的SWI研究:不同利手者间的差异
田 浩 赵金丽 周国锋 陈小华 吴献华 顾红梅
目的:使用磁敏感加权成像(SWI)探讨左、右、混合利手人群铁沉积的差异。方法:共有87个正常人(年龄20~45岁,46例男,41例女)入组,分三组:右利手(51例),左利手(19例)或混合(17例)。磁共振检查包括常规和SWI序列,采用相位图量化铁沉积在尾状核头部和豆状核的角弧度差异,并进行各组间比较。结果:左豆状核区铁沉积:左利手明显低于右利手(P<0.001)和混合手(P =0.006),后两者间没有显著差异(P =0.545);右豆状核区铁沉积:右利手低于左利手组(P<0.001),其余之间无差异(P =0.07,0.121)。双侧尾状核头区铁沉积各组间未见显著性差异。结论:成人豆状核铁沉积因利手不同而有显著性差异,左侧豆状核以左利手者最低,右侧豆状核也是右利手低于左利手,而尾状核头部铁沉积则无此种差异。
磁共振成像;磁敏感加权成像;铁沉积;左利手;右利手
左利手和右利手者在大脑结构和功能方面有何不同?是否存在着左利手者更善于利用潜在的右侧大脑的运作,以及对情绪、运动、认知等的影响?这些类似的问题正在引起越来越多的关注。磁共振成像(MRI)近几年发展快速,可以更好地帮助我们了解神经系统的情况。研究人员开始尝试着分析左、右利手者之间的大脑结构差别[1],以及这种结构上的差异是否与大脑的功能相关联[2]。
采用SWI序列量化铁沉积首先应用于神经系统变性类疾病,如阿尔茨海默病和帕金森病[3]。这些疾病的部分病理基础在于有铁蛋白代谢的异常,铁蛋白是构成各种神经递质(多巴胺,脑啡肽和γ-氨基丁酸)以及脑代谢辅酶(单胺化合物,谷氨酸羟化酶和氢氧化酶)的主要成分,即参与大脑的生理活动[4-7]。在大脑中神经核团内具有较高量的铁沉积,神经系统的异常代谢可以造成铁代谢的紊乱,过量的铁沉积加剧β淀粉样蛋白的积累,它的神经毒性作用可导致神经细胞死亡,并导致神经纤维的传导障碍[5,8,9]。最近有学者研究表明,铁在基底节的沉积随着年龄的增长而增多,这种铁沉积的增多可能具有一定的规律性。Haacke等报道基底节铁质的增加随年龄增加可能存在一定的规律[10-11]。还有其他一些研究表明左、右利手者在神经系统有着不同的铁沉积情况[12-13]。我们推测左、右利手及混合利手人群在颅内的铁沉积可能存在一定的差异,特别是在基底节区,而基底节区是调节运动和认知功能区的主要功能区域。本研究旨在利用SWI定量基底节去铁沉积的量的差异来探讨与利手相关的大脑结构和功能的差异。
方 法
共有87名健康受试者(46男,41女)入组这项研究 (图1) ,年龄在20~45岁(平均年龄=29.1岁,SD= 6.0岁) ,其中右利手51例,左利手19例,混合利手17例(表1)。受试者无神经系统疾病、脑血管疾病史,无脑外伤病史,无癫痫、偏头痛、高血压、糖尿病,或其他类型的可能会影响神经系统代谢的疾病。
左利手、右利手、混合利手的判定:采用Annett’s handedness问卷和Edinburgh Handedness Inventory[1-2]。惯用手是按照10项手动任务来判定(如经常采用那只手完成以下工作:用笔、用剪刀、用筷子、扔东西、刷牙等)(表1)。同时采用了两个独立样本的t检验,进行组间的年龄、性别、受教育年数、IQ等方面进行比较(表2)。
1.磁共振检查及数据测量
采用西门子3.0T verio 进行磁共振检查(MAGENTOM, software VB 17, Verio, Siemens Healthcare, Erlangen, Germany),扫描序列包括(T1W, T2W)DWISWI。扫描参数如下:T2W:TR/TE 6000ms/95ms, FA 150°, matrix 384×384,层厚6mm, Dist factor 30%, FOV250mm; T1W FLAIR: 轴位/矢状位扫描 TR/TE 2000ms/9ms,FA 150°,matrix 320×320,层厚 6mm, Dist factor 30%,FOV 250mm,SWI:轴 位 扫 描TR/TE 28ms /20ms, FA 15°,matrix 320×320,层厚1.2mm,Dist factor 30%,FOV 230mm。
2.数据测量
使用相位图像量化铁沉积。由两位神经放射学专家(分别5年工作经验和8年工作经验)手动概述根据解剖结构T1图像豆状核和尾状核作为感兴趣区(ROI)的头部(图1C)。在此之后,豆状核和尾状核头部的平均相位值由下面的变换式进行测定。
所测量的值(Y)的范围为(-4096~4095),其映射到相位值X(π~-π),所以转换公式如下Y=-X×180 °/4096
分别获得尾状核头和豆状核的角弧度值,计算得出角弧度值[14]。

表1 左利手和右利手的考核标准
结 果
左侧豆状核铁沉积以左利手最低,低于右利手(P<0.001)和混合组(P=0.00625),但右利手和混合组间没有显著差异(P=0.545)。
右侧豆状核铁沉积各组比较发现右利手低于左利手组(P<0.001),而左、右利手与混合组间均无显著性差异(P=0.06978,0.121)(表3)。
以构建“四驱双核”服务型教工支部为特色,把服务学院专业发展和学生培养作为创建工作的主线贯穿始终,通过创新驱动、品牌驱动、目标驱动和任务驱动的“四驱”措施保障,创新活动载体、机制载体和组织载体,探索性的将教工党支部服务关口前移,充分调动和发挥全体教工党员的积极性、主动性、创造性,逐步形式示范、导向和辐射作用,以期全面推进特色教工党支部建设,持续提高基层党建质量,确保基层党支部发展的活力,为更好发挥基层党支部的战斗堡垒作用和党员先锋模范作用努力奋斗。(图1为“四驱双核”服务型教工党支部建设内涵示意图)
各利手组间双侧尾状核头铁沉积未见统计学差异(图2 , 表 4) 。
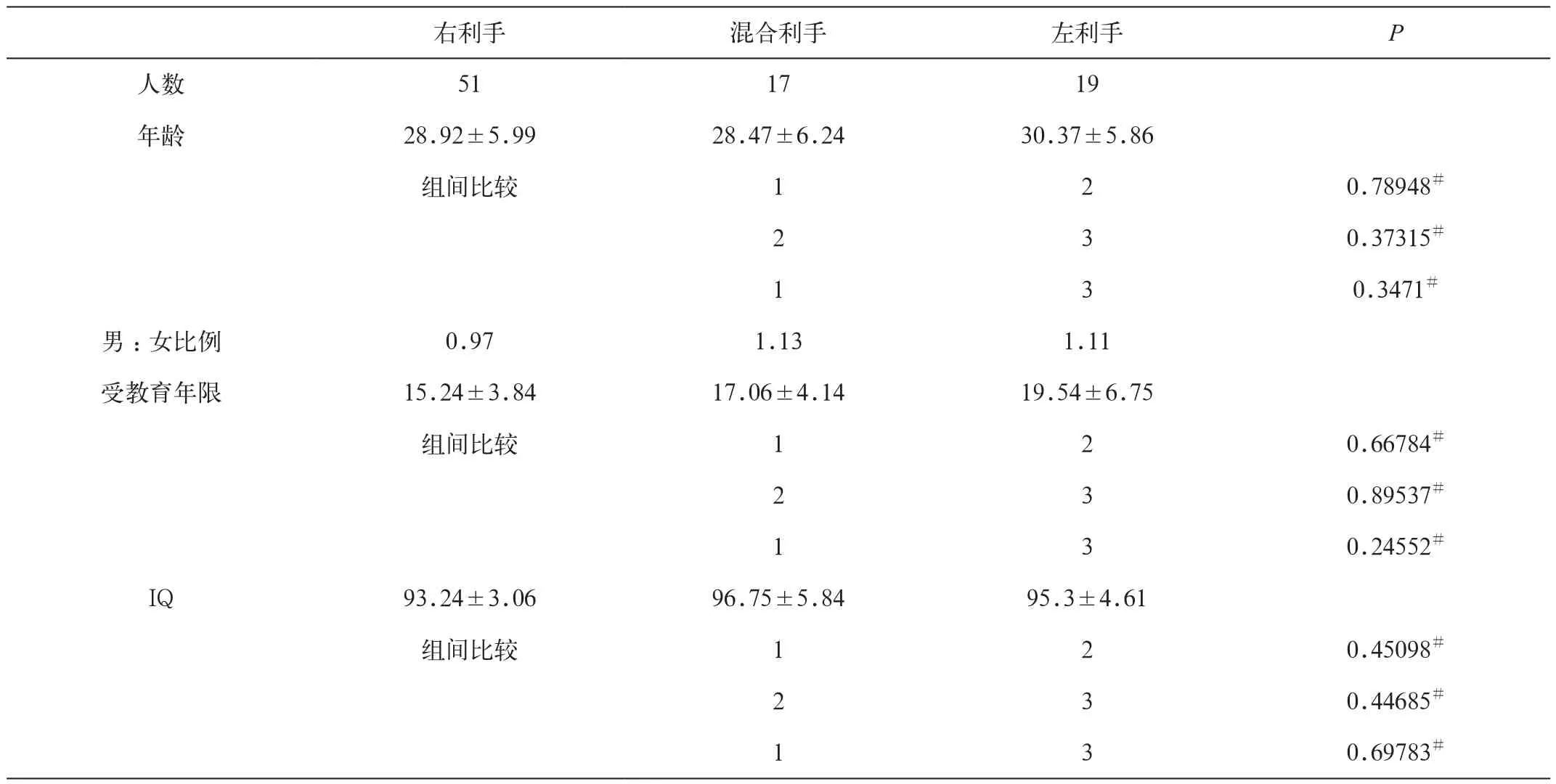
表2 各组基本资料比较
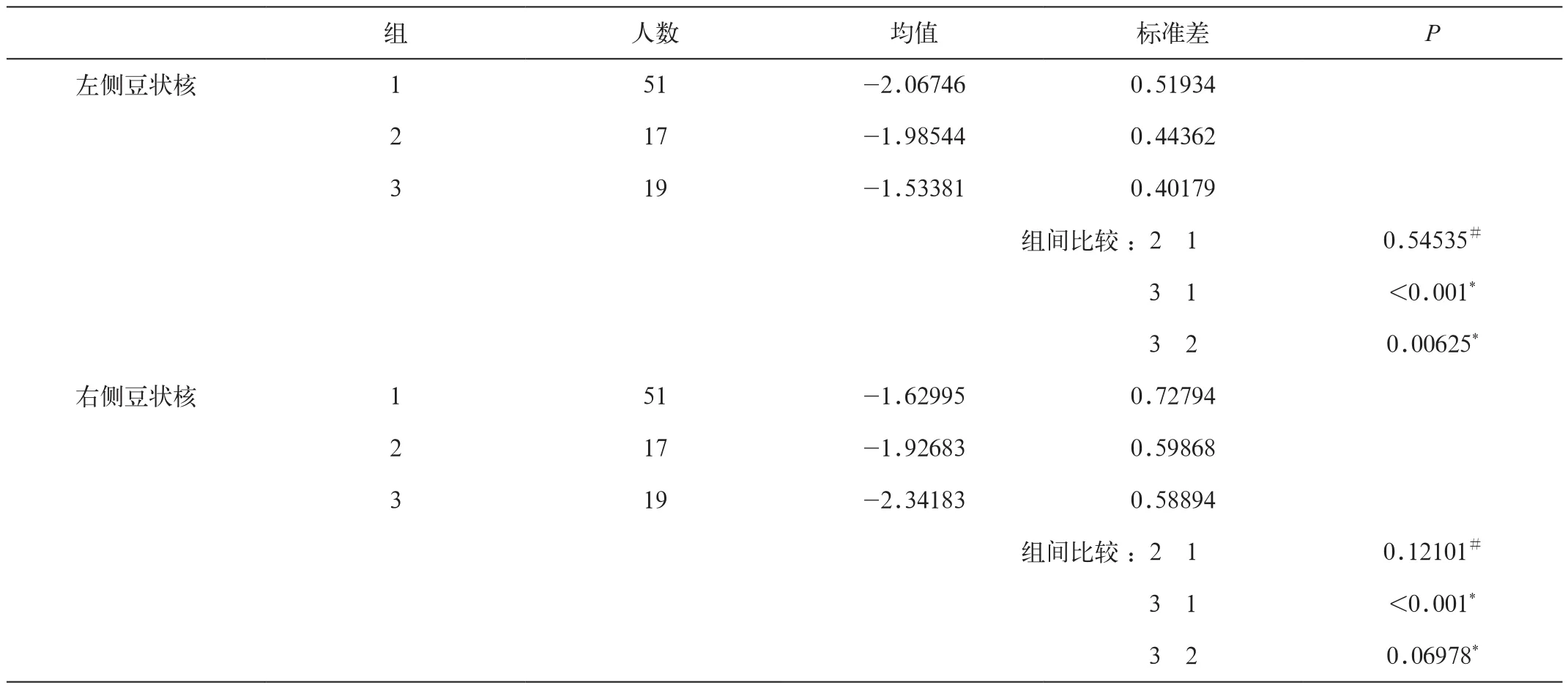
表3 各组双侧豆状核的铁沉积差异
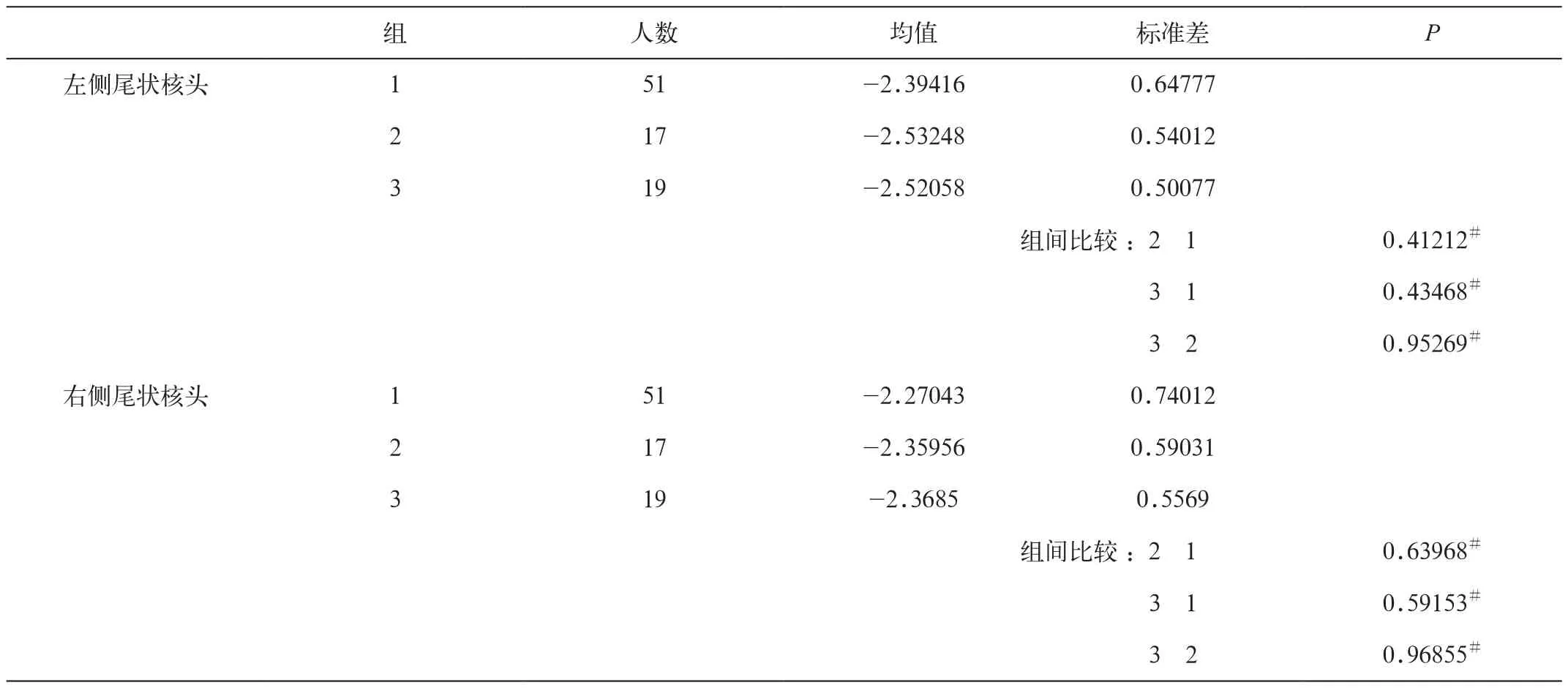
表4 各组双侧尾状核头的铁沉积差异

图1 健康女性,43岁,左利手。 A.轴位T1加权像; B.轴位T2加权图像; C.相位图;D.幅度图; E.SWI图。
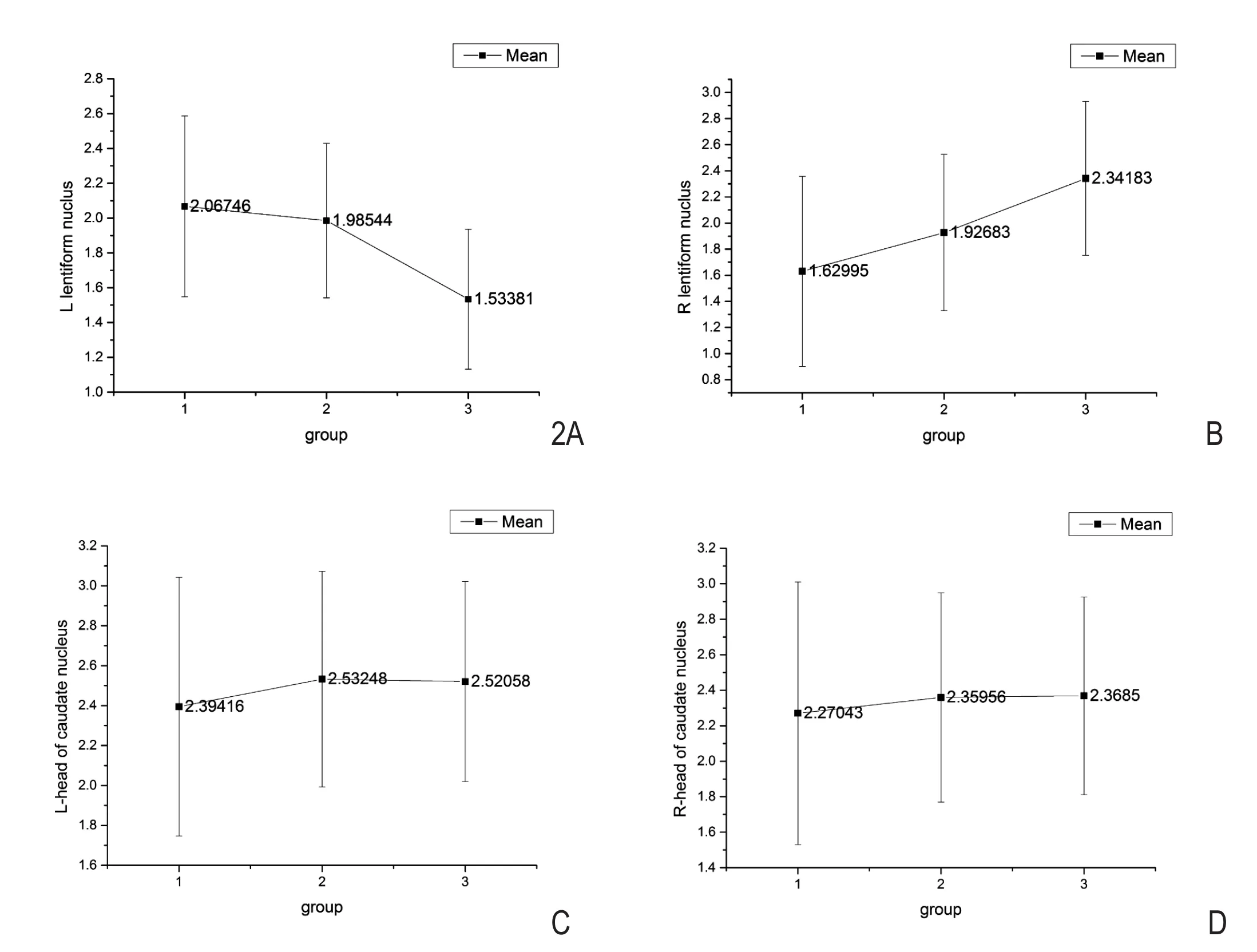
图2 双侧尾状核头部及双侧豆状核铁沉积的角弧度值比较:右利手(第1组),混合利手(第2组)和左利手(第3组)。
讨 论
本研究的特色在于采用SWI来量化铁沉积,在豆状核左利手与右利手、左利手与混合利手之间有显著性差异,右利手与混合利手组之间没有显著差异。但是在尾状核头部铁沉积含量的比较在左利手、右利手及混合利手三组间没有显著差异。这表明,混合利手组在大脑的结构和功能方面类似于右利手组。发生这种现象的原因尚不清楚。我们推测这种相似性部分可能与左右大脑半球的功能不同有关。大量的研究调查表明,左、右大脑半球在某些功能有优势的趋势,而惯用手(左利手或右利手)加剧了这一趋势[15]。左利手或右利手与大脑不同的结构和功能相关,因而也导致了氧气消耗和局部组织代谢的差异,以上这些都会影铁的代谢沉积。这也是本研究的病理生理基础。Steinmetz等研究表明大脑左利手和右利手人群的不对称性[2]。他们发现,颞叶的不对性与左、右手的主导地位相关,左利手人群较右利手人群显著降低了颞叶的不对称性[2]。大脑在结构和功能方面均存在不对称性。大多数混合利手人群是从左利手纠正到右利手的,从右利手纠正到左利手是很罕见的。在左利手、右利手功能的发展过程中,学习这个因素起了很重要的作用。例如,Steinmetz等发现后天生活习惯的养成较先天惯用手起到了主导性的作用[2]。
在本研究中,SWI成像被用于定量分析大脑中铁沉积的含量,是基于以下这些方面的考虑:采用SWI的相位图量化铁沉积是一种在活体有效的无创性测量脑内铁沉积含量的方法[8];SWI的理论基础在于脑内铁的沉积将改变局部磁场均匀性和产生的相位条件,这导致减少T2*信号的损失[5];SWI这种技术具有比常规T2WI或T2*WI更高分辨率和更高的信噪比[6,11]。
在Cabinio和Klöppel等的研究中,采用功能磁共振成像方法来观察左利手、右利手人群激活运动皮质区的差异[1,14]。 这些研究主要是基于左利手和右利手人群大脑皮质血运情况的不同,不同于本研究中研究解剖结构上的不同。而且本研究的特色在于在左利手、右利手的基础上还有混合利手的人群入组,这样能覆盖更普遍的人群情况。并且,本研究三组人群年龄均在20~45岁之间还排除了年龄等因素对于铁沉积影像的影响。
虽然本研究采用了先进的方法来测量铁质沉积,却存在仅测量尾状核的头部和豆状核铁沉积情况的局限性。我们认为,对于不同利手人群建立关于豆状核铁质沉积及与它们相关白质纤维区以及运动皮质的关系方面可以进一步研究。
本研究结果显示,左利手、右利手和混合利手在尾状核头部的铁沉积无显著差异,在豆状核有显著差异,这表明左、右利手对于与大脑结构和功能在铁沉积方面有一定的影响。
[ 2 ]Steinmetz H, Volkmann J, Jancke L, et al. Anatomical left-right asymmetry of language-related temporal cortex is different in leftand right-handers. Ann Neurol, 1991, 29: 315-319.
[ 3 ]王 丹, 李跃华. 磁敏感加权成像量化阿尔茨海默病患者铁沉积的研究. 实用放射学杂志, 2014, 30: 1605-1609.
[ 4 ]Haacke EM, Makki M, Ge Y, et al. Characterizing iron deposition in multiple sclerosis lesions using susceptibility weighted imaging. J Magn Reson Imaging, 2009, 29: 537-544.
[ 5 ]Pfefferbaum A, Adalsteinsson E, Rohlfing T, et al. MRI estimates of brain iron concentration in normal aging: comparison of fielddependent (FDRI) and phase (SWI) methods. Neuroimage, 2009, 47: 493-500.
[ 6 ]Rossi M, Ruottinen H, Elovaara I, et al. Brain iron deposition and sequence characteristics in Parkinsonism: comparison of SWI, T* maps, T-weighted-, and FLAIR-SPACE. Invest Radiol, 2010, 45: 795-802.
[ 7 ]Aquino D, Bizzi A, Grisoli M, et al. Age-related iron deposition in the basal ganglia: quantitative analysis in healthy subjects. Radiology, 2009, 252: 165-172.
[ 8 ]de Rochefort L, Liu T, Kressler B, et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn Reson Med, 2010, 63: 194-206.
[ 9 ]Haller S, Bartsch A, Nguyen D, et al. Cerebral microhemorrhage and iron deposition in mild cognitive impairment: susceptibility-weighted MR imaging assessment. Radiology, 2010, 257: 764-773.
[10]Haacke EM, Ayaz M, Khan A, et al. Establishing a baseline phase behavior in magnetic resonance imaging to determine normal vs. abnormal iron content in the brain. J Magn Reson Imaging, 2007, 26: 256-264.
[11]Xu X, Wang Q, Zhang M. Age, gender, and hemispheric differences in iron deposition in the human brain: an in vivo MRI study. Neuroimage, 2008, 40: 35-42.
[12]Brooks DJ, Luthert P, Gadian D, et al. Does signal-attenuation on high-field T2-weighted MRI of the brain reflect regional cerebral iron deposition? Observations on the relationship between regional cerebral water proton T2 values and iron levels. J Neurol Neurosurg Psychiatry, 1989, 52: 108-111.
[13]Aoki S, Okada Y, Nishimura K, et al. Normal deposition of brain iron in childhood and adolescence: MR imaging at 1.5 T. Radiology, 1989, 172: 381-385.
[14]Kloppel S, van Eimeren T, Glauche V, et al. The effect of handedness on cortical motor activation during simple bilateral movements. Neuroimage, 2007, 34: 274-280.
[15]Zhang J, Zhang Y, Wang J, et al. Characterizing iron deposition in Parkinson's disease using susceptibility-weighted imaging: an in vivo MR study. Brain Res, 2010, 1330: 124-130.
Study of the Basal Ganglia Iron Deposition in the Left- and Right-handed People by SWI
TIAN Hao, ZHAO Jin-li, ZHOU Guo-feng, CHEN Xiao-hua, WU Xian-hua, GU Hong-mei
Purpose:To investigate whether right-, left- or mixed-handed people differ in terms of iron deposition by using susceptibility weighted imaging (SWI) in healthy subjects.Methods:A total of 87 people (right-handed 51 subjects, left-handed 19 subjects, mixed-handed 17 subjects) aged 20–40 years old were enrolled. They were all undergone magnetic resonance examination, including conventional and SWI sequences. Phase images were used to quantify iron deposition in the head of the caudate nucleus and lenticular nucleus. The angle radian value was calculated and compared between the three groups.Results:There was no signifcant difference in the radian angle values between left-, right- or mixed-handed people for either the right or left side of the caudate nucleus head. However, the amount of iron deposition in the left lenticular nucleus was signifcantly higher in right-handed subjects than that in left-handed subjects (P < 0.001), and significantly higher in mixed-handed subjects than that in lefthanded subjects (P = 0.006). In addition, the amount of iron deposition in the right lenticular nucleus in right-handed subjects was signifcantly lower than that in left-handed subjects (P < 0.001).Conclusion:There were signifcant differences in iron deposition in the lenticular nucleus between left- and right-handed subjects, and between left- and mixed-handed subjects. However, there was no signifcant differences in iron deposition in the head of the caudate nucleus.
MRI; Susceptibility weighted imaging; Quantitative iron deposition; Handness
R814.42
A
1006-5741(2017)-01-0001-06
2016.06.03;修回时间:2016.09.26)
中国医学计算机成像杂志,2017,23:1-6
南通大学附属医院放射科
通信地址:江苏省南通市崇川区西寺路20号, 南通市 226001
吴献华 (电子邮箱:38625496@qq.com)
Chin Comput Med Imag,2017,23:1-6
Department of Radiology, Affliated Hospital of Nantong Medical University
Address: No. 20, Xisi Rd., Chongchuan District, Nantong 226001, P.R.C.
Address Correspondence to WU Xian-hua (E-mail: 38625496@qq.com)
